Что происходит в тканях мышц ног кратко
Обновлено: 07.07.2024
Мышечное сокращение. Характеристика и механизм мышечного сокращения
Выделяют несколько последовательных этапов запуска и осуществления мышечного сокращения.
1. Потенциал действия распространяется вдоль двигательного нервного волокна до его окончаний на мышечных волокнах.
2. Каждое нервное окончание секретирует небольшое количество нейромедиатора ацетилхолина.
3. Ацетилхолин действует на ограниченную область мембраны мышечного волокна, открывая многочисленные управляемые ацетилхолином каналы, проходящие сквозь белковые молекулы, встроенные в мембрану.
4. Открытие управляемых ацетилхолином каналов позволяет большому количеству ионов натрия диффундировать внутрь мышечного волокна, что ведет к возникновению на мембране потенциала действия.
5. Потенциал действия проводится вдоль мембраны мышечного волокна так же, как и по мембране нервного волокна.
6. Потенциал действия деполяризует мышечную мембрану, и большая часть возникающего при этом электричества течет через центр мышечного волокна. Это ведет к выделению из саркоплазматического ретикулума большого количества ионов кальция, которые в нем хранятся.
7. Ионы кальция инициируют силы сцепления между актиновыми и миозиновыми нитями, вызывающие скольжение их относительно друг друга, что и составляет основу процесса сокращения мыщц.
8. Спустя долю секунды с помощью кальциевого насоса в мембране саркоплазматического ретикулума ионы кальция закачиваются обратно и сохраняются в ретикулуме до прихода нового потенциала действия. Удаление ионов кальция от миофибрилл ведет к прекращению мышечного сокращения.
Далее мы обсудим молекулярные механизмы этого процесса.
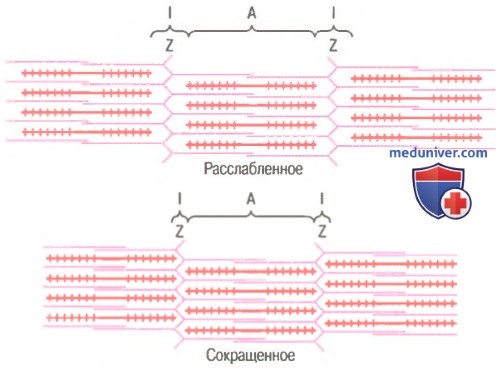
Миофибрилла в расслабленном и сокращенном состоянии. Показано (вверху), что актиновые нити (розовые) вдвинуты в пространства между миозиновыми нитями (красные). Сближение Z-дисков друг с другом (внизу).
Молекулярные механизмы мышечного сокращения
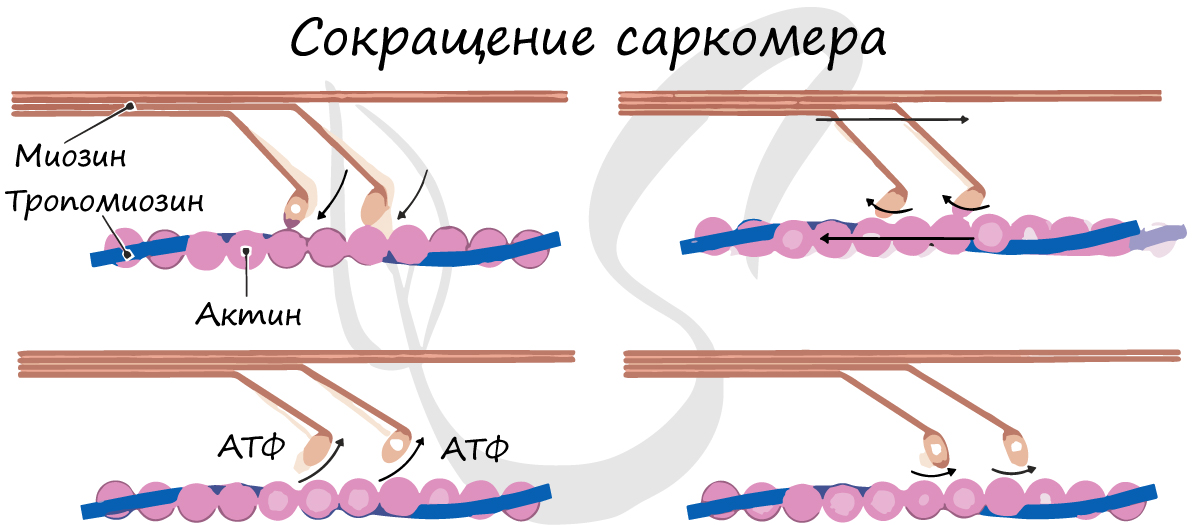
Механизм скольжения нитей для мышечного сокращения. На рисунке показан основной механизм мышечного сокращения. Показано расслабленное состояние саркомера (вверху) и сокращенное состояние (внизу). В расслабленном состоянии концы актиновых нитей, отходящие от двух последовательных Z-дисков, лишь незначительно перекрываются. Наоборот, в сокращенном состоянии актиновые нити втягиваются внутрь между миозиновыми так сильно, что их концы максимально перекрывают друг друга. При этом Z-диски притягиваются актиновыми нитями к концам миозиновых. Таким образом, мышечное сокращение осуществляется путем механизма скольжения нитей.
Что заставляет нити актина скользить внутрь среди нитей миозина? Это связано с действием сил, генерируемых при взаимодействии поперечных мостиков, исходящих от нитей миозина, с нитями актина. В условиях покоя эти силы не проявляются, однако распространение потенциала действия вдоль мышечного волокна приводит к выделению из саркоплазматическо-го ретикулума большого количества ионов кальция, которые быстро окружают миофи-бриллы. В свою очередь, ионы кальция активируют силы взаимодействия между нитями актина и миозина, в результате начинается сокращение. Для осуществления процесса сокращения необходима энергия. Ее источником являются высокоэнергетические связи молекулы АТФ, которая разрушается до АДФ с высвобождением энергии. В следующих разделах мы приведем известные детали молекулярных процессов сокращения.
Молекулярные особенности сократительных нитей
Миозиновая нить. Она состоит из множества молекул миозина, молекулярная масса каждой составляет около 480000. На рисунке показана отдельная молекула; и также — объединение многих молекул миозина в миозиновую нить, а также взаимодействие одной стороны этой нити с концами двух актиновых нитей.
В состав молекулы миозина входят 6 полипептидных цепей: 2 тяжелые цепи с молекулярной массой около 200000 каждая и 4 легкие цепи с молекулярной массой около 20000 каждая. Две тяжелые цепи спирально закручиваются вокруг друг друга, формируя двойную спираль, которую называют миозиновым хвостом. С одного конца обе цепи изгибаются в противоположных направлениях, формируя глобулярную полипептидную структуру, называемую миозиновой головкой. Таким образом, на одном конце двойной спирали молекулы миозина образуются 2 свободные головки; 4 легкие цепи также включены в состав миозиновой головки (по 2 в каждой). Они помогают регулировать функцию головки во время мышечного сокращения.
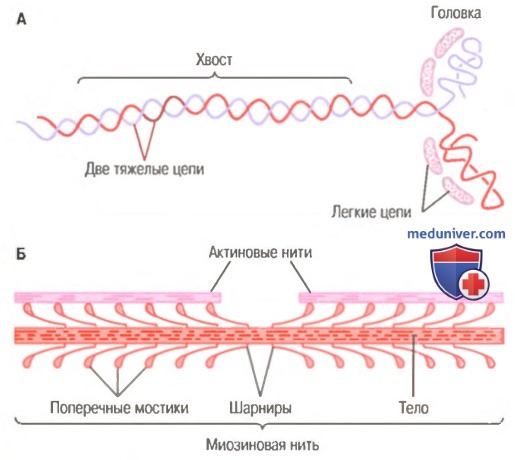
А. Молекула миозина.
Б. Объединение многих молекул миозина в одну миозиновую нить.
Показаны также тысячи миозиновых поперечных мостиков и взаимодействие их головок с прилежащими актиновыми нитями.
Миозиновая нить состоит из 200 или более отдельных молекул миозина. Видно, что хвосты молекул миозина объединяются, формируя тело нити, а многочисленные головки молекул выдаются наружу по сторонам тела. Кроме того, наряду с головкой в сторону выступает часть хвоста каждой миозиновой молекулы, образуя плечОу которое выдвигает головку наружу от тела, как показано на рисунке. Выступающие плечи и головки вместе называют поперечными мостиками. Каждый поперечный мостик может сгибаться в двух точках, называемых шарнирами. Один из них расположен в месте, где плечо отходит от тела миозиновой нити, а другой — где головка крепится к плечу. Движение плеча позволяет головке или выдвигаться далеко наружу от тела миозиновой нити, или приближаться к телу. В свою очередь, повороты головки участвуют в процессе сокращения, что обсуждается в следующих разделах.
Общая длина каждой миозиновой нити остается постоянной и равна почти 1,6 мкм. В самом центре миозиновой нити на протяжении 0,2 мкм поперечных мостиков нет, поскольку снабженные шарнирами плечи отходят в стороны от центра.
Сама миозиновая нить сплетена таким образом, что каждая последующая пара поперечных мостиков смещена в продольном направлении относительно предыдущей на 120°, что обеспечивает распределение поперечных мостиков во всех направлениях вокруг нити.
АТФ-азная активность миозиновой головки. Есть и другая особенность миозиновой головки, необходимая для мышечного сокращения: миозиновая головка функционирует как фермент АТФ-аза. Как объясняется далее, это свойство позволяет головке расщеплять АТФ и использовать энергию расщепления высокоэнергетической связи для процесса сокращения.
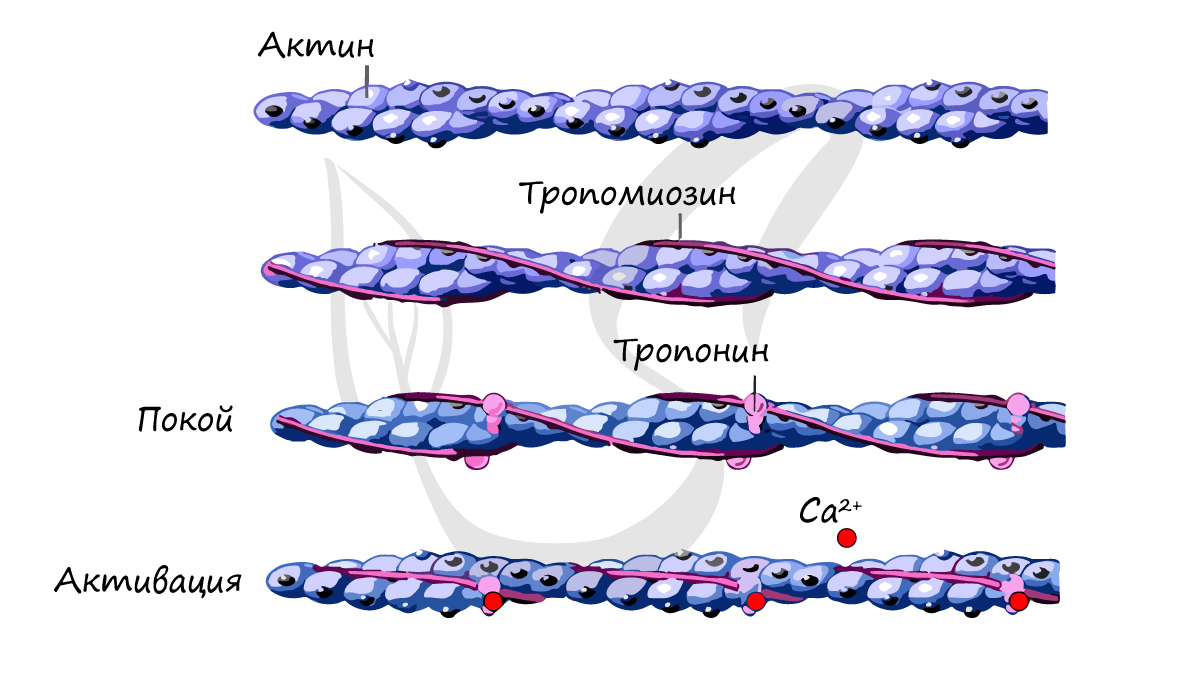
Актиновая нить. Актиновая нить состоит из трех белковых компонентов: актина, тропомиозина и тропонина.
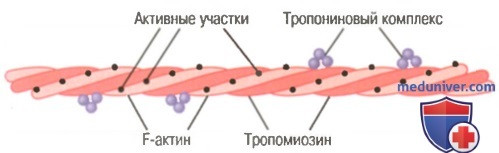
Актиновая нить, состоящая из двух спиралевидных цепочек молекул F-актина и двух цепочек молекул тропомиозина, расположенных в желобках между цепочками актина.
К одному концу каждой молекулы тропомиозина прикреплен тропониновый комплекс, который запускает сокращение.
Основой актиновой нити являются две цепи белковой молекулы F-актина. Обе цепи закручиваются в спираль так же, как и молекула миозина.
Каждая цепь двойной спирали F-актина состоит из полимеризованных молекул G-актина с молекулярной массой около 42000. К каждой молекуле G-актина прикреплена 1 молекула АДФ. Полагают, что эти молекулы АДФ являются активными участками на актиновых нитях, с которыми взаимодействуют поперечные мостики миозиновых нитей, обеспечивая мышечное сокращение. Активные участки на обеих цепях F-актина двойной спирали расположены со смещением таким образом, что вдоль всей поверхности актиновой нити встречается один активный участок примерно через каждые 2,7 нм.
Длина каждой актиновой нити — около 1 мкм. Основания актиновых нитей прочно встроены в Z-диски; концы этих нитей выступают в обоих направлениях, располагаясь в пространствах между миозиновыми молекулами.
Молекулы тропомиозина. Актиновая нить также содержит другой белок — тропомиозин. Каждая молекула тропомиозина имеет молекулярную массу 70000 и длину 40 нм. Эти молекулы спирально оплетают спираль из F-актина. В состоянии покоя молекулы тропомиозина располагаются поверх активных участков актиновых нитей, препятствуя их взаимодействию с миозиновыми нитями, лежащему в основе сокращения.
Тропонин и его роль в мышечном сокращении. По ходу молекул тропомиозина к ним периодически прикреплены другие белковые молекулы, называемые тропонином. Они представляют собой комплексы трех слабосвязанных белковых субъединиц, каждая из которых играет специфическую роль в регуляции мышечного сокращения. Одна из субъединиц (тропонин I) имеет высокое сродство к актину, другая (тропонин Т) — к тропомиозину, третья (тропонин С) — к ионам кальция. Считают, что этот комплекс прикрепляет тропомиозин к актину. Высокое сродство тропонина к ионам кальция, как полагают, инициирует процесс сокращения, о чем говорится в следующей статье.
Видео физиология мышц и мышечного сокращения - профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Мышечная дистрофия: причины появления, симптомы, диагностика и способы лечения.
Определение
Мышечные дистрофии - это большая группа наследственных заболеваний, которые характеризуются прогрессирующей слабостью и дегенерацией скелетных мышц, то есть потерей мышечной массы. К наиболее распространенным миодистрофиям относятся миодистрофия Ландузи-Дежерина (плече-лопаточно-лицевая миопатия), мышечная дистрофия Дюшенна и дистрофия Беккера. Также в эту группу входят дистрофия Эмери-Дрейфуса, миодистрофия Эрба-Рота и другие.

Миодистрофия Дюшенна поражает в основном мальчиков, а распространенность этого заболевания составляет 3,3 на 100 000 населения, 1 из 3500 новорожденных мальчиков страдает данной патологией. Этот вид дистрофии часто выделяют в одну группу с миодистрофией Беккера (частота встречаемости 1 на 20 000 новорожденных). Миодистрофии Дюшенна и Беккера наследуются по Х-сцепленному рецессивному типу. Это означает, что повреждение находится в Х-половой хромосоме и передается от матери к сыну, а дочери являются носительницами и, как правило, сами не болеют.
Миопатия Ландузи-Дежерина (плече-лопаточно-лицевая миопатия) встречается с частотой 0,9-2 на 100 000 населения. Заболевание наследуется по аутосомно-доминантному, аутосомно-рецессивному (самый редкий) или Х-связанному типу. Для аутосомно-доминантного типа наследования достаточно одной копии дефектного гена от одного из родителей.
Частота развития мышечной дистрофии Эмери-Дрейфуса точно не известна, описано 7 генетических форм, но частота установлена лишь для одной из них - Х-сцепленной рецессивной формы, она составляет 1 на 100 000.
Причины появления мышечной дистрофии
Причиной развития разных миодистрофий являются патологии в генах - известно порядка 25 генов, ответственных за развитие врожденных миодистрофий.
При мышечной дистрофии Дюшенна вследствие мутации нарушается выработка белка дистрофина, который обеспечивает прочность, стабильность и функциональность мышечных волокон, и его нехватка приводит к повреждению мембран мышечных клеток (миоцитов).
Классификация заболеваний
Мышечные дистрофии могут классифицироваться в зависимости от того, какой белок подвергся мутации. Кроме того, их подразделяют по типу наследования: аутосомно-доминантные, аутосомно-рецессивные, Х-сцепленные.
Симптомы мышечной дистрофии
Мышечная дистрофия Дюшенна обычно манифестирует в возрасте 2-3 лет. Патологические процессы сначала происходят в мышцах ног, дети могут ходить на пальцах, вразвалку, отмечается избыточное выгибание позвоночника вперед – лордоз. Детям становится сложно бегать, прыгать, подниматься по лестнице, вставать с пола. Для разных типов миодистрофий характерным является симптом Говерса – вследствие слабости мышц бедер и тазового пояса больному, чтобы подняться из положения на корточках, приходится опираться руками об пол, затем подниматься, опираясь руками об колени. Мышечная слабость прогрессирует, у детей развивается сколиоз и сгибательные контрактуры – когда ребенок не может полностью разогнуть конечность. Дети часто падают, поэтому велик риск переломов рук или ног. Отдельные мышечные группы могут замещаться жировой или фиброзной тканью, в результате чего появляется псевдогипертрофия мышц, особенно заметная на лодыжках. Если страдает миокард (сердечная мышца), то существует предрасположенность к развитию нарушений ритма и проводимости сердца, а также дилатационной кардимиопатии (состояния, когда камеры сердца увеличены, а стенки истончены), приводящей к сердечной недостаточности.

В 20-30% случаев при мышечной дистрофии Дюшенна появляются нарушения интеллекта и памяти.
К 12 годам большинство детей вынуждено пользоваться инвалидной коляской. В возрасте 15-20 лет пациентам уже требуется респираторная поддержка, умирают больные миодистрофией Дюшенна от дыхательных или кардиальных осложнений в возрасте 12-25 лет.
Миодистрофия Беккера дебютирует в 10-20 лет и медленно прогрессирует, способность к самостоятельной ходьбе сохраняется в течение 15-20 лет от начала заболевания. Симптоматика схожа с миодистрофией Дюшенна, слабость распространяется на мышцы бедер, таза, плеч, пациенты ходят на носочках или вразвалку, также наблюдается гипертрофия мышц голеней.
Развитие заболевания очень индивидуально, некоторым пациентам требуется инвалидное кресло к 30 годам, некоторые длительное время обходятся тростью.
У пациентов с миодистрофией Беккера также отмечается поражение сердечной мышцы с развитием сердечной недостаточности.
Для миодистрофии Эмери-Дрейфуса характерны контрактуры локтевых и голеностопных суставов, возникающие в раннем детстве (укорочение ахилловых сухожилий приводит к тому, что ребенок не может опуститься на пятки), тугоподвижность позвоночника, медленно прогрессирующая слабость лопаточно-плечевых и тазово-перонеальных мышц (мышц бедра и голени), а также выраженная кардиомиопатия с нарушениями ритма и проводимости. Тяжесть заболеваний сердца часто определяет прогноз течения болезни вследствие высокой вероятности внезапной сердечной смерти или развития прогрессирующей сердечной недостаточности.
Диагностика мышечной дистрофии
Предварительный диагноз врач может установить уже при осмотре, наблюдая за попытками ребенка побежать, прыгнуть, подняться по ступенькам, встать с пола.
Для подтверждения диагноза проводятся:
-
Анализ крови на сывороточную креатинкиназу, АСТ, АЛТ.
Синонимы: Анализ крови на креатинкиназу. CK; Creatine Phosphokinase (CPK). Краткая характеристика определяемого вещества Креатинкиназа Креатинкиназа катализирует обратимый перенос фосфорильного остатка с АТФ на креатин и с креатинфосфата на АДФ. Содержится преимущественно в скелетной мускулатуре.
Мышечные ткани - это ткани, для которых способность к сокращению является главным свойством. Мышечные ткани составляют активную часть опорно-двигательного аппарата (пассивной частью являются кости, соединения костей).
Общими свойствами всех мышечных тканей является сократимость и возбудимость. К данной группе тканей относятся гладкая, поперечнополосатая скелетная и поперечнополосатая сердечная мышечные ткани. Клетки мышечной ткани имеют хорошо развитый цитоскелет, содержат много митохондрий.
Гладкая (висцеральная) мускулатура
Эта мышечная ткань встречается в стенках внутренних органах (бронхи, кишечник, желудок, мочевой пузырь), в стенках сосудов, протоках желез. Эволюционно является наиболее древним видом мускулатуры.
Состоит из веретенообразных миоцитов - коротких одноядерных клеток. Между клетками имеются межклеточные контакты - нексусы (лат. nexus - связь). Благодаря нексусам возбуждение, возникшее в одной клетке, волнообразно распространяется на все остальные клетки.
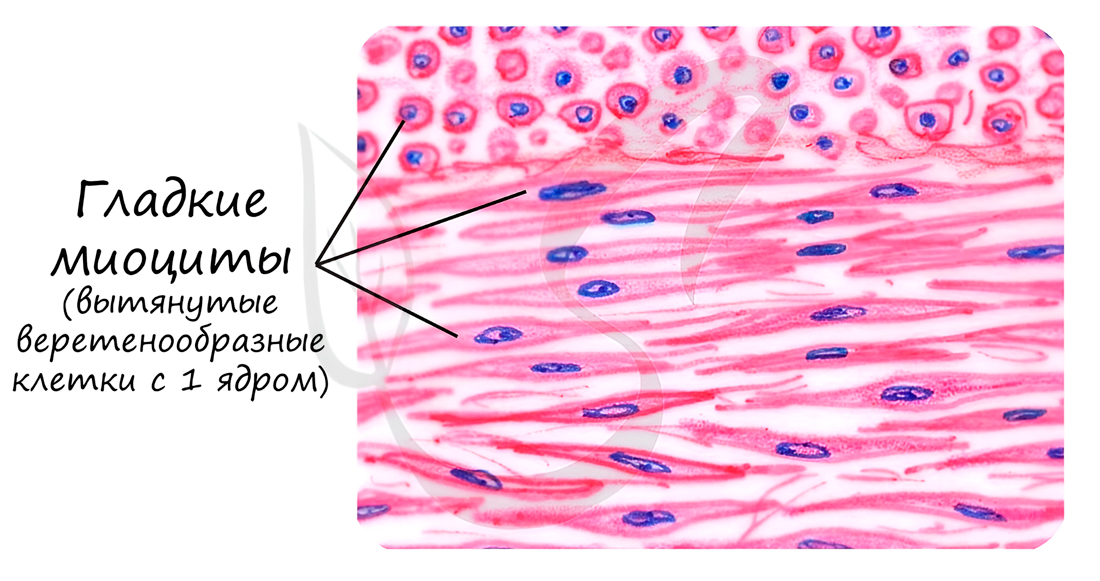
Гладкая мышечная ткань отличается своей способностью к длительному тоническому напряжению, что очень важно для работы внутренних органов (к примеру мочевого пузыря), сокращается медленно, практически не утомляется. Скелетная мышечная ткань, которую мы изучим чуть позже, такой способностью не обладает - сокращается и утомляется быстро.
Осуществляется сокращение с помощью клеточных органоидов - миофиламентов, которые расположены в клетке хаотично и не имеют такой упорядоченной структуры, как миофибриллы в скелетной мускулатуре (все познается в сравнении, уже скоро мы их тоже изучим).
Особо заметим, что в гладкой мышечной ткани миофиламенты собираются в миофибриллы только во время сокращения. У таких временных миофибрилл не может быть регулярной организации, а значит ни у таких миофибрилл, ни у гладких миоцитов не может быть поперечной исчерченности.
Гладкая мышечная ткань сокращается непроизвольно (неподвластна воле человека). Работа гладких мышц обеспечивается вегетативной (автономной) нервной системой. К примеру невозможно по желанию сузить или расширить бронхи, кровеносные сосуды, зрачок.
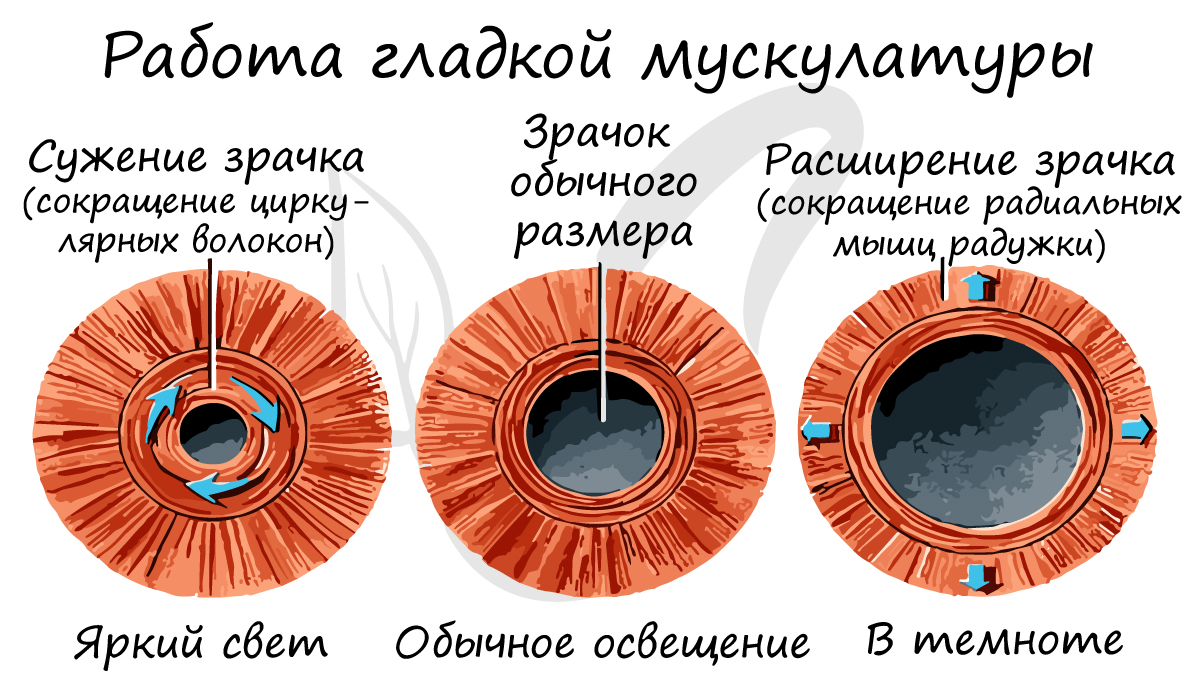
Гладкая мышечная ткань называется неисчерченной, так как не обладает поперечной исчерченностью, характерной для поперечнополосатых скелетной и сердечной мышечных тканей.
Скелетная (поперечнополосатая) мышечная ткань
Скелетная мышечная ткань образует диафрагму (дыхательную мышцу), мускулатуру туловища, конечностей, головы, голосовых связок.
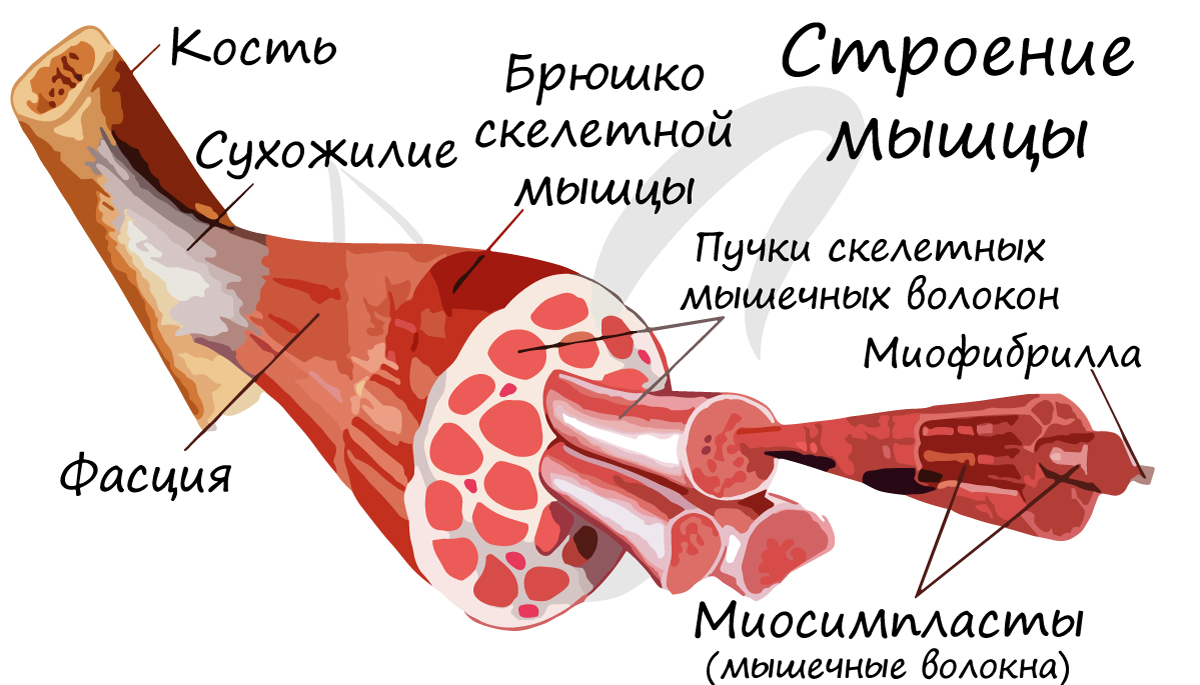
В отличие от гладкой мускулатуры, скелетная образована не отдельными одноядерными клетками, а длинными многоядерными волокнами, имеющими до 100 и более ядер - миосимпластами. Миосимпласт (греч. sim - вместе + plast - образованный) представляет совокупность слившихся клеток, имеет длину от нескольких миллиметров до нескольких сантиметров (соответствует длине мышцы).
Внутри миосимпласта находится саркоплазма, снаружи миосимпласт покрыт сарколеммой. Сократительные элементы - миофибриллы (лат. fibra - волоконце) - длинные тяжеобразные органеллы в миосимпласте (около 1400).
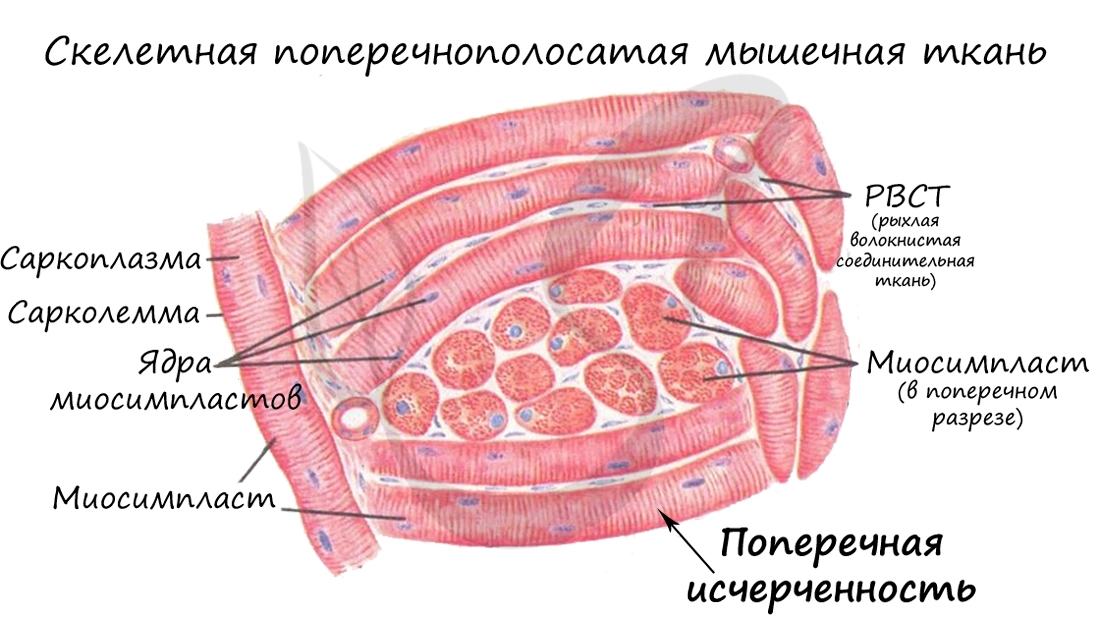
Характерная черта данной ткани - поперечная исчерченность, выражающаяся в равномерном чередовании светлых и темных полос на мышечном волокне. Это происходит потому, что границы саркомеров в соседних миофибриллах совпадают, вследствие чего все волокно приобретает поперечную исчерченность. Теперь самое время изучить микроскопическую основу мышцы - саркомер.
Саркомер (от греч. sarco - мясо (мышца) + mere - маленький)
Саркомер - элементарная сократительная единица поперечнополосатых мышц, структурная единица миофибриллы. В состав саркомера (и миофибриллы в целом) входят миофиламенты (лат. filamentum - нить) двух типов, которые обеспечивают сократимость мышечной ткани.
Саркомер состоит из актиновых (тонких) и миозиновых (толстых) филаментов, которые образованы главным образом белками актином и миозином. Сокращение происходит за счет взаимного перемещения миофиламентов: они тянутся навстречу друг другу, саркомер укорачивается (и мышца в целом).
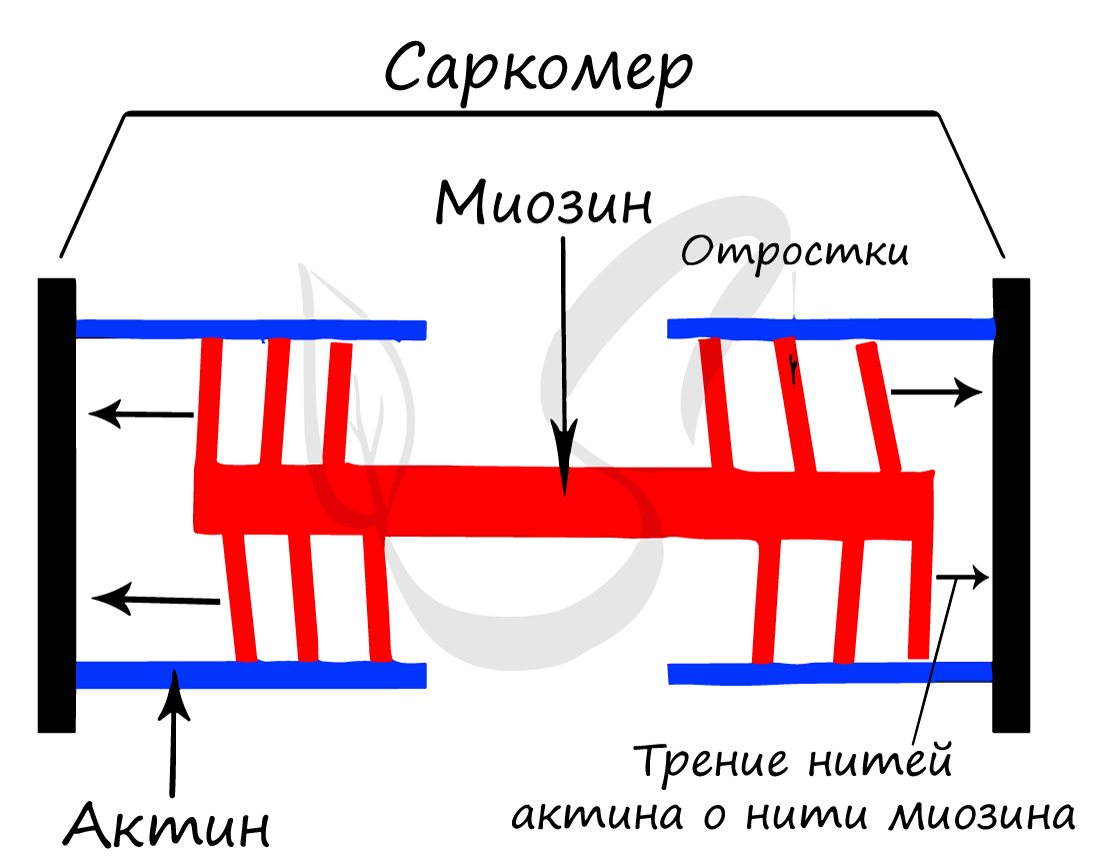
Источником энергии для сокращения служат молекулы АТФ. К тому же невозможно представить сокращение мышц без участия ионов кальция: именно они связываются с тропонином, что приводит к изменению конформации тропомиозина (тропонин и тропомиозин - регуляторные белки между нитями актина), за счет чего становится возможно соединение актина и миозина. При сокращении мышц выделяется тепло (сократительный термогенез).
Замечу, что трупное окоченение (лат. rigor mortis) - посмертное затвердевание мышц - связано именно с ионами кальция, которые устремляются в область низкой концентрации (в саркоплазму миосимпласта), способствуя связыванию актина и миозина.
После смерти в мышце перестает синтезироваться АТФ, ее уровень быстро снижается. Как следствие этого перестает функционировать Ca-АТФаза - насос, выкачивающий ионы Ca из саркоплазмы в саркоплазматический ретикулум (мембранная органелла мышечных клеток (сходная с ЭПС), в которой запасаются ионы Ca).
В саркоплазме повышается концентрация ионов Ca - замыкаются мостики между актином и миозином, однако разомкнуться они уже не могут, в связи с чем наблюдается стойкая мышечная контрактура (лат. contractura - стягивание, сужение): конечности очень сложно разогнуть или согнуть.
Вернемся к скелетным мышцам. Имеется еще ряд важных моментов, о которых нужно знать.
В процесс возбуждения вовлекается изолированно один миосимпласт, соседние миосимпласты (волокна) не возбуждают друг друга, в отличие от гладких миоцитов, где возбуждение предается между соседними клетками через нексусы. Скелетные мышцы сокращаются быстро и быстро утомляются (у гладких мышц фазы сокращения и расслабления растянуты во времени, мало утомляются) .
Скелетные мышцы сокращаются произвольно: они подконтрольны нашему сознанию. К примеру, по желанию мы можем изменить скорость движения руки, темп бега, силу прыжка. Мышцы покрыты фасцией, крепятся к костям сухожилиями, и, сокращаясь, приводят в движение суставы.
Сердечная поперечнополосатая мышечная ткань
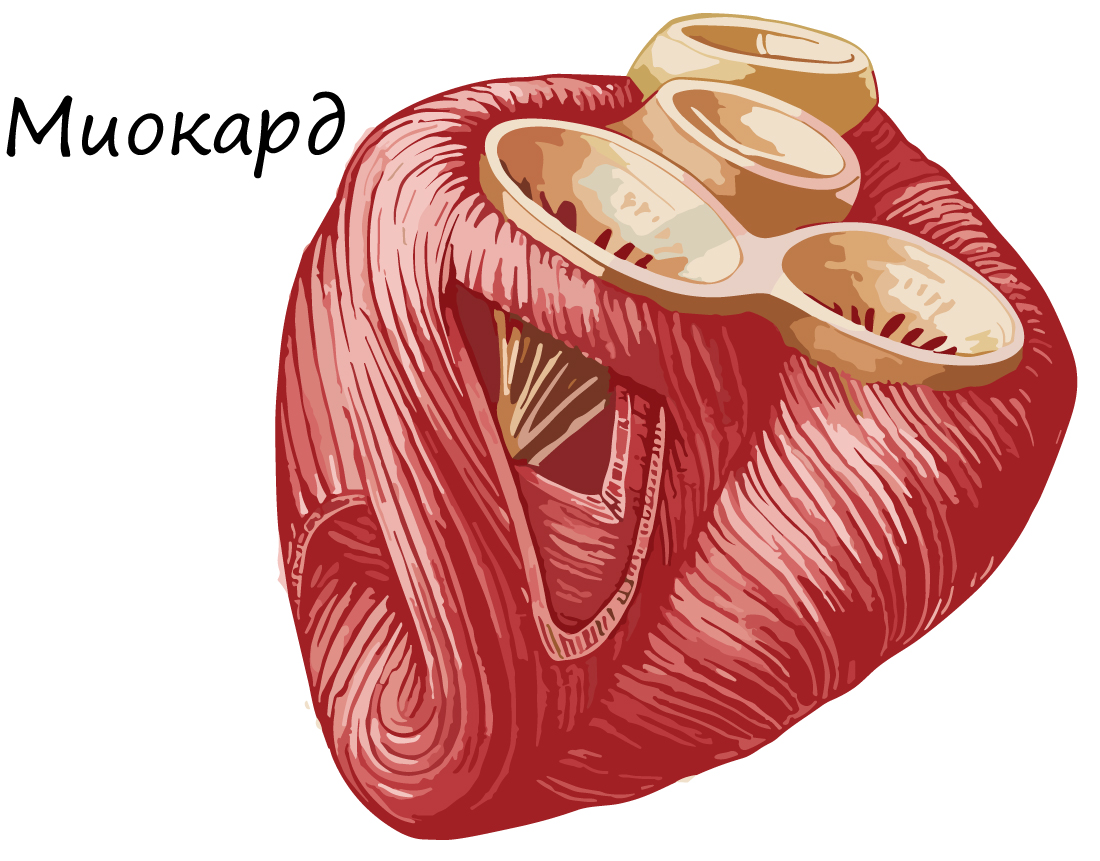
Сердечная мышечная ткань состоит из кардиомиоцитов - одиночных клеток, имеющих поперечную исчерченность. Соединяясь друг с другом, кардиомиоциты образуют функциональные волокна.
Этот тип мышечной ткани удивительным образом сочетает свойства двух предыдущих, изученных нами, тканей (возбудимость, сократимость) и имеет одно новое уникальное свойство - автоматизм.
Автоматизм - способность сердечной мышечной ткани возбуждаться и сокращаться самопроизвольно, без влияний извне. Это легко можно подтвердить, наблюдая сокращения изолированного сердца лягушки в физиологическом растворе: сокращения сердца в нем будут продолжаться несколько десятков минут после отделения сердца от организма.
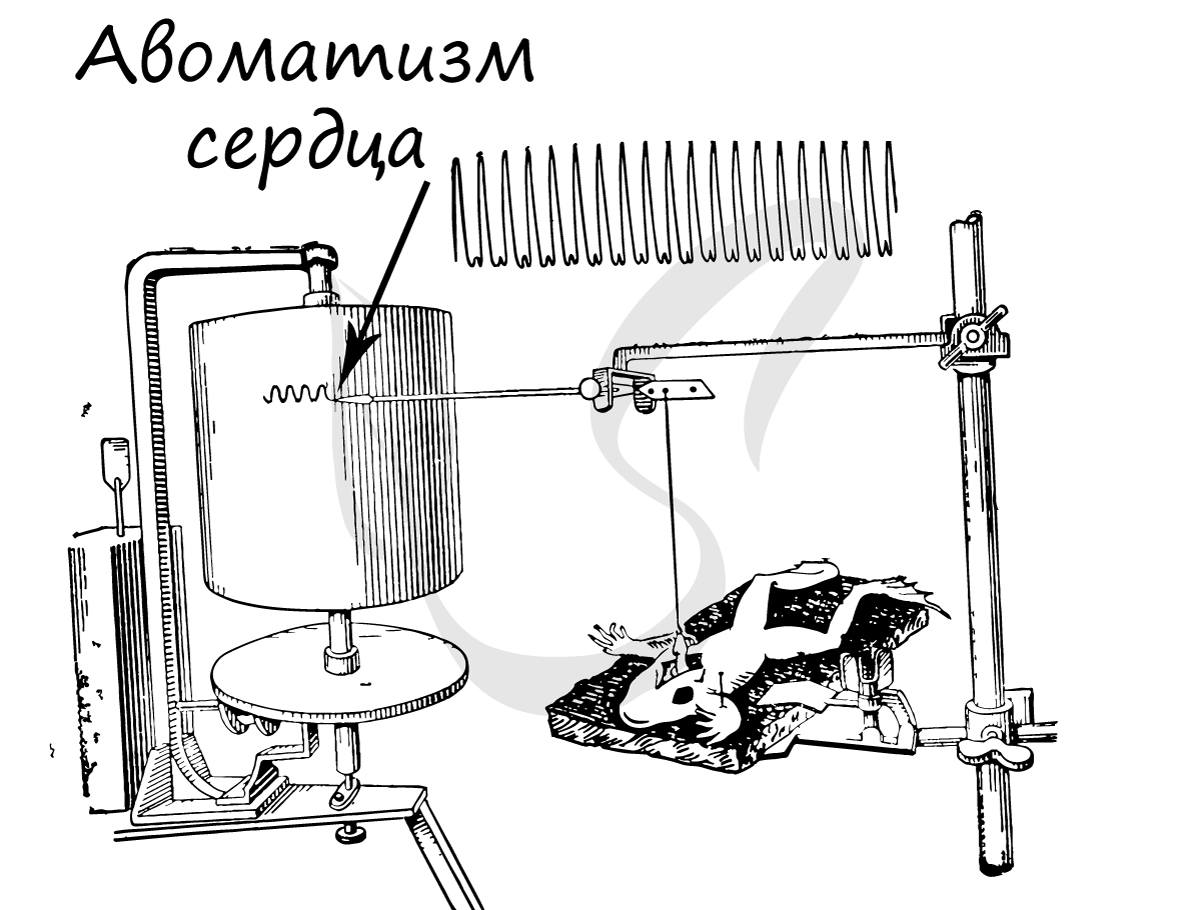
Места контактов соседних кардиомиоцитов - вставочные диски (в их составе находятся нексусы), благодаря которым возбуждение одной клетки передается на соседние, таким образом волнообразно охватываются возбуждением и сокращаются новые участки миокарда.
Большое число контактов между кардиомиоцитами обеспечивает высокую эффективность и надежность проведения возбуждения по миокарду. Сокращается эта ткань непроизвольно, не утомляется.
На рисунке или микропрепарате узнать данную ткань можно по центральному положению ядер в клетках, поперечной исчерченности, наличию вставочных дисков и анастомозов (греч. anastomosis - отверстие) - мест соединений боковых поверхностей функциональных волокон (кардиомиоцитов).

В норме возбуждение проводится по проводящей системе сердца от предсердий к желудочкам (однонаправленно). Участок сердечной мышцы, в котором генерируются импульсы, определяющие частоту сердечных сокращений - водитель сердечного ритма.
Автоматизм возможен благодаря наличию в миокарде особых пейсмекерных (англ. pacemaker - задающий ритм) клеток, которые также называют водителями ритма. Они спонтанно генерируют нервные импульсы, которые охватывают весь миокард, в результате чего осуществляется сокращение. Именно благодаря водителям ритма сердце лягушки продолжает биться, будучи полностью отделенным от тела.
Ответ мышц на физическую нагрузку
Физические нагрузки приводят к гипертрофии мышц (от др.-греч. ὑπερ- чрез, слишком + τροφή - еда, пища) - в них увеличивается количество мышечных волокон, объем мышечной массы нарастает.

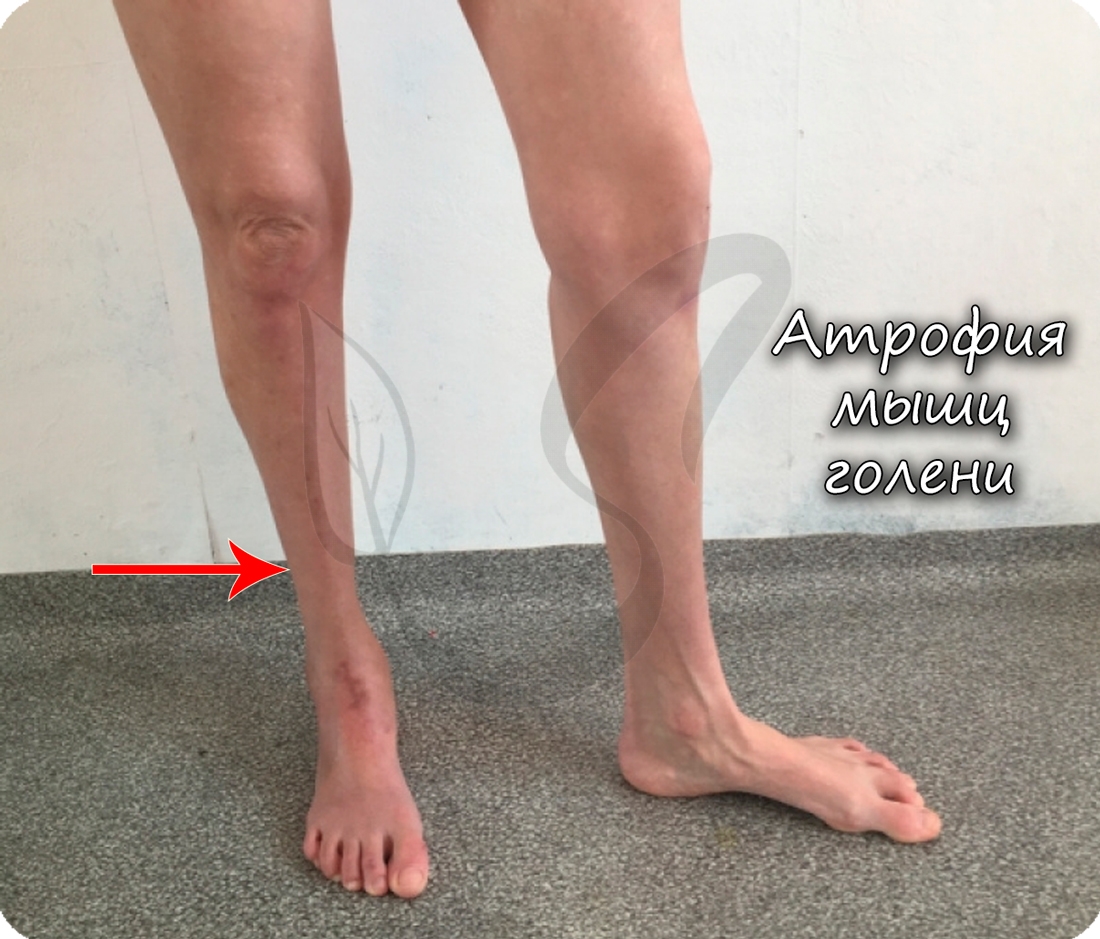
В условиях гиподинамии (от греч. ὑπό - под и δύνᾰμις - сила), то есть пониженной активности, мышцы уменьшаются вплоть до полной атрофии (греч. а – "не" + trophe – питание). В худшем случае волокна мышечной ткани перерождаются в соединительную ткань, после чего пациент становится обездвиженным.
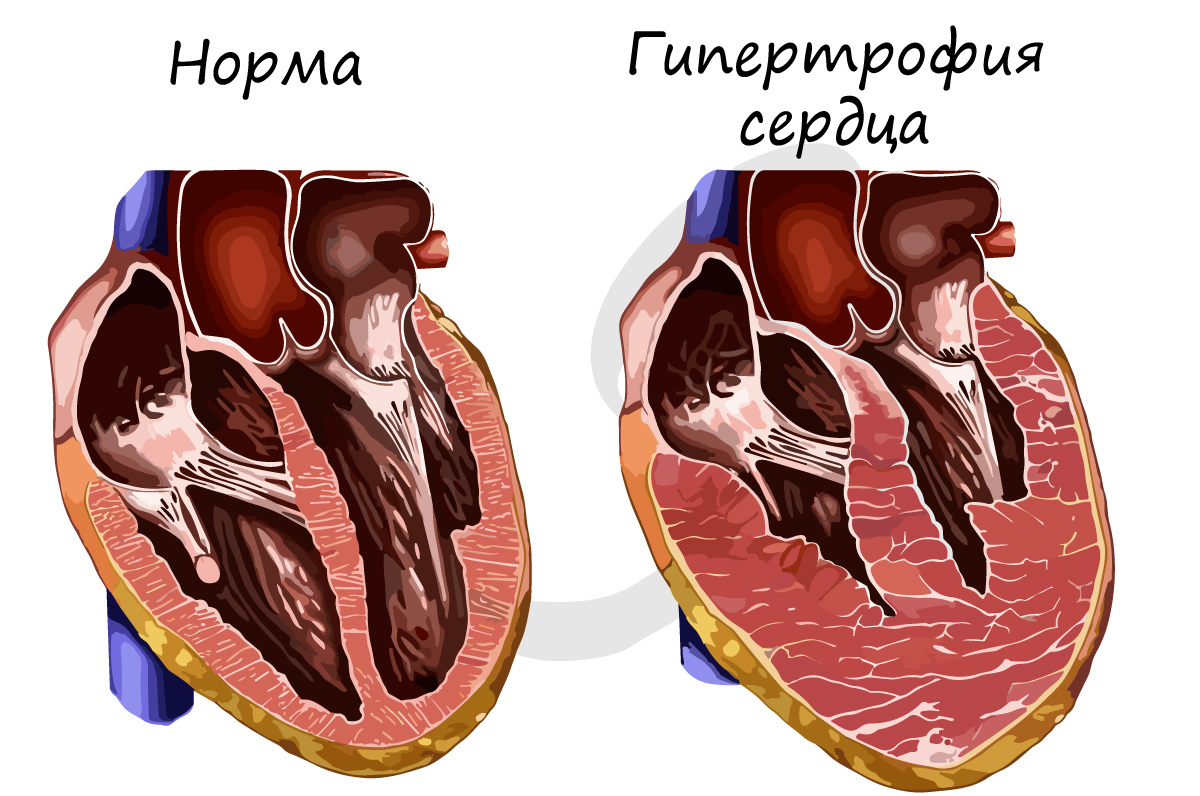
Необходимо отметить, что сердечная мышечная ткань также дает ответную реакцию на чрезмерную нагрузку: сердце увеличивается в размере, нарастает масса миокарда. Причиной могут быть генетические заболевания, повышенное артериальное давление. Гипертрофия сердца - состояние, требующее вмешательства врача и наблюдения за пациентом.
В большинстве случае гипертрофия сердца обратима, а у спортсменов наблюдается так называемая физиологическая гипертрофия (вариант нормы).
Происхождение мышц
Мышцы развиваются из среднего зародышевого листка - мезодермы.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
При осмотре пораженной конечности выявляют бледность и истончение кожных покровов, выпадение волос и гипотрофию мышц. На нарушение кровоснабжения ног указывают также снижение кожной температуры и отсутствие пульсации артерий на всех уровнях дистальнее места окклюзии.
Стадии хронической ишемии
Выраженность болевого синдрома при различных функциональных состояниях и трофические нарушения отражают степень нарушения артериального кровообращения в конечности и позволяют определить стадию заболевания. В клинической практике широко используется классификация выраженности хронической ишемии нижних конечностей Fontaine – Покровского, которая выделяет четыре стадии (табл. 3. ).
Степени острой ишемии
Острый тромбоз и эмболия проявляются синдромом острой ишемии конечности. При этом у больного внезапно возникает боль в пораженной конечности, появляются чувство онемения и похолодания, расстраивается поверхностная и глубокая чувствительность. При выраженной ишемии быстро нарушаются активные движения в конечности, вплоть до полной обездвиженности. Появление субфасциального отека мышц служит признаком тяжелой ишемии конечности. Самым грозным признаком острой артериальной непроходимости служит ишемическая мышечная контрактура с нарушением пассивных движений в суставах. Этот симптом свидетельствует о начинающихся некробиотических изменениях в мягких тканях и угрозе гангрены конечности. Степень выраженности клинических проявлений и скорость их нарастания зависит от состояния коллатерального кровообращения в пораженной конечности и отражает степень ее ишемии. По клиническим признакам различают три степени острой ишемии конечности (табл. 4. ).
Более точно оценить степень нарушения кровообращения в конечности, уровень и распространенность поражения позволяют инструментальные методы диагностики.
Инструментальная диагностика
Пациентам с ишемией конечностей в первую очередь необходимо выполнить ультразвуковое допплеровское исследование. Этот метод дает возможность определить уровень окклюзии и объективно оценить степень нарушения кровоснабжения дистальных отделов пораженной конечности.
При допплерографии производят измерение максимального артериального систолического давления на разных сегментах конечности и рассчитывают так называемые индексы давления. Чаще всего определяют лодыжечно-плечевой индекс (ЛПИ), который выражает соотношение давление в артериях голени и плечевой артерии. В норме данный индекс равен или превышает единицу. Индекс ниже 0, 9 почти всегда отражает наличие гемодинамически значимого стеноза или окклюзии магистральной артерии. Величина этого показателя ниже 0, 3 отражает критическое снижение кровообращения и угрозу развития гангрены конечности. Более полную информацию о состоянии артериального русла дает ультразвуковое ангиосканирование. Метод позволяет точно определить степень и протяженность поражения сосуда и выбрать адекватный метод хирургического вмешательства.
Тактика лечения
Другой принципиальный подход должен быть к больным с III и IV стадиями ишемии. При этих степенях ишемии конечности наилучшие результаты дает реконструктивная сосудистая операция. При IV стадии ишемии реконструктивная операция сочетается с некрэктомией или малой ампутацией. При невозможности улучшения кровообращения у больных с критической ишемией производят ампутацию конечности. Следует подчеркнуть, что 90% ампутаций нижних конечностей во всем мире выполняется именно по поводу критической ишемии. На фоне сахарного диабета критическая ишемия встречается примерно в 5 раз чаще.
Тактика лечения острой артериальной непроходимости зависит от причины ее вызвавшей и определяется степенью ишемии конечности (табл. 5). При умеренной ишемии крайней необходимости в экстренной операции нет и существует возможность для проведения пробной консервативной терапии. Это может быть антикоагулянтная терапия, катетерный тромболизис или катетерная тромбэктомия. При безуспешности подобного лечения больным показана срочная тромбэмболэктомия или реконструктивная операция на магистральных сосудах. Выраженная острая ишемия конечности требует экстренного восстановления артериального кровотока. В этой ситуации только полноценное хирургическое устранение окклюзии обеспечивает сохранение жизнеспособности конечности и восстановление ее функции. При тотальной ишемической контрактуре конечности восстановление артериального кровотока противопоказано в связи с развитием некорригируемого постишемического синдрома и угрозой полиорганной недостаточности. В подобной ситуации срочная первичная ампутация конечности может быть единственно возможной мерой спасения жизни больного.
Ни возраст больного, ни наличие ИБС, ни перенесенные ранее инфаркты миокарда, ни артериальная гипертензия, ни другие заболевания не являются противопоказанием для проведения сосудистой операции. Противопоказаниями могут служить лишь сердечная недостаточность 2Б-3 степени, наличие крайней степени хронической почечной недостаточности, требующей проведения гемодиализа и тяжелая декомпенсированная легочная недостаточность.
Методы хирургического лечениия
Техника большинства реконструктивных сосудистых операций хорошо отработана. Изучение многолетних отдаленных результатов выявило малые различия в проходимости различных шунтов при дистальном анастомозе с подколенной артерией выше щели коленного сустава. Поэтому в этой позиции все чаще используются синтетические протезы из политетрафторэтилена. При необходимости шунтирования артерий с дистальным анастомозом ниже щели коленного сустава предпочтительнее использовать большую подкожную вену больного.
В последнее десятилетие в лечении облитерирующих заболеваний артерий нижних конечностей все шире используются эндовазальные вмешательства. Стентирование артерий нижних конечностей выполняют начиная со II стадии заболевания. Наиболее часто выполняется стентирование подвздошных, поверхностной бедренной и подколенной артерий. Однако, с каждым годом диапазон эндоваскулярных вмешательств расширяется. В настоящее время появилась возможность лечить миниинвазивным способом поражения и более мелких артерий. Идеальным для стентирования типом поражения является короткий концентрический стеноз или изолированная окклюзия протяженностью менее 5 см для подвздошных и менее 10 см для поверхностной бедренной артерий. Полное исчезновение или значительное уменьшение выраженности симптомов ишемии нижних конечностей отмечается в 90-95% наблюдений. Проходимость расширенного просвета подвздошных артерий в течение 5 лет после эндоваскулярных операций составляет 85-90%, бедренных артерий – 60-75%. Чем дистальнее располагается оперированный сегмент и меньше его диаметр, тем хуже результаты реваскуляризации. Причинами рестеноза в отдаленные сроки после стентирования является гиперплазия неоинтимы, реже – механическая деформация стента.
Диагностические критерии неспецифического аортоартериита
(Американская ревматологическая ассоциация, 1990) Таблица 1.
¨ Возраст менее 40 лет
¨ Ослабление пульса на лучевой артерии, ослабление пульсации на одной или обеих плечевых артериях.
¨ Разница систолического АД на правой и левой плечевых артериях более 10 мм рт. ст.
¨ Систолический шум над подключичными артериями или брюшной аортой.
¨ Ангиографические изменения: сужение или окклюзия аорты и/или ее ветвей, не связанное с атеросклерозом, фибромускулярной дисплазией или другими причинами. Изменения обычно локальные или сегментарные.
Диагностические критерии облитерирующего тромбангиита
¨ Начало до 45 летнего возраста
¨ Отсутствие источника эмболии
¨ Отсутствие травмы
¨ Отсутствие аутоиммунного заболевания
¨ Отсутствие диабета
¨ Отсутствие гиперлипидемии
¨ Отсутствие гиперкоагуляции
¨ Нормальные проксимальные артерии
¨ Объективное доказательство дистальных окклюзий (ангиография, ангиосканирование и т. д. )
Диагностические критерии облитерирующего тромбангиита:
- Большой критерий – ишемия нижних конечностей у курящих молодых людей при отсутствии гиперлипидемии, сахарного диабета, системных заболеваний соединительной ткани, гематологической патологии или троьбоэмболии.
- Повторный мигрирующий тромбофлебит.
- Ишемия верхних конечностей.
Стадии хронической артериальной недостаточности. Таблица 3.
I – Начальные проявления (зябкость, похолодание, парестезии,
безболевая ходьба до 1 000 м).
II – Недостаточность кровообращения при функциональной нагрузке
II А - более 200 м;
II Б - менее 200 м.
III – Недостаточность кровообращения в покое (боли в покое или при
IV – Язвенно-некротические изменения конечности.
Степени острой ишемии конечности Таблица 4.
I – Онемение, парестезии, боль в покое или при физической нагрузке.
II – Двигательные расстройства и/или субфасциальный отек:
II А - Парез (ограничение активных движений) ;
II Б - Паралич (отсутствие активных движений) ;
II В - Субфасциальный отек.
III – Контрактура конечности:
III А - Парциальная контрактура;
III Б - Тотальная контрактура.
Тактика ведения больных с острой артериальной окклюзией
Характер артериальной окклюзии
Эмболия
Тромбоз
I
Баллонная ангиопластика и стентирование
Срочная реконструктивная операция
II
А
II
Б
Экстренное хирургическое восстановление
II
В
Экстренное хирургическое восстановление
артериального кровотока + фасциотомия
III
А
Экстренное хирургическое восстановление артериального кровотока + фасциотомия + некрэктомия
Ножные мышцы постоянно подвергаются нагрузке натяжением, но риск их растяжения актуален только тогда, когда:
- степень натяжения превышает предельную способность мышечного волокна ноги растягиваться (растяжение в спорте, физические перегрузки);
- нагрузка прилагается на не разогретые мышцы;
- после длительной гиподинамии в части ног при резком начале движения.
Растяжение мышц при этом не сопровождается серьезными последствиями (при своевременной реакции) и наблюдается значительно реже, чем повреждение связок ноги. В том числе, потому что сами мышцы по структуре больше, и в ноге их меньше, чем сухожилий (в зоне риска растяжения – всего 4 крупные мышцы). Тем не менее игнорировать растяжение не получится.
Что происходит с мышцей при чрезмерном натяжении?

Прежде всего, из-за ключевого сигнала о растяжении – резкой или нарастающей, пульсирующей боли. Характерная особенность последнего синдрома при растяжении: он усиливается при любой активности поврежденной ноги и снижается при полном бездействии мышц.
Кроме боли, при растяжении наблюдаются:
- покраснение тканей;
- могут иметь место подкожные излияния-гематомы или синяк;
- локальное нарастание температуры (в зоне растяжения кожа становится горячей и пульсирует);
- припухлость ноги.
Виды растяжений:
Как отличить мышцы от связок?
Ключевая задача врача травматолога при жалобах на растяжение мышечной ткани ноги – правильно и быстро отличить растяжение мышечных и сухожильных волокон. По уровню серьезности травмы не отличаются: те же три степени от легкой до тяжелой. А вот реакция на растяжение мышцы нужна не такая комплексная и сложная, как в случае с суставными элементами.
Для распознавания растяжения проводят объективный осмотр (уже по тому, когда возникает дискомфорт в ноге, врач может сделать первые выводы). На следующем уровне – УЗИ части ноги, в которой имеет место растяжение, для контроля воспалительного процесса. При сильных повреждениях мягких тканей ноги желателен рентгенологический контроль.
Помощь при болевых синдромах – самостоятельная и профессиональная

Помощь при травме мышц первоначально должен оказать себе сам больной или его окружение. Первые действия с ногой:
Если боли через 2–3 дня снизились, а отек мышц спадает, можно применять согревательные ванночки. На 4–5 день мышцы можно мягко массировать, накладывать специальные пластыри (тейпы), выполнять упражнения.
Если нога продолжает сильно болеть, в мышце заметны изменения (отечность, пульсация), отек не спадает, – следует обратиться к травматологу. Последний назначит индивидуальную программу ЛОФ, правильное обезболивание, выпишет направление на процедуры физиотерапии. Часто для снижения дискомфортной симптоматики используют методы иглоукалывания, акупунктуры, кинезио тейпирования.
Как правило, на восстановление мышц уходит от 2-х недель до месяца. При грамотном сопровождении (массаж, компрессы, ЛОФ) последствий растяжение не имеет.
Читайте также:

