Анализ и методика изложения темы фазы фазовое равновесие фазовые переходы
Обновлено: 30.06.2024
Презентация на тему: " ФАЗОВОЕ РАВНОВЕСИЕ ФИЗИЧЕСКАЯ ХИМИЯ. ЛЕКЦИЯ 8.. Основные понятия Фазовым равновесием называется равновесие, которое устанавливается при переходе вещества." — Транскрипт:
1 ФАЗОВОЕ РАВНОВЕСИЕ ФИЗИЧЕСКАЯ ХИМИЯ. ЛЕКЦИЯ 8.
2 Основные понятия Фазовым равновесием называется равновесие, которое устанавливается при переходе вещества из одной фазы в другую без изменения химического состава ( Δ G=0) Примеры : плавление - кристаллизация испарение - конденсация сублимация - конденсация аллотропические превращения веществ другие 2
3 Основные понятия Фаза – гомогенная часть системы, которая на всём протяжении обладает одинаковыми термодинамическими свойствами и отделена от других частей системы поверхностью раздела Фаза может быть образована одним или несколькими составляющими веществами Составляющим веществом или компонентом фазы называют вещество, которое может быть выделено из системы и существовать вне её В воздухе азот, кислород, аргон и другие газы представляют собой составляющие вещества В водном растворе хлорида натрия NaCl и вода H 2 O являются составляющими веществами Наименьшее число составляющих веществ, через которое выражается состав любой фазы, называется числом независимых компонентов данной системы 3
4 Фазовое равновесие без химической реакции Число независимых компонентов может совпадать и не совпадать с числом индивидуальных веществ В случае фазового равновесия, установившегося без протекания химической реакции, число независимых компонентов равно общему числу компонентов Например, в смеси, состоящей из газообразных азота N 2, кислорода O 2 и аргона Ar, между которыми нет взаимодействия, число составляющих веществ равно числу независимых компонентов, т. е. трём 4
5 Равновесная система с химической реакцией Количества составляющих веществ зависят друг от друга, и состав фаз можно определить по концентрациям не всех, а лишь части веществ Число независимых компонентов равняется числу составляющих индивидуальных веществ минус число уравнений, связывающих эти вещества ( их концентрации ) Например, в смеси трёх газов HI, I 2 и H 2 возможна реакция : Между концентрациями трёх веществ устанавливается соотношение, определяемое константой равновесия : Зная концентрации двух составляющих веществ ( например, HI и H 2 ) можно определить концентрацию третьего компонента (I 2 ) Число независимых компонентов равно двум : 3 – 1 = 2, где 3 – число составляющих веществ, 1 – число уравнений, связывающих между собой их концентрации Если концентрации I 2 и H 2 в равновесной смеси равны, то добавляется ещё одно условие, связывающее между собой концентрации двух составляющих веществ в газовой фазе, и число независимых компонентов равно одному : 3 – 2 = 1 5
6 Равновесная система с химической реакцией 6
7 Степени свободы в механике Степени свободы это совокупность независимых координат перемещения и / или вращения, полностью определяющая положение системы или тела Твёрдое тело, движущееся в трёхмерном пространстве, максимально может иметь шесть степеней свободы : три поступательных и три вращательных Автомобиль, если его рассматривать как твёрдое тело, перемещается по некоторой двумерной поверхности ( в двумерном пространстве ); он имеет три степени свободы ( одну вращательную и две поступательные ) Поезд перемещается по рельсовому пути и поэтому имеет только одну степень свободы 7 Степени свободы двухатомной молекулы связаны с поступательным движением (3 степени свободы ) и вращением ( две степени свободы ), всего 5 степеней свободы
8 Термодинамические степени свободы Термодинамической степенью свободы ( числом степеней свободы или вариантностью системы ) называют число параметров, которые можно независимо менять, не меняя при этом числа и вида фаз данной системы ( т. е. так, чтобы не появлялись новые и не исчезали старые фазы ) Термодинамические параметры, которые можно произвольно менять : температура T давление P объём V концентрации веществ с i 8
9 Правило фаз Гиббса Основной закон фазового равновесия Является применением второго закона термодинамики к изучению превращений в гетерогенных системах, в которых возможны как переходы веществ из одной фазы в другую, так и химические реакции Число степеней свободы С ( число переменных, которые можно варьировать, не изменяя фазового состояния системы ), число фаз Ф, число независимых компонентов К и внешних условий N, влияющих на равновесие, взаимно связаны соотношением : С + Ф = К + N Отсюда число степеней свободы С = К - Ф + N В состоянии равновесия С = 0 и число фаз Ф = К + N, а в общем случае, когда С 0, Ф К + N 9
10 Правило фаз Гиббса С = К - Ф + N Число внешних условий N, оказывающих влияние на состояние системы, может быть разным На фазовое равновесие обычно влияют температура и давление, т. е. два внешних условия, N=2 Число степеней свободы равновесной термодинамической системы равно С = К - Ф + 2 В некоторых системах изменение температуры или давления практически не влияют на равновесие ( например, на равновесие в конденсированных системах не влияет давление ), т. е N=1 При этом число степеней свободы уменьшается на единицу : С = К - Ф
11 Классификация систем по числу степеней свободы Безвариантные ( нонвариантные ) системы, число степеней свободы равно нулю, С = 0 Одновариантные ( моновариантные ), число степеней свободы равно единице, С = 1 Двухвариантные ( бивариантные ), число степеней свободы равно двум, С = 2 и т. д. 11
12 Фазовые равновесия в однокомпонентной системе Примеры однокомпонентных систем : вода образует три фазы : водяной пар, жидкая вода и твёрдая фаза – лёд ; известно 14 различных модификаций льда, и каждая является отдельной фазой сера кристаллизуется в ромбической и моноклинной формах, может быть в жидком и газообразном состоянии белое и серое олово, а также жидкое олово и пары олова Число степеней свободы в однокомпонентной системе ( при К = 1) С = 1 - Ф + 2 С = 3 - Ф В состоянии равновесия С = 3 – Ф = 0, т. е. Ф = 3, а в общем случае Ф (1 + 2) или Ф 3. Таким образом, в однокомпонентной системе число равновесных фаз не может быть больше трёх, т. е. могут существовать системы однофазные, двухфазные и трёхфазные 12
13 Уравнение Клаузиуса - Клапейрона Даёт зависимость давления p фазового перехода от температуры T для любых двух фаз, образуемых одним веществом : На практике для расчёта теплот фазовых переходов в каждом конкретном случае это уравнение интегрируют в интервале температур от Т 1 до Т 2 и используют в виде 13
14 Уравнение Клаузиуса - Клапейрона Фазовый переход твёрдое тело – жидкость Фазовый переход твёрдое тело – газ Фазовый переход жидкость – газ 14
15 Диаграммы состояния однокомпонентных систем ( фазовые диаграммы ) Состояние однокомпонентной системы определяется двумя независимыми параметрами, например, давлением и температурой, а объём системы есть функция этих параметров V=f(p,T) Если по трем координатным осям отложить соответственно давление, температуру и объем, то получится пространственная диаграмма, характеризующая зависимость состояния системы и фазовых равновесий в ней от внешних условий. Такая диаграмма называется диаграммой состояния или фазовой диаграммой 15 р-V-T диаграмма SL G L+G S+L S+G
16 Диаграммы состояния однокомпонентных систем ( фазовые диаграммы ) Пространственные диаграммы сложны и неудобны в применении Используют плоские фазовые диаграммы ( проекции пространственной диаграммы на плоскость ) p-T, p-V, T-V На диаграмме состояния при равновесии каждому сочетанию фаз и каждой фазе в отдельности соответствует свой геометрический образ : плоскость, линия, точка. На плоской диаграмме состояния каждой фазе соответствует участок плоскости ( область или поле ), представляющий совокупность фигуративных точек, изображающих состояния равновесной системы. Линия пересечения областей характеризует равновесие двух фаз, а точка пересечения этих линий – равновесие трех фаз. Такая точка называется тройной точкой. 16
17 Фазовые диаграммы Фазовой диаграммой или диаграммой состояния называется диаграмма, выражающая зависимость состояния системы и фазовых равновесий в ней от внешних условий или ее состава. Показывает, какие фазы могут существовать при данных условиях Фазы, существующие в равновесии одновременно, называются сосуществующими фазами. Кривые фазового равновесия – линии, отражающие на фазовой диаграмме состояния сосуществующих фаз. Три фазовых поля : твердая фаза (solid phase), жидкая фаза (liquid phase), газообразная фаза (gaseous phase). Три кривые фазового равновесия : кривая испарения, кривая плавления, кривая возгонки ; описываются соответствующим уравнением Клапейрона - Клаузиуса. Тройная точка : точка, в которой одновременно равновесно существуют три фазы – твердая, жидкая и газообразная Правило фаз : С = К - Ф +2 Для однокомпонентной системы С =3- Ф Если Ф = 1, то С =2, система двухвариантная / бивариантна ; однофазная область описывается полем ; т. е. можно менять температуру и давление, и это не вызовет изменения числа и вида фаз системы ; Ф = 2, то С =1, система одновариантная / моновариантная ; двухфазная область описывается линией ; т. е. можно менять либо температуру, либо давление, вторая переменная изменится согласно уравнению Клапейрона - Клаузиуса Ф = 3, то С =0, система безвариантная / нонвариантная ; трехфазная область описывается точкой. 17 Фазовая диаграмма р= f(Т) однокомпонентной системы при V=const
18 18 Для вещества с несколькими кристаллическими модификациями диаграмма состояния имеет более сложный характер На рисунке изображена диаграмма для случая, когда число различных кристаллических модификаций равно двум. В этом случае имеются две тройные точки В точке Tp в равновесии находятся жидкость, газ и первая кристаллическая модификация вещества, В точке Tp´ находятся в равновесии жидкость и обе кристаллические модификации
19 19 Диаграмма состояния для каждого конкретного вещества строится на основе экспериментальных данных. Зная диаграмму состояния, можно предсказать, в каком состоянии будет находиться вещество при различных условиях ( при различных значениях p и T), а так же какие превращения будет претерпевать вещество при различных процессах
20 Фазовая диаграмма воды 20 Диаграмма состояния воды при средних давлениях (до 1 МПа)
21 21 Диаграмма состояния воды при высоких давлениях
22 Фазовая диаграмма серы Сера образует две кристаллические модификации : ромбическую и моноклинную Возможно существование четырех фаз : ромбической, моноклинной, жидкой и газообразной А, В и С – тройные точки 22
23 Фазовая диаграмма диоксида углерода СО в жидком состоянии может быть получен только при высоких давлениях. При атмосферном давлении твердый диоксид углерода переходит в газообразное состояние, минуя жидкую фазу. Этот процесс протекает достаточно медленно, что позволяет использовать двуокись углерода в качестве хладагента ( сухого льда ) 23 Критическое состояние диоксида углерода

Закон действия масс является законом для гомогенных систем, однако на практике часто приходится иметь дело с гетерогенными системами, в которых вещества находятся в различных агрегатных состояниях.
Равновесие в гетерогенных системах рассматривается применительно закона равновесия фаз или правила фаз (выведенное американским ученым Д. Гиббсом в 1873-1876 г.). Оно устанавливает, при каких условиях (температуре, давлении, концентрациях веществ) отдельные однородные участки гетерогенных систем (фазы) находятся в состоянии термодинамического равновесия.
Молекулы жидкостей и твердых тел при любой температуре могут переходить в газообразную фазу. Переход жидкости в газообразную фазу называется испарением, обратный процесс – конденсацией.
Переход вещества из твердой фазы в газообразную, минуя жидкую фазу – сублимация (возгонка), обратный процесс – десублимация.
Возможен переход твердого вещества в жидкое состояние – плавление, а наоборот – кристаллизация. Все эти процессы, при которых вещества без изменения химического состава вещества переходом из одного агрегатного состояния в другое, называются фазовым переходом.
Основные понятия
Фаза (Ф) – однородные участки системы, отделенные друг от друга видимыми поверхностями раздела.
(Система, состоящая из воды и льда – две фазы (Ф=2): одна жидкая, вторая – твердая.
Смесь газов в закрытом сосуде – система состоит из одной фазы (Ф=1).
Насыщенный раствор соли в воде – 3х фазная система: твердая соль, жидкость, пар над раствором).
Гетерогенная система – система, состоящая из нескольких фаз.
Гомогенная система – состоящая из одной фазы.
Между фазами гетерогенной системы установиться равновесие, которое называется фазовым равновесием.
(Примером может служить наступление равновесия в системе насыщенный раствор соли – в равновесии находятся жидкий раствор и кристаллы. Скорость растворения в такой системе равна скорости кристаллизации.)
Гетерогенная система может состоять из одного или нескольких компонентов.
Компонент (К) – независимая часть системы, которая может быть выделена и существовать самостоятельно.
Для физических реакций или систем, в которых не идут химические реакции, число компонентов равно числу составных частей, входящих в систему (числу химически индивидуальных веществ).
Например, в системе водного раствора хлорида натрия два компонента: вода и хлорид натрия. К=2.
В системе, состоящей из трех различных фаз

Вещество одно H2O К=1.
Для химических реакций (когда в системе идет реакция) число компонентов равно числу составных частей минус число реакций, протекающих между этими веществами.

К=3. Реакция одна.

Если менять условия p, t, концентрацию в гетерогенной системе, равновесие будет смещаться.
Но эти параметры можно менять без смещения равновесия.
Например, если Т=const, сжимать насыщенный пар (давление увеличивается), то пар будет конденсироваться, все равно система состоит из 2х фаз: пар и жидкость.
Число условий, которые можно менять произвольно, не меняя числа и вида фаз, называется числом степеней свободы (С).
Соотношение между числом и видом фаз называется правилом фаз.
Число фаз + число степеней свободы = числу компонентов плюс 2.
С – число степеней свободы.
К – число компонентов.
Если С = 1, т.е. степень свободы равна 1 – одновариантные системы.
С = 2 двухвариантные системы.
С = 0 безвариантная система.
Пример 1. Определить степень свободы для систем, состоящих:
А) раствор KNO3 и раствор NaNO3 в присутствии кристаллов KNO3 и кристаллов NaNO3 и паров Н2О. Система физическая.
Число веществ KNO3, NaNO3, Н2О равно трем.
Число фаз: жидкая, пары воды, две твердые KNO3 и NaNO3. Ф = 4.
Б) Раствор обеих солей в присутствии льда, кристаллов KNO3, NaNO3 и
паров Н2О.
В) Раствор обеих солей в присутствии льда и паров Н2О.
Двухвариантная система (можно из 2 параметра Т, концентрацию).
Пример 2. При сплавлении молей КСl и NaNO3 идет реакция.

Определить степень свободы, если жидкий расплав находится в равновесии с кристаллами NaNO3.
Так как система состоит из жидкой и твердой фазы
С = 3 – 2 + 1 = 2. Двухвариантная система.
Вычислить максимальное число фаз и число степеней свободы для однокомпонентной системы.
Предположим фаз = 1.
Для однокомпонентной системы максимальное число фаз равно трем, а степень свободы двум.
Урок №2: Однокомпонентные системы.
Диаграмма состояния воды.
В однокомпонентной системе (гетерогенной) фазы состоят из одного вещества (т.е. фаз несколько: пар, лед, жидкость, а вещество одно: вода, или S, Fe, FgNO3). На однокомпонентных системах, не содержащих примеси, изучаются физические и химические свойства веществ.
В однокомпонентной системе число равновесных фаз не может быть больше трех:
▲ При большем числе фаз число степеней свободы будет отрицательным, что не имеет физического смысла.
Предположим, что Ф = 1 (лед, вода, пар).
Если К = 1 ,Ф = 1, С = К – Ф + 2 = 1 – 1 + 2 = 2.
В этом случае можно изменять и температуру, и давление без нарушения равновесия, причем изменение одного параметра не вызовет изменения другого.
Если К = 1, Ф = 2, С = 1 – 2 + 2 = 1.
Ф = 2 (лед ↔ пар, вода ↔пар, лед ↔ вода и т.д.)
В этом случае можно изменить только один параметр без нарушения равновесия, при этом второй параметр изменяется в зависимости от первого.
Наступает равновесие, которое характеризуется определенными параметрами (р и Т) и ни один из них не может быть изменен без нарушения равновесия системы.
Вывод: в однокомпонентной системе: 1) наибольшее число фаз равно трем; 2) степенно свободы равна 2 (изменять возможно t, p, а концентрация остается неизменной величиной).
Рассмотрим графическую зависимость фазового состояния однокомпонентных систем, например, воды от внешних условий (p и T).

Такие графики называются фазовые диаграммы или диаграммы состояния. Их строили на основе экспериментальных данных.
На диаграмме состояния воды имеются три линии АО, ВО, СО, пересекающиеся в точке О и разделяющие всю систему на 3 части.
ОВ – показывает зависимость давления насыщенного пара над жидкой водой от температуры (или ее можно характеризовать как зависимость температуры кипения от давления).
Кривая ОВ обрывается при ординате t = 374 0 С – это критическая температура воды, а при более высокой температуре жидкая вода не может существовать.
Кривую ОС можно определить как зависимость температуры плавления льда (или замерзания жидкой воды) от давления.
Она имеет небольшой наклон влево т.е. с повышением давления температура уменьшается. Такой ход кривой характерен только для веществ (вода, Ag, Bi), т.к. это связано с тем, что при затвердевании их объем увеличивается (вода в бутылке, когда замерзнет, может разорвать ее).
У большинства же веществ при затвердевании объем уменьшается и кривая ОС будет смещена вправо.
На графике выделяются три области:
1) АОС – область льда (вода может быть только в виде льда при p и t, лежащих в этой области).
2) ВОС – область жидкой воды.
3) АОВ – область пара.

Все кривые пересекаются в точке О, которая соответствует равновесию трех фаз:
(На данной диаграмме масштаб не выдержан)
По правилу фаз число степеней свободы равно:
Если возьмем точки, лежащие на кривых, тогда для этих точек К = 1, а фаз Ф = 2. Например,

Значит можно менять произвольно только один параметр, но чтобы сохранить равновесие, который тоже будет меняться в зависимости от первого.
Для точек А или В, С, лежащих в любой из областей, К = 1, Ф = 1.

Число степеней свободы С = 1 + 2 – 1 = 2, т.е. в известных пределах можно менять значение двух факторов (р, t) независимо друг от друга, не изменяя числа фаз.
Наибольшее давление насыщенного пара наблюдается при критической температуре воды (374 0 С) и равно 2,212*10 7 Н/м 2 .

Примером относительно простой фазовой диаграммы с двумя кристаллическими фазами может служить диаграмма состояния углерода. Углерод встречается в двух кристаллических формах – в виде алмаза и графита. Эти две формы образовались при медленном охлаждении магмы – жидкой массы, находящейся в глубинных слоях земной коры. При высоких температуре и давлении из растворенного в магме углерода кристаллизовался алмаз – более устойчивая кристаллическая форма при этих условиях. По мере охлаждения магмы температура и давление понижались до таких значений, при которых кристаллизация алмаза прекращалась и начиналась кристаллизация графита. В принципе, алмаз в обычных условиях представляет собой неустойчивую форму углерода, не успевшую при охлаждении магмы превратиться в графит. При давлении же свыше 6000 МПа и температурах 1500-2000 К графит превращается в алмаз. На этом основано получение искусственных алмазов.
Урок №3:Равновесие в двухкомпонентных системах.
Примером двухкомпонентной системы являются сплавы из двух металлов, или расплавы солей.
К = 2 С = 2 + 2 – Ф
К = 2 Ф = 1 С = 2 + 2 – 1 = 3
К = 2 Ф = 2 С = 2 + 2 – 2 = 2
К = 2 Ф = 3 С = 2 + 2 – 3 = 1
К = 2 Ф = 4 С = 2 + 2 – 4 = 0.
Наибольшее число фаз, находящихся в равновесии в 2х-компонентной системе равно 4 (например, 2 твердые фазы одного и второго компонента, жидкая форма и пар).
Наибольшее число степеней свободы равно 3 при Ф = 1 – температура, давление, концентрация одного из компонентов (С1), концентрация второго компонента, зависящая от первой и находится из уравнения С2 = 100% - С1 (концентрацию выражают в мольных или весовых долях, %).
В общем случае для построения диаграммы состояния 2х-компонентной системы пользуются тремя осями координат: t, p, c. При этом получаются пространственные модели.
При изучении конденсированных систем, состоящих только из жидких и твердых фаз.
Фактор давления можно не учитывать и если исследование проводится при атмосферном давлении, колебания которого незначительны.
В этом случае построение фазовых диаграмм упрощается (плоское изображение в координатах: температура – концентрация).
Примером конденсированных 2х-космпонентных систем служит сплав из двух нелетучих металлов.
Главный метод изучения сплавов – термический анализ.
Проводим термический анализ сплавов висмута (Bi) с кадмием (Сd). Имеем ряд образцов состава:
Каждый из образцов расплавляют и затем медленно охлаждая регистрируют температуру расплава через определенные промежутки времени термометром. По полученным данным строят кривые охлаждения.
Кривая 1 характеризует охлаждение чистого Bi. Вначале температура понижается (происходит охлаждение расплавленного висмута).
Кривые охлаждения сплавов и диаграмма Bi – Cd.

При 271 0 С Bi начинает кристаллизоваться: температура при этом постоянная.
Постоянная температура при отвердевании связана с безвариантностью системы.
Ф = 2 (жидкая и твердая). С = К + 1 – Ф = 1 + 1 – 2 = 0.
После того, как весь Bi отвердеет, температура понижается равномерно, происходит охлаждение отвердевшего металла.
Кривая 7 – кривая охлаждения чистого Сd t = 321 0 C (аналогично кривой №1).
Кривые 2, 3, 4, 5, 6 характеризуют остывание сплавов различного состава.
Кривая 2. Вначале t падает, охлаждается жидкий сплав. При некоторой t скорость охлаждения становится меньшей, так как в жидкости появляются первые кристаллы висмута, и выделяющаяся при этом теплота кристаллизации частично компенсирует охлаждение жидкого сплава. По мере охлаждения из жидкого сплава все больше выделяется кристаллов висмута и увеличивается содержание кадмия в жидкой фазе. При достижении определенной температуры и состава жидкой фазы наряду с висмутом начинает кристаллизоваться и кадмий. Температура при этом остается постоянной до тех пор, пока полностью не отвердеет сплав. После этого начинается равномерное охлаждение застывшего сплава.
Кривая 3. Подобным же образом происходит охлаждение сплава 3, однако начало кристаллизации висмута из жидкого сплава (точка излома) наблюдается при более низкой t, чем у сплава 2.
При охлаждении сплавов 5 и 6 из жидкой фазы первоначально выпадают кристаллы кадмия.
Из сопоставления кривых охлаждения 2, 3, 5 и 6 видно, что процесс кристаллизации сплавов не происходит при какой-то одной постоянной температуре, а захватывает определенный интервал. При этом начало кристаллизации сплавов различного состава наблюдается при различных температурах, окончательное отвердевание их происходит при одной и той же температуре (140 0 ).
Исключение Кривая 4. Она имеет такую же форму как и у чистых металлов. При охлаждении такого сплава вплоть до 140 0 кристаллизация не происходит. При 140 0 из жидкой фазы в виде кристаллов одновременно начинают выпадать оба компонента, причем состав выпадающей твердой фазы одинаков с составом жидкого сплава. Этот сплав, который обладает наиболее низкой температурой кристаллизации, называется эвтектическим.
При температуре эвтектики в равновесии находятся 3 фазы:
Число компонентов К = 2.
С = К + 1 – Ф = К + 1 – 3 = 0.
Эвтектика механическая смесь, она неоднородна и состоит из мелких кристаллов одного и другого компонента.
▲ Одновременная кристаллизация обоих компонентов мешает образованию крупных кристаллов.
Температура окончания кристаллизации всех сплавов одинакова и лежит на одной прямой СD.
Это линия, отвечающая температурам полного отвердевания, называется линией солидуса. (Солидус – твердый, плотный).
Область диаграммы выше линии АЕВ характеризует жидкие сплавы всевозможного состава.
Правило фаз для этой области:
Ф = 1 (жидкая фаза)
С = К + 1 – Ф = 2 + 1 – 1 = 2.
Т.е. как бы не изменялись состав сплавов и температура, количество фаз остается прежней (одна фаза).
Кривая АЕВ, отвечающая температуре начала кристаллизации, называется линией ликвидуса.
Область ниже прямой СD составляет твердый сплав Bi и Cd.
Точка Е выражает состав и температура плавления эвтектического сплава .
При этом Ф = 3. С = 0.
Поле АЕС – область сплавов с содержанием Cd менее 40%, отвечает одновременному сосуществованию в равновесии жидких расплавов переменного состава с кристаллами висмута.
В этом случае Ф = 2, С = 1, т.е. т.а. до известного предела определенной t соответствует строго определенный состав жидкой фазы, находящейся в равновесии с кристаллами.
Поле ВЕD – область сплавов с содержанием Cd более 40%, характеризует равновесие жидких сплавов различного состава с кристаллами Сd при определенной температуре.
Точка А является температурой плавления чистого висмута.
Точка В – температура плавления чистого Cd.
По мере добавки к Bi кадмия или Cd висмута температура плавления металлов понижает t плавления понижается.
Всякая примесь, находящаяся в веществе, снижает его t плавления.
Линия BЕ - процесс кристаллизации Cd из жидких сплавов.
Одновременно линии АЕ и ВЕ указывают как изменяется состав жидкой фазы по мере кристаллизации Bi и Cd.
При 140 0 состав твердой фазы одинаков с составом жидкого сплава.
Вид, подобный диаграмме Сd – Bi ….. вещества, неограниченно растворимые в жидком состоянии и не образующие между собой химических соединений и твердых растворов (Pb – Ag, Al - Si).
Руководствуясь диаграммами плавкости, можно подбирать состав сплавов, обладающих определенной температурой плавления (низкой или высокой).
Если из данной пары веществ нужно получить сплав с низкой температурой плавления, то компоненты берут в таком соотношении, в каком они находятся в эвтектическом сплаве.
По диаграмме можно также определять состав сплавов, обладающих наиболее высокими температурами плавления, хорошими механическими свойствами (мелкозернистые эвтектические сплавы), области устойчивости и распада образующихся химических соединений, твердых растворов, условия образования новых кристаллических модификаций и т. д. Фазовые диаграммы состояния широко используют при получении различных сплавов, при расчетах состава шлаков, шихты для получения стекла, цемента, огнеупорных материалов.
Диаграммы состояния применяют также для нахождения состава сплава, предварительно точно определив его температуру плавления (т. е. для целей анализа). При этом очень важно, чтобы в данной смеси не присутствовали примеси посторонних веществ, которые могут исказить результаты анализа.
В Советском Союзе в области изучения фазовых равновесий работал крупнейший ученый и выдающийся деятель отечественной промышленности Н. С. Курнаков (1860—1941 гг.). Изучение Н. С. Курнаковым равновесий в различных солевых системах способствовало выяснению условий кристаллизации солей в природе, что дало возможность научно эксплуатировать солевые богатства нашей страны. Н. С. Курнаковым совместно с учениками были решены такие важные солевые проблемы, как проблемы извлечения глауберовой соли Na2SO4•10Н2О из вод залива Каспийского моря — Кара-Богаз-Гола, проблема переработки соликамского карналлита KCl • MgCl2 • 6H2O с целью извлечения из него чистого хлористого калия и получения фосфорно-аммиачно-калиевых концентрированных удобрений в формах, легко усваиваемых растениями, и многие другие.
В термодинамике фазой называется совокупность однородных, одинаковых по своим свойствам частей системы. Примером фаз одного и того же вещества являются пар, вода и лёд. Различные кристаллические модификации так же представляют собой фазы, например, графит и алмаз – различные твёрдые фазы углерода.
Разные фазы одного и того же вещества могут находиться в равновесии, соприкасаясь, друг с другом. Это равновесие возможно в определённом диапазоне температур. Причём каждой температуре соответствует определённое давление, при котором возможно равновесие. На диаграмме (p,T) двухфазное состояние изобразится линией. Три фазы одновременно могут находиться в равновесии только в одной единственной точке, её называют тройной точкой. Она лежит на кривых равновесия двух фаз, взятых попарно. Равновесие более, чем трёх фаз одного вещества невозможно.
Различают фазовые переходы первого и второго рода.
Характерной особенностью фазовых переходов первого рода является поглощение или выделение теплоты при их осуществлении. К фазовым переходам первого рода относятся превращения при испарении, конденсации, плавлении и кристаллизации вещества. Фазовые переходы первого рода сопровождаются поглощением или выделением теплоты, которая называется скрытой теплотой перехода.
При фазовых переходах второго рода теплота не выделяется и не поглощается, но для них характерны скачкообразные изменения теплоемкости, температурного коэффициента расширения и сжимаемости вещества. Примерами фазовых переходов второго рода являются превращение магнитного сплава из ферромагнитного состояния в парамагнитное, переход металла или сплава в сверхпроводящее состояние и переход жидкого гелия в сверхтекучее состояние.
Далее речь пойдет только о фазовых переходах первого рода.
5.1. Испарение и конденсация
Как в жидкостях, так и в твердых телах всегда имеется некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам и которые способны оторваться от поверхности жидкости или твердого тела и перейти в окружающее их пространство.
Переход жидкости в газообразное состояние называется испарением.
Переход твердого тела в газообразное состояние называется сублимацией.
При испарении и сублимации тело покидают наиболее быстрые молекулы, и в результате тело охлаждается. Что бы поддерживать температуру постоянной, к нему нужно непрерывно подводить тепло.
Количество тепла Q, которое необходимо сообщить жидкости для испарения единицы её массы при постоянной температуре, называется удельной теплотой парообразования r.
Количество теплоты, которое надо затратить, чтобы перевести в пар жидкость массой m,
В результате хаотического движения над поверхностью жидкости молекула пара, попадая в сферу действия молекулярных сил, вновь возвращается в жидкость. Этот процесс называется конденсацией. При конденсации тепло возвращается обратно.
Испарение жидкости происходит при любой температуре и тем быстрее, чем выше температура, больше площадь свободной поверхности испаряющейся жидкости и быстрее удаляются образовавшиеся над жидкостью пары.
5.2. Насыщенные и ненасыщенные пары
Если за одно и то же время число испаряющихся и конденсирующихся молекул пара одинаково, то число молекул пара над жидкостью будет оставаться постоянным. Такое состояние называют динамическим равновесием пара и жидкости.Пар, находящийся в динамическом равновесии с жидкостью, называют насыщенным. Давление, при котором наблюдается равновесие между жидкостью и паром, называется давлением насыщенного пара.При неизменной температуре плотность насыщающего пара над жидкостью остается постоянной.
Пар, плотность которого меньше плотности насыщающего пара при той же температуре, называют ненасыщенным. Ненасыщенный пар подчиняется законам идеального газа.
Частным случаем испарения является кипение.Это процесс интенсивного парообразования не только со свободной поверхности, но и в объеме жидкости. В объеме образуются пузыри, заполненные насыщенным паром. Они поднимаются вверх под действием выталкивающей силы и разрываются на поверхности. Центрами их образования являются мельчайшие пузырьки посторонних газов или частиц различных примесей.

Процесс превращения жидкости в пар требует затрат энергии на разрыв связей между молекулами жидкости и на работу против сил внешнего давления. Давление насыщенного пара Pнас внутри пузырька, находящегося у поверхности жидкости, равно сумме внешнего давления на жидкость Рвн и давления под искривленной поверхностью жидкости.
где r - радиус пузырька, σ - коэффициент поверхностного натяжения.
Если пузырек имеет размеры порядка нескольких миллиметров и более, то вторым слагаемым можно пренебречь и, следовательно, для больших пузырьков при неизменном внешнем давлении жидкость закипает, когда давление насыщенного пара в пузырьках становится равным внешнему давлению.
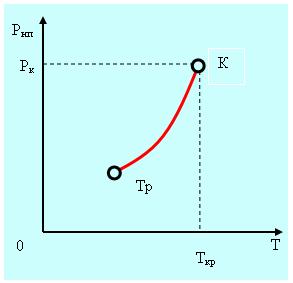
При повышении температуры равновесие между жидкостью и паром нарушается и в течение некоторого времени поток молекул в направлении из жидкости в пар будет больше чем в направлении пар - жидкость. Затем равновесие восстановится, но при другом давлении. Зависимость давления насыщенного пара от температуры представлена на рис. 5.1. Тр – тройная точка, Ткр и Ркр – температура и давление в критической точке, которая будет обсуждаться ниже.
Всё сказанное о равновесии между жидкостью и паром справедливо и для системы твёрдое тело – газ.
5.3. Равновесие жидкости и насыщенного пара
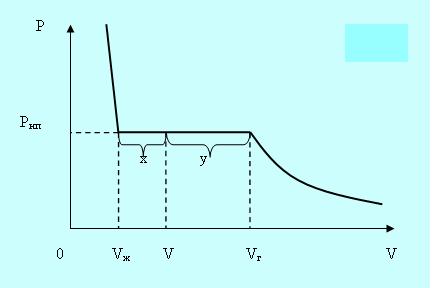
Если сжимать реальный газ при постоянной температуре, то по достижении некоторого значения объёма Vг давление перестанет увеличиваться, а вещество становится неоднородным, так как часть газа конденсируется в жидкость. Если и дальше уменьшать объём, то всё большее количество вещества переходит в жидкое состояние, причём давление остаётся постоянным и равным давлению насыщенного пара Рнп. После того как весь пар превратится в жидкость в точке Vж, давление начинает расти очень быстро, так как жидкость – плохо сжимаемая фаза (рис. 5.2).
При любом промежуточном значении объёма V часть вещества будет находится в жидком состоянии mж, а часть в парообразном mп. Найдём отношение mж/ mп.
Величина V’ называется удельным объёмом единицы массы вещества. Удельные объёмы насыщенного пара и жидкости при давлении Рнп равны:
В промежуточном состоянии на долю жидкости будет приходиться объём V’жmж и аналогично на долю пара будет приходиться объём - Vпmп (из определения удельного объёма). Вместе они должны быть равны объёму системы в этом промежуточном состоянии:
Этот результат справедлив для любых двух фазных состояний, в том числе и для двух кристаллических модификаций одного и того же вещества:
Для того чтобы судить, много или мало водяных паров находится в воздухе, вводят понятие влажности. Абсолютная влажность - количество пара, выраженное в килограммах, содержащееся в 1 м 3 при данной температуре, т.е. абсолютная влажность равна плотности паров воды.
Относительная влажность В - это отношение абсолютной влажности к плотности насыщенного пара при данной температуре.
В = 100% . (5.7)
Плотность насыщенного водяного пара при данной температуре есть величина табличная. Для определения относительной влажности надо знать абсолютную влажность, которую можно определить по точке росы.
В термодинамике фазой называется совокупность однородных, одинаковых по своим свойствам частей системы. Примером фаз одного и того же вещества являются пар, вода и лёд. Различные кристаллические модификации так же представляют собой фазы, например, графит и алмаз – различные твёрдые фазы углерода.
Разные фазы одного и того же вещества могут находиться в равновесии, соприкасаясь, друг с другом. Это равновесие возможно в определённом диапазоне температур. Причём каждой температуре соответствует определённое давление, при котором возможно равновесие. На диаграмме (p,T) двухфазное состояние изобразится линией. Три фазы одновременно могут находиться в равновесии только в одной единственной точке, её называют тройной точкой. Она лежит на кривых равновесия двух фаз, взятых попарно. Равновесие более, чем трёх фаз одного вещества невозможно.
Различают фазовые переходы первого и второго рода.
Характерной особенностью фазовых переходов первого рода является поглощение или выделение теплоты при их осуществлении. К фазовым переходам первого рода относятся превращения при испарении, конденсации, плавлении и кристаллизации вещества. Фазовые переходы первого рода сопровождаются поглощением или выделением теплоты, которая называется скрытой теплотой перехода.
При фазовых переходах второго рода теплота не выделяется и не поглощается, но для них характерны скачкообразные изменения теплоемкости, температурного коэффициента расширения и сжимаемости вещества. Примерами фазовых переходов второго рода являются превращение магнитного сплава из ферромагнитного состояния в парамагнитное, переход металла или сплава в сверхпроводящее состояние и переход жидкого гелия в сверхтекучее состояние.
Далее речь пойдет только о фазовых переходах первого рода.
5.1. Испарение и конденсация
Как в жидкостях, так и в твердых телах всегда имеется некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам и которые способны оторваться от поверхности жидкости или твердого тела и перейти в окружающее их пространство.
Переход жидкости в газообразное состояние называется испарением.
Переход твердого тела в газообразное состояние называется сублимацией.
При испарении и сублимации тело покидают наиболее быстрые молекулы, и в результате тело охлаждается. Что бы поддерживать температуру постоянной, к нему нужно непрерывно подводить тепло.
Количество тепла Q, которое необходимо сообщить жидкости для испарения единицы её массы при постоянной температуре, называется удельной теплотой парообразования r.
Количество теплоты, которое надо затратить, чтобы перевести в пар жидкость массой m,
В результате хаотического движения над поверхностью жидкости молекула пара, попадая в сферу действия молекулярных сил, вновь возвращается в жидкость. Этот процесс называется конденсацией. При конденсации тепло возвращается обратно.
Испарение жидкости происходит при любой температуре и тем быстрее, чем выше температура, больше площадь свободной поверхности испаряющейся жидкости и быстрее удаляются образовавшиеся над жидкостью пары.
5.2. Насыщенные и ненасыщенные пары
Если за одно и то же время число испаряющихся и конденсирующихся молекул пара одинаково, то число молекул пара над жидкостью будет оставаться постоянным. Такое состояние называют динамическим равновесием пара и жидкости.Пар, находящийся в динамическом равновесии с жидкостью, называют насыщенным. Давление, при котором наблюдается равновесие между жидкостью и паром, называется давлением насыщенного пара.При неизменной температуре плотность насыщающего пара над жидкостью остается постоянной.
Пар, плотность которого меньше плотности насыщающего пара при той же температуре, называют ненасыщенным. Ненасыщенный пар подчиняется законам идеального газа.
Частным случаем испарения является кипение.Это процесс интенсивного парообразования не только со свободной поверхности, но и в объеме жидкости. В объеме образуются пузыри, заполненные насыщенным паром. Они поднимаются вверх под действием выталкивающей силы и разрываются на поверхности. Центрами их образования являются мельчайшие пузырьки посторонних газов или частиц различных примесей.
Процесс превращения жидкости в пар требует затрат энергии на разрыв связей между молекулами жидкости и на работу против сил внешнего давления. Давление насыщенного пара Pнас внутри пузырька, находящегося у поверхности жидкости, равно сумме внешнего давления на жидкость Рвн и давления под искривленной поверхностью жидкости.
где r - радиус пузырька, σ - коэффициент поверхностного натяжения.
Если пузырек имеет размеры порядка нескольких миллиметров и более, то вторым слагаемым можно пренебречь и, следовательно, для больших пузырьков при неизменном внешнем давлении жидкость закипает, когда давление насыщенного пара в пузырьках становится равным внешнему давлению.
При повышении температуры равновесие между жидкостью и паром нарушается и в течение некоторого времени поток молекул в направлении из жидкости в пар будет больше чем в направлении пар - жидкость. Затем равновесие восстановится, но при другом давлении. Зависимость давления насыщенного пара от температуры представлена на рис. 5.1. Тр – тройная точка, Ткр и Ркр – температура и давление в критической точке, которая будет обсуждаться ниже.
Всё сказанное о равновесии между жидкостью и паром справедливо и для системы твёрдое тело – газ.

5.3. Равновесие жидкости и насыщенного пара
Если сжимать реальный газ при постоянной температуре, то по достижении некоторого значения объёма Vг давление перестанет увеличиваться, а вещество становится неоднородным, так как часть газа конденсируется в жидкость. Если и дальше уменьшать объём, то всё большее количество вещества переходит в жидкое состояние, причём давление остаётся постоянным и равным давлению насыщенного пара Рнп. После того как весь пар превратится в жидкость в точке Vж, давление начинает расти очень быстро, так как жидкость – плохо сжимаемая фаза (рис. 5.2).

При любом промежуточном значении объёма V часть вещества будет находится в жидком состоянии mж, а часть в парообразном mп. Найдём отношение mж/ mп.
Величина V’ называется удельным объёмом единицы массы вещества. Удельные объёмы насыщенного пара и жидкости при давлении Рнп равны:
В промежуточном состоянии на долю жидкости будет приходиться объём V’жmж и аналогично на долю пара будет приходиться объём - Vпmп (из определения удельного объёма). Вместе они должны быть равны объёму системы в этом промежуточном состоянии:
Этот результат справедлив для любых двух фазных состояний, в том числе и для двух кристаллических модификаций одного и того же вещества:
Для того чтобы судить, много или мало водяных паров находится в воздухе, вводят понятие влажности. Абсолютная влажность - количество пара, выраженное в килограммах, содержащееся в 1 м 3 при данной температуре, т.е. абсолютная влажность равна плотности паров воды.
Относительная влажность В - это отношение абсолютной влажности к плотности насыщенного пара при данной температуре.
В = 100% . (5.7)
Плотность насыщенного водяного пара при данной температуре есть величина табличная. Для определения относительной влажности надо знать абсолютную влажность, которую можно определить по точке росы.
Если у вас возникли сложности с курсовой, контрольной, дипломной, рефератом, отчетом по практике, научно-исследовательской и любой другой работой - мы готовы помочь.


Для простоты ограничимся рассмотрением простейшего случая сосуществования двух пространственно неупорядоченных фазовых состояний - жидкости и пара. Рассмотрим жидкость, в которой находится небольшой пузырек насыщенного пара. При этом вдоль поверхности раздела действует сила поверхностного натяжения. Для ее учета введем параметры:
(4.36)
Здесь - площадь поверхности пленки,
- коэффициент поверхностного натяжения. Знак “-” во втором равенстве (4.36) соответствует тому, что пленка стягивается и работа внешней силы направлена на увеличение поверхности:
(4.37)
Тогда с учетом поверхностного натяжения потенциал Гиббса изменится на величину:
Вводя модель системы под поршнем и, учитывая равенство , запишем выражение для потенциала Гиббса в виде
(4.39)
Здесь и - удельные значения свободной энергии, и - удельные объемы каждой из фаз. При фиксированных значениях ( ) величина (4.39) достигает минимума. При этом потенциал Гиббса можно проварьировать по . Эти величины связаны с помощью соотношения:
,
где R можно выразить через : . Выберем в качестве независимых параметров величины , тогда потенциал Гиббса (4.39) можно переписать в виде:
(4.46)
(здесь учтено )
Выполняя варьирование (4.40), запишем:
(4.47)
Учитывая независимость величин , сведем (4.41) к системе
(4.42а)
(4.42б)
(4.42в)
Проанализируем полученное равенство. Из (4.42а) следует:
(4.43)
Его смысл в том, что давление в фазе 1 равно внешнему давлению.
Вводя выражения для химических потенциалов каждой из фаз и учитывая
запишем (4.42б) в виде:
(4.44)
Здесь - давление во II фазе. Отличие уравнения (4.44) от условия равновесия фаз (4.25) в том, что давление в (4.44) в каждой из фаз может быть различным.
Из равенства (4.42в) следует:
.
Сравнивая полученное равенство с (4.44) и выражением для химического потенциала, получим формулу для давления газа внутри сферического пузырька:
(4.45)
Уравнение (4.45) представляет собой известную из курса общей физики формулу Лапласа. Обобщая (4.44) и (4.45) запишем условия равновесия между жидкостью и пузырьком пара в виде:
(4.46)
В случае исследования задачи фазового перехода жидкость – твердое тело ситуация существенно осложняется в связи с необходимостью учета геометрических особенностей кристаллов, анизотропии направления преимущественного роста кристалла.
5.
Фазовые переходы наблюдаются и в более сложных случаях, при которых разрыв терпят только вторые производные химического потенциала по температуре и давлению. В этом случае кривая фазового равновесия определяется не одним, а тремя условиями:
(4.47а)
(4.47б)
(4.47в)
Фазовые переходы, удовлетворяющие уравнениям (4.47), получили название фазовых переходов II рода. Очевидно, скрытая теплота фазового перехода и изменение удельного объема в этом случае равно нулю:
(4.48)
Для получения дифференциального уравнения кривой фазового равновесия использовать уравнение Клапейрона – Клаузиуса (4.35) нельзя, т.к. при непосредственной подстановке в выражение (4.35) значений (4.48), получается неопределенность . Учтем, что при движении вдоль кривой фазового равновесия сохраняется условие и . Тогда:
(4.49)
Вычислим производные в (4.49)
(4.50а)
(4.50б)
(4.50в)
Подставляя полученные выражения в (4.49), находим:
(4.51)
Система линейных уравнений (4.51), записанная относительно и является однородной. Поэтому ее нетривиальное решение существует только в том случае, если определитель, составленный из коэффициентов равен нулю. Поэтому запишем
или
Учитывая полученное условие и выбирая из системы (4.51) любое уравнение, получаем:
(4.52)
Уравнения (4.52) для кривой фазового равновесия в случае фазового перехода II рода получили название уравнений Эренфеста. В этом случае кривая фазового равновесия может быть определено по известным характеристикам скачков теплоемкости , коэффициента теплового расширения , коэффициента упругости .
Фазовые переходы второго рода встречаются значительно ранее фазовых переходов I рода. Это очевидно даже из условия (4.47), которое значительно жестче уравнения кривой фазового равновесия (4.юю) с условиями (4.31). Примерами таких фазовых переходов может служить переход проводника из сверхпроводящего состояния в нормальное при отсутствии магнитного поля.
Кроме того, встречаются фазовые переходы с равной нулю скрытой теплотой , для которых при переходе наблюдается наличие сингулярности в калорическом уравнении (теплоемкость терпит разрыв второго рода). Такой тип фазовых переходов носит название фазового перехода типа. Примерами таких переходов являются переход жидкого гелия из сверхтекучего состояния в нормальное, переход в точке Кюри для ферромагнетиков, переходы из неупругого состояния в упругое для сплавов и т.д.
Читайте также:
- Технологическая карта почему нужно есть много овощей и фруктов 1 класс школа россии
- План саморазвития психолога доу
- Почему формулирование клеточной теории ускорило исследование клетки кратко
- Почему лермонтов любил кавказ кратко
- Проектная деятельность в основной и старшей школе стандарты второго поколения

