Сообщение о применении кислорода озона серы
Обновлено: 04.07.2024
Химический элемент кислород может существовать в виде двух аллотропных модификаций, т.е. образует два простых вещества. Оба этих вещества имеют молекулярное строение. Одно из них имеет формулу O2 и имеет название кислород, т.е. такое же, как и название химического элемента, которым оно образовано.
Другое простое вещество, образованное кислородом, называется озон. Озон в отличие от кислорода состоит из трехатомных молекул, т.е. имеет формулу O3.
Поскольку основной и наиболее распространенной формой кислорода является молекулярный кислород O2, прежде всего мы рассмотрим именно его химические свойства.
Химический элемент кислород находится на втором месте по значению электроотрицательности среди всех элементов и уступает лишь фтору. В связи с этим логично предположить высокую активность кислорода и наличие у него практически только окислительных свойств. Действительно, список простых и сложных веществ, с которыми может реагировать кислород огромен. Однако, следует отметить, что поскольку в молекуле кислорода имеет место прочная двойная связь, для осуществления большинства реакций с кислородом требуется прибегать к нагреванию. Чаще всего сильный нагрев требуется в самом начале реакции (поджиг) после чего многие реакции идут далее уже самостоятельно без подвода тепла извне.
Среди простых веществ не окисляются кислородом лишь благородные металлы (Ag, Pt, Au), галогены и инертные газы.
Сера сгорает в кислороде с образованием диоксида серы:
Фосфор в зависимости от избытка или недостатка кислорода может образовать как оксида фосфора (V), так и оксид фосфора (III):
Взаимодействие кислорода с азотом протекает в крайне жестких условиях, в виду того что энергии связи в молекулах кислорода и особенно азота очень велики. Также свой вклад в сложность протекания реакции делает высокая электроотрицательность обоих элементов. Реакция начинается лишь при температуре более 2000 o C и является обратимой:
Не все простые вещества, реагируя с кислородом образуют оксиды. Так, например, натрий, сгорая в кислороде образует пероксид:
а калий – надпероксид:
Чаще всего, при сгорании в кислороде сложных веществ образуется смесь оксидов элементов, которыми было образовано исходное вещество. Так, например:
Однако, при сгорании в кислороде азотсодержащих органических веществ вместо оксида азота образуется молекулярный азот N2. Например:
При сгорании в кислороде хлорпроизводных вместо оксидов хлора образуется хлороводород:
Химические свойства озона:
Озон является более сильным окислителем, чем кислород. Обусловлено это тем, что одна из кислород-кислородных связей в молекуле озона легко рвется и в результате образуется чрезвычайно активный атомарный кислород. Озон в отличие от кислорода не требует для проявления своих высоких окислительных свойств нагревания. Он проявляет свою активность при обычной и даже низкой температурах:
Как было сказано выше, серебро с кислородом не реагирует, однако, реагирует с озоном:
Качественной реакцией на наличие озона является то, что при пропускании исследуемого газа через раствор иодида калия наблюдается образование йода:
Химические свойства серы
Сера как химический элемент может существовать в нескольких аллотропных модификациях. Различают ромбическую, моноклинную и пластическую серу. Моноклинная сера может быть получена при медленном охлаждении расплава ромбической серы , а пластическая напротив получается при резком охлаждении расплава серы, предварительно доведенного до кипения. Пластическая сера обладает редким для неорганических веществ свойством эластичности – она способна обратимо растягиваться под действием внешнего усилия, возвращаясь в исходную форму при прекращении этого воздействия. Наиболее устойчива в обычных условиях ромбическая сера и все иные аллотропные модификации со временем переходят в нее.
Молекулы ромбической серы состоят из восьми атомов, т.е. ее формулу можно записать как S8. Однако, поскольку химические свойства всех модификаций достаточно схожи, чтобы не затруднять запись уравнений реакций любую серу обозначают просто символом S.
Сера может взаимодействовать и с простыми и со сложными веществами. В химических реакциях проявлет как окислительные, так и восстановительные свойства.
Окислительные свойства серы проявляются при ее взаимодействии с металлами, а также неметаллами, образованными атомами менее электроотрицательного элемента (водород, углерод, фосфор):
Как восстановитель сера выступает при взаимодействии с неметаллами, образованными более электроотрицательными элементами (кислород, галогены), а также сложными веществами с ярко выраженной окислительной функцией, например, серной и азотной концентрированной кислотами:
Также сера взаимодействует при кипячении с концентрированными водными растворами щелочей. Взаимодействие протекает по типу диспропорционирования, т.е. сера одновременно и понижает, и повышает свою степень окисления:

Средняя оценка: 4.5
Всего получено оценок: 268.
Средняя оценка: 4.5
Всего получено оценок: 268.
Озон – химическое газообразное вещество, которое является сильным окислителем. Какими свойствами обладает газ, и для каких целей его получают?
Общая информация

Рис. 1. Х. Ф. Шенбейн.
Формула озона – О3, то есть озон состоит из трех молекул кислорода. Озон – это аллотропное видоизменение кислорода. О3 – газ светло-синего цвета, с характерным запахом, нестойкий, токсичный. При температуре -111,9 градусов этот газ сжижается. Растворимость озона в воде больше, чем у кислорода: 100 объемов воды растворяют 49 объемов озона.

Рис. 2. Формула озона.
Это вещество образуется в атмосфере при электрических разрядах. Озоновый слой в стратосфере (25 км. от поверхности) поглощает ультрафиолетовое излучение, опасное для всех живых организмов.
Озон – сильный окислитель, даже более сильный, чем кислород. Он способен окислять такие металлы, как золото и платина.
Особая химическая активность озона объясняется тем, что его молекула легко распадается на молекулу кислорода и атомарный кислород. Образовавшийся атомарный кислород более активно реагирует с веществами, чем молекулярный.
Озон способен из раствора йодистого калия выделять йод:
Бумага, смоченная йодистым калием и крахмалом в воздухе, содержащем озон, синеет. Эта реакция используется для обнаружения озона.
В 1860 году ученые Эндрюс и Тэт экспериментально доказали при помощи стеклянной трубки с манометром, наполненной чистым кислородом, что при превращении кислорода в озон происходит уменьшение объема газа
Получение и применение озона
Получают озон при действии электрических разрядов на кислород в озонаторах.
Озон применяют для обеззараживания питьевой воды, для обезвреживания промышленных сточных вод, в медицине – в качестве дезинфицирующего средства. Также как и хлорирование, озонирование обладает обеззараживающим эффектом, но его плюсом является то, что при использовании озона в обработанной воде не образуется токсинов. Озон также эффективно борется с плесенью и бактериями.

Рис. 3. Озонирование.
При остром отравлении озон поражает органы дыхания, раздражает слизистые глаз, вызывает головную боль. Токсичность озона резко возрастает при одновременном воздействии оксидов азота.
Что мы узнали?
Озон – газ, который был обнаружен в конце XVIII века, а свое современное название получил только в середине XIX века. В отличие от кислорода этот газ имеет характерный запах и отличается светло-синим цветом.
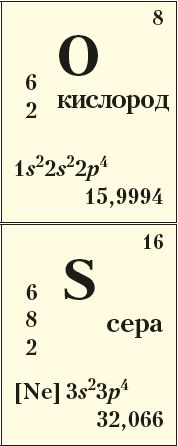
Как вам известно, кислород — самый распространённый элемент на Земле, он составляет 49 % от массы земной коры.
Сера — шестнадцатый по распространённости элемент, встречается как в виде соединений, так и в самородном состоянии ( табл. 26 ).
Таблица 26. Химические элементы халькогены
На внешнем электронном слое, общая конфигурация которого ns 2 np 4 , атомы халькогенов имеют по 6 электронов, из которых два неспаренных на р-подуровне ( Приложение 1 ):
8O
16S
Из приведённых электронных конфигураций внешнего электронного слоя атомов кислорода, серы следует, что низшая степень окисления этих халькогенов –2 . Сера проявляет положительные степени окисления +4, +6 при возбуждении s- и p-электронов внешнего слоя на d-подуровень . Сера по электроотрицательности уступает галогенам (кроме йода), азоту и кислороду. Кислород, будучи вторым после фтора по электроотрицательности, проявляет положительную степень окисления +2 только в соединении со фтором .
Неприятные запахи, ощущаемые при гниении трупов животных, можно объяснить выделением соединений серы (меркаптанов и сероводорода), которые образуются при разложении белков.
Кислород как простое вещество
Рис. 72. Электронная
и структурная
формулы, масштабная
и шаростержневая
модели молекулы
кислорода
Кислород существует в природе в виде двух простых веществ (аллотропных модификаций) молекулярного строения — кислорода О2 и озона О3. В молекуле кислорода существует двойная ковалентная неполярная связь ( рис. 29 , 72).
Физические свойства кислорода. Кислород мало растворим в воде: при 20 °С в 1 дм 3 воды растворяется 31 см 3 кислорода. Тем не менее этого хватает для дыхания рыб в водоёмах. Жидкий кислород — подвижная, слегка голубоватая жидкость, кипящая при температуре –183 °С . Твёрдый кислород представляет собой синие кристаллы, плавящиеся при ещё более низкой температуре –219 °С .
Химические свойства кислорода. Кислород во всех реакциях, кроме взаимодействия со фтором, проявляет свойства окислителя. При окислении кислородом простых и сложных веществ образуются, как правило, оксиды.
1. Кислород взаимодействует с металлами:
Он окисляет практически все металлы, кроме серебра, золота и платины. С активными металлами кислород может образовывать не только оксиды, но и пероксиды (Na2O2), надпероксиды (KО2) или другие бинарные соединения.
2. Реагируя с неметаллами, кислород образует кислотные или несолеобразующие оксиды:
С хлором, бромом и йодом кислород не реагирует.
3. Кислород окисляет сложные неорганические и органические вещества:
При этом отметим, что горение углеводородов используют как источник тепловой энергии:
В органическом синтезе кислород широко применяется в реакциях каталитического окисления:

Рис. 73. Хранение кислорода
в баллонах и газометре
Получение кислорода
В промышленности кислород получают разделением жидкого воздуха, небольшие порции хранят в баллонах голубого цвета, а в лабораториях — в газометрах ( рис. 73 ). Важнейшим лабораторным способом его получения служит разложение некоторых кислородсодержащих веществ — перманганата калия, бертолетовой соли, воды, пероксида водорода:
В сосуды кислород собирают методом вытеснения воды или воздуха ( рис. 74 ).
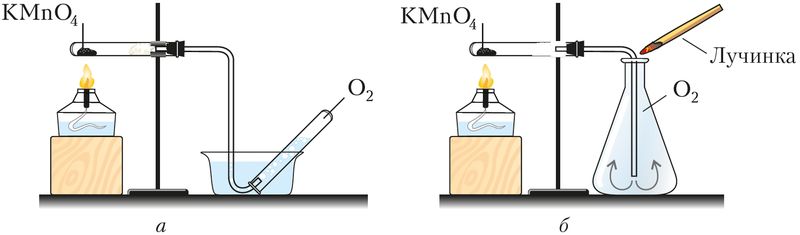
Рис. 74. Получение кислорода разложением перманганата калия и собирание газа
методом: а — вытеснением воды, б — вытеснением воздуха
Озон — газ с резким запахом, имеет бледно-голубой цвет, в жидком состоянии — синий. В процессе реакций озон распадается с образованием атомарного кислорода:
поэтому по сравнению с кислородом обладает большей химической активностью. В природе озон образуется из атмосферного кислорода при грозовых разрядах, а на высоте 10–30 км — под действием ультрафиолетового излучения. Озоновый слой над поверхностью Земли задерживает коротковолновое ультрафиолетовое излучение Солнца, вредное для живых организмов.
Озон образуется при работе лазерных принтеров, источников рентгеновского и ультрафиолетового излучения. Предельно допустимая концентрация (ПДК) озона в воздухе рабочей зоны составляет 0,1 мг/м 3 . Характерный запах озона начинает ощущаться уже при концентрациях 0,004–0,010 мг/м 3 , то есть во много раз ниже гигиенического норматива, что важно для персонала, работающего с озоном.
Воду обеззараживают хлорированием или озонированием. Озонирование воды более безопасно для человеческого организма, чем хлорирование.
Состав и строение молекулы серы. Молекулы кристаллической серы имеют форму замкнутых циклов. Если расплавленную серу вылить в стакан с холодной водой (быстро охладить), то образуется пластическая сера. Её молекулы представляют собой длинные цепи ( рис. 75 ). Пластическая сера неустойчива и уже через несколько часов после получения превращается в жёлтые кристаллы ромбической серы как наиболее устойчивой из аллотропных модификаций.

Рис. 75. Строение молекул и внешний вид серы различных модификаций:
а — молекулы S8, б — цепи атомов пластической серы, в — кристаллы ромбической серы, г — кристаллы моноклинной серы, д — пластическая сера
Известно несколько аллотропных модификаций серы: две кристаллические — моноклинная S8 ( Tпл.= 119,3 °С ) и ромбическая S8 ( Tпл.= 112,8 °С ), а также пластическая S∞ ( рис. 75 ). Наиболее устойчива при комнатной температуре ромбическая сера.
Химические свойства. Сера — достаточно активный неметалл. При нагревании легко окисляется кислородом и галогенами, реагирует как окислитель с водородом и металлами (кроме золота и платины):
Применение кислорода и серы. Наиболее значимые области применения кислорода и серы указаны в таблице 27.
Таблица 27. Области применения кислорода, озона и серы
Кислород нашёл применение в дыхательных аппаратах ( рис. 76 ).
.jpg)
Рис. 76. Портативный аппарат
искусственной вентиляции
лёгких (ИВЛ)
Электронная конфигурация валентного слоя халькогенов ns 2 np 4 . Низшая степень их окисления –2 .
Кислород как окислитель реагирует с простыми и сложными веществами, образуя, как правило, оксиды.
Сера является окислителем в реакциях с металлами и водородом, но восстановителем в реакции с кислородом.
Вопросы, задания, задачи
1. Перечислите наиболее характерные степени окисления:
- а) кислорода;
- б) серы;
- в) селена.
Приведите примеры соответствующих соединений.
2. Назовите аллотропные модификации:
3. Составьте формулы оксидов и сульфидов лития, магния, алюминия.
4. Рассчитайте массу порции серы количеством 3,5 моль .
| Реагенты | Кислород | Сера |
| Н2 | ||
| Mg | ||
| Ca | ||
| Fe | ||
| Li | ||
| Na |
6. Составьте 10 уравнений возможных реакций между веществами, формулы которых Ba, K, Рt, ZnS, S, H2, O2. Укажите при этом степени окисления элементов.
7. Чему равен объём воздуха, необходимый для сжигания:
- а) серы массой 12 г ;
- б) бутана объёмом 10 м 3 (н. у.) ?
8. Рассчитайте объём кислорода, который может быть получен при разложении бертолетовой соли массой 49 г .
9. Составьте уравнения реакций согласно схеме:
10. При нагревании перманганата калия массой 3,16 г получен кислород объёмом 168 см 3 ( н. у. ). Определите массовую долю разложившейся соли.
*Самоконтроль
1. Низшая степень окисления атомов халькогенов равна:
2. Укажите выражения, характеризующие серу как простое вещество:
- а) при горении серы в кислороде возникает голубое пламя;
- б) на внешнем энергетическом уровне атома серы находится 6 электронов;
- в) сера используется для вулканизации каучука;
- г) сера входит в состав пирита и медного колчедана.
3. С кислородом могут реагировать:
4. К халькогенам относятся элементы с конфигурацией внешнего электронного слоя атома:

Исторически так сложилось, что химический элемент и одно из простых веществ, образованных атомами этого элемента, имеют общее название — кислород. Поскольку между этими понятиями существует принципиальная разница, следует четко различать, о чем идет речь — о кислороде как о химическом элементе или о простом веществе.
Кислород как химический элемент
Самым первым химическим элементом, к изучению которого мы приступаем, является кислород. Как вы уже знаете, химический знак кислорода — О. Относительная атомная масса кислорода равна 16:
Позднее вы узнаете, какое строение имеет атом кислорода и чем он отличается от атомов других химических элементов.
Кислород как простое вещество
Простое вещество кислород существует в виде молекул. Молекула кислорода состоит из двух атомов химического элемента кислорода (рис. 73), поэтому химическая формула кислорода как простого вещества — O2.
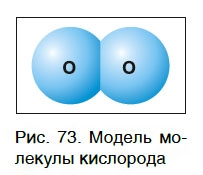
Поскольку относительная атомная масса кислорода равна 16, то относительная молекулярная масса простого вещества кислорода равна:
![]()
Следовательно, молярная масса кислорода равна:
![]()
Как у всех газов, молярный объем кислорода при нормальных условиях равен:
![]()
История открытия кислорода
Кроме кислорода, существует еще одно простое вещество, молекулы которого состоят только из атомов кислорода. Это озон, молекула которого содержит три атома кислорода (рис. 74), его формула — О3.
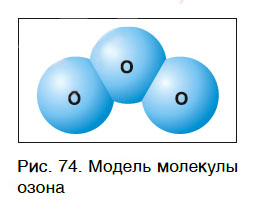
При нормальных условиях озон представляет собой газ с резким раздражающим запахом. Он очень токсичен для всех живых организмов и поэтому используется вместо хлора для обеззараживания воды.
Небольшие количества озона образуются в воздухе во время грозы, а также в результате взаимодействия смолы хвойных деревьев с кислородом. Озон оказывает губительное действие на бактерии, поэтому лесной воздух (особенно в хвойных лесах) обладает целебным действием.
В небольших количествах озон образуется также при работе копировальных аппаратов и лазерных принтеров. Использовать такие приборы следует только в хорошо проветриваемых помещениях.
В верхних слоях атмосферы Земли (на высоте примерно 30—40 км) существует озоновый слой. Содержащийся в нем озон образуется из кислорода под воздействием солнечного излучения. Некоторые компоненты этого излучения губительны для живых организмов и растений на нашей планете, а озоновый слой поглощает их. Если бы не было озонового слоя, то жизнь на Земле постепенно бы прекратилась.
Многие ученые считают, что вещества, образующиеся в процессе производственной деятельности человека, разрушают озоновый слой. Это прежде всего фреоны — соединения, использующиеся в холодильных установках и дезодорантах, выбросы реактивных самолетов и ракет. Попадая в озоновый слой, эти вещества приводят к уменьшению его толщины или даже разрыву этого слоя — образованию так называемых озоновых дыр. В результате образования и увеличения размеров озоновых дыр могут наступить серьезные экологические катастрофы.
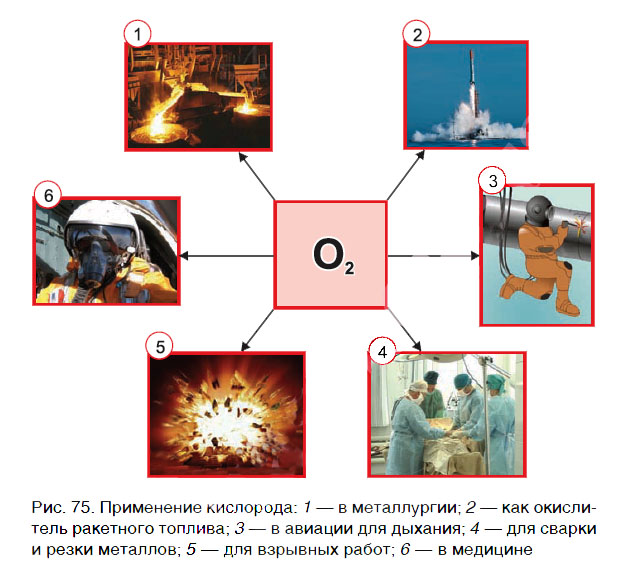
Применение кислорода
Кислород очень широко применяется в народном хозяйстве. На рисунке 75 приведены основные области применения кислорода. Главными потребителями кислорода являются металлургическая промышленность (выплавка стали), космическая техника (окислитель ракетного топлива), процессы обработки металлов (сварка и резка металлов).
Краткие выводы урока:
- Химический элемент кислород образует два простых вещества — кислород О2 и озон О3.
- Когда говорят о кислороде как о химическом элементе, подразумевают атомы кислорода О.
- Когда говорят о кислороде как о простом веществе, подразумевают вещество, состоящее из молекул и имеющее формулу О2.
Читайте также:

