Сообщение металлы в природе
Обновлено: 30.06.2024
Многие металлы широко распространены в природе. Так, содержание некоторых металлов в земной коре следующее:
Большое количество натрия и магния содержится в морской воде: — 1,05%, — 0,12%.
В природе металлы встречаются в различном виде:
— в самородном состоянии: серебро , золото , платина , медь , иногда ртуть
— в виде оксидов: магнетит Fe3O4, гематит Fe2О3 и др.
— в виде смешанных оксидов: каолин Аl2O3 • 2SiO2 • 2Н2О, алунит (Na,K)2O • АlО3 • 2SiO2 и др.
сульфидов: галенит PbS, киноварь НgS,
хлоридов: сильвин КС1, галитNaCl, сильвинит КСl• NаСl, карналлит КСl • МgСl2 • 6Н2О, сульфатов: барит ВаSO4, ангидрид Са8О4 фосфатов: апатит Са3(РО4)2, карбонатов: мел, мрамор СаСО3, магнезит МgСО3.
Многие металлы часто сопутствуют основным природным минералам: скандий входит в состав оловянных, вольфрамовых руд, кадмий — в качестве примеси в цинковые руды, ниобий и тантал — в оловянные.
Железным рудам всегда сопутствуют марганец, никель, кобальт, молибден, титан, германий, ванадий.
Соединения элементов главной подгруппы II группы, за исключением бериллия и радия, широко распространены в природе. Кальций и магний относятся к числу наиболее распространенных элементов (кальция в земной коре содержится 3,4 %, а магния 2,0 %). Однако благодаря большой химической активности элементы щелочноземельной группы никогда не встречаются в свободном состоянии, а всегда в виде соединений.
Карбонаты кальция и магния в виде известняка и мела (СаСО3), а также доломита (СаСО3∙МgСО3) образуют целые горные кряжи. Хотя и не в таких огромных массах, как только что названный двойной карбонат, поместами также в виде могцных залежей встречается простой карбонат магния МgСО3, магнезит, называемый также горьким шпатом, или тальковым шпатом. В Европе он находится главным образом в Штойермарко и на острове Эвбее, а из внеевропейских стран — в Калифорнии, Канаде и в китайской части Мав.чжурии. Местами встречается в больших количествах мрамор, состоящий почти из совершенно чистого карбоната кальция. Меньшее распространение имеют карбонаты тяжелых щелочноземельных металлов: стронцианит SrСO3 и витерит ВаСО3.
Мощные залежи образует гипс СаSO4∙2H2O (называемый также селенитом). Разновидностью его является алебастр. Безводный сульфат кальция СаSO4 — ангидрит — наряду с кизеритом МgSO4∙H2О является почти постоянным спутником каменной соли. Но н помимо этого, нередко встречаются слоистые залежи ангидрита. Из дцух сульфатов стронция и бария — целестина (SrSO4) и тяжелого шпата (ВаSO4) — особо широко распространен последний.
Из силикатов магния следует указать оливин (Мg,Fе)2[SiO4], энстатит Мg2[Si2О6], а также содержащие воду силикаты — серпентин, асбест, тальк и морскую пенку. Чрезвычайный многообразием отличаются двойные силикаты магния и особенно кальция. К числу соединений кальция относятся следующие минералы: фосфорит, апатит 3Са3(РO4)2∙Са(F,С1)2 и плавиковый шпат (флюорит СаF2). Кроме того, следует еще упомянуть встречающуюся в небольших количествах, но довольно распространенную шпинель МgО∙Аl2О3, некоторые разновидности которой ценятся как драгоценные камни.
Бериллий встречается в природе в виде некоторых минералов, не имеющих особенного распространения. Чаще всего из пих встречается берилл Ве3Al2[Si6O18], крупные месторождения которого известны в Бразилии, Северной Америке, Африке, Индии, Англии, Норвегии, Испании и на Урале.
Некоторые содержащие бериллий минералы иногда встречаются в виде очень красивых экземпляров и считаются поэтому драгоценными камнями. Так, смарагд и аквамарин — разновидности берилла, а александрит — разновидность хризоберилла. Эвклаз и фенакит тоже считаются драгоценными камнями.
Радий в совершенно ничтожных количествах содержится в рудах урана, из которого он образуется путем радиоактивно го распада. Отношение радия к урану в этих рудах практически постоянно и равняется 1:3 000 000. Главный минерал, содержащий уран, — урановая смоляная руда — содержит в среднем 0,14 г радия на 1 т (1000 кг). Еще ничтожнее содержание радия в других урановых рудах, например в аутупите, карнотите и в других подобных минералах
44.
Основные способы получения металлов. Металлы получают из руд, т.е. исходного сырья, в котором содержится экономически приемлемое количество металла. По мере истощения руд уменьшается экономически приемлемое содержание в них металла и повышается его стоимость.
Предварительно руда обрабатывается для увеличения концентрации металла путем отделения пустой породы и разделения остатка на различные фракции. Последующие операции заключаются в получении соединения металла, из которого удобно выделить металл тем или иным способом. Так как большинство металлов в природе находится в окисленном состоянии, то извлечение их основано на восстановлении из тех или иных соединений в растворах при невысокой температуре) или расплавах (при повышенных температурах).
Восстановление проводят химическими или электрохимическими способами. Химическое восстановление заключается во взаимодействии соединений металлов с углем, водородом или металлами-восстановителями. Например, при взаимодействии оксидов же-еза со специально обработанным углем (коксом) образуется чугун. J помощью водорода получают вольфрам, молибден, кобальт и ругие металлы, например, по реакции:
WO3 + ЗН2 = W + ЗН2О
Многие металлы производят взаимодействием соединений ме-ллов с другими металлами, например:
BeF2 + Mg = Be + MgF2 Таким способом получают кадмий, олово, хром, серебро, титан И другие металлы. Кроме магния восстановителями обычно служат Цинк и алюминий. Электролизом из растворов осаждают медь, ни-Ксль, серебро, хром, кадмий, индий, олово и другие металлы. Элек-1ролизом из расплавов осаждаются сильные восстановители, такие, Как щелочные металлы, магний и алюминий.
Получение чистых металлов. Свойства металлов зависят от содержания в них примесей. Например, титан долгое время не находил применения из-за хрупкости, обусловленной наличием примесей. После освоения методов очистки области применения титана резко расширились. Содержание лишь 0,03 % (масс, ноли) мышьяка приводит к снижению электрической проводимости меди на 14%. Особенно большое значение имеет чистота материалов в электронной и вычислительной технике и ядерной энергетике.
В зависимости от суммарной атомной доли примесей (от 10'1 до 10~10%) различают 10 классов чистоты веществ. Если те или иные примеси особенно нежелательны для данной области применения материала, то оговаривают допустимое содержание этих примесей. Например, атомная доля бора, гафния и кадмия в материалах атомной энергетики не должна превышать 10"4 — 10"6%. Стоимость материалов возрастает по мере повышения их степени очистки.
Все методы очистки металлов можно разделить на химические
Физико-химические. Химические методы очистки заключаются во взаимодействии металлов с теми или иными реагентами, образующими с основными металлами или примесями осадки или газообразные продукты. Из-за контакта металла с реагентами и материалами аппаратуры не удается достичь высокой степени чистоты металла. Более высокую степень очистки дают транспортные химические реакции в которых металл с реагентом образует газообразные продукты, передаваемые в другую зону, где они разлагаются на чистый металл и исходный реагент.
Физико-химические методы включают в себя электрохимические, дистилляционные, кристаллизационные и др.
При электрохимическом способе (рафинировании) очищаемый металл служит анодом, чистый металл осаждается на катоде электролизера, примеси переходят либо в раствор электролита, либо в виде осадка накапливаются в шламе (см. гл. 9). Дистилляционные методы заключаются в испарении жидкого (например, ртути) или расплавленного металла с последующей конденсацией паров. Отделение примесей обусловлено разной температурой испарения основного металла и примеси.
Кристаллизационные методы основаны на различном содержании примесей в твердом и расплавленном металлах. Они включают зонную плавку, кристаллизационное вытягивание из расплава и др. Особенно широко применяют зонную плавку, заключающуюся в том, что вдоль слитка (стержня) медленно перемещается зона нагрева и соответственно зона расплавленного металла. Некоторые примеси концентрируются в расплаве и собираются в конце слитка, другие — в начале слитка. После многократных прогонок отрезают начальную и концевую части слитка, остается очищенная средняя часть металла
ПОЛУЧЕНИЕ МЕТАЛЛОВ ВЫСОКОЙ ЧИСТОТЫ
В связи с развитием в настоящее время новых отраслей техники и технологии требования к чистоте используемых материалов (металлов) постоянно повышаются. Перед современной металлургией остро стоит проблема разработки и освоения методик тонкой очистки металлов от примесей. С этой целью достаточно широко используют методы электролитического рафинирования металлов (см. гл.8 “Электрохимические процессы”) и некоторые другие.
Перегонка и переплавка в вакууме основаны на различной летучести металлов. При определенной температуре примесь отделяют от менее летучего металла или, наоборот, отгоняют более летучий металл от менее летучих примесей. Таким образом, металлы (Nb, Ta, Mo, W, Re и др.) очищают, от растворенных в них газов (кислорода, водорода, азота и др.).
В методе термической диссоциации (пиролиз) летучих соединений используют способность некоторых соединений металлов (галидов, карбонилов и др.) разлагаться при высоких температурах. Так, ряд металлов (Ti, Zr и др.) образуют с иодом при сравнительно низких температурах летучие соединения - иодиды, которые легко отделяют от примесей. При более высокой температуре пары иодидов на W- или Ta- проволоке разлагаются на чистый металл и иод:
Данный метод очистки металлов иногда называют методом транспортных реакций. Кроме иода в нем используют и другие реагенты, в частности, оксид углерода (II), при помощи которого в процессе очистки от примесей никеля, железа, кобальта, хрома и других металлов получают соответствующие карбонилы, которые, после отделения от примесей разлагают на чистый металл и CO:
Для получения чистых металлов в ряде случаев применяют метод диспропорционирования суть которого сводится к процессам внутримолекулярного окисления - восстановления или диспропорционирования солей некоторых металлов с образованием металлов:
2AuCl3 = Au + 3Cl2
2TiCl2 = TiCl4 + Ti
Зонная плавка основана на различной растворимости примесей в твердом и расплавленном металле. Процесс заключается в том, что через высокотемпературную зону очень медленно передвигают стержень из очищаемого металла. Образующаяся при этом узкая зона расплавленного металла, в которой концентрируются примеси, перемещается в конец стержня со скоростью 2-3 см/час. Описанную операцию многократно повторяют. Конец стержня механически отделяют. Данным методом получают металлы, в которых остается один атом примеси на 10 атомов очищаемого металла.
Металлы, находящиеся в чистом состоянии, отличаются по своим физическим свойствам от неочищенных. Например, полупроводниковые свойства у германия проявляются лишь в образцах с содержанием примесей 10 . Чистый хром отличается от неочищенного высокой пластичностью, электро-, теплопроводностью. Изменяются и другие характеристики металлов.
45.
МАГНИЙ (Magnesium) Mg, хим. элемент II гр. периодич. системы, ат. н. 12, ат. м. 24,305; относится к щелочноземельным элементам. Прир. магний состоит из трех стабильных изотопов 24Mg (78,60%), 25Mg (10,11%) и 26Mg (11,29%).Конфигурация внеш. электронной оболочки 3s2; степень окисления +2, очень редко +1. Содержание магния в земной коре 2,35% по массе. Встречается в природе только в виде соединений. Известно более 100 минералов, содержащих магний; большинство из них - силикаты и алюмосиликаты. Магний - серебристо-белый металл. Магний - сравнительно мягкий, пластичный и ковкий металл. При обычных условиях пов-сть магния защищена прочной пленкой магния оксида MgO, только при нагр. на воздухе до ~ 600 °С происходит разрушение этой пленки и металл сгорает ослепительно белым пламенем с образованием MgO и нитрида Mg3N2. С холодной водой магний не реагирует, из кипящей воды вытесняет Н2 и образует магния гидроксид Mg(OH)2. Аналогично реагирует с р-рами солей аммония.
Бериллий (Be) - имеет атомный номер 4 и атомный вес 9.0122. Он находится во втором периоде периодической системы и возглавляет главную подгруппу 2 группы, в которую также входят магний, кальций, стронций, барий и радий. Электронная структура атома бериллия 1s 2s. На внешней оболочке он имеет два электрона, что является характерным для элементов этой группы. Электронная структура внешней оболочки иона каждого из этих элементов с зарядом +2 соответствует электронной структуре инертного газа с атомным номером на две единицы меньше номера рассматриваемого элемента. Бериллий вещество серо-стального цвета; при комнатной температуре металлический бериллий имеет плотно упакованную гексагональную решетку, подобную решетке магния. Атомный (металлический) радиус бериллия равен 1.13 А. Увеличение массы и заряда ядра при сохранении конфигурации электронных оболочек служит причиной резкого уменьшения атомного и ионного радиусов бериллия по сравнению с соседним литием. После отрыва валентных электронов атом бериллия образует ион типа благородных газов, и несет, подобно литию, всего одну электронную оболочку, но характеризуется значительно меньшими размерами и компактностью. Истинный ионный радиус бериллия - 0,34 А является наименьшим среди металлов. Потенциалы ионизации у бериллия равны (соответственно для первого, второго, третьего и четвертого электронов) I1-9,28; I2-18,12; I3-153,1; I4-216,6 эВ. На кривой потенциалов ионизации бериллий занимает одно из верхних мест. Последнее соответствует его малому радиусу и характеризует бериллий как элемент не особенно охотно отдающий свои электроны, что в первую очередь определяет степень химической активности элемента. Этот же фактор имеет решающее значение в образование того или иного типа химической связи при соединение бериллия с другими элементами. С точки зрения электроотрицательности бериллий наряду с алюминием может рассматриваться как типичный переходный элемент между электроположительными атомами металлов, легко отдающих свои электроны, и типичными комплексообразователями, имеющими тенденцию к образованию ковалентной связи. В нейтральных растворах гидрокcилы бериллия дисcоциируют по схеме:
Be2+ + OH- Be(OH)2 H2BeO2 2H+ + [BeO2]2-
46.
Алюминий представляет собой серебристо–белый, довольно твердый металл с плотностью 2,7, плавящийся при 660° и кипящий при 2350°С. Он характеризуется большой тягучестью и высокой электропроводностью (составляющей 0,6 электропроводности меди). С этим связано его использование в производстве электрических проводов.
Значительно более обширно применение алюминия в виде различных сплавов, наряду с хорошими механическими качествами характеризующихся своей легкостью. Особенно важен так называемый дуралюминий (приблизительный состав: 94% Аl, 4% Cu, по 0,5% Mg, Mn, Fe и Si). Он ценен тем, что при равной прочности изделия из него почти в три раза легче стальных. Не говоря уже об авиационной промышленности, для которой легкость материала особенно важна, облегчение металлических конструкций имеет громадное значение для ряда областей техники.
2Аl + 2NaOH + 2Н2 О = 2NaAlO2 + ЗН2
В ряду напряжений он располагается между Mg и Zn. Во всех своих устойчивых соединениях алюминий трехвалентен.Легкость растворения алюминия в сильныхшелочах обусловлена снятием с него защитной окисной пленки по схеме: Аl2 О3 + 2ОН– = 2АlO2 – +Н2 О.
Тита́н (Ti) — элемент побочной подгруппы четвёртой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 22. Простое вещество титан— лёгкий металл серебристо-белого цвета. Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре 0,57 % по массе. Практическое значение Ti и Zr особенно велико для металлургии. Присадка титана придает стали твердость и эластичность, а присадка циркония сильно повышает ее твердость и вязкость. За последнее время стало быстро развиваться использование титана в самолетостроении, а циркония – при сооружении ядерных реакторов. Соединения обоих элементов находят применение в различных отраслях промышленности. Как правило, исходным материалом для производства титана и его соединений служит диоксид титана со сравнительно небольшим количеством примесей. В частности, это может быть рутиловый концентрат, получаемый при обогащении титановых руд. Однако запасы рутила в мире весьма ограничены, и чаще применяют так называемый синтетический рутил или титановый шлак, получаемые при переработке ильменитовых концентратов. Для получения титанового шлака ильменитовый концентрат восстанавливают в электродуговой печи, при этом железо отделяется в металлическую фазу (чугун), а не восстановленные оксиды титана и примесей образуют шлаковую фазу. Богатый шлак перерабатывают хлоридным или сернокислотным способом.
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4:

Образующиеся пары TiCl4 при 850 °C восстанавливают магнием:



Этот видеофрагмент даёт возможность учащимся вместе с путешественником побывать в местах, где были найдены самые большие самородки металлов, он расскажет о распространённости металлов в земной коре, о некоторых исторических фактах, касающихся металлов, а также о рудах и минералах. Вместе с ним ребята побывают на дне водоёма и увидят отложения металлов, смогут представить себя в роли геолога и сравнить такие минералы, как красный, бурый и магнитный железняк. Путешественник расскажет им об основных методах получения металлов и затронет некоторые вопросы охраны окружающей среды, связанные с получением металлов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Получение металлов. Нахождение их в природе"
Получение металлов. Нахождение их в природе
Ребята, сегодня мы побываем с вами в местах, где получают металлы, а также узнаем, где же встречаются металлы.
Ну что ж, начинаем путешествие. Металлы встречаются в природе в свободном состоянии, их называют самородными металлами, так и в виде соединений.

А вот распространённость химических элементов металлов в земной коре различна. К наиболее распространённым металлам относятся алюминий (7,45%), железо (4,20%), кальций (3,25%), натрий (2,40%), калий (2,35%) и магний (2,35%). Содержание других металлов в земной коре может составлять тысячные доли процента и ниже.

Некоторые историки считают, что упадок Римской империи был обусловлен массовым отравлением свинцом. Известно, что водопроводы Древнего Рима были из свинца. В свинцовых чанах хранили воду и вино. Попадая в человеческий организм, свинец вызывает поражение центральной нервной системы, приводит к изменению состава крови.
Многие металлы являются элементами, необходимыми для функционирования живых организмов. На долю ионов Na + , K + , Mg 2+ , Ca 2+ в организме человека приходится 99% всех ионов металлов.

К биологически наиболее значимым металлам относятся: K, Na, Mg, Ca, Fe, Cu, Co, Mn, Zn, Mo.
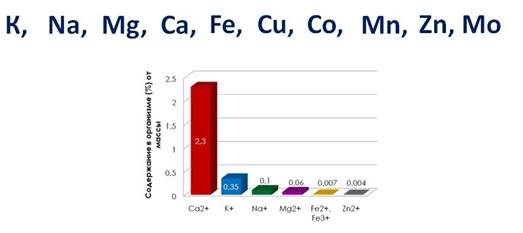
В земной коре металлы чаще всего встречаются в виде соединений: таких, как оксиды, силикаты, карбонаты, сульфиды и хлориды. Эти соединения входят в состав руд и минералов.
Рудой называют горную породу, получение из которой чистого металла экономически выгодно. В состав руды входят минералы и примеси в виде пустой породы. А минералы – это природные тела, имеющие определённый химический состав. Давайте с вами посмотрим названия и химический состав некоторых минералов.
Химический состав
Красный железняк (гематит)
Магнитный железняк (магнетит)
Железный колчедан (пирит)
Медный колчедан (халькопирит)
Свинцовый блеск (галенит)













К наиболее известным минералам относится пирит, или железный колчедан (FeS2), киноварь (HgS), малахит ((CuOH)2CO3). Пирит и киноварь используют в промышленности для получения соответствующих металлов, то есть железа и ртути, а малахит, как поделочный камень.

Представьте себя геологом или минералогом, как же это увлекательно. Для этого сравним такие минералы, как красный, бурый и магнитный железняк.
Цвет красного железняка коричнево-красный, сам он прочный, плотный, если провести образцом руды по поверхности фарфоровой ступки, то он оставляет красно-коричневый след, не притягивается магнитом.

Бурый железяк имеет жёлто-коричневую окраску, сам прочный и плотный, не притягивается магнитом, оставляет на фарфоровой ступки жёлто-бурую полосу.

Магнитный железняк чёрного цвета, сам прочный и плотный, притягивается магнитом, оставляет чёрный цвет черты на поверхности фарфоровой ступки, имеет металлический блеск.

Здорово, получается, что минералы отличаются между собой окраской, магнитными свойствами, цветом черты и некоторыми другими показателями.
В современной технике широко используют более 75 металлов и многочисленные сплавы на их основе. Поэтому большое значение придаётся промышленным способам получения металлов из руд. Обычно перед получением металлов из руды её измельчают, потом предварительно обогащают – отделяют пустую породу, примеси. В результате образуется концентрат, служащий сырьём для металлургического производства. Затем обогащённую руду превращают в оксид и только после этого восстанавливают металл.

Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов, о получении сплавов и обработке металлов. В зависимости от метода получения металла из руды (концентрата) существует несколько видов металлургических производств.
Представьте, что из одной т медной руды можно получить шестнадцать кг концентрата и только четыре кг чистой меди.

Такая отрасль металлургии, как пирометаллургия занимается переработкой руд, она основана на химических реакциях, при чём они проходят при высоких температурах, ведь от греч. пирос, означает огонь.
Пирометаллургические процессы включают обжиг и плавку.
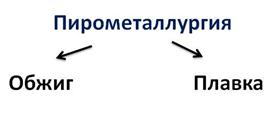
При обжиге сульфиды переводят в оксиды, а сера удаляется в виде оксида серы (IV). А затем из оксида восстанавливают металл. Полученный металл или сплав подвергают механической обработке, придают ему соответствующую форму. В процессе выделения металлов (плавке) из оксидов в качестве восстановителей используют углерод, оксид углерода (II), водород, кремний или более активные металлы.
Например, ещё древние металлурги для получения железа из его руд использовали в качестве восстановителя углерод. Но этот способ неудобен тем, что реакция между твёрдыми веществами идёт только в местах их соприкосновения.
В промышленных масштабах для получения железа, цинка и других цветных металлов из оксидов используют в качестве восстановителя оксид углерода (II).
Сейчас мы посмотрим, как получают чугун и сталь. Восстановление железа проводят в специальных вертикальных печах, называемых доменными, высотой до нескольких десятков метров и внутренним объёмом до 5000 м 3 . Они имеют стальной корпус, а изнутри выложены огнеупорным кирпичом. По характеру своей работы доменная печь – аппарат непрерывного действия. Сверху в печь подаётся твёрдое сырьё – шихта, представляющая собой смесь железной руды, кокса (переработанного угля), известняка и других добавок, а снизу вдувается подогретый или обогащённый кислородом воздух. В нижней части печи кокс сгорает в горячем воздухе, образуя углекислый газ.

Углекислый газ поднимается вверх в печи и взаимодействует с новыми порциями раскалённого кокса
с образованием оксида углерода (II).
В результате реакций СО с оксидом железа (III) образуется железо.
В доменном процессе получается железо с относительно большим (более 2%) содержанием углерода – чугун.
Чугун превращают в сталь, удаляя избыточный углерод путём окисления кислородом воздуха в специальных установках – мартеновский печах, конвертерах или электропечах.

Для получения некоторых металлов в качестве восстановителя используют водород.

В роли восстановителей можно также использовать более активные металлы, способные вытеснять другие металлы из их оксидов и солей. Этот способ получения металлов называется металлотермией. Если используют алюминий, то говорят об алюминотермии:

Восстановление железа методом алюминотермии до сих пор применяется при сварке рельсов.

Этот метод получения металлов был предложен русским учёным
Н.Н. Бекетовым.

Гидрометаллургия – это методы получения металлов, основанные на химических реакциях, происходящих в растворе. Гидрометаллургические процессы включают стадию перевода нерастворимых соединений металлов из руд в растворы, с последующим восстановительным выделением металлов из полученных растворов с помощью других металлов или электрического тока.
Электрометаллургия – методы получения металлов, основанные на электролизе, т.е. выделение металлов из растворов или расплавов их соединений с помощью постоянного электрического тока. Этот метод применяют для получения активных металлов – щелочных и щелочноземельных, алюминия, также для получения легированных сталей. С помощью этого метода, английский химик Г. Дэви впервые получил калий, натрий, барий и кальций.


Таким образом, металлы встречаются в природе в виде соединений или в самородном состоянии. В земной коре металлы чаще всего встречаются в виде соединений: оксидов, силикатов, карбонатов, сульфидов, хлоридов. Эти соединения входят в состав руд и минералов. Для получения металлов из руд руду сначала измельчают, обогащают, переводят в оксид и только после этого восстанавливают металл. В качестве восстановителей используют C, CO, H2, Si или более активные металлы. Металлургия занимается получением металлов и их сплавов из руд. В зависимости от метода получения металла из руды существует несколько видов металлургических производств: пирометаллургия, гидрометаллургия и электрометаллургия.
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами .
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Металлические элементы, образующие химически активные металлы ( Li–Mg ), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.


В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3 ( P O 4 ) 2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности ( Al–Pb ), в природе чаще всего встречаются в виде оксидов и сульфидов.


Металлические элементы, образующие химически неактивные металлы ( Cu–Au ), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Рис. \(7\). Самородное золото Au | Рис. \(8\). Самородное серебро Ag | Рис. \(9\). Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Рис. \(13\). Положение металлов в Периодической системе. Знаки металлических химических элементов расположены ниже ломаной линии B — Si — As — Te
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны (электроны внешнего энергетического уровня).
Рис. \(14\). Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Рис. \(15\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей .
Большинство химических элементов относится к металлам (химия, 9 класс). Под этим материалом подразумеваются простые вещества, наделенные определенным комплексом свойств: кристаллическая структура, блеск, высокая теплопроводность и электропроводимость, а также ее зависимость от нагрева, способность легко отдавать электроны, ковкость, тягучесть, склонность к образованию сплавов.
Большинство химических элементов относится к металлам (химия, 9 класс). Под этим материалом подразумеваются простые вещества, наделенные определенным комплексом свойств: кристаллическая структура, блеск, высокая теплопроводность и электропроводимость, а также ее зависимость от нагрева, способность легко отдавать электроны, ковкость, тягучесть, склонность к образованию сплавов.

Общая характеристика
В атомах металлов наружные электроны удерживаются довольно слабо (если сравнивать с другими, неметаллическими, элементами). В химических реакциях металлы обычно выступают в качестве восстановителей — это объясняется тем, что они имеют низкую степень ионизации.
Для металлов и их сплавов характерна металлическая связь, то есть та, что возникает за счет перекрытия валентных электронов. Это дает возможность осуществлять взаимные атомные смещения без нарушения кристаллической решетки (это объясняет тот факт, что эти вещества более пластичные по сравнению с неметаллами).

- Щелочные (примером таких выступают натрий Na, калий K, цезий Cs, франций Fr и прочие).
- Щелочноземельные — кальций Ca, стронций Sr, барий Ba.
- Переходные — медь Cu, серебро Ag, золото Au. Эта группа — самая многочисленная, она насчитывает 38 веществ.
- Легкие — алюминий Al, олово Sn, титан Ti.
- Полуметаллы — кремний (Si), бор (B), мышьяк (As), сурьма (Sb).
- Лантаноиды — лантан (La), лютеций (Lu), скандий, иттрий.
- Актиноиды (они до конца не изучены) — торий, плутоний, уран, нептуний.
Примечательно, что такие элементы, как магний и бериллий, нельзя отнести ни к одной из групп — их свойства отличаются от характеристик прочих металлов. Например, при нормальных условиях они устойчивы к воздействию воды и воздуха, потому что имею тончайшую оксидную пленку по всей своей поверхности.
Большинство металлов при нормальных условиях находятся в твердом состоянии. Но бывают исключения: например, ртуть и франций (условно) при комнатной температуре и обычном атмосферном давлении.
Твердость у всех элементов отлична. Температура плавления колеблется от -39°C (Hg) до 3410 °C (W). В зависимости от плотности они делятся на легкие (Li) и тяжелые (Os, Ir).
Нахождение в природе и получение

Металлы (общая формула записывается как Me) могут присутствовать в природе как самородки. Это характерно для тех, что практически не окисляются на воздухе (пример: платина, золото, серебро, реже — ртуть и медь).
Активные Me в природе находятся в виде солей (нитраты, карбонаты, сульфаты, хлориды), оксидов. Минералы входят в состав руд и горных пород.
В промышленности Me получают восстановлением соответствующих руд. Один из основных методов получения Me — флотация (определенный способ обогащения руд, основанный на способности минералов удерживаться на межфазовой поверхности). В этом случае руду, содержащую необходимые элементы, переводят в определенную (единую) форму: например, в оксид: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2. Полученные окислы затем восстанавливают. Сделать это возможно несколькими способами:

- Металлотермия — восстановление элемента другим, более активным (с точки зрения химии): Cr2O3 + 2Al → 2Al2O3 + 2Cr; CuO + C → Cu + CO.
- Термическое разложение. Fe (CO)5 (пентакарбонилжелезо)→ Fe + 5CO. Такой способ применяется, если нужно получить высокочистый элемент.
- Электролиз. Используется для получения щелочных металлов: 2NaCL → 2Na + Cl2; 2LiCl → 2Li + Cl2.
- Вытеснение более активным металлом менее активного из раствора соли. CuSO4 + Fe → FeSO4 + Cu.
Химические особенности
Все Me в свободном состоянии — восстановители, их степени окисления имеют положительное значение. Химическая активность этих веществ зависит от двух величин: электродного потенциала и энергии ионизации (в таблице Менделеева это значение увеличивается слева направо). Типичные реакции:

- Взаимодействие с хлором и фтором: Cu + Cl2 → CuCl2.
- Окисление кислородом (протекает не слишком энергично): 4Li + O2 → 2Li2O; K + O2 → KO2 (название этого соединения — надпероксид калия).
- С серой протекают только при повышенных температурах: Fe + S → FeS. Золото и платина в подобных реакциях не участвуют.
- Участие водорода приводит к образованию гидридов: Mg + H2 → MgH2; 2Na + H2 → 2NaH.
- С углеродом взаимодействуют только активные металлы. 2Na + 2C → Na2C2 (ацетиленид натрия); Na2C2 + 2H2O → 2NaOH + C2H2 (ацетилен). 4Al + 3C → Al4C3 (метанид алюминия); Al4C3 + 12H2O → 3CH4 (метан) + 4Al (OH)3.
- Реакции замещения с кислотами. В этом случае все будет зависеть от того, какая активность у элемента. Например: Zn + H2SO4 (разб) → ZnSO4 + H2; Zn + H2SO4 (конц) → ZnSO4 + S + H2O.
- Вода будет давать реакцию по такой схеме: 2Na + 2H2O → 2NaOH + H2.
- Возможны реакции с растворами солей: Fe + CuSO4 → FeSO4 + Cu.
Кроме того, металлы способны образовывать комплексы. Это происходит за счет наличия свободных электронных орбиталей.
Способность к комплексообразованию зависит от величины заряда и его радиуса: чем выше первый показатель и ниже второй, тем сильнее способность.
Названия таких соединений подчиняются определенной структуре: сначала указывается наименование аниона, а затем — катиона, из которых состоит вещество. Например: [Li (H2O)4]NO3 — нитрат тетрааквалития.
Образование сплавов

Примечательно, что сплавы бывают не только состоящие исключительно из металлов — в них часто присутствуют и неметаллические вещества. При этом они могут не просто смешиваться механически, но и образовывать атомные соединения. Такие сплавы будут значительно отличаться по своим физическим и химическим свойствам от элементов-исходников. Кроме того, существует возможность заранее задавать свойства, которыми будет обладать полученный материал:


- Чугун — сплав Fe с C, в котором присутствуют легирующие добавки. Используется для изготовления деталей, различных предметов в тяжелой промышленности (машиностроение, автомобилестроительная индустрия и прочие).
- Латунь — медь + цинк. Материал устойчив к коррозии, легко сваривается со сталью. Благодаря своему цвету (золотистый) широко применяется для изготовления фурнитуры, художественных изделий.
- Амальгама — металлическая смесь, содержащая ртуть. Применяется для золочения металлсодержащих изделий, в производстве зеркал, люминесцентных ламп.
- Сталь — смесь железа с углеродом (но второго компонента меньше, чем в чугуне — всего до 1,8%), также с использованием легирующих добавок, в качестве которых используются Ni, P, Si, Mn, и некоторые другие. Используется для изготовления различных инструментов (слесарных, столярных), в строительстве, судоремонтной и авиационной промышленности.
- Мельхиор — медь и никель. Применяется для изготовления посуды, бюджетных ювелирных и художественных изделий.
- Бронза — медь, олово и легирующие добавки. Используется в машиностроении, ракетостроении, авиационной индустрии, для изготовления художественных изделий и прочего.
- Дюралюминий (дюраль) — сплав Al + Cu + Mg + Mn. Используется в авиастроении, производстве скоростных поездов, и прочих отраслях машиностроения.
Поэтому изучение этих элементов, проведение опытов с различными сплавами, еще долгое время будет являться одним из приоритетных направлений науки и промышленности.
Читайте также:

