Трансплантация хрящевой ткани реферат
Обновлено: 05.07.2024
а) Трансплантация хряща перегородки носа. Четырехугольный хрящ перегородки носа является неоценимым трансплантатом для хирурга головы и шеи. Благодаря знакомству оториноларингологов с этой процедурой, забор хряща происходит быстро и безопасно. При условии наличия здоровой и не прооперированной перегородки, в большинстве случаев хирург сможет получить пласт хрящевой ткани около 1 мм толщиной, которую можно сформировать или измельчить и смоделировать до желаемой формы.
Чаще всего хрящ перегородки носа используется для восстановления функции носового клапана. Размер и форма хряща позволяют легко нарезать его на несколько фрагментов прямоугольной формы (3 х 14 мм), которые для расширения области внутреннего носового клапана размещаются между перегородкой носа и верхними латеральными хрящами.
Также эта техника может использоваться для расширения средней части носа и придания опорной функции верхним латеральным хрящам, которые были частично разрушены или проваливаются в полость носа. Кроме того, из хряща перегородки носа легко смоделировать реечные трансплантаты, использующиеся для укрепления наружного носового клапана.
б) Трансплантация верхних и нижних латеральных хрящей. Верхние и нижние латеральные хрящи редко используются в качестве первичного источника аутохрящевой ткани, поскольку это может привести к косметическим и, возможно, функциональным нарушениям. Тем не менее, иногда в ходе ринопластики эти хрящи частично резецируются (например, цефалическая резекция нижних латеральных хрящей).
До окончания операции эти фрагменты следует хранить в перевязочном материале, пропитанном физиологическим раствором. В некоторых случаях их можно будет разрушить и измельчить для того, чтобы скрыть мелкие неровности, чаще всего в области верхушки носа.
Другим преимуществом является тот факт, что одновременно с забором хряща можно проводить подготовку реципиентной области. В отличие от хряща перегородки носа, ушной хрящ достаточно слабый. Он более тонкий и более гибкий, из-за этого его не следует использовать в ситуациях, где трансплантат должен быть крепким; у пожилых людей он также может оказаться достаточно ломким. При попытке измельчения он превращается в мокрую крошку.
г) Трансплантация реберного хряща. При обширных реконструкциях носа или ушной раковины часто необходим забор реберного хряща. В этом случае удается получить достаточно большой объем хрящевой ткани, которую можно смоделировать и использовать для самых разных реконструктивных целей. Одним из наиболее частых показаний к забору реберного хряща является реконструкция ушной раковины при микротии. Для того, чтобы воссоздать из реберного хряща множество сложных анатомических структур, требуется особое мастерство, поэтому всем хирургам для получения опыта стоит в свободное время практиковаться на каких-либо замещающих материалах.
Тем не менее, никакое количество часов практики вне реальной операционной не может гарантировать успешного результата.
Для уменьшения длительности операции забор реберного хряща может выполнять второй хирург. Всегда следует помнить о возможности развития осложнений со стороны донорской области. В некоторых случаях шрам на груди может стать крайне неприглядным, особенно тщательно к выбору места для разреза нужно относиться у пациентов женского пола. Также во время забора хряща существует реальная вероятность повредить плевру с дальнейшим развитием пневмоторакса.
При обнаружении повреждения плевры во время операции дефект нужно ушить кисетным швом над красным резиновым катетером с аспирацией отрицательным давлением; в этом случае вероятность развития осложнений должна быть минимальна. Как и при любых операциях на ребрах, в послеоперационном периоде необходимо выполнить рентгенографию органов грудной клетки. Если пневмоторакс обнаружен уже в послеоперационном периоде, требуется дренирование плевральной полости и назначение соответствующих консультаций. К другим возможным осложнениям относятся появление грубого рубца, боль в области грудной клетки, ателектаз, пневмония. Это еще раз подчеркивает важность получения подробного информированного согласия перед любыми элективными или косметическими хирургическими операциями.
д) Аллотрансплантаты хрящей. Если хирург решает, что для выполнения реконструктивной операции ему требуется хрящевой трансплантат, в его арсенале имеется еще один инструмент. В некоторых ситуациях может использоваться облученный трупный хрящ. Если пациент или его родственники не согласны на забор аутореберного хряща, либо предполагаемые риски его забора перевешивают возможную пользу, стоит рассмотреть использование трупного материала. И хотя некоторые авторы сообщают об очень большой частоте резорбции трупного хряща при длительном наблюдении, другие хирурги считают, что риск резорбции не настолько велик.
Помимо вероятности резорбции есть риск деформации хряща. Также существуют опасения о возможной передаче вирусной инфекции (хотя автору неизвестен ни один опубликованный случай такой передачи). Легко понять хирургов, которые предпочитают использовать собственный хрящ пациента.
е) Сложные трансплантаты. Сложные трансплантаты состоят из двух и более слоев тканей, поэтому они даже в большей степени, чем полнослойные кожные трансплантаты зависят от кровоснабжения реципиентной области. Поэтому для успешного приживления трансплантата требуется тщательно отбирать пациентов и проводить коррекцию всех неблагоприятных факторов (отказ от курения, контроль уровня глюкозы, использование антикоагулянтов).
Частым показанием к использованию сложных трансплантатов является реконструкция крыла носа. Надежным и эстетически приемлемым материалом в данном случае является корень завитка. Установка трансплантата аналогично таковой при полнослойных кожных лоскутах. Невозможно переоценить важность тщательного обеспечения гемостаза и искусной хирургической техники.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Отделение ортопедии Клиники Фридрихсхафен получило сертификат Немецкой ассоциации травматологической медицины, принимает более 25 000 пациентов и проводит более 3 тысяч операций в год.
Его глава — профессор, доктор Ойген Винтер, является признанным специалистом в области ортопедической хирургии и не только проводит операции, но и обучает других врачей. Отделение ортопедии занимается лечением травм и заболеваний позвоночника, бедренных, коленных, плечевых и локтевых суставов, стоп, рук, хронических болей, сдавливания нерва и т.д.
Основная специализация отделения ортопедии — эндопротезирование бедренных и коленных суставов, включая полную замену сустава и восстановление хрящевой ткани путем ее трансплантации.
При повреждении или заболевании сустава могут страдать не только кости, но и покрывающие их ткани. В некоторых случаях нарушение целостности хряща предшествует разрушению кости.
Повреждение хрящевой ткани
Повреждение хрящевой ткани может быть вызвано несколькими причинами, в том числе:
- травмой,
- постоянным износом из-за чрезмерного веса или тяжелых физических нагрузок,
- нарушением обмена веществ,
- неправильным расположением элементов сустава (например коленного),
- возрастными изменениями,
- воспалением
Хрящевая ткань сама почти не восстанавливается. До недавнего времени считалось, что единственным решением при сильном повреждении была замена сустава.
Однако современная медицина предлагает иной способ: трансплантацию (пересадку) хрящевой ткани, хотя здесь имеются некоторые ограничения. Подобный способ лечения рекомендуется в основном для молодых пациентов со средним и обширным повреждением хрящевой ткани и не подходит для пожилых людей с остеоартритом.
Трансплантация хрящевой ткани проводится в случае, если размер пораженного участка не более 3-х квадратных сантиметров.
Для трансплантации может использоваться несколько видов хрящевой ткани:
- образец ткани с надкостницы (соединительной пленки, покрывающей кость там, где нет суставных хрящей)
- костно-хрящевой (трансплантация части хрящевой ткани вместе с кусочками костной, образующая своего рода мозаику на кости сустава)
- образец пасты стволовых клеток суставного хряща ( часть хрящевой ткани из углубления в центре коленного сустава извлекается и измельчается в специальном растворе, после чего им заполняют место удаленного поврежденного хряща).
- Трансплантация выращенных из собственного образца клеток хрящевой ткани
Трансплантация выращенных из собственного образца клеток хрящевой ткани - последная разработка медицины.
Во время минимально инвазивной операции у пациента берут небольшой образец здоровых клеток хряща и в лаборатории выращивают из них подходящий материал для трансплантации, а из пораженной части сустава извлекают разрушившиеся области. В некоторых случаях для компенсации нагрузки взятые здоровые клетки хряща заменяют своими же больными. Сама процедура занимает от половины до целого часа.
Для того, чтобы новая хрящевая ткань достигла необходимых размеров требуется в среднем три-четыре недели.
По истечении этого срока готовые к трансплантации клетки на специальной подложке пересаживают в место повреждения хряща.
После операции по трансплантации хрящевой ткани требуется восстановительный период длительностью от 6 до 12 недель, в некоторых случаях прописывают курс физиотерапии. Занятия спортом можно возобновлять только через 12- 16 недель. В зависимости от рода занятий, человеку, перенесшему операцию по трансплантации хрящевой ткани, может понадобиться отпуск с отрывом от производства.
Клинические испытания коллагенового геля (CaReS)
Клинические испытания модернизированного объемного коллагенового геля (CaReS) при лечении фокальных хрящевых дефектов коленного сустава.
Результаты: Пациентам вводят коллагеновый гель в область пораженного хряща. Во всех случаях гелеобразный матрикс беспрепятственно соединяется с фибрином в месте дефекта, чем укрепляет межтканевое взаимодействие. В среднем время хирургического вмешательства составляет 69 минут, а длина разреза для операционного доступа - 8,2 см. Специфические осложнения после операции не зафиксированы. В послеоперационном периоде со стороны объективных/субъективных IKDC-показателей, а также со стороны функциональных показателей и успешности процесса в целом, отмечаются значительные улучшения через 3-6 месяцев и до завершения наблюдения через 2 года. Метод очень прост в применении и демонстрирует, спустя незначительное время, превосходные клинические результаты.
Для подтверждения успешности конвенциональной АСТ по сравнению с классическими старыми методами было проведено долгосрочное исследование, в котором принимали участие множество пациентов, и в которое были включены гистологические и биомеханические методы диагностики регенеративной способности ткани.
Трансплантация хряща
Конвенциональная трансплантация хряща была разработана и введена в городе Бриттберг более 15 лет назад. Она получила признание в качестве действующего метода при лечении хондральных и остеохондральных дефектов. Успеху трансплантация хряща обязана многолетнему опыту ее использования в прошлом. Методика, которую врачи проводят в 2 этапа, по сей день считается стандартом лечения хряща сустава во всем мире и проводится после подтверждения показаний к операции.
- В первом этапе проводится артроскопия, во время которой в малонагруженном локусе медиально и латерильно надколенной поверхности бедренной кости или углубления, проводится изъятие хрящевых клеток (биологические пробы).
- После культивирования хрящевых клеток в специальной суспензии, на втором этапе оперативного вмешательства, суспензия вводится в биоактивную камеру. Последняя плотно вшивается в ткань периоста (высокая герметичность), расположенным по краям хрящевого дефекта. Защитная поверхность должна быть не только гидрофобной и устойчивой к механическим факторам, но и должна обладать хондрогенным эффектом (продуцировать рост новых дифференцированных клеток периоста).
Результаты: данного 2-хэтапного метода клинически определялись, как успешные и очень успешные (более 70%). И в сравнении с другими хирургическими методами лечения хрящевых дефектов, например таким, как классическая трансплантация (ACT) с его обширными дефектами и длительным временем курации, явно видно, на чьей стороне преимущества.
Недостатки классической трансплантации хрящя
Воодушевляющие результаты конвенциональной трансплантации хрящя не обходятся без недостатков на клеточном и техническом уровне. В результате непосредственного использования периоста появляется угроза кальцификации и расщепления. Использование жидкой клеточной суспензии может привести к потере герметичности.
При потере стабильности и целостности хрящевой основы становится сложно сшить концы ткани периоста, что негативно влияет на результат операции. Получение ткани периоста возможно при массивной артротомии или при многочисленных надрезах. Обе манипуляции требуют много времени, как и процесс фиксации трансплантата.
Кроме того, из-за обширного оперативного доступа травматизация сустава усугубляется, послеоперационный период удлиняется и появляются осложнения, например: артрофиброз. Низкое качество культивированных хондроцитов или уменьшение ширины ткани периоста может привести к плохому заполнению дефекта или к отказу от проведения операции.
Матрикссвязывающее лечение хряща, при помощи CaReS технологии
Чтобы избежать вышеописанной проблемы, были созданы разнообразные биоматериалы для матрикссвязывающей трансплантации(ATC). Некоторые варианты биоматериала находятся в лаборатории на стадии испытаний или в мультицентрическом клиническом введении. К используемому биоматериалу относится коллагеновый гель и мембраны, синтетические полимеры и структуры с гиалуроновой кислотой.
Используемая нами объемная матрикс-конструкция основана на коллагеновом геле 1 типа, который получают из крысиных хвостов. Процесс культивирования и заливка аутохондроцитов происходит после извлечения их из экстрацеллюлярного матрикса первичного хряща без каких-либо других действий.
Благодаря этому, обычно сводится к нулю возможность неверной дифференциации клеток при множественной заливке. Трансплантация возможна только при гомогенизации клеточной суспензии. Матрикс CaReS ведет к дальнейшей пролиферации клеток без возможности возникновения неверной дифференциации. Оперирующий врач может задать трансплантату желаемую консистенцию и точный размер.
Оперативная техника лечение хряща
После клинических исследований и готовности рентгенологических и МРТ-снимков, проводится артроскопия для определения размера и локализации хрящевого дефекта.
Инновационное оборудование для биопсии
Здесь важно повторно проверить консистенцию и прочность основания хряща, состояние необходимой суставной поверхности, а также менисков и связок. Биопсия выполняется по предписанию: от медиального до латерального края надколенной поверхности бедренной кости.
Для данной манипуляции мы используем специальное оснащение для изъятия хрящевой ткани. С помощью современной аппаратуры для биопсии становится возможным изъятие любого количества материала. Под визуальным контролем при помощи инструментов захватывается верхний конец от медиального до латерального края надколенной поверхности бедренной кости. С помощью инструментов проводится изъятие внутренних структур хряща, которые врач-лаборант осторожно вытягивает наружу, чтобы сделать срез ткани для биопсии. Последним этапом биопсии является перемещении образца ткани в пробирку со средой. Для культивирования клеток необходимы пробы, размером от 1 до 5 см, массой от 200 до 300 мг. Биоптат заливают веществом (не содержащим серы), добавляя 120-150 мл цельной крови и отправляют для дальнейшей обработки и культивирования, которое выполняет фирма “Ars Arthro”, город Эсслинген. Хрящевой биоптат смешивается с коллагеназой, из которого путем центрифугирования получают хондроциты. После оценки жизнеспособности к хрящевым клеткам добавляется коллаген-1 типа до образования гелеобразной суспензии.
Диаметр и плотность трансплантата может меняться в зависимости от состояния дефекта. После образования желеподобной изолированной субстанции и двухнедельной подготовки в серосодержащей среде, процесс завершается рассеиванием клеток хондроцитов в коллагеновом геле, который используется непосредственно для трансплантации.
На втором этапе оперативного вмешательства, после введения антибиотиков и наложения кровоостанавливающего жома, коленный сустав, в зависимости от локализации дефекта, медиально или латерально осуществляется парапателярный доступ. Проводится эта манипуляция, когда речь идет только о повреждении хряща, в прочих случаях при помощи кюретки проводится освобождение хряща до субхондральной зоны от омертвевшей ткани. Краевая часть срезается скальпелем таким образом, чтобы здоровая ткань слегка выступала. Следующим этапом является создание субхондральной кости. Здесь мы используем, при глубоком дефекте кости, один или несколько костных цилиндров, которые извлекаются из дистального бедренного метафиза или из головки большеберцовой кости при помощи костной дрели, после чего материал помещается в специальный вакутейнер для забора материала. Все выступающие неровности заполняются губчатым веществом. Следующие оперативные действия применяются при обоих видах повреждений. Дефект измеряется в соответствии с шаблоном, после чего заранее подготовленная конструкция клеточного матрикса вырезается строго по его размеру. Края дефекта смазываются тонким слоем фибринового клеящего вещества (Tissucol, компания Baxter), после чего в центр дефекта укладывается матрикс. Благодаря своей плотной структуре коллагеновый гель затвердевает в центре, а в остальных зонах его можно моделировать. Перед послойным заполнением повреждения проводится проверка сустава на подвижность, что позволяет максимально точно определить верную позицию для установки трансплантата.
Прочная, желатинообразная консистенция материала делает трансплантат гладким и однородным (нет разделения на отдельные волокна). Подготовленный коллагеновый гель после обработки фибрином основания трансплантата и краев, аккуратно укладывается в зону повреждения. Сразу после укладки коллагенового геля создается желаемая форма, которая полностью заполняет дефект, обволакивая рядом расположенные ткани. Средняя длина разреза для создания оперативного доступа составляет 8,2 см.
Реабилитация, после лечение хряща
Для изолированного бедренного дефекта мы накладываем временную шину на 48 часов, которая обеспечивает полное обездвиживание конечности. Также рекомендуется активная вспомогательная гимнастика, эргометрия и комплексные упражнения на мышцы после 12 недель. Спортивная нагрузка возможна через год после операции.
Результаты
Субъективное состояние пациентов в общем до проведения оперативного лечение оценивается, как плохое или очень плохое. Но уже спустя 3 месяца после проведения операции не остается ни одного негативного отзыва со стороны пациентов, касающегося состояния здоровья. Большое количество пациентов через 12 недель после хирургического вмешательства, а если быть точнее - 18,2% пациентов оценивают свое состояние, как очень хорошее, 54,5% оценивают свое состояние, как хорошее, и 27,3% чувствуют себя удовлетворительно. Через 6 месяцев повышается количество пациентов, оценивающих свое состояние, как очень хорошее и хорошее - 31,8 % и 50%, а количество пациентов, чувствующих себя удовлетворительно сокращается до до 18,2%. Через 2 года после операции 38,5% пациентов чувствуют себя очень хорошо, 46,1% - хорошо и всего 15,4% - удовлетворительно.
Послеоперационные осложнения после применения данного метода в практике не наблюдались.
Классическая трансплантация до настоящего момента является самым приемлемым методом для лечения массивных хондральных и остеохондральных дефектов в коленном суставе. Конвенциональная трансплантация показывает блестящие результаты, как в процессе многочисленных исследований, так и в клинической практике. Также показательными являются и интерпретации гистологических и биомеханических результатов. Результаты наших исследований демонстрируют значительное клиническое улучшение состояния больных после операции на бедре (повреждение хряща) с использованием объемного коллагенового геля. Через 12 месяцев после операции 86,4% пациентов (ICRS функциональный показатель) не имеют никаких ограничений. В процессе наблюдения отмечается значительное улучшение общего состояния среди пациентов: через 12 месяцев 90,9%, через 24 месяца 92,3%.
Также стоит отметить, что трансплантат прост в изготовлении, а операция по имплантации считается несложной. Продолжительность операции недолгая, разрез при операции незначительный. Послеоперационные трансплантационные осложнения, которые наблюдаются только при классической трансплантация, до сих пор не наблюдались, зато сразу дают о себе знать преимущества. Метод демонстрирует хорошие клинические результаты, что является основанием для его частого использования.
Резюме
Обобщив всю информацию, можно утверждать, что жидкие хондрофиллеры - оптимальный и надежный продукт для трансплантации. Любые дефекты хрящевой ткани можно заполнить при помощи представленных филлеров. Их надежность проявляется в отсутствии необходимости ревизии и дополнительного введения филлера, так как невозможно частичное вытекание или дислокация. При проведении МРТ (магнитно-резонансной томографии) у пациентов, зафиксированных в нашей базе, визуализируется четкое заполнение дефекта гелем, что подтверждает превосходный результат лечения суставного повреждения.
Артроз – самая частая причина хронической боли в колене. С возрастом хрящевая поверхность изнашивается. Из-за отсутствия в хряще нервных окончаний человек ощущает болезненность, только когда дегенеративные изменения затрагивают костный слой. На поздних стадиях пациенту часто предлагают операцию по замене сустава.
Но есть и другие варианты, например курсы инъекций протезов синовиальной жидкости. Еще один инновационный и пока еще экспериментальный, очень дорогой метод – трансплантация хондроцитов.

На поздних стадиях артроза трансплантация хрящевых клеток не поможет
Что такое трансплантация хондроцитов
Трансплантация хрящевых клеток в сустав – это инновационное хирургическое лечение остеоартроза, которое проводят пока только несколько клиник в Германии. Операция направлена на то, чтобы уменьшить боль в суставе, восстановить физическую выносливость, улучшить подвижность. Искусственным путем хирург регенерирует поврежденную хрящевую ткань, вследствие чего пациенту удается избежать эндопротезирования.
Операция по трансплантации хондроцитов будет успешной при соблюдении таких условий:
- стабильность колена;
- целостность боковых и крестообразных связок;
- отсутствие деформации в оси сустава (вальгусная или варусная деформация ног является противопоказанием);
- отсутствие суставной мыши – фрагментов хрящевой ткани в суставе;
- полное или частичное сохранение менисков;
- повреждение хряща на одной из двух поверхностей сустава.
Трансплантацию хондроцитов проводят пациентам в возрасте от 15 до 55 лет при условии, что величина дефекта в хряще не превышает 10 см2. Коленный сустав должен быть стабильным, структура связок – целостной. Чтобы операция дала результаты, пациенту рекомендуют исключить чрезмерные нагрузки на суставы и избавиться от лишнего веса заранее.

Оптимальный возраст пациента для трансплантации хрящевых клеток – 15-55 лет
Как проходит трансплантация хондроцитов
У пациента берут небольшой, величиной с рисовое зерно, образец аутогенной хрящевой ткани. Полученные из него хондроциты изолируют и выращивают в специальной лаборатории в стерильных условиях. Манипуляция забора проводится амбулаторно и длится около получаса. На следующий день человек сдает кровь, из которой извлекают сыворотку.
В лаборатории хондроциты отделяют от образца ткани и размножают в условиях собственной плазмы крови пациента. Контакт с чужеродными белками или другими составляющими крови полностью исключен. Через 6-8 недель образуются шарообразные клеточные субстанции, в составе которых – сотни тысяч хондроцитов, способных к размножению. Их доставляют в клинику в специальных холодильных контейнерах, чтобы сохранить свойства.
Пересадку выполняют по малоинвазивным методикам. Чтобы ввести хондроциты, хирургу достаточно минимальных разрезов. Сначала сустав очищают от поврежденной хрящевой ткани, а затем выращенные хондросферы помещают на поврежденный участок. Они сразу прилегают к кости и через несколько недель образуют соединительную ткань хрящевого типа, исправляя дефект.

Методику трансплантации хондроцитов практикуют уже более 25 лет
ТОП-4 вопроса о трансплантации хондроцитов
Каковы результаты?
Пересадка хрящевых тканей – это дорогостоящее, но достаточно эффективное лечение гонартроза. После операции улучшается состояние хрящевых тканей, снижается болевой синдром, восстанавливается подвижность.
Чаще всего хондроциты пересаживают под общим наркозом. Реже практикуют спинальную анестезию. Выбор зависит от пациента и клинической картины.
- Придется ли терпеть боль в колене после операции?
Сразу после пересадки колено охлаждают и держат какое-то время в приподнятом состоянии. Швы снимают примерно через 12 дней. Очень важно все это время беречь сустав от нагрузок. Передвигаться стоит на костылях с опорой на локоть. Чтобы за этот период нижняя конечность не утратила мышечной массы, пациенту рекомендуют лечебную физкультуру и другие виды физиотерапии.

После пересадки хондроцитов ходить с костылями придется не меньше 6 недель
Трансплантация хондроцитов подходит только тем, у кого сустав разрушен не критично. Если изменения слишком глобальные, она не избавит от боли и не вернет работоспособности. Альтернатива – инъекции протеза синовиальной жидкости. Препарат вводят внутрь сустава в условиях медкабинета. Он раздвигает трущиеся поверхности, перемешивается с суставной жидкостью и берет на себя амортизационные функции.
Такое лечение дает быстрый результат, подходит и пациентам с 2-3 стадией артроза, не требует восстановления и хождения с костылями. А главное – пройти курс можно в любом городе, не отправляясь за границу и не выкладывая немалые суммы.
Артроз (износ) суставного хряща — это самое известное суставное заболевание. Одной из наиболее распространенных форм болезни является артроз коленного сустава - патология, являющаяся причиной хронической боли, а также ограниченности в движениях больного. На протяжении нескольких лет скользящая поверхность суставного хряща постепенно снашивается, в связи с чем медленно теряет свои исходные свойства. Так как у хрящевой ткани отсутствуют нервные окончания (ноцицепторы), травмы колена становятся ощутимы лишь тогда, когда дефект достигает костного слоя, находящегося под суставным хрящом.
Аутологичная трансплантация хондроцитов или, другими словами, трансплантация хрящевых клеток, — это инновационное хирургическое лечение артроза коленного сустава, целью которого является исправление деформаций хряща при помощи собственных хрящевых клеток. Успешное лечение артроза коленного сустава по данной методике проводят лишь несколько специалистов по лечению заболеваний колена в Германии. Д-р Баум является первым хирургом в мире, который выполнил артроскопическую трансплантацию суставного хряща. Кроме того, он является одним из разработчиков данной методики лечения артроза коленного сустава, который регулярно проводит обучение новых специалистов.
Лечение артроза коленного сустава: Краткий обзор целей аутологичной трансплантации хондроцитов:
- Уменьшение боли при артрозе коленного сустава
- Восстановление физической выносливости и развитие спортивных способностей
- Улучшение подвижности
- Регенерация хрящевой ткани
- Предотвращение замены суставов
- Сохранение сустава и профилактика артроза коленного сустава
Кому подходит подобное лечение артроза коленного сустава?
Метод трансплантации хрящевой ткани как лечение артроза коленного сустава подходит не каждому пациенту. На прогрессирующей стадии заболевания данная методика уже не принесет желаемого результата. В таких случаях хирурги Геленк Клинки в г. Фрайбург порекомендуют больному суставосохраняющее частичное протезирование либо полное эндопротезирование коленного сустава. Успешное проведение аутологичной трансплантации хондроцитов зависит от следующих факторов:
- стабильность колена, неповрежденность крестообразных и боковых связок
- прямая ось сустава без деформаций (напр. вальгусная или варусная деформация ног)
- отсутствие суставной мыши (фрагменты ткани, образующиеся вследствие дефектов суставного хряща)
- хотя бы частичное сохранение менисков
- повреждения хряща только на одной из двух суставных поверхностях
Обычными показаниями к трансплантации хрящевой ткани (хондроцитов) называют локальные травмы суставного хряща в колене.
Каковы идеальные условия для выполнения аутологичной трансплантации хондроцитов?
- Возраст пациента от 15-ти до 55-ти лет
- Размер дефекта до 10 см.2 при наличии здоровых участков хряща
- Стабильность коленного сустава, не нарушенная структура связок
- Отсутствие чрезмерных нагрузок на колено, в частности из-за лишнего веса
Как правило эта методика подходит людям в возрасте до 55-ти лет. Однако решающим фактором в данном случае является не биологический, а календарный возраст пациента. Иногда, при наличии всех необходимых показаний, трансплантация хрящевой ткани проводится и больным, которым уже за 65. Для того чтобы с точностью сказать, подходит ли данное хирургическое вмешательство именно Вам, специалистам нашей ортопедической клиники необходимы рентгеновские симки, а также МРТ колена. Зачастую, только во время операции хирург принимает решение касательно окончательной методики лечения: иногда пациенту достаточно и частичного эндопротезирования, а иногда, для восстановления подвижности необходимо выполнить пересадку хрящевой ткани.
Если врачи смогут установить, что аутологичная трансплантация хондроцитов не имеет смысла, Вам будут предложены такие способы лечения артроза, как например, частичное протезирование при помощи надколеннико-бедренного протеза HEMICAP, протезирование по Repicci либо полное эндопротезирование.
Методики восстановления суставного хряща
Шаг 1: Взятие образца хрящевой ткани (биоптат) с коленного сустава
В начале артроскопического оперативного вмешательства (артроскопия) хирурги Геленк Клиники извлекают небольшой образец аутогенной хрящевой ткани. При этом биоптат, размером в рисовое зернышко, берут из здорового, наименее нагружаемого участка колена. Затем полученные хондроциты (хрящевые клетки) изолируются в специальной узкоспециализированной лаборатории после чего их культивируют (выращивают) в стерильных условиях.
Операция проходит амбулаторно и длится примерно 30 минут. На следующий день пациента направляют на анализ крови, во время которого из вены извлекают от 120-ти до 150-ти мл. крови, из которой в лаборатории получают сыворотку (жидкий элемент крови без форменных частей).
Шаг 2: Культивирование клеток в лаборатории
Взятый биоптат размером в рисовое зернышко доставляется в лабораторию вместе с анализом крови. Затем хондроциты отделяют от образца ткани и размножают в стерильных условиях в собственной плазме крови пациента. Данный метод полностью исключает контакт с чужеродными белками либо составляющими частями крови.
Врач какого профиля проводит аутологичную трансплантацию хрящевых клеток?
Очень важным элементом для сотрудников ортопедического медицинского центра Геленк Клиник в г. Фрайбург является тесная связь между врачами и пациентами. Это значит, что Ваш лечащий врач будет заботиться о Вас начиная с дня составления анамнеза до самой операции. Ваш специалист по коленным суставам будет оказывать Вам надлежащую помощи и в течение послеоперационного периода. Таким образом у Вас будет контактное лицо, которое разбирается в Вашей ситуации и сможет в любое время ответить на все Ваши вопросы. Экспертами, проводящими лечение артроза коленного сустава при помощи аутологичной трансплантации хондроцитов, являются Д-р Петер Баум, проф. д-р Свен Остермаер и приват-доцент доктор медицинских наук д-р Бастиан Марквас..
Насколько успешно будет лечение артроза путем пересадки хондроцитов?
Методика аутологичной трансплантации хондроцитов известна на протяжении 25-ти лет. Различные научные исследования показали, что пересадка клеточных тканей приводит к значительным улучшениям хрящевой поверхности коленного сустава. После операции трансплантат сложно отличить от настоящего суставного хряща. Подобное лечение артроза способствует снижению болевого синдрома, а также восстанавливает прежнюю подвижность больного.
Д-р Баум является одним из самых лучших специалистов мирового стандарта в этой области и выполняет аутологичную трансплантацию хондроцитов в Геленк Клинике на высочайшем уровне. Д-р Баум был первым хирургом-ортопедом, который выполнил данное вмешательство артроскопически, то есть щадяще и почти без шрамов. Проф. д-р Остермаер и приват-доцент доктор медицинских наук д-р Марквас являются лидерами в изучении методик лечения артроза коленного сустава, которые опубликовали множество научных публикаций по данной теме.
Что происходит перед операцией?
Сначала проводится комплексное клиническое и визуализационное обследование, к которому кроме составления анамнеза и физического осмотра пациента, относится и рентген под нагрузкой, а также магнитно-резонансная томография (МРТ).
Таким образом врачу будет легче определить степень повреждения суставного хряща. Если все пройденные обследования покажут, что вышеуказанное лечение артроза подходит пациенту, лечащий врач проводит с ним разъяснительную беседу, во время которой объясняет ход операции, а также рассказывает о возможных осложнениях после вмешательства. После этого, с пациентом беседует анестезиолог, который еще раз проверяет состояние здоровья больного. Как правило операция проводится на следующий день после согласия хирурга и анестезиолога.
Как проходит артроскопическая трансплантация хондроцитов?
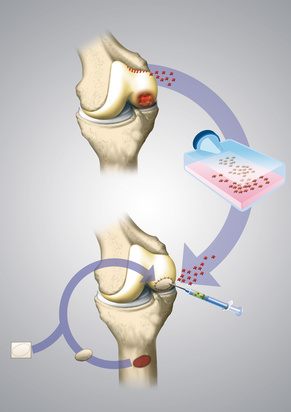
Трансплантация суставного хряща коленного сустава: после культивации клеток в специальной лаборатории, проводится имплантация хондроцитов по малоинвазивной методике. © dissoid, Fotolia
Пересадка полученных в лаборатории хрящевых клеток проводится всегда артроскопически, то есть в малоинвазивном порядке. Для ввода необходимых инструментов в колено хирургу достаточно минимальных разрезов.
В начале операции проводится чистка коленного сустава от поврежденной хрящевой ткани, после чего выращенные хрящевые шарики (хондросферы) помещаются на поврежденный участок колена. Так хондросферы сразу прилегают к кости и спустя несколько недель исправляют дефект путем образования соединительной ткани хрящевого типа.
После контакта хрящевых клеток с подготовленным местом хрящевого дефекта соединительные молекулы (адгезивные белки) уже через 10 минут начинают стабильно прилегать к кости. Таким образом, хондроциты врастают в поврежденный отдел колена, пока он не заполнится полностью. При отсутствии необходимости в коррекции крестообразных связок либо мениска, хирургическое лечение артроза коленного сустава путем аутологичной трансплантации хондроцитов в Геленк Клинике длится примерно 30-60 минут.
Для того, чтобы оперативное лечение артроза колена по выше указанной методике прошло удачно, необходимо установить, и по необходимости вылечить проблемы (напр. деформационные патологии, разрыв крестообразной связки, травмы мениска), которые послужили причиной травматизации суставного хряща. Именно поэтому пациенту необходимо принять во внимание длительное послеоперационное лечение, а также необходимость бережного отношения к своему здоровью.
Какой вид анестезии получает пациент во время хирургического лечения артроза коленного сустава?
Как правило операция проходит под общим наркозом. Иногда для того, чтобы избежать последствий полного наркоза, хирурги проводят вмешательство и под спинальной анестезией, являющейся разновидностью местной анестезии. Во время данной манипуляции анестетик вводится в позвоночный канал поясничного отдела позвоночника, что позволяет пациенту находится при полном сознании. Специалисты ортопедической клиники Геленк Клиник в г. Фрайбург обладают долголетним опытом проведения обеих методик. Какой вид анестезии является наиболее подходящим в Вашем отдельном случае обсуждается перед самой операцией, учитывая при этом все анализы и состояние Вашего здоровья.
Будет ли болеть колено после операции?
Хирургическое лечение артроза коленного сустава, как и другие вмешательства, связаны с определенной болью. Высокой профессионализм наших хирургов позволяет сократить риск возникновения болевого синдрома к минимуму. Как правило перед операцией проводится медикаментозная блокада поврежденного коленного сустава, которая обезболивает колено примерно на 30 часов. После этого самая сильная болевая волна уже позади и лечение можно проводить уже при помощи обычных медикаментов. Наша цель — это максимальное освобождение пациента от боли.
Условия размещения в Геленк Клинике

Частная палата в Геленк Клинике в г. Гунделфинген в Германии
Как правило, во время стационарного пребывания в клинике Вы находитесь в отдельной палате с душем и туалетом. Кроме того, мы предоставляем Вам полотенца, халат и тапочки. Так же, Вы можете пользоваться мини-баром и сейфом. В каждой палате есть окно.
С собой необходимо иметь лишь собственные медикаменты, удобную одежду и ночное белье. После хирургического лечения артроза коленного сустава мы гарантируем круглосуточный уход в лице квалифицированного обслуживающего персонала и опытных физиотерапевтов. В основном, срок пребывания в стационаре после операции составляет три дня. Члены Вашей семьи могут остановиться в отеле, который находиться в нескольких шагах от клиники. Мы с удовольствием позаботимся о резервации номера в гостинице.
На что нужно обратить внимание после операции?
Сразу после операции колено необходимо охладить и держать в приподнятом положении. Спустя примерно 12 дней снимаются швы. После этого Вы сможете снова принять душ.
Для того, чтобы избежать осложнений после хирургического лечения артроза коленного сустава, мы рекомендуем не оказывать особых нагрузок на колено. На это время Вам будет выдан больничный и костыли с опорой на локоть. Профилактика тромбоза на время невозможности полных нагрузок является обязательной. На этом этапе очень важным элементом является физиотерапевтическое лечение с целью противодействия потере мышечной массы и сохранения функций коленного сустава.
Обратный полет можно планировать не менее чем через 10 дней. Однако мы рекомендуем лететь домой только через две недели.

Физиотерапия проводится с целью сохранения функций коленного сустава и укрепления мышц колена.. © Elnur, Fotolia
Рекомендации после артроскопии (1-ая операция)
- Стационарное лечение: 2 дня
- Рекомендуемое время пребывания в клинике: 7 дней
- Когда возможен обратный полет: спустя 10 дней после операции
- Когда можно принять душ: через 5 дней
- Рекомендуемая продолжительность больничного: 2 недели
- Когда снимаются швы: через 5 дней
- Когда разрешается снова сесть за руль: через 2 недели
Рекомендации к аутологичной трансплантации хондроцитов либо устранение причины повреждения суставного хряща (2-ая операция)
- Стационарное лечение: 3 дня
- Когда разрешается не использовать локтевые костыли: через 6 недель
- Постепенное восстановление нормальных физических нагрузок на прооперированную ногу: через 6-8 недель
- Рекомендуемое время пребывания в клинике: 10 дней
- Когда возможен обратный полет: спустя 10 дней после операции
- Рекомендуемый обратный полет: через 2 недели
- Когда можно принять душ: через 7 дней
- Рекомендуемая продолжительность больничного: 6 недель
- Когда снимаются швы: через 7-12 дней
- Когда разрешается снова сесть за руль: через 6-12 недель
Сколько стоит лечение артроза коленного сустава при помощи аутологичной трансплантации хондроцитов?
Кроме стоимости самого хирургического лечения лечение артроза коленного сустава при помощи аутологичной трансплантации хондроцитов подразумевает и диагностику, приемы врачей, а также дополнительные ресурсы как например костыли с опорой на локоть. Таким образом, сумма может составлять от 1.500 до 2000 евро. Если после пребывания в Геленк Клинике Вам потребуется физиотерапевтическое лечение, мы с удовольствием поможем Вам и составим предварительную смету расходов.
Подходит ли мне этот метод?
Для того, чтобы составить точную картину состояния коленного сустава, врачу потребуются МРТ и рентгенограмма пациента.На основании предоставленных изображений специалисты Геленк Клиники установят подходит ли Вам данное лечение. Если метод аутологичной трансплантации хондроцитов окажется не самым оптимальным решением для Вас, опытные сотрудники нашего медицинского центра с удовольствием предоставят Вам информацию касательно альтернативных методик лечения.
Как записаться на прием и на саму операцию иностранному пациенту?
Для того, чтобы оценить состояние коленного сустава необходимо предоставить результаты визуализационной диагностики - рентгеновские снимки, а также МРТ. После просмотра пересланных изображений на нашем сайте, в течение 1-2 рабочих дней Вы получите всю необходимую информацию, предложение по лечению, а также смету расходов на хирургическое лечение артроза коленного сустава.
Иностранные пациенты могут записаться на прием к специалисту Геленк Клиники в короткие сроки, соответствующие их планам. Мы с радостью поможем Вам с оформлением визы после того, как на наш счет поступит предоплата, указанная в смете затрат. В случае отказа в предоставлении визы, мы возвращаем Вам предоплату в полном объёме.
Для иностранных пациентов мы стараемся свести промежуток времени между предварительным обследованием и хирургическим лечением артроза коленного сустава к минимуму. Таким образом Вам не нужно будет приезжать в клинику несколько раз. Во время амбулаторного и стационарного пребывания в Геленк Клинике в г. Фрайбург наш персонал отдела управления делами пациента, владеющий несколькими языками (английский, русский, испанский, португальский) ответит на все, интересующие Вас вопросы. Кроме того, мы предоставляет переводчика (например, на арабский), оплата которого производится пациентом самостоятельно. Так же, мы с удовольствием поможем Вам в организации трансфера, поиске гостиницы и подскажем как провести свободное время в Германии Вам и Вашим родственника.

Стратегии на основе клеток, направленные на восстановление суставного хряща, преимущественно фокусируются на использовании двух типов клеток, либо зрелых хондроцитов или мезенхимальных стромальных клеток, оба из которых имеют свои ограничения. Будучи клеточной единицей суставного хряща, хондроциты являются логичным выбором для использования в репаративных подходах на основе клеток, но все же есть ряд недостатков в их успешном использовании: во-первых, относительно ограниченная доступность донорских сайтов с относительно низким выходом клеток, выделенных из аутологического устройства (1–5 % от общего объема ткани); во-вторых, отсутствие подходящих протоколов расширения культуры in vitro, которые снижают риск дедифференцировки хондроцитов, в результате чего появляется фенотип фибробластоподобных клеток (Benya P.D., Shaffer J.D., 1982). Во время монослойного расширения синтез коллагена II типа и аггрекана, обычно продуцируемого в гиалинном хряще, снижается, в то время как производство коллагена I типа увеличивается (Darling E.M., Athanasiou K.A., 2005). Дедифференцированные хондроциты в основном становятся волокнистым, а не гиалиновым хрящем (Tew S.R., Clegg P.D., 2011) с более низкими биомеханическими свойствами (Peterson L., et al., 2000; Roberts S., et al., 2003), что ограничивает применение суставных хондроцитов при восстановлении хряща.
Суставные хондроциты являются самыми ранними используемыми источниками клеток для трансплантация аутологичных хондроцитов. Пионерами в этом направлении считаются Brittberg M., et al. (1994), опубликовавшие первые результаты лечения хрящевых дефектов в коленном суставе. Трансплантация аутологичных хондроцитов имеет то преимущество, что не нарушается зона костно-хрящевого соединения и используются клетки на заключительных стадиях дифференцировки, то есть с более детерминированной направленностью своего развития. Среди различных типов клеточных культур, представляющих интерес для трансплантации аутологичных хондроцитов, рассматриваются монослойные, трехмерные культуральные системы и модели культуральных систем, предназначенные для тканевой инженерии. В настоящее время монослойная культура остается основным способом получения хондроцитов в виде суспензии для трансплантации аутологичных хондроцитов. Главным недостатком монослойной культуры признается утрата фенотипа хондроцитами во время пассажей. Гистологическое строение таких клеток начинает напоминать фибробласты, они теряют способность секретировать протеогликаны. Трансплантация хондроцитов считается золотым стандартом в восстановлении суставного хряща для пациентов с большими размерами пораженной суставной поверхности а долгосрочные последствия продемонстрировали улучшение клинических симптомов (Peterson L., et al., 2000; Peterson L., et al., 2003). Однако, несмотря на эти положительные результаты, по-прежнему существуют недостатки, в том числе инвазивность хирургии и потенциал для дедифференцировки хондроцитов in vitro с последующей сниженной способностью формировать внеклеточный матрикс при трансплантации хондроцитов (Pelttari K., et al., 2008). Реализации технологии в настоящее время включают второе и третье поколение ACI (Marlovits S., et al., 2006). Во втором поколении трансплантации аутологичных хондроцитов биоабсорбируемый 3D-слой используется в качестве носителя клеток для имплантации в место дефекта (Behrens P., et al., 2006).
В последнее время расширяется применение технологии имплантации аутологичных хондроцитов основанной на использовании матрицы. В отличие от обычной трансплантации аутологичных хондроцитов, эта технология требует инкубации расширенных аутологичных хондроцитов на смешанной коллагеновой мембране до имплантации (Nixon A.J., et al., 2015; Basad E., et al., 2015). Последнее утверждение Управления по контролю за продуктами и лекарствами США о клиническом использовании аутологичных культивируемых хондроцитов на мембране из свиного коллагена для восстановления симптоматических дефектов коленного сустава является позитивным моментом в ракурсе дальнейшего расширения использования потенциала клеточной терапии различных патологических изменений хряща (Lee W.Y.-W., Wang B., 2017). В 2017 году были сообщены результаты первого этапа первого клинического испытания с использованием аллогенных МСК у пациентов с фокальным дефектом хряща (de Windt T.S., et al., 2017). В исследовании, анализировали результаты аутологичной трансплантации хондронов, содержащих хрящевые клетки единого происхождения в комплексе с прилежащим к ним межклеточным веществом и аллогенными МСК. Полное заполнение дефекта и интеграция с окружающими тканями наблюдались по данным магниторезонансной томографии через 12 месяцев после операции. Кроме того, магниторезонансная томография, повторная артроскопия и гистологическая оценка показали образование гиалиновой ткани в месте дефекта.
Независимо от методологии регенерации хрящевой ткани, хондроциты вновь регенерированного хряща остаются восприимчивыми к воздействию воспалительных и механических факторов, которые, как известно, лежат в основе остеоартрических заболеваний. Поэтому меры хондрозащиты должны быть разработаны для хондроцитов регенерированного хряща, которые находятся в непосредственной близости к биоактивным факторам внеклеточных матриц и воспалительным агентам, ответственным за дегенеративный остеоартрит. Последующие изменения, связанные с артритом, и аберрантное функционирование этих хондроцитов, вероятно, вступают в компромисс с интеграцией, функцией и долговечностью регенерированного хряща (Djouad F., et al., 2009). Таким образом, хондрозащита регенерированного хряща от основного заболевания может обеспечить более долговременный терапевтический эффект.
Wang D., et al. (2011) исследовали использование избыточной экспрессии ПТГрП суставными хондроцитами для подавления артритоподобных изменений, вызванных механической травмой. Были испытаны две изоформы: ПТГрП (1-141) и ПТГрП (1-173). Бычьи хондроциты были трансфицированы конструкциями человеческого ПТГрП. Для стимулирования артритных изменений бычьих суставных хондроцитов in vitro использовалась модель циклического растягивающего воздействия, которая индуцировала фенотип изменений хондроцитов, включая повышенную экспрессию генов коллагеназ и аггреканаз, а также увеличение экспрессии гена, маркера гипертрофии хондроцитов коллагена X типа. Под воздействием циклического растягивающего воздействия возрастала эндогенная экспрессия гена бычьего ПТГрП, что соответствовало увеличению секреции ПТГрП, наблюдаемой в человеческом остеоартритном хряще (Terkeltaub R., et al., 1998; Okano K., et al., 1997) и свидетельствующей о самовосстановлении поврежденного хряща (Gomez-Barrena E., et al., 2004).
Поскольку период полураспада N-концевого фрагмента составляет обычно от 6 до 8 мин (Henry J.G., et al., 1997) в конечном итоге требуется постоянная доставка ПТГрП, чтобы ингибировать проявления артритоподобных изменений для достижения оптимальных терапевтических результатов. Такой механизм устойчивой доставки ПТГрП авторы обеспечили путем невирусного переноса гена человеческого ПТГрП c ДНК в сами суставные хондроциты. Как и ожидалось, хондроциты, экспрессирующие экзогенный человеческий ПТГрП, показали более высокие уровни секреции общего ПТГрП (бычьего и человеческого), чем контрольные. Сверхэкспрессия изоформ человеческого ПТГрП ингибирует индуцированную механической деформацией и базальную экспрессию гена коллагена X типа в суставных хондроцитах. Циклическое растягивающее воздействие увеличило производство NO и простагландина-E2, которые оба действуют как сильные катаболические сигналы в хряще, изменяя функцию хондроцитов и улучшая их апоптотический потенциал (Goldring M.B., Berenbaum F., 2004). Хотя известно, что ПТГрП стимулирует высвобождение NO из эндотелиальных клеток для локальной регуляции сосудистого тонуса (Kalinowski L., et al., 2001), не выяснен возможный механизм опосредованного ПТГрП высвобождения NO в хондроцитах. Кроме того исследования показали, что простагландин-E2 увеличивает продукцию ПТГрП в хондроцитах (Yoshida T., et al., 1998; Yoshida T., et al., 2001). Это исследование демонстрирует, что избыточная экспрессия ПТГрП ингибирует гипертрофические синдромы суставных хондроцитов, индуцированные механическим воздействием. Установлено, что хондроциты, сверхэкспрессирующие ПТГрП, резистентны к гипертрофическим изменениям, вызванным механическими деформациями. Терапевтический перенос гена ПТГрП можно рассматривать для применения хондрозащиты в недавно регенерированном хряще.
Как известно, регенерация хрящевой ткани является многоступенчатым динамическим процессом, и различные конкретные факторы могут определять эффективность процесса на определенном этапе. Процесс восстановления суставного хряща часто сопровождается гипертрофией хондроцитов и непреднамеренной эндохондральной оссификацией. ПТГрП продуцируется в суставных хондроцитах и регулирует скорость их дифференцировки. ПТГрП ингибирует терминальную дифференцировку суставных хондроцитов и МСК и участвует в защите суставного хряща (Macica C., et al., 2011). Это исследование подтвердило гипотезу о том, что ПТГрП может иметь регулирующую роль в поддержании суставных хондроцитов. Кроме того, экспрессия ПТГрП снижена в пораженной ткани хряща (Gelse, K., et al., 2012). Таким образом, экзогенный ПТГрП может дополнять потенциал торможения терминальной дифференцировки, тем самым улучшая восстановление хряща. В экспериментах на кроликах с моделированием глубоких дефектов хряща коленного сустава Kudo S., et al. (2011) активировали ПТГ/ПТГрП-рецепторы путем введения в суставную полость непрерывно либо прерывисто рекомбинантного человеческого ПТГ. Установлено, что непрерывное или прерывистое введениение ПТГ на ранней стадии восстановления успешно индуцировало хондрогенез в репаративной ткани дефектов хряща. Констатировано, что введение ПТГ в течение первых 2 недель индуцирует появление пролиферирующих хондропрогениторных клеток на участке восстановления. Образование хряща происходило через 4 недели как при непрерывном, так и при прерывистом введении ПТГ. Через 8 недель прерывистого введения ПТГ после моделирования травмы, регенерирующий хрящ заполнил дефекты и успешно восстановил исходное состояние сустава. Таким образом, прерывистая активация ПТГ/ПТГрП сигнализации на ранних стадиях процесса восстановления хряща облегчают индукцию регенеративного хондрогенеза при дефектах суставного хряща.
Zhang W., et al., (2013) исследовали эффективность стратегии тканевой инженерии путем комбинирования ПТГрП и коллагено-шелковых каркасов для восстановления остеохондрального дефекта. Анализ механизмов синергетического эффекта объединения введения ПТГрП с имплантацией коллагено-шелковых каркасов при восстановлении остеохондрального дефекта коленного сустава показал, что введениеПТГрП значительно уменьшало экспрессию маркеров, связанных с терминальной дифференцировкой, которое достигается частично за счет блокировки активации канонического Wnt/β-catenin сигнального пути. В исследовании восстановления хряща in vivo внутрисуставная инъекция ПТГрП кроликам проводилась в трех разных временных окнах (4–6, 7–9 и 10–12 недель) вместе с имплантацией двухслойного коллагено-шелкового каркаса. Дефекты, обработанные ПТГрП в окне времени 4–6 недель, показали лучшую регенерацию (восстановление хряща и субхондральной кости) с минимальной терминальной дифференцировкой (гипертрофия, оссификация и деградация матрицы), а также усиленный хондрогенез (клеточная форма, накопление коллагена II типа и гликозоаминогликана) по сравнению с эффектами в других временных окнах. Полученные результаты показали, что внутрисуставная инъекция ПТГрП через 4–6 недель после травмы вместе с имплантацией коллагено-шелковых каркасов является эффективной стратегией для ингибирования терминальной дифференцировки и усиления хондрогенеза, что улучшает восстановление и регенерацию хряща в модели остеохондрального дефекта (Zhang W., et al., 2016). Поэтому использование ПРТГрП в надлежащее время является критически значимым для получения эффективного результата восстановления хряща Полученные данные дают представление о понимании задействованных механизмов и прокладывают путь для клинического применения ПТГрП для восстановления остеохондральных дефектов (Zhang W., et al., 2014).
Вполне очевидно, что ПТГрП может использоваться для ограничения аномальной гипертрофии в процессе восстановления хряща. Декларируются две различные стратегии восстановления суставного хряща с использованием ПТГрП. В первом варианте рекомбинантный ПТГрП вводится в сустав непосредственно или с помощью биосовместимых инъекционных каркасов. Второй подход предусматривает использование генетических манипуляций включая доставку гена ПТГрП путем внутрисуставной инъекции генных конструкций или ПТГрП-трансфицированных клеток отдельно или в сочетании с инъекционными каркасами (Zhang W., et al., 2012). Генная терапия представляет собой новый подход, обеспечивающий постоянный синтез необходимых белков в целевых сайтах in vivo. Было проведено несколько исследований, посвященных регенерации хряща с использованием гена ПТГрП. Генная терапия с использованием ПТГрП может быть проведена двумя способами. Ген ПТГрП, доставленный аденовирусом, лентавирусом или другими векторами, может быть непосредственно введен в совместное пространство синовиальных клеток, суставных хондроцитов и МСК, так что они будут секретировать ПТГрП. Альтернативно ген ПТГрП можно трансфицировать в культивируемые клетки, такие как хондроциты, МСК и другие клетки, с последующей трансплантацией этих клеток в целевые локусы для устойчивого производства ПТГрП (Xian C.J., Foster B.K., 2006). Несколько подходов к генной терапии в настоящее время исследуются для устранения дефектов хряща и ингибирования прогрессирования остеоартрита. Однако имеется проблема безудержного производства ПТГрП при генной терапии, аналогичная чрезмерному введению рекомбинантного ПТГрП, поэтому уровень ПТГрП должен быть точно контролироваться и целесообразно управлять геном ПТГрП в течение этого периода. Разработаны различные стратегии регулирования, направленные на управление трансгенной экспрессией (Yazawa M., et al., 2009; Hundt W., et al., 2009), которые могут применяться для контроля экспрессии ПТГрП.
В патенте США № US 8,513,193 B2 (45) от 20.08.2013 представлены композиции и способы, связанные с защитой или восстановлением суставного хряща и/или скелетно-мышечной мягкой ткани, путем контактирования хряща, тканей или их клеточных компонентов с агонистом рецептора ПТГ/ПТГрП (PTH/PTHrP). Способ содействия защите или восстановлению хряща включает прерывистое введение агонистов рецептора ПТГ/ПТГрП или высвобождающего их агента для приготовления лекарственного средства. Указанные в патенте композиции и способы предназначены для защиты или ремонта суставного хряща и скелетно-мышечных мягких тканей, таких как неартикулярный хрящ, сухожилие, межпозвоночные диски, связка, мениск, и скелетные мышцы. Соединения могут вводиться в форме фармацевтической композиции в комбинации с фармацевтически приемлемым носителем.
Читайте также:

