Стволовые клетки печени реферат
Обновлено: 30.06.2024
1. О механизмах воздействия трансплантации фетальных тканей человека на патологический процесс в печени у детей с хроническим вирусным гепатитом и циррозом печени. Л.В. Чистова, Е.Л. Панченко, И.В. Дворяковский, М. Солх, В.В. Шеляпина, И.К. Филипов, В.М. Синякович, С.А. Клочков, В.В. Ботвиньева, А.П. Фисенко // Бюл. эксперим. биол. и мед., 1998, с. 117-125.
2. Gordon M.Y., Levicar N., Pai M. et al. Characterization and clinical application of human CD34+ stem/progenitor cell populations mobilized into the blood by granulocyte colony-stimulating factor // Stem Cells. 2006. Vol. 24. P. 822–1830.
Введение. Применение стволовых клеток в медицине, в том числе в гепатологии, считается одним из наиболее перспективных путей лечения огромного перечня заболеваний, например таких, как гепатит или цирроз
Цель. Показать, что СК можно использовать в качестве альтернативного лечения заболеваний печени.
Об этом факте свидетельствуют некоторые исследования, проводимые над пациентами с циррозом печени.
1. В пилотном исследовании M.Y. Gordon у 4 из 5 пациентов с циррозом положительные сдвиги в синтетической функции печени сохранялись на протяжении 12 мес после введения СК костного мозга. Кроме того, клеточная терапия ведет к интенсификации регенерации печеночной ткани.
2. Наблюдали 48 детей в возрасте 7-14 лет с хроническим вирусным гепатитом и циррозом печени. Группу наблюдения составили 25 детей, которым была проведена трансплантация плодных тканей (ТПТ). ТПТ как однократная, так и в виде серии инъекций улучшает общее состояние, повышает эмоциональный тонус, уменьшает симптомы печеночной недостаточности. Курсовой метод позволяет добиться более выраженного эффекта. В этом случае наряду с изменением показателей кровотока отмечается улучшение функциональных проб печени и показателей физического развития.
Вывод. Имплантация стволовых клеток различных типов способствует регенерации печени, тем самым компенсируя дефекты нормального функционирования гепатоцитов. В будущем данный метод может стать реальной альтернативой трансплантации, как единственного варианта лечения наиболее тяжелых заболеваний печени.

Фиброз печени, способный привести к тяжелым нарушениям структуры и функции этого органа, представляет собой актуальную медицинскую проблему. Механизмы, лежащие в основе его развития, включают избыточное отложение и недостаточное разрушение внеклеточного матрикса, повреждение гепатоцитов, воспаление, изменение структуры капилляров. Развитие патологического процесса обусловлено взаимным влиянием нескольких популяций клеток печени. В настоящее время фиброз печени не удается эффективно излечивать фармакологическими, хирургическими или физиотерапевтическими методами. Большие надежды в этом отношении возлагаются на клеточную терапию с использованием мезенхимных стромальных клеток. Они способны защищать и восстанавливать печеночную ткань благодаря продукции широкого спектра регуляторных молекул, которые способствуют выживанию гепатоцитов и гибели фиброгенных клеток, уменьшают воспаление, стимулируют рост кровеносных сосудов и удаление избытков внеклеточного матрикса. Комплексное влияние мезенхимных стромальных клеток на различные клеточные популяции, участвующие в развитии фиброза печени, дает основание рассматривать эти клетки и их секреторные продукты как перспективный ресурс для клинического использования.
Хронические заболевания печени, которые могут быть вызваны травмами, вирусными инфекциями, алкоголем, токсинами или нарушением обмена веществ, входят в число наиболее частых причин нетрудоспособности и смертности населения многих развитых стран. Печень имеет высокую способность к регенерации, но при длительном воздействии повреждающих факторов этой способности может оказаться недостаточно для полноценного восстановления, и тогда возникает фиброз, а затем и цирроз – необратимое замещение нормальной ткани печени рубцовой тканью (Заглавная иллюстрация). Дальнейшее развитие патологического процесса приводит к печеночной недостаточности, а часто и к раку печени. Первым шагом к развитию фиброза обычно становится повреждение гепатоцитов, составляющих основную массу клеток печени. Под действием вредных факторов из них выделяются свободные радикалы и другие вещества, вызывающие активацию клеток Ито. Эти клетки, в нормальной печени запасающие витамин А, являются ключевыми участниками фиброгенеза. Под влиянием различных повреждающих факторов, прежде всего тех, которые выделяются из гибнущих гепатоцитов, они теряют липидные включения с витамином А и начинают образовывать большое количество коллагена и прочих белков внеклеточного матрикса, характерных для рубцовой ткани. Ситуация усугубляется тем, что активированные клетки Ито усиленно размножаются, из-за чего количество откладываемого ими матрикса еще более возрастает. Фиброгенные клетки могут возникать также из фибробластов, расположенных вокруг кровеносных сосудов, и из клеток мезотелия, покрывающего печень снаружи. Одновременно с усилением продукции внеклеточного матрикса ослабляется его разрушение, в результате чего матрикс накапливается в избыточном количестве, нарушая структуру и функции печени. В развитии фиброза участвуют также клетки желчных протоков – холангиоциты, резидентные макрофаги (клетки Купфера), стволовые клетки печени и эндотелиальные клетки печеночных капилляров. Претерпевая патологические изменения под влиянием повреждающих факторов, все они тоже приобретают способность активировать клетки Ито и прочие фиброгенные клетки. В большинстве случаев развитию фиброза предшествует воспаление, которое в печени, в отличие от большинства других органов, чаще всего является стерильным (неинфекционным). При этом печень инфильтрируют различные популяции клеток иммунной системы; выделяемые ими факторы могут как усиливать фиброз, так и подавлять его развитие. Таким образом, развитие фиброза печени – сложный процесс, обусловленный взаимным влиянием нескольких клеточных популяций.
В настоящее время эффективность лечения фиброза печени фармакологическими, хирургическими или физиотерапевтическими методами невелика. Большие надежды в этом отношении возлагаются на клеточную терапию, в качестве одного из перспективных ресурсов для которой рассматриваются мезенхимные стромальные клетки (МСК). Практически повсеместно распространенные по организму, МСК способны давать начало зрелым клеткам различных тканей и органов, в том числе, по некоторым данным, и печени. Но главная роль МСК в регенерации тканей состоит не в замещении погибших клеток, а в регуляторном воздействии на сохранившиеся. Они выделяют множество биологически активных молекул, создающих в поврежденной ткани благоприятное для регенерации микроокружение. МСК защищают гепатоциты от повреждения и гибели и стимулируют их размножение, а на активированные клетки Ито действуют противоположным образом – размножение подавляют, а гибель усиливают. Кроме того, под влиянием факторов, выделяемых МСК, фиброгенные клетки откладывают меньше коллагена, а его разрушение усиливается. Воздействуя на макрофаги и лимфоциты, МСК подавляют воспаление, являющееся неотъемлемым компонентом патологического процесса при фиброзе. Предполагается также, что они усиливают рост сосудов, улучшая кровоснабжение печени, и способствуют образованию гепатоцитов и холангиоцитов из стволовых клеток. Всё это приводит к тому, что при трансплантации МСК экспериментальным животным с различным повреждениями печени (токсинами, перевязкой общего желчного протока, высокожировой диетой) выраженность фиброза оказывается меньшей, а функциональное состояние печени лучшим, чем у нелеченых животных с теми же повреждениями. Результаты подобных экспериментов позволяют надеяться на успешное клиническое применение МСК для лечения хронических заболеваний печени, однако их использование сопряжено с рядом трудностей. Так, клетки теряют исходные свойства в ходе культивирования, из-за чего их бывает трудно нарастить в достаточном количестве; они плохо выживают в неблагоприятном микроокружении воспаленной печени, могут сами становиться фиброгенными либо вызывать раковую опухоль.
Эффективной и безопасной альтернативой трансплантации МСК может стать введение их секреторных продуктов, в первую очередь внеклеточных везикул – мембранных пузырьков, содержащих различные биологически активные молекулы и способных передавать их клеткам-мишеням, оказывая на последние регуляторное действие. Будучи введены экспериментальным животным, эти везикулы влияют на поврежденную печень таким же образом, как и производящие их МСК – предотвращают гибель гепатоцитов, уменьшают выраженность воспаления и фибротических изменений. При этом внеклеточные везикулы по сравнению с клетками легче нарабатывать и хранить, они менее иммуногенны и не вызывают опухолей. Дополнительное преимущество везикул состоит в возможности направленного изменения их состава и свойств. В частности, в них можно вводить конкретные молекулы, оказывающие гепатопротективный эффект. Однако успешное применение производимых МСК везикул, как и самих клеток, для лечения фиброза печени требует дальнейшего исследования клеточных и молекулярных механизмов, лежащих в основе их терапевтического эффекта, а также подтверждения эффективности и безопасности их введения в клинических испытаниях.
Научный центр хирургии им. М.А. Топчибашева
Кафедра хирургических болезней II Азербайджанского медицинского университета, Баку, Азербайджанская Республика
Азербайджанский медицинский университет, Баку, Азербайджан; Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМНУ, Донецк, Украина
Азербайджанский медицинский университет, Баку, Азербайджан; Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМНУ, Донецк, Украина
Использование стволовых клеток в лечении цирроза печени
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2014;(4): 77-81
Агаев Б.А., Агаев Р.М., Попандопуло А.Г., Джафарли Р.Э. Использование стволовых клеток в лечении цирроза печени. Хирургия. Журнал им. Н.И. Пирогова. 2014;(4):77-81.
Agaev BA, Agaev RM, Popandopulo AG, Dzhafarli R. The use of stem cells in treatment of liver cirrhosis. Pirogov Russian Journal of Surgery = Khirurgiya. Zurnal im. N.I. Pirogova. 2014;(4):77-81. (In Russ.).
Научный центр хирургии им. М.А. Топчибашева





Научный центр хирургии им. М.А. Топчибашева
Кафедра хирургических болезней II Азербайджанского медицинского университета, Баку, Азербайджанская Республика
Азербайджанский медицинский университет, Баку, Азербайджан; Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМНУ, Донецк, Украина
Азербайджанский медицинский университет, Баку, Азербайджан; Институт неотложной и восстановительной хирургии им. В.К. Гусака НАМНУ, Донецк, Украина
Проблема эффективного лечения цирроза печени (ЦП) и его осложнений относится к одной из актуальных в современной медицине [2, 5, 32].
Среди причин смертности от болезней органов пищеварения (исключая опухолевую этиологию) ЦП занимает первое место [27]. По данным Всемирной организации здравоохранения, смертность от хронической печеночной недостаточности занимает пятое место в мире [28]. Если при компенсированной стадии болезни 10-летняя выживаемость составляет 47%, то на стадии декомпенсации 5-летняя выживаемость отмечается лишь в 16% наблюдений [2].
В настоящее время при ЦП используются консервативная терапия (этиотропная, патогенетическая, симптоматическая) и оперативное лечение (трансплантация печени, наложение портокавальных шунтов и др.) [20].
У больных с декомпенсированным ЦП применяют трансплантацию печени [7], однако высокая частота заболевания, дефицит донорских органов, тяжелое течение заболевания, а также материальные и технические моменты являются основными причинами, препятствующими осуществлению в большинстве наблюдений пересадки органа.
Указанные выше обстоятельства послужили причиной поиска наиболее эффективных и доступных способов лечения, позволяющих ускоренно стимулировать процессы регенерации в печеночной паренхиме при цирротическом ее поражении.
В связи с этим большой интерес представляют технологии заместительной клеточной терапии, которые считаются альтернативой органной трансплантации [8, 16].
Клеточная терапия основана на использовании живых клеток, направлена на восстановление утраченной или нарушенной функции различных органов и тканей. Клеточные технологии применяются при лечении самого широкого спектра заболеваний и являются темами множества научных и практических работ во многих странах мира [9, 25].
Особое место в клеточной терапии отводится стволовым клеткам (СК). Способность СК дифференцироваться в клетки различных типов позволяет стимулировать регенерацию в пораженных тканях [21].
Среди используемых в настоящее время способов лечения больных ЦП стволовыми клетками можно выделить следующие основные направления, которые интенсивно разрабатываются в эксперименте и находят практическое применение.
Первое направление основано на использовании эмбриональных стволовых клеток. Их источником является бластоциста - зародыш, который формируется к 5-му дню оплодотворения [14].
По данным литературы [12, 16, 18, 29], восстановить структуру поврежденной ткани печени могут несколько видов клеток.
1. Зрелые гепатоциты отвечают за восстановление печеночной ткани при наличии небольших ее повреждений. Указанные клетки многочисленны, унипотентны (способны дифференцироваться в клетки одного типа) и быстро активизируются после повреждения печени. Указанные виды гепатоцитов можно считать функциональными СК печени.
3. Источником экзогенных СК могут быть циркулирующие гемопоэтические клетки или клетки костного мозга. Они также немногочисленны, мультипотентны, но с очень продолжительной способностью к пролиферации. Например, некоторыми исследователями при искусственно созданном в эксперименте перипортальном некрозе (вызванном аллиловым спиртом) была обнаружена пролиферация клеток, у которых отсутствуют маркеры гепатоцитов или холангиоцитов, что можно объяснить трансдифференцировкой СК костного мозга.
В последние годы в литературе увеличилось число работ, посвященных изучению эффективности различных способов введения СК в печень при цирротическом ее поражении [3, 4, 20, 26].
В экспериментальных и клинических исследованиях при заболеваниях печени ряд авторов предпочитают применять трансплантацию СК костного мозга [28, 32].
Взаимодействие между компонентами внеклеточного матрикса в присутствии специфических факторов роста и других типов печеночных клеток должно обеспечить пересаженным клеткам оптимальные условия для выживания, дифференцировки и пролиферации [6, 13, 22].
В последние годы в некоторых центрах, проводящих исследования СК, широкое распространение получило использование радиоактивных и флюоресцентных методов диагностики приживления и эффективности пересаженных гепатоцитов [30].
По некоторым данным, гепатоциты при трансплантации в печень попадают в синусоиды, где выполняют свои органоспецифические функции, так как они находятся в благоприятных условиях и контактируют с портальной кровью. Обнаружено, что СК после введения в организм больного не только образуют новые ткани, но и вырабатывают специальные биологически активные вещества, стимулирующие деление гепатоцитов, тем самым обновляя клеточный состав органа. Попадая в зону гибели гепатоцитов, стволовые собственные клетки замещают пораженные и разрушенные клетки печени новыми, здоровыми гепатоцитами и нормализуют в тканях органа все восстановительные процессы [17].
Получен положительный эффект при введении гепатоцитов в паренхиму пораженной печени путем чрескожной пункции органа. Авторы указывают, что однократная внутрипеченочная трансплантация аллогенных СК при ЦП на 10-е сутки приводила к снижению уровня АЛТ в 2,5 раза, ACT в 2 раза, а трансплантация сингенных СК - к снижению аналогичных показателей в 1,6 и 1,8 раза соответственно [25].
Некоторые авторы на модели ЦП у мышей (поражение четыреххлористым углеродом) обнаружили замедление развития и регресс заболевания при внутривенной трансплантации мезенхимальных СК костного мозга. Исследователи в своих работах показывают, что трансплантированные клетки проникают в печень прямо из синусоидального кровотока, затем перемещаются через базальную мембрану в каналы Херинга и дифференцируются после этого в холангиоцитоподобные клетки [2].
Рядом исследователей в опытах на животных установлено, что при внутривенном введении СК в организм при ЦП изначально они собираются в печеночных синусоидах и впоследствии мигрируют из сосудов и внедряются в печеночную паренхиму. Прогрессивное ускорение регенерации печени происходит лишь при повторной трансплантации. Результаты биохимических исследований также показали улучшение функционального состояния печени, которое характеризовалось снижением уровня АЛТ в 1,6 раза, ACT в 2,2 раза. Летальность при этом уменьшалась в 4 раза [10, 11].
P. Kharaziha и соавт. [19] для лечения 8 больных ЦП использовали внутривенное введение мезенхимальных СК (полученных из костного мозга). При этом побочные эффекты отсутствовали. Мониторинг результатов проводили на протяжении 1 года. Исследования показали значительное уменьшение выраженности асцитов, а также улучшение качества жизни пациентов. Биохимические исследования свидетельствовали о нормализации в крови содержания креатинина, альбумина и билирубина, понижении уровня общего сывороточного билирубина и снижении индекса тяжести болезни.
Восстановление поврежденной печени клетками костного мозга in vivo происходит также путем клеточного слияния их с гепатоцитами. Через 5 мес после пересадки костного мозга от здоровых мышей наблюдали почти полную репопуляцию печени здоровыми клетками. Гепатоциты содержали генетический материал как донорских, так и своих клеток, имели наборы по 80 и 120 хромосом (диплоидное и тетраплоидное слияние). Исследователи сделали заключение, что гепатоциты, происходящие из костного мозга, образуются раньше путем клеточного слияния [3].
Некоторые авторы после частичной гепатэктомии трансплантировали мышам генетически меченные зеленым флюоресцентным белком СК костного мозга. В поврежденную печень встраивалось гораздо больше донорских клеток, чем в неповрежденную (контрольная группа). Донорские клетки обнаруживались главным образом среди эндотелиальных и купферовских клеток. Было показано увеличение концентрации эндотелиальных прогениторных клеток [28].
H. Tanimoto и соавт. [26] сообщили, что трансплантированные СК костного мозга уменьшают фиброз печени за счет увеличения экспрессии матриксных металлопротеиназ и разрушения коллагеновых волокон. Это способствовало улучшению выживаемости мышей с экспериментально выработанной моделью ЦП.
Ряд исследователей после трансплантации костного мозга от донора-мужчины в гепатоцитах реципиента-женщины обнаруживали Y-хромосомы. Подобные результаты наблюдали и при трансплантации печени от женщин мужчинам. В этом случае до 40% гепатоцитов и холангиоцитов являлись потомками гемопоэтических СК реципиента, вселившихся в трансплантат, причем были найдены как диплоидные, так и полиплоидные гепатоциты с Y-хромосомой [25].
Другие авторы утверждают, что применение гемопоэтических и мезенхимальных клеток-предшественников, произведенных из СК костного мозга, вызывает у животных с моделью ЦП регрессию фиброза и стимулирует регенерацию печени, а введение в воротную вену эндотелиальных клеток-предшественников уменьшает за счет выработки ими HGF, TGFα, EGF и VEGF экспрессию коллагена I типа, фибронектина, TGFβ1, индуцирует пролиферацию гепатоцитов, реконструкцию синусоидов и редукцию фиброза печени, улучшая таким образом ее функцию [15, 18].
Как известно, гемопоэтические клетки могут давать начало не только гепатоцитам, но и овальным клеткам. При введении иммунодефицитным мышам человеческих гемопоэтических СК костного мозга идентифицировали человеческий альбумин, у некоторых животных отмечалась экспрессия человеческого цитокератина, который является специфическим маркером холангиоцитов.
У контрольных животных (с гепатитом, без клеточной терапии) человеческий альбумин ни в печени, ни в сыворотке не определялся [28].
Для стимуляции регенерации печени при ее обширных резекциях у онкологических больных начато клиническое исследование эффективности трансплантации клеток костного мозга аутологичных CD 133 + . Обнаружено, что через 2-3 нед после введения клеток внутрипортально прирост ткани печени был в 2,5 раза выше, чем в контрольной группе, что свидетельствовало о безопасности процедуры аутологичной трансплантации [23].
Некоторые авторы показывают преимущества не только пересадки СК, но и использования гептрала (Abbott) в дозе 800 мг внутривенно в течение 10 дней. СК вводили в двух порциях - 500 млн в объеме 2 мл внутрипеченочно и 500 млн в объеме 50 мл внутривенно капельно. Динамические исследования свидетельствовали о положительной динамике клинико-лабораторных показателей у больных через 3 мес после лечения по предложенному способу: снижении выраженности астеновегетативного синдрома, асцита, анемического и тромбоцитопенического синдромов, улучшении белково-синтетической функции печени (увеличение уровня альбумина), снижении цитолиза (уменьшение показателей тимоловой пробы и АЛТ), нормализации анализа мочи (исчезновение ацетона и уробилина), что в целом подтверждает уменьшение выраженности печеночно-клеточной недостаточности [5].
Теоретически преимуществ использования СК костного мозга для стимуляции регенерации печени достаточно: это простота получения, способность к пролиферации, эффективность in vitro к трансфекции, возможность применения аутологичных клеток. Но, несмотря на многообещающие результаты, ключевыми вопросами при этом являются отсутствие тканевой специфичности и недоказанность достижения необходимого уровня печеночной репопуляции.
Многие исследователи для лечения ЦП предлагают использовать фетальные (полученные из абортивных плодов) СК [14, 19, 31].
Некоторыми авторами доказан также положительный эффект аллогенной трансплантации фетальных гепатоцитов без применения иммуносупрессивной терапии [14, 31]. Так, по данным Ж.А. Доскалиева [3], применение фетальных СК в комплексном лечении больных ЦП после второй трансплантации приводит к улучшению качества их жизни. Индекс качества жизни увеличивался на 29%, индекс тяжести болезни снижался на 42,5%. После третьей трансплантации отмечали уменьшение клинических проявлений заболевания: астенического, болевого, диспепсических растройств, кровоточивости тканей, желтушности кожных покровов, энцефалопатии, асцита, а также улучшение лабораторных показателей крови и данных ультразвукового и допплерографического исследований, проведенных в динамике лечения в течение года [3].
Некоторыми исследователями успешно была проведена трансплантация гепатоцитов в селезенку [3]. При этом отмечено размножение гепатоцитов в пульпе селезенки у крыс с тяжелой интоксикацией D-галактозамином, было достигнуто значительное увеличение выживаемости животных.
Для лечения экспериментального ЦП некоторые авторы применяли трансплантацию ксеногенных гепатоцитов. Подопытным животным (крысам) в пульпу селезенки вводили свиные гепатоциты. Донорские гепатоциты обнаруживали в печени через 50 дней после трансплантации. При биохимическом анализе крови регистрировали появление свиного альбумина. Результаты исследований свидетельствовали о восстановлении метаболической функции крови. Исследователи также показали, что уровень синтеза ДНК в гепатоцитах, пересаженных в селезенку, был выше, чем в клетках печени реципиента [29].
Последние исследования показывают, что условия портального кровоснабжения гепатоцитов, пересаженных в селезенку, могут способствовать начальному гепатоцеллюлярному дисморфогенезу, что облегчает приживление клеток и пролиферацию в ранние сроки. Трансплантированные клетки могут обнаруживаться в легких, что может потенциально вызывать серьезные осложнения [17].
Внутриселезеночная трансплантация в ряде наблюдений сопровождается осложнениями, такими как инфаркт селезенки, периспленит, тромбоз воротной вены, транзиторная портальная гипертензия и др. [28].
Как указано выше, для пересадки СК при ЦП используют различные зоны. Брюшная полость при этом считается некоторыми авторами наиболее подходящей вследствие возможности введения большого объема ткани, доступности применения микроносителей. Такой способ не лишен ряда недостатков. Интраперитонеальная трансплантация свободной взвеси клеток приводит в большинстве случаев к их гибели, поэтому была разработана технология прикрепления донорских клеток к носителям. Последние позволяют подтверждать не только выживание пересаженных клеток, но и их участие в метаболических процессах [29].
Трансплантация гепатоцитов под кожу является наиболее простым способом введения донорского материала, он лишен осложнений, которые возможны при внутриорганном введении клеток. Этот способ введения изолированных гепатоцитов целесообразно использовать при лечении хронических заболеваниях печени [10]. Разновидностью подкожного введения изолированных гепатоцитов является имплантация под влагалище прямой мышцы живота клеток, полученных от 9-17-недельных плодов человека с целью коррекции врожденных нарушений обмена [14].
Исследованиями некоторых авторов показана дифференцировка в функционирующие гепатоциты in vitro и in vivo человеческих стромальных СК жировой ткани [20].
Хотя трансплантация гепатоцитов под кожу технически проста, потенциальное пространство жировой прослойки для неоорганогенеза невелико. По данным других авторов, после трансплантации СК в дорсальную жировую прослойку гепатоциты быстро организуются и продолжают проявлять характерные фенотипические свойства [22].
Таким образом, приведенные данные экспериментальных и клинических исследований показывают перспективные возможности использования стволовых клеток в лечении больных циррозом печени. Однако, несмотря на имеющиеся в этой области достижения, многие вопросы, касающиеся обеспечения оптимальных условий для роста, дифференцировки стволовых клеток, а также способов их более эффективного приживления полностью не решены и находятся на стадии дальнейшего изучения.

Важным методом терапии терминальных стадий течения множества заболеваний печени все еще остается трансплантация органа или его части. Недостаточное количество донорского материала и специфика применения аллогенного компонента (вопросы иммунологической совместимости донора и реципиента) способствуют поиску новых способов заместительной клеточной терапии в гепатологии. Развитие биомедицины и биотехнологий позволяет моделировать различные микроструктуры и корректировать печеночную недостаточность у таких пациентов.
Помимо методов экспансии гепатоцитов, исследуются возможности использования ксеногенных клеток и, как наиболее перспективное направление, способы дифференцировки гепатоцитоподобных клеток из стволовых клеток (ГПК), например, из индуцированных плюрипотентных стволовых клеток (ИПСК). Перепрограммирование клеток для производства аутологичных гепатоцитов позволяет обходить дефицит человеческой донорской печени, а также избегать аллогенного отторжения. На сегодняшний день трансформированные ГПК не являются достаточно зрелыми, они фенотипически и функционально более сходны с фетальными гепатоцитами, чем с гепатоцитами взрослого человека [4].
Возможности применения стволовых клеток также включают создание благоприятной среды для роста ГПК или даже нативных первичных гепатоцитов. Совместное культивирование с мезенхимальными стволовыми клетками (МСК) обеспечивает собственные гепатоциты человека прямой структурной и паракринной трофической поддержкой, что приводит к улучшению их жизнеспособности и функции [4].
Агрегация гепатоцитов в органоидоподобные структуры была протестирована на клеточных линиях первичных гепатоцитов и ГПК, полученных из стволовых клеток, как в монокультурах, так и совместно с МСК. Жизнеспособность, клеточная морфология и фенотипическая стабильность гепатоцитов были выше в совместных культурах [4,5].
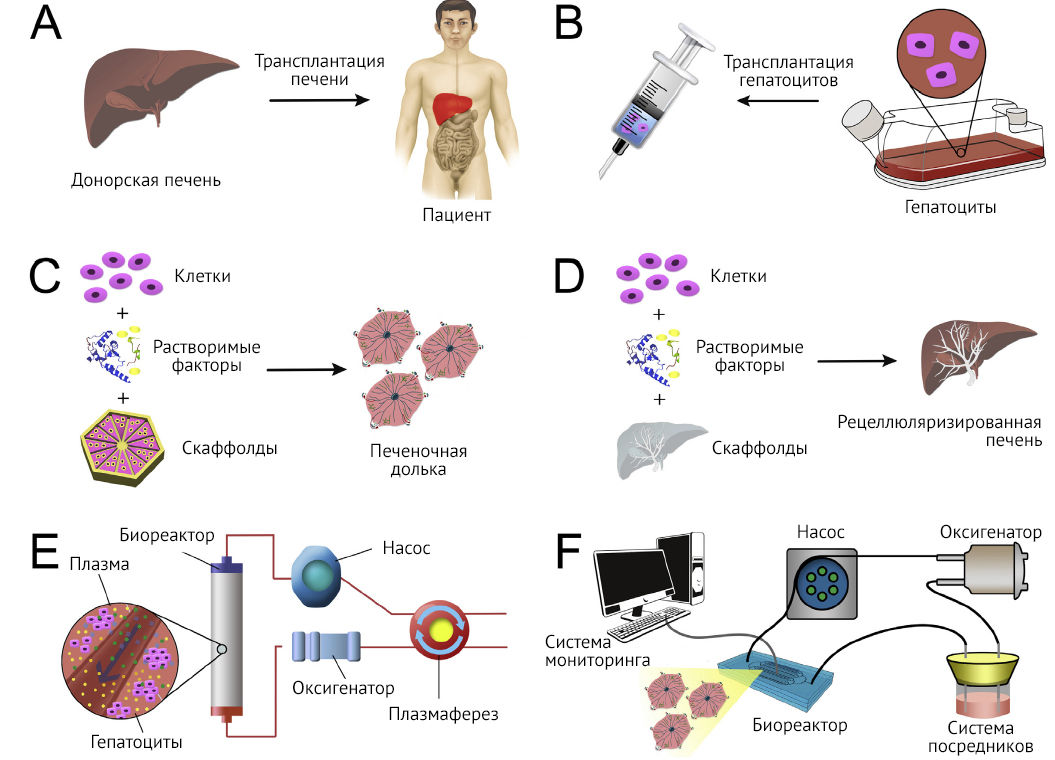
Успехи биоинженерии создают фундамент для развития регенеративной медицины, что особенно актуально при патологии печени (рис. 1) [3]. Прежде чем эти терапевтические стратегии будут включены в клиническую практику, требуется решение ряда проблем. Прежде всего должен быть определен оптимальный тип клеток для каждого направления терапии. Клеточная линия должна быть получена или произведена в количестве, достаточном для полноценного функционального обеспечения. Также эти клетки должны эффективно культивироваться in vitro, и при частичной трансплантации или генерации полноценной биоинженерной печени успешно приживаться in vivo. И, несомненно, клеточные линии должны иметь достаточный профиль безопасности, исключая ксенозоонозные негативные реакции, и не иметь онкогенного потенциала.
.
Читайте также:

