Строение атома реферат по химии
Обновлено: 05.07.2024
Открытие сложного строения атома - важнейший этап становления современной физики. Первые сведения о строении атома были получены при изучении процессов прохождения электрического тока через жидкости. В тридцатых годах XIX в. опыты выдающегося физика М. Фарадея навели на мысль о том, что электричество существует в виде отдельных единичных зарядов. Открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью, стало прямым доказательством сложности строения атома. В 1902 году английские учёные Эрнест Резерфорд и Фредерик Содди доказали, что при радиоактивном распаде атом урана превращается в два атома - атом тория и атом гелия. Это означало, что атомы не являются неизменными, неразрушимыми частицами.
Цель реферата: отразить процесс эволюции представлений о строении атомов на примере моделей Эрнеста Резерфорда и Нильса Бора.
Задачи реферата: изучить, проанализировать, обобщить представления о строении атомов, высказанные Э. Резерфордом и Н. Бором, сделать выводы о наиболее верном, с точки зрения современной физики, предположении.
Практическая значимость реферата заключается в том, чтобы познакомить студентов на лекциях по КСЕ с современными представлениями о строении атома и с вкладом Резерфорда и Бора в изучение этого вопроса.
В процессе работы были использованы различные виды источников: учебники С. Х. Карпенкова и Т.И. Трофимовой, предназначенные для высшей школы. В них доступным языком рассказывается об истории возникновения и развития знаний о строения атома; Интернет - ресурсы. использованные для изучения данной темы с точки зрения современной науки. Данный подход обусловлен стремлением изучить проблему во всей многогранности.
Глава 1. Модели строения атома Томсона и Резерфорда
Представление об атомах как неделимых мельчайших частицах веществ возникло еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века учение об атомах, будучи материалистическим, не получило признания. К началу XVIII в. атомистическая теория приобретает все большую популярность. К этому времени работами французского химика А. Лавуазье (1743-1794), великого русского ученого М.В. Ломоносова и английского химика и физика Д. Дальтона (1766-1844) была доказана реальность существования атомов. Однако в это время вопрос о внутреннем строении атомов даже не возникал, так как атомы считались неделимыми.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Д.И. Менделеев, разработавший в 1869 г. периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Во второй половине XIX в. было экспериментально доказано, что электрон является одной из основных частей любого вещества. Эти выводы, а также многочисленные экспериментальные данные привели к тому, что в начале XX в. серьезно встал вопрос о строении атома. Существование закономерной связи между всеми химическими элементами, ярко выраженное в периодической системе Менделеева, наталкивает на мысль о том, что в основе строения всех атомов лежит общее свойство: все они находятся в близком родстве друг с другом.
Положительно заряженных частиц внутри атома модель атома Томсона (Приложение А) не предполагала. Но как же тогда объяснить испускание положительно заряженных альфа-частиц радиоактивными веществами? Модель атома Томсона не давала ответа и на некоторые другие вопросы.
В 1911 г. английским физиком Эрнестом Резерфордом при исследовании движения альфа-частиц в газах и других веществах была обнаружена положительно заряженная часть атома. Дальнейшие более тщательные исследования показали, что при прохождении пучка параллельных лучей сквозь слои газа или тонкую металлическую пластинку выходят уже не параллельные лучи, а несколько расходящиеся: происходит рассеяние альфа-частиц, т. е. отклонение их от первоначального пути. Углы отклонения невелики, но всегда имеется небольшое число частиц (примерно одна из нескольких тысяч), которые отклоняются очень сильно. Некоторые частицы отбрасываются назад, как если бы на пути встретилась непроницаемая преграда. Это не электроны - их масса гораздо меньше массы альфа-частиц. Отклонение может происходить при столкновении с положительными частицами, масса которых того же порядка, что и масса альфа-частиц. Исходя из этих соображений, Резерфорд предложил ядерную (планетарную) модель строения атома. (Приложение Б)
Глава 2. Модель строения атома Бора.
.1 Постулаты Бора
Первая попытка построить качественно новую - квантовую теорию атома была предпринята в 1913г. датским физиком Нильсом Бором. Он поставил перед собой цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил ядерную модель Резерфорда. Он предположил, что электроны движутся вокруг ядра по круговым орбитам. Движение по окружности даже с постоянной скоростью обладает ускорением. Такое ускоренное движение заряда эквивалентно переменному току, который создает в пространстве переменное электромагнитное поле. На создание этого поля расходуется энергия. Энергия поля может создаваться за счет энергии кулоновского взаимодействия электрона с ядром. В результате электрон должен двигаться по спирали и упасть на ядро. Однако опыт показывает, что атомы - очень устойчивые образования. Отсюда следует вывод, что результаты классической электродинамики, основанной на уравнениях Максвелла, неприменимы к внутриатомным процессам. Необходимо найти новые закономерности. В основу своей теории Бор положил два постулата.
Первый постулат Бора (постулат стационарных состояний): «в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн. В стационарном состоянии атома электрон, двигаясь по круговой орбите должен иметь дискретные квантовые значения момента импульса, удовлетворяющие условию:
mevrn = n? (n = 1, 2, 3,…)
Второй постулат Бора (правило частот): «при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
равной разности энергий соответствующих стационарных состояний (En и Em - соответственно энергии стационарных состояний атома до и после излучения и поглощения). При En > Em происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т.е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при En ? при движении электрона по окружности создается кулоновской силой Fэ. Следовательно,
В атоме водорода заряд ядра равен заряду e электрона, поэтому для атома водорода получим:
Двигаясь по каждой из разреженных стационарных круговых орбит, электрон обладает определенным запасом кинетической энергии, а также и потенциальной энергией в электрическом поле атомного ядра. Обозначим через En сумму кинетической энергии электрона на стационарной орбите с номером n и потенциальной энергии взаимодействия электрона с атомным ядром. Тогда каждой разрешенной стационарной орбите электрона в атоме можно поставить соответствие в значение энергии атома в стационарном состоянии. Для наглядного представления возможных энергетических состояний атомов используются энергетические диаграммы. (Приложение В)
На энергетической диаграмме каждое стационарное состояние атома отмечается горизонтальной линией, называемой энергетическим уровнем. Ниже всех остальных на диаграмме располагается энергетический уровень, соответствующий энергии E1 основного состояния атома, энергетические уровни возбужденных состояний располагаются над основным уровнем на расстояниях, пропорциональных разности энергий возбужденного и основного состояний. Переходы атома из одного состояния в другое изображаются вертикальными линиями между соответствующими уровнями на энергетической диаграмме, направление перехода указывается стрелкой.
Переходу электрона со стационарной орбиты под номером m на стационарную орбиту под номером n соответствует переход атома из состояния с энергией Em в состояние с энергией En. Этот переход на диаграмме энергетических уровней обозначается вертикальной стрелкой от уровня Em к уровню En. (Приложение Г)
2.3 Объяснение происхождения линейчатых спектров
Постулаты Бора позволяют объяснить происхождение линейчатых спектров излучения и поглощения, связывая их существование с наличием дискретного ряда энергетических состояний атомов.
Все атомы одного химического элемента обладают одинаковым зарядом атомного ядра. При одинаковом заряде ядра атомы обладают одинаковым строением электронных оболочек и потому имеют одинаковый набор возможных энергетических состояний и переходов между ними. Излучение и поглощение фотонов происходит при переходах атомов из одного разрешенного стационарного состояния в другое. Энергия фотона, поглощаемого атомом при переходе из нормального состояния с энергией E1 в возбужденное состояние с энергией En, в точности равна энергии фотона, излучаемого атомом при обратном переходе, так как и в том, и в другом случае она равна разности энергий атома в этих двух состояниях:
2.4 Достоинства и недостатки теории Бора
. Достоинства теории Бора.
. Недостатки теории Бора
Теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно - уравнение движения электрона - классическое, другое - уравнение квантования орбит - квантовое. Также, она не смогла объяснить интенсивность спектральных линий. Даная теория справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева без экспериментальных данных (энергии ионизации или других). Теория Бора являлась недостаточно последовательной и общей. Поэтому она в дальнейшем была заменена современной квантовой механикой, основанной на более общих и непротиворечивых исходных положениях. Сейчас известно, что постулаты Бора являются следствиями более общих квантовых законов. Но правила квантования широко используются и в наши дни как приближенные соотношения: их точность часто бывает очень высокой.
Итак, теория Бора - это крупный шаг в развитии атомной физики. Она является важным этапом в создании квантовой механики. Однако эта теория обладает многими противоречиями (с одной стороны, применяет законы классической физики, а с другой - основывается на квантовых постулатах). Она рассмотрела спектры атома водорода и водородоподобных систем и вычислила частоты спектральных линий, однако не смогла объяснить их интенсивности и ответить на вопрос: почему совершаются те или иные переходы? Серьезным недостатком теории Бора была невозможность описания с ее помощью спектра - атома гелия - одного из простейших атомов, непосредственно следующего за атомом водорода.
орбита излучение бор энергетический
В ХХ веке некоторые положения теории Н. Бора были дополнены и переосмыслены. Наиболее значительным изменением стало введение понятия об электронном облаке, которое сменило понятие об электроне только как частице. Позже теорию Бора сменила квантовая теория Альберта Эйнштейна, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
Основой современной теории строения атома является планетарная модель, дополненная и усовершенствованная. Согласно данной теории, ядро атома состоит из протонов (положительно заряженных частиц) и нейронов (не имеющих заряда частиц). А вокруг ядра по неопределённым траекториям движутся электроны (отрицательно заряженные частицы).
В ходе данного исследования был отражен процесс эволюции представлений о строении атомов на примере моделей Эрнеста Резерфорда и Нильса Бора. Полностью изучены, проанализированы и обобщены представления о строении атомов, высказанные Резерфордом и Бором. С точки зрения современной физики, наиболее верное предположение о строении атома было сделано датским ученым - Нильсом Бором.
На одной из лекций по КСЕ студенты будут ознакомлены с современными представлениями о строении атома и с вкладом Резерфорда и Бора в изучение этого вопроса.
1. Карпенков, С. Х. Концепции современного естествознания: Практикум: учебное пособие / С. Х. Карпенков. - М.: Культура и спорт, 1998. - 237с.
. Трофимова, Т.И. Курс физики: учебное пособие / Т. И. Трофимова - М.: Высшая школа, 1990. - 478с.
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
Реферат по химии на тему
Существование закономерной связи между всеми химическими элементами, ярко выраженное в периодической системе, наталкивает на мысль о том, что в основе всех атомов лежит нечто общее, что все они находятся в близком родстве друг с другом. Однако до конца 19 в. в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. При всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части.
Но все эти предположения в то время еще не могли быть подтверждены какими либо экспериментальными данными. Лишь в конце 19в. были сделаны открытия, показавшие сложность строения атома и возможность превращения при известных условиях одних атомов в другие. На основе этих открытий начало быстро развиваться учение о строении атома. Первые указания на сложную структуру атомов были получены при изучении катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую
впаяны два металлических электрода, выкачивается по
возможности весь воздух и затем пропускается сквозь
нее ток высокого напряжения. При таких условиях от
катодатрубки перпендикулярно к его поверхности
распространяются "невидимые" катодные лучи, вызывающие
яркоезеленоесвечение в том месте, куда они
приводить в движение на их пути легко подвижные тела и
магнитном и электрическом поле (в последнем в сторону
положительно заряженной пластины). Действие катодных
лучей обнаруживается только внутри трубки, так как
стекло для нихнепроницаемо.Изучениесвойств
катодныхлучейпривелок заключению, что они
представляют собой поток мельчайших частиц, несущих
отрицательныйэлектрическийзаряд и летящих со
скоростью, достигающей половиныскоростисвета.
Особыми приемами удалось определить массу катодный частицы и величину их заряда. Оказалось, что масса каждой частицы равняется 0,00055 углеродной единицы, что составляет всего 1.1840 часть массы водорода, самого легкого из всех атомов. Заряд катодной частицы
электростатических единиц. Особенно замечательно, что
масса частиц и величина их заряда не зависит ни от
природы газа, остающегося в трубке, ни от вещества из
которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут быть лишены своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет, самую сущность их природы. Эти частицы получили название электронов. По современным воззрениям, заряд электрона есть наименьший электрический заряд, наименьшее кол-во электричества, какое только может существовать. В катодных трубках электроны отделяются от катода под влиянием электрического заряда. однако они могут возникать и вне всякой связи с электрическим зарядом. Так, например, все металлы испускают электроны при накаливании; в пламени горелки также присутствуют
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
ООО Учебный центр
Реферат по дисциплине:
Чумакина Галина Петровна
Москва 20 17 год
2. Периодический закон и система Менделеева …………………………. 4
4. Изменение свойств химических элементов ……………………………. 8
Использованная литература …………………………………………………12
Первые представления о том, что вещество состоит из отдельных неделимых частиц, появилось в глубокой древности. В древней Индии признавалось не только существование первичных неделимых частиц вещества, но и их способность соединяться друг с другом, образуя новые частицы. Древнегреческий ученый Аристотель писал, что причинами всех вещей являются определенные различия в атомах, а именно: форма, порядок и положение. Позднее древнегреческий философ – материалист ввел понятие о массе атомов и их способности к самопроизвольному отклонению во время движения. Французский ученый Пьер Гассенди ввел понятие о молекуле, под которой он понимал качественно новое образование, составленное путем соединения нескольких атомов.
Английский ученый Дж. Дальтон рассматривал атом как мельчайшую частицу химического элемента, отличающуюся от атомов других элементов прежде всего массой.
Установленные С. Канниццаро атомные массы элементов послужили Д. И. Менделееву основной при открытии периодического закона.
Физический смысл Периодического закона был вскрыт лишь после выяснения того, что заряд ядра атома возрастает при переходе от одного химического элемента к соседнему (в периодической системе) на единицу элементарного заряда. Численно заряд ядра равен порядковому номеру (атомному номеру Z) соответствующего элемента в периодической системе, то есть числу протонов в ядре, в свою очередь равному числу электронов соответствующего нейтрального атома. Химические свойства атомов определяются структурой их внешних электронных оболочек, периодически изменяющейся с увеличением заряда ядра, и, следовательно, в основе Периодического закона лежит представление об изменении заряда ядра атомов, а не атомной массы элементов.
Периодические закон имеет огромное естественнонаучное и философское значение. Он позволил рассматривать все элементы в их взаимной связи и прогнозировать свойства неизвестных элементов.
Заслуг ами Д.И.Менделеева, таким образом являются:
1. Он рассматривал периодичность не одного какого-либо свойства, а всех свойств - химических и физических (в отличие от предшественников).
2. Он ввел длинные ряды и периоды - таблица не представляет собой аккуратного прямоугольника, что предусматривает возможности дальнейшего развития. 1895 - открыты инертные газы.
3. Он оставил пустые клетки в таблице, которые позднее были заполнены вновь открытыми элементами, причем их свойства с большой точностью совпадают с предсказанными Д.И.Менделеевым.
Экабор - скандий , 1879, Нильсен
Экаалюминий - 1875, галлий, Лекок де Буабодран
Экасилиций - 1885, германий, Винклер
4. Исправил атомные веса некоторых элементов, что потом было подтверждено экспериментально (Cr, In, Pt, Au, U)
5. Переставил некоторые элементы местами вопреки некоторой немонотонности в изменении атомных масс (никто еще не подозревал тогда о существовании изотопов). Te (127.60) он поставил перед иодом (126.90). А открытый гораздо позднее аргон (39.94) поставил в группу инертных газов перед калием (39.1).
Современная Периодическая система элементов охватывает 106 химических элементов; из них все трансурановые (Z = 93—106), а также элементы с Z = 43 (Tc), 61 (Pm), 85 (At) и 87 (Fr) получены искусственно. За всю историю периодической системы было предложено большое количество (нескольких сотен) вариантов её графического изображения, преимущественно в виде таблиц; известны изображения и в виде различных геометрических фигур (пространственных и плоскостных), аналитических кривых (например, спирали) и т.д. Фундаментальным принципом построения периодической системы элементов является разделение всех химических элементов на группы и периоды. Каждая группа в свою очередь подразделяется на главную (а) и побочную (б) подгруппы. В каждой подгруппе содержатся элементы, обладающие сходными химическими свойствами. Элементы а - и б -подгрупп в каждой группе, как правило, обнаруживают между собой определённое химическое сходство, главным образом в высших степенях окисления, которые, как правило, соответствуют номеру группы. Периодом называется совокупность элементов, начинающаяся щелочным металлом и заканчивающаяся инертным газом (особый случай — первый период); каждый период содержит строго определённое число элементов. Периодическая система элементов состоит из 8 групп и 7 периодов (седьмой пока не завершен).
Атом (от греч. atomos — неделимый) -это частица вещества микроскопических размеров и очень малой массы (микрочастица), наименьшая часть химического элемента, являющаяся носителем его свойств. Каждому элементу соответствует определённый род атомов ., обозначаемых символом элемента (например, атом водорода Н , атом железа Fe; атом ртути Hg; атом урана U).

П
о современным представлениям атом - это сложная система, состоящая из положительно заряженного ядра и электронов, окружающих ядро. Состав атома элемента можно представить в виде схемы (рис.1) :
Рис.1 Состав атома элемента.
Ядро атом а, главным образом , состоит из протонов и нейтронов (общее название нуклоны). Протоны - это положительно заряженные микрочастицы с массой, равной 1 а.е.м. и зарядом +1,6 ∙ 10 -19 К , условно принятым за единицу положительного заряда (+1). Нейтроны - нейтральные частицы с массой 1 а.е.м. Количество протонов в ядре определяет заряд ядра атома в порядковых номер элемента в периодической системе элементов Менделеева. Например, у атома калия (порядковый номер в таблице Менделеева 19, атомная масса 39 а.е.м.) в ядре находится 19 протонов и 20 нейтронов, у бария (порядковый номер 56, атомная масса 137) в ядре 56 протонов и 71 нейтрон.
Электроны, окружающие ядро атома - это отрицательно заряженные микрочастицы, имеющие массу ~ 5∙10 -4 а.е.м. и заряд -1,6 ∙ 10 -19 К (-1). Так как масса электрона ничтожно мала по сравнению с массой протона или нейтрона, масса атома практически равна массе его ядра, т.е. сумме масс протонов и нейтронов. Число электронов в атоме равно числу положительно заряженных протонов, входящих в состав ядра.
Размеры атома в целом определяются размерами его электронной оболочки и велики по сравнению с размерами ядра атома . Электронные оболочки атома не имеют строго определённой границы; значения размеров атома в большей или меньшей степени зависят от способов их определения и весьма разнообразны
В 1911 году, английский учёный Эрнест Резерфорд придумал "планетарную" модель атома, согласно которой в центре атома Резерфорд расположил крохотное, но очень плотное ядро, в котором сосредоточена почти вся масса атома, а электроны вращались вокруг него по определённым орбитам, как планеты вокруг Солнца.
Потом оказалось, что каждый электрон движется вокруг ядра так быстро, что его не только нельзя рассмотреть с помощью самого мощного микроскопа, но невозможно даже представить в виде точки, движущейся по определённой траектории. Электрон как бы "размазан" в пространстве и образует электронное облако, причём форма электронного облака может быть различной.
На данный момент известны четыре формы электронных облаков : s -электроны (сферическая форма электронного облака) ; p -электроны (форма электронного облака - гантель или объёмная восьмёрка) ; d -электроны ; f -электроны .
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
Графическим изображением периодического закона , как уже отмечалось, является периодическая таблица. Она содержит 7 периодов и 8 групп.
Период - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов. Номер периода обозначает число энергетических уровней в атоме элемента.
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns 2 np 6 ).
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические - присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями. Заполнение внешнего s- подуровня указывает на металлические свойства атома, а формирование внешнего p- подуровня - на неметаллические свойства. Увеличение числа электронов на p- подуровне (от 1 до 5) усиливает неметаллические свойства атома. Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns 2 np 6 ) химически инертны.
В больших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n - 1) d- подуровня при сохранении внешнего ns 2 - слоя. Большие периоды состоят из четных и нечетных рядов.
У элементов четных рядов на внешнем слое ns 2 - электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np- подуровень, что объясняет значительное ослабление металлических свойств.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d- подуровне (или (n - 2) f- подуровне).
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III - VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные.
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I - III групп образуют твердые вещества - гидриды (водород в степени окисления - 1), а IV - VII групп - газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН 4 ) - нейтральны, V группы (ЭН 3 ) - основания, VI и VII групп (Н 2 Э и НЭ) - кислоты (таблица 1) .

Атом – наименьшая частица вещества. Его изучение началось еще в Древней Греции, когда к строению атома было приковано внимание не только ученых, но и философов. Каково же электронное строение атома, и какие основные сведения известны об этой частице?
Строение атома
Уже древнегреческие ученые догадывались о существовании мельчайших химически частиц, из которых состоит любой предмет и организм. И если в XVII-XVIII вв. химики были уверены, что атом неделимая элементарная частица, то на рубеже XIX-XX вв., опытным путем удалось доказать, что атом не является неделимым.
Атом, будучи микроскопической частицей вещества, состоит из ядра и электронов. Ядро в 10000 раз меньше атома, однако практически вся его масса сосредоточена именно в ядре. Главной характеристикой атомного ядра, является то, что он имеет положительный заряд и состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны не имеют заряда (они нейтральны).
Связаны они друг с другом с помощью сильного ядерного взаимодействия. Масса протона примерно равна массе нейтрона, но при этом в 1840 раз больше массы электрона. Протоны и нейтроны имеют в химии общее название – нуклоны. Сам атом является электронейтральным.
Атом любого элемента можно обозначить электронной формулой и электронно графической формулой:
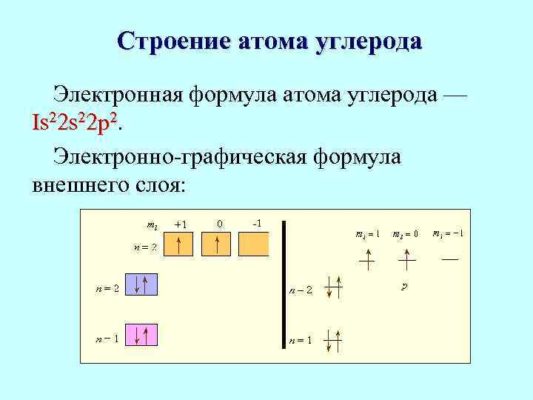
Рис. 1. Электронно-графическая формула атома.
Единственным химическим элементом из периодической системы, в ядре которого не содержатся нейтроны, является легкий водород (протий).
Электрон является отрицательно заряженной частицей. Электронная оболочка состоит из движущихся вокруг ядра электронов. Электроны имеют свойства притягиваться к ядру, а между друг друг на них оказывает влияние кулоновское взаимодействие. Чтобы преодолеть притяжения ядра, электроны должны получать энергию от внешнего источника. Чем дальше электрон находится от ядра, тем меньше энергии для этого необходимо.
Модели атомов
На протяжении долго времени ученые стремились познать природу атома. На раннем этапе большой вклад внес древнегреческий философ Демокрит. Хотя сейчас его теория и кажется нам банальной и слишком простой, в тот период, когда представления об элементарных частицах только начинало зарождаться, его теория о кусочках материи воспринималась совершенно серьезно. Демокрит считал, что свойства любого вещества зависят от формы, массы и других характеристик атомов. Так, например, у огня, полагал он, острые атомы – поэтому огонь обжигает; у воды атомы гладкие, поэтому она способна течь; у твердых предметов, по его представлению, атомы были шереховатые.
Демокрит считал, что из атомов состоит абсолютно все, даже душа человека.
В 1904 году Дж. Дж. Томсон предложил свою модель атома. Основные положения теории сводились к тому, что атом представлялся положительно заряженным телом, внутри которого находились электроны с отрицательным зарядом. Позже эта теория была опровергнута Э. Резерфордом.

Рис. 2. Модель атома Томсона.
Также в 1904 году японским физиком Х. Нагаока была предложена ранняя планетарная модель атома по аналогии с планетой Сатурн. Электроны по этой теории объединены в кольца и вращаются вокруг положительно заряженного ядра. Эта теория оказалась ошибочной.
В 1911 году Э. Резерфорд, проделав ряд опытов, сделал выводы, что атом по своему строению похож на планетную систему. Ведь электроны, словно планеты, движутся по орбитам вокруг тяжелого положительно заряженного ядра. Однако это описание противоречило классической электродинамике. Тогда датский физик Нильс Бор в 1913 году ввел постулаты, суть которых заключалась в том, что электрон, находясь в некоторых специальных состояниях, не излучает энергию. Таким образом, постулаты бора показали, что для атомов классическая механика неприменима. Планетарная модель, описанная Резерфордом и дополненная Бором, получила название – планетарная модель Бора-Резерфорда.

Рис. 3. Планетарная модель Бора-Резерфорда.
Дальнейшее изучение атома привело к созданию такого раздела, как квантовая механика, с помощью которого объяснялись многие научные факты. Современные представления об атоме развились из планетарной модели Бора-Резерфорда.
Что мы узнали?
В данной статье по химии (8 класс) рассказывается кратко и понятно о строении атома. На протяжении многих веков ученые разных стран изучали мельчайшие частицы вещества. Появлялись разные теории, модели и разные формулы строения атома. Современные представления об атоме основываются на модели Бора-Резерфорда, по которой атом состоит из ядра и электронного облака, в котором электроны движутся вокруг ядра.
Читайте также:

