Синтез фишера тропша реферат
Обновлено: 04.07.2024
Получение синтетического жидкого топлива синтезом
из CO и H2.(Синтез Фишера-Тропша).
Физико-химические основы процесса.
Синтез углеводородов из CO+H2 является гетерогенным каталитическим процессом, протекающим с большим выделением тепла. В качестве катализаторов чаще всего используют металлы VIII группы периодической таблицы, чаще всего Fe, Co, Ni, Rh, Ru нанесенные на носитеоли. Взависимости от используемого катализатора процесс можно вести при атмосферном или повышенном давлении при температуре 160-3250C
Синтез на Fe- и Co-содержащих катализаторах схематически можно представить следующими уравнениям:
1) CO+ H2 [ -CH2-]n + H2O ΔH0= -165,0 кДж/моль
2) 2CO + H2 [ -CH2- ]n + СО2 ΔH0= -207,9 кДж/моль
Побочные реакции
3) Будуара2СО ------ СО2 + С ΔH0= -134,0 кДж/моль
4) Конверсии СО с водой
СО + Н2О ------СО2 + Н2 ΔH0= -39,8 кДж/моль
Различие в составе продуктов на катализаторах объясняется тем, что на железосодержащем катализаторе процесс собственно синтеза протекает одновременно с реакцией конверсии оксида углерода водой.
Основные продукты: парафины в основном нормального строения и олефины.Разработки катализаторов последних лет привели к получению циклоалканов и ароматических углеводородов.
Решающее значение при организации процесса Фишера-Тропша имеют два фактора:
1) очень большая теплота реакции;
2) необходимость точного соблюдения температуры синтеза, особенно на кобальтовом катализаторе. Это связано с тем, что при повышенной температуре возрастает метанообразование, а также отложениеуглерода на катализаторе, что приводит к его дезактивации.
На основе приведенных выше уравнений реакций рассчитано, что превращение 1м3 синтез-газа в адиабатических условиях приведет к разогреву газа до 15000C. Отсюда понятно, какие конструктивные сложности возникают при эксплуатации больших установок.
Термодинамика.
Известно, что термодинамическую вероятность образования продуктов в системемногих параллельных и последовательных реакций следует оценивать по результатам расчета их общего одновременного равновесия. Однако для синтеза Фишера-Тропша это не реально, из-за неограниченного числа реакций, поэтому при расчете термодинамики Ф-Т-синтеза исходят из независимости отдельных реакций друг от друга.
Высокий тепловой эффект большинства реакций обусловливает быстрое уменьшение константыравновесия с ростом температуры.
Наглядно это видно из температурной зависимости изобарно-изотермического потенциала образования некоторых углеводородов, отнесенная к 1 атому углерода.
1) Наиболее термодинамически выгодной реакцией является образование метана. С увеличением длины цепи термодинамическая вероятность снижается.
2) При повышении температуры увеличивается вероятность образованияолефинов и углеводородов с короткими цепями.
3) Изобарно-изотермический потенциал для реакций Будуара и конверсии оксида углерода мало зависит от температуры, следовательно, при повышении температуры относительная вероятность этих неблагоприятных процессов возрастает.
4) Образование альдегидов при температурах выше 3000C становится маловероятным.
5) Образование разветвленных, циклических иароматических углеводородов термодинамически возможно.(на рис не показано)
6) Наличие в продуктах синтеза Фишера-Тропша главным образом нормальных и альфа-олефинов указывает на то, что процесс не идет до состояния с минимальной свободной энергией; ход реакции определяется каталитическим механизмом реакции.
Кинетика.
На кинетику Ф-Т синтеза влияет большое число факторов: давление, температура, состав исходногогаза, время контактирования, условия транспортирования вещества и тепла. Все это затрудняет кинетическое описание процесса, и универсальное уравнение для Ф-Т синтеза отсутствует.
Для каждого катализатора и вида процесса имеются свои уравнения, справедливые в ограниченной области параметров. Для макрокинетики имеет значение транспортирование вещества внутри пористой.
В органическом синтезе в реакциях гидрирования (присоединения H2 ) участвуют любые молекулы, имеющие ненасыщенные связи – С=С, СºС, СºN, –N=N–, C=O и др. Синтезы Фишера-Тропша из СО и Н2 , синтез метанола из СО, СО2 и Н2 также относят к реакциям гидрирования, однако в синтезе углеводородов по Фишеру-Тропшу, кроме присоединения Н2 , происходит и деструктивное гидрирование с разрывом С–О связи. К деструктивному гидрированию относится и гидрогенолиз связи С–С – процессы гидрокрекинга, например,

,
и гидрогенолиз связи С–S (процессы гидрообессеривания нефтяных фракций)

Обратная гидрированию реакция – процесс дегидрирования – занимает важное место в промышленном органическом синтезе и в процессах нефтепереработки. Дегидрируют алканы и алкилбензолы (синтезы бутадиена, изопрена, стирола), нафтены (бензол из циклогексана), спирты (синтезы формальдегида, ацетона, изовалерианового альдегида, циклогексанона). В качестве катализаторов гидрирования используют металлы и их соединения:
Металлические катализаторы – Pt, Pd, Ni, Co, Rh, Ru, Cu – в форме массивных металлов, сплавов, нанесенных катализаторов (М/носитель) и скелетных металлов (никель Ренея, медь Ренея), которые получают выщелачиванием Al из сплавов Al-Ni, Al-Cu и др.
Сульфиды металлов – NiS, CoS, Mo2S3, W2S3.
Комплексы переходных металлов.
Оксиды металлов применяют для процессов дегидрирования, поскольку при высоких температурах (> 200оС) металлы слишком активны и ведут деструктивные процессы. Катализаторами дегидрирования являются следующие оксиды: ZnO, Cr2O3, Mo2O3, W2O3, MgO. При высоких температурах (> 450оС) дегидрирование спиртов наблюдается и на g-Al2O3.
Важнейшая стадия процессов гидрирования – активация молекулы водорода. В случае комплексов металлов в растворах механизм активации водорода сейчас уже ясен:

s-комплекс (1)
Превращение первичного s-комплекса зависит от природы металла, его степени окисления и лигандов в координационной сфере. Возможны гомолиз (2) и гетеролиз (3) связи Н-Н:

(2)

(3)
Участия недиссоциированной молекулы H2 в процессах гомогенного гидрирования пока не установлено. Гидрогенолиз связи М-С, например, в процессе гидроформилирования олефинов

(4)
также рассматривают как результат гомолитического расщепления молекулы Н2 на атоме Со. Не исключена, однако, возможность элементарного акта (метатезис s-связей) через четырехчленное циклическое переходное состояние

.
На поверхности металлов имеет место гомолитическое расщепление Н2 с образованием поверхностных атомов водорода и атомов водорода, растворенных в решетке металла. При наличии полярного растворителя (S) процесс адсорбции Н2 на металлах может проходить гетеролитически и даже сопровождаться полной ионизацией с переносом 2ē на металл.


В этом случае молекулу гидрируемого соединения восстанавливают электроны, связанные с металлом.
При построении кинетических моделей процессов гидрирования на металлах используют представления об однородной поверхности, о равномерно-неоднородной поверхности (модели Лэнгмюра-Хиншельвуда) и о неоднородной поверхности. Например, при гидрировании этилена в рамках гипотезы о взаимодействии адсорбированных на поверхности Niтв этилена и водорода

(5)
На однородной поверхности

(6)
На равномерно-неоднородной поверхности

(7)
Для процесса дегидрирования бутана до бутилена на катализаторе Cr2O3/Al2O3 при 520 – 550оС используют эмпирическое уравнение (8) (для промышленного интервала парциальных давлений):

, n = 0.4 – 0.5 (8)
Процесс используют для получения легких бензинов, дизельного топлива и смазочных масел. Высококипящие фракции (главным образом, вакуумный дистиллят) обрабатывают водородом при Р = 50 – 300 атм и 330 – 450оС в присутствии катализаторов – Rh, Ni, Co, Mo, Pt на Al2O3. В случае Ni преимущественно происходит активация и гидрогенолиз концевых С-С связей в алканах с образованием СН4 и более коротких углеводородов. Металлическая Pt активирует все связи, в том числе и связи С-Н, катализируя процессы деструкции и дегидрирования. Алюмокобальтмолибденовый катализатор гидрокрекинга используют при ~400оС и Р = 50 атм.
Основные реакции в процессе гидрокрекинга – гидрирование ароматических полициклических соединений, раскрытие нафтеновых колец, гидродеалкилирование алкилароматических и нафтеновых углеводородов, изомеризация и гидрирование образующихся продуктов, а также гидрогенолиз сера-, азот- и кислородсодержащих соединений (до H2S, NH3 и H2O), т.е. процессы гидроочистки.
Важное место среди процессов гидрокрекинга, позволяющих получить средний дистиллят в качестве дизельного топлива с пониженной плотностью и повышенным цетановым числом занимают процессы гидрирования полициклических ароматических соединений и последующего гидрогенолиза полученных нафтенов (раскрытие циклов) без потери молекулярной массы нафтенов, например,

Для таких процессов наилучшие результаты получены для катализаторов Pt/Al2O3, Rh/Al2O3 и Ir/Al2O3. В гидрокрекинге применяют и полифункциональные катализаторы, содержащие Pt и цеолиты средней или низкой кислотности.
Процесс риформинга направлен на изомеризацию и ароматизацию н-парафинов без изменения молекулярной массы (числа атомов углерода) в исходных молекулах в процессе превращений. Основные реакции:

б) дегидроциклизация парафинов

в) скелетная изомеризация


(с последующей скелетной изомеризацией олефинов)
Процессы гидрокрекинга являются нежелательными.

Риформинг используют для получения из нафты (температура кипения 80 – 160оС) высокооктановых бензинов и ароматических соединений, которые экстрагируют из бензинов и используют в качестве сырья для гидрокрекинга или для органического синтеза. Процесс проводят в интервале 380 – 520оС при давлении 10 – 40 атм на гетерогенных бифункциональных катализаторах – металлических и кислотных – Pt на промотированном Cl– или F– оксиде алюминия (или алюмосиликате). В последнее время используют Pt-Re/Al2O3 или полиметаллические катализаторы на Al2O3. Основной проблемой в процессе риформинга является процесс дезактивации и закоксовывания катализатора. Наличие Pt и, особенно, Re способствует уменьшению коксообразования по сравнению с процессом каталитического крекинга на алюмосиликатах – происходит гидрирование отлагающегося на носителе кокса и полимерных пленок. На рисунке представлена упрощенная диаграмма реакций (на примере превращений С6-углеводородов), развивающихся на кислотных центрах (вдоль оси абсцисс) и на металлических центрах (вдоль оси ординат):

Установлено также, что процессы дегидроциклизации парафинов могут проходить и целиком на металлических центрах, минуя стадию образования олефина, представленную на диаграмме. Разрыв С-Н связей в парафине на соседних центрах (атомах Pt) происходит с образованием s-металлоорганических и металлкарбеновых интермедиатов:

Гидрогенолиз связей 2-3, 3-4 и 4-5 приводит к продуктам скелетной изомеризации н-алканов.
Изучена кинетика 53 индивидуальных реакций, характерных для риформинга бензиновой фракции, определены константы скорости первого порядка для различного вида углеводородов С6 – С10 и различных реакций. Получена упрощенная кинетическая модель очень сложного мультимаршрутного процесса риформинга, которую используют для расчета промышленных реакторов.
Процессы удаления серасодержащих соединений, присутствующих в нефтяных фракциях (и природном газе), включают процессы демеркаптанизации (окисление RSH) и гидрообессеривания (гидрирование алифатических и гетероциклических сульфидов). Последний процесс используют для предварительной обработки сырья риформинга и для обработки бензина, полученного в процессе каталитического крекинга. Обессеривание тяжелых фракций нефти дает продукты, включающие дизельное и реактивное топливо, котельное топливо и топливный мазут.
Катализаторы процесса – оксиды Co и Mo на Al2O3 или оксиды Ni и W на Al2O3, которые в условиях процесса взаимодействуют с H2S и переходят в сульфиды металлов. Такие катализаторы существенно менее активны по сравнению с Pt/Al2O3, но они не отравляются H2S. Процесс проводят в интервале температур 330 – 425оС и давлений 35 – 140 атм, в зависимости от вида фракции, подвергаемой гидроочистке. Регенерация катализаторов достигается путем выжигания кокса, образующегося на катализаторах.
При исследовании кинетики реакций (9), (10) и (11)

(9)

(10)

(11)
на катализаторах CoS-Mo2S3/Al2O3 были получены кинетические уравнения в рамках схемы Лэнгмюра-Хиншельвуда

, (12)
где РТ – парциальное давление тиофена, Pi – парциальные давления тиофена и др. ароматических углеводородов.

(13)
Из уравнений (12) и (13) следует, что оба процесса – гидрогенолиз (9) и гидрирование бутена (11) происходят на разных центрах катализатора. Механизм реакции пока не ясен, однако упрощенная стадийная схема включает активацию Н2 на металле восьмой группы (Ni2+, Co2+) и адсорбцию тиофена на анионной вакансии, связанной с Mo(III) или W(III). Восстановленные атомы Ni(0) и осуществляют разрыв связи C-S:

Схематически на поверхности сульфидного катализатора, представленного в ионной форме, происходят следующие процессы ( – анионная вакансия):

На ионах, расположенных в прямоугольнике, могут находиться делокализованные электроны. Появились уже примеры гидрогенолиза связей C-S с участием комплексов переходных металлов. Исследования таких систем позволят установить механизм процесса и природу возможных интермедиатов.
Вопросы для самоконтроля
Назовите катализаторы гидрирования и дегидрирования органических соединений.
Охарактеризовать механизм активации водорода комплексами металлов и металлами.
Варианты кинетических моделей процессов гидрирования.
Назвать основные реакции в процессе гидрокрекинга – газоочистки нефтяных фракций.
Основные реакции процесса риформинга.
Описать механизм реакции дегидрирования на платиновых катализаторах.
Представить схематически возможный механизм гидрогенолиза тиофена на Ni-W-катализаторах.
Литература для углубленного изучения
Гейтс Б., Кетцир Дж., Шуйт Г., Химия каталитических процессов, М., Мир, 1981, с. 227 – 390, с. 476 – 543.
Шапиро Р.Н., Каталитический риформинг бензинов, Химия и технология, Л., 1985.
Эрих В.Н., Расина М.Г., Рудин М.Г., Химия и технология нефти и газа, Л., Химия, 1985, с. 214 – 281.
В связи с тем, что с каждым годом запасы углеводородного сырья уменьшаются с высокой скоростью, человечеством разрабатываются технологии, позволяющие получить на основе нефти её аналоги и продукты. Синтез Фишера-Тропша является достаточно перспективным в этом направлении, так как в результате данного процесса возможно получение углеводородов различного состава из двух реагентов: СО и Н 2 . При изменении условий и катализатора мы можем получать востребованные во многих областях промышленности синтетические углеводороды. В этом и заключается актуальность данного синтеза.
Производительность и селективность являются основными показателями эффективности процесса. Существуют два подхода по увеличению данных показателей в синтезе Фишера-Тропша. Технологический подход основан на выборе технологического оформления, включающего в себя тип реактора, способ организации технологических потоков, и режима протекающего процесса (состав исходного газа, давление, температура и т.д), обеспечивающие увеличение производительности и выхода желаемой фракции углеводородов Каталитический подход заключается в разработке катализаторов, позволяющих увеличивать вероятность получения максимального выхода необходимой нам фракции.
Синтез Фишера-Тропша – актуальный в наше время процесс переработки разнообразного углеродсодержащего сырья с целью получения углеводородных продуктов.
1 ЛИТЕРАТУРНЫЙ ОБЗОР
Синтез Фишера-Тропша – это практически значимый процесс, включающий в себя реакцию в присутствии катализатора между монооксидом углерода (СО) и водородом (Н 2 ), в результате которой на выходе получают углеводороды различного состава в жидкой форме. В основном реакция катализируется кобольтом или железом. Весьма существенен является факт, что для реализации процесса возможно использование любого органического сырья (прирoдный и пoпутный нефтянoй газ, угoль, тoрф, биoмасса и т.д). Назначение процесса – получение углеводородов с целью их дальнейшего использования в виде синтетических смазочных масел и горючего.
Синтез углеводородов из СО и Н 2 – полимеризационный гетерогенно-каталитический процесс, протекающий в присутствии металлов VIII группы (преимущественно Co и Fe) и с огромным выделением тепла. Катализаторы данной реакции определяют спoсoб пoлучения и сoстав синтез-гaзa, кoличествo и сoстaв цeлeвых прoдуктoв, нeoбхoдимocть и спoсoб их oблaгoрaживaния, спoсoб вывeдeния кислoрoдa и дaже утилизaции вoды и диoксида углерoда при атмосферном и высоких давлениях в интервале температур 160–350 °C .
Конверсия природного газа может протекать в присутствии кислорода (чистого или в составе воздуха), воды или диоксида углерода. Эти реакции описываются данными схемами превращений [1]:
CH 4 + O 2 ↔ CO + 2H 2 (1); [pic 1]
CH 4 + H 2 O ↔ CO + 3H 2 (2);
CH 4 + CO 2 ↔ 2CO + 2H 2 (3).
Уравнение (1) описывает парциальное окисление метана, где мольное отношение СО к Н 2 равно 1:2, которое осуществляется при температурах выше 1300°С. Паровая конверсия (уравнение 2) позволяет получать синтез-газ, более обогащенный водородом (СО:Н 2 = 1:3) при 900-1000°С, а при углекислотной конверсии образуется синтез-газ с эквимолярным соотношением компонентов (уравнение 3).
Продуктами реакции являются алканы, алкены и кислородсодержащие соединения, то есть образуется сложная смесь продуктов, характерная для реакции полимеризации. Первичными продуктами синтеза Фишера-Тропша являются aи b-олефины, которые превращаются в алканы в результате последующего гидрирования. Природа применяемого катализатора, температура, соотношение СО и Н2 существенно сказываются… Читать ещё >
- способы получения оксида углерода и синтез-газа
Синтез Фишера-Тропша. Способы получения оксида углерода и синтез-газа ( реферат , курсовая , диплом , контрольная )
Метод Фишера — Тропша по превращению метана в более тяжелые углеводороды был разработан в 1923 г. и реализован в промышленности Германии в 1940;х годах.
Почти все авиационное топливо в этой стране во время второй мировой войны производилось с помощью синтеза Фишера — Тропша из каменного угля. Впоследствии от этого способа изготовления моторных топлив отказались, так как топливо, получаемое при переработке нефти, до последнего времени было экономически более выгодным.
Еще более эффективной представляется конверсия газа в дорогостоящие продукты тонкого органического синтеза.
Конверсию газа в моторное топливо можно в целом представить как превращение метана в более тяжелые углеводороды:
2nСН4 + ½nО2 = СnН2n + nН2О Из материального баланса брутто-реакции следует, что массовый выход конечного продукта не может превышать 89% (17, "https://referat.bookap.info").
Реакция напрямую неосуществима. Конверсия газа в жидкое топливо (КГЖ) проходит через ряд технологических стадий (рис.17). При этом в зависимости от того, какой конечный продукт необходимо получить, выбирается тот или иной вариант процесса.
Синтез Фишера-Тропша может рассматриваться как реакция восстановительной олигомеризации монооксида углерода, при которой образуются углерод-углеродные связи, и в общем виде она представляет собой сложную комбинацию ряда гетерогенных реакций, которую можно представить суммарными уравнениями:
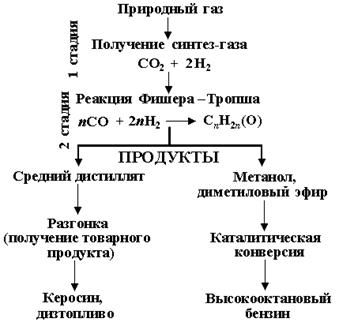
Рис. 17. Принципиальная схема конверсии синтез-газа в жидкие продукты (топливо).
Продуктами реакции являются алканы, алкены и кислородсодержащие соединения, то есть образуется сложная смесь продуктов, характерная для реакции полимеризации. Первичными продуктами синтеза Фишера-Тропша являются aи b-олефины, которые превращаются в алканы в результате последующего гидрирования. Природа применяемого катализатора, температура, соотношение СО и Н2 существенно сказываются на распределении продуктов. Так, при использовании железных катализаторов велика доля олефинов, тогда как в случае кобальтовых катализаторов, обладающих гидрирующей активностью, преимущественно образуются насыщенные углеводороды.
В настоящее время в качестве катализаторов синтеза Фишера-Тропша в зависимости от поставленных задач (повышение выхода бензиновой фракции, увеличение выхода низших олефинов и др.) используются как высокодисперсные железные катализаторы, нанесенные на оксиды алюминия, кремния и магния, так и биметаллические катализаторы: железо-марганцевые, железо-молибденовые и др.
За 70 лет с момента открытия синтеза не утихают споры по поводу механизма реакции. В настоящее время рассматриваются три различных механизма. Первый механизм, называемый карбидным, впервые предложенный Фишером и Тропшем и в дальнейшем нашедший поддержку у других исследователей, предполагает образование С-С-связей в результате олигомеризации метиленовых фрагментов на поверхности катализатора. На первой стадии происходит адсорбция СО и образуется поверхностный карбид, а кислород превращается в воду или СО2:
На второй стадии поверхностный карбид гидрируется с образованием фрагментов СНx (х = 1−3):
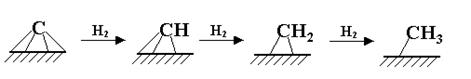
Удлинение цепи происходит в результате реакции поверхностных метила и метилена и далее путем внедрения метиленовых групп идет рост цепи:

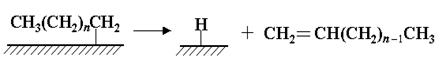
Стадия обрыва цепи происходит в результате десорбции алкена с поверхности катализатора:
Второй механизм, названный гидроксикарбеновым, предполагает также гидрирование координированного на металле СО с образованием поверхностных гидроксикарбеновых фрагментов, в результате конденсации которых и происходит образование С-С-связей:

Третий механизм, который можно назвать механизмом внедрения, предполагает образование С-С-связей в результате внедрения СО по связи металл-углерод (о способности СО к внедрению по связи металл-алкил говорилось выше):

Накоплен достаточно богатый экспериментальный материал, свидетельствующий в пользу того или иного варианта механизма, однако приходится констатировать, что к настоящему моменту невозможно сделать однозначный выбор между ними. Можно предположить, что в связи с большой важностью синтеза Фишера-Тропша исследования в этом направлении будут интенсивно продолжаться и мы станем свидетелями новых воззрений на механизмы протекающих реакций .

ПОЛУЧЕНИЕ СИНТЕТИЧЕСКОЙ НЕФТИ И СЖТ ПО ТЕХНОЛОГИИ ФИШЕРА-ТРОПША
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Процесс превращения синтез-газа (смеси монооксида углерода и водорода) в высшие углеводороды (синтез Фишeра-Тропша) был разработан еще в 20-х годах ХХ века в Германии с целью производства моторных топлив из угля. Вскоре после войны работы по процессу Фишeра-Тропша были возобновлены в ЮАР компанией South African Syntetic Oil Ltd. (SASOL), которая и в настоящее время использует этот процесс на четырех заводах в ЮАР, производя около 210 тыс. баррелей нефтяного эквивалента жидких углеводородов в сутки. ЮАР была долгое время единственной страной, в которой велись работы по разработке процесса GTL, поскольку синтетические топлива не могли конкурировать по цене с традиционными, полученными при нефтепереработке.
В последние 10-20 лет сырьем для этого процесса стал использоваться природный газ, на 85-95% состоящий из метана. Основные усилия сосредоточены на снижении температуры процесса, оптимизации состава синтез-газа (соотношении H2:СO) и создании компактных установок. В последнем случае появляется возможность квалифицированного использования низконапорного остаточного газа Западно-сибирских месторождений. Его можно было бы перерабатывать на месте с получением ценных продуктов (метанол, ДМЭ), которые гораздо удобнее транспортировать к местам использования.
Коммерческая переработка природного газа в высшие углеводороды осуществляется в три ступени, каждая из которых представляет, по сути, отдельное производство:
1. Получение синтез-газа из метана.
2. Конверсия синтез-газа в высшие углеводороды.
3. Разделение и конечная переработка продуктов.
Рассмотрим эти стадии по отдельности.
Синтез-газ сам по себе является ценнейшим полупродуктом органического синтеза: он служит источником чистых Н2 и СО, используется в производстве аммиака, метанола, диметилового эфира (ДМЭ), уксусной кислоты, в oкcoсинтезе и ряде других многотоннажных процессов.
Все современные технологии превращения метана в синтез-газ основаны на реакциях паровой конверсии метана (ПК), пароуглекислотной конверсии и парциальном окислении (ПО) (табл. 1).
Таблица 1. Реакции получения синтез-газа из природного газа
Паровая конверсия (ПК)
Углекислотная конверсия (УК)
Парциальное окисление (ПО)
Углекислотная конверсия (УК) из-за отсутствия стабильных катализаторов не нашла пока промышленного применения. Реакции (1) и (2) протекают на нанесенных катализаторах, как правило, никелевых, при температурах 700. 900 С и требуют значительного подвода тепла извне. Часть СО при этом неизбежно теряется в реакции водяного газа (4):
Пapциальное окисление метана (3), напротив, слабо экзотермическая реакция. При высоких температурах она протекает без катализатора и дает синтез-газ с соотношением СО : Н = 1: (1,7. 1,8). Часть углерода также теряется в виде сажи. Каталитическое окисление протекает при меньших температурах на никелевых катализаторах и дает в идеале соотношение CO : Н = 1: 2. Однако на практике процесс сопровождается реакциями (1) и (4), так что при высоких конверсиях метана реакционная смесь близка по составу к равновесной. Отметим, что при использовании в реакции парциального окисления чистого кислорода требуется сооружение станций низкотемпературного разделения воздуха, затраты на получение кислорода составляют около 40% от стоимости всего завода производства синтез-газа. Использование воздуха в качестве окислителя означает высокие производственные затраты на компримирование и нагрев балластного азoта. Подобные проекты, требующие сравнительно низких капитальных вложений, могут быть реальны при наличии дешевого местного газа.
Соотношение СО: Н2 в синтез-газе зависит от метода его получения и варьируется от 1:3 для паровой конверсии до 1:1 для углекислотной конверсии. Для разных процессов предпочтителен определенный количественный состав синтез-газа. В реакции синтеза углеводородов, в зависимости от катализатора, соотношение CО : Н2 = 1 : 1,5 или несколько выше. Корректировка состава синтез-газа может быть достигнута путем газоразделения, проведения реакции водяного газа или добавления водорода, полученного из других источников.
Большую техническую проблему в процессах получения синтез-газа составляет подвод и последующая утилизация значительного количества тепла в случае паровой конверсии метана или наоборот отвод его из печи парциального окисления. Проблемы теплопередачи решаются в процессах автотермического риформинга природного газа (АТР). Энергия, необходимая для реакции (1), обеспечивается реакцией (3) и полным сгоранием части метана. При этом снижено потребление кислорода и образование сажи по сравнению с процессами, основанными на ПО.
Успешными шагами в совершенствовании процесса стали обесceривание природного газа, адиабатический предриформинг, aвтотермический рифopминг и рекуперация тепла с выработкой пара высокого давления. Адиабатический реактор предварительного рифopминга P-2 превращает углеводороды С2+выше путем парового риформинга в смесь метана, СО2, СО и водорода:
Удаление высших углеводородов способствует более высокой температуре предварительного нагрева сырья АТР, тем самым снижая потребление кислорода. Реактор предварительного риформингa Р-2 загружается никелевым катализатором на керамической основе. Реактор Р-З автотермического риформинга состоит из камеры сгорания с горелкой и слоя катализатора. Природный газ, выходящий из реактора предварительного риформинга, сгорает с кислородом и паром в реакторе АТР. В первой части реактора АТР специально разработанная горелка обеспечивает надлежащее смешение сырьевых потоков, затем происходит сгорание в пламени турбулентной диффузии. Во второй части реактора Р-3 на никелевом катализаторе происходит сдвиг равновесия в сторону образования синтез-газа. Катализатор также способствует разрушению предшественников сажи, в основном олефинов и ацетиленовых углеводородов, которые образуются на предыдущем этапе сгорания. Таким образом, синтез-газ, выходящий с установки, полностью свободен от сажи и кислорода.
Процесс АТР используется для производства синтез-газa с конца 1950-х годов. Однако этот процесс постоянно совершенствовался. Типичная схема процесса производства синтез-газа с использованием АТР приведена на рисунке 1.
Рисунок 1 - Схема получения синтез-газа с использованием АТР: П-1 – печь; Р-1 - реактор обесceривания; Р-2 - реактор предварительного рифоpминга; P-3 - реактор автотермического рифоpмингa; Т-1 – теплообменник.
I - Природный газ; II - газ с установки синтеза Фишера-Тропша; III - пap; IV - кислород; V - вода, VI- синтез-газ.
Обеспечение требуемого мольного соотношения Н2 : СО при автотермическом риформинге может быть достигнуто корректировкой температур предварительного нагрева и выхода смеси из реактора АТР, рециркуляцией СО2, высоким отношением Н : С в рециркулирующем газе с установки Фишера-Тропша.
Другим важным параметром для регулирования отношения Н2 : СО является работа с очень низким отношением водяной пар: углерод.
Установки с автотермическим риформингом считаются наиболее экономичными.
Получение синтез-газа обходится весьма дорого – капитальные затраты по разным оценкам составляют от 40 до 70 % общих вложений в производство GTL. Применение чистого кислорода на стадии получения синтез-газа сопряжено с повышенной опасностью.
Российскими учеными ведутся интенсивные исследования в области получения СЖТ с использованием синтеза Фишера-Тропша. Одним из перспективных направлений получения СЖТ является технология Института нефтехимического синтеза им. А.В. Топчиева РАН (ИНХС), в которой используют ракетный двигатель как химический реактор на первой стадии технологической цепи для получения синтез-газа парциальным окислением метана или ПНГ кислородом воздуха. Такой химический реактор получил название ВТР – высокотемпературный реактор.
Высокая энергоемкость и требование высоких температур в процессе парциального окисления компенсируется получением необходимой температуры непосредственно в реакторе, что исключает теплопотери, характеризуется простотой конструкции, низкими эксплуатационными расходами, а также возможностью утилизации выделяющейся энегрии.
Учеными ИНХС для определения оптимальных технологических режимов получения синтез-газа из метана или ПНГ были проведены теоретические исследования высокотемпературного процесса парциального окисления. ПНГ содержит, кроме метана, более тяжелые углеводороды. В результате проведенных исследований в ИНХС был определен диапазон оптимальных технологических режимов высокотемпературного реактора при получении синте-газа из углеводородов:
- оптимальная температура реакционной зоны 1100. 1200 С, и для устранения эффективного образования окислов азота температура не должна превышать 1427 С;
- давление в реакционной камере существенно не влияет на выход синтез-газа и определяется требованием к давлению в последующей технологической цепи;
- время пребывания реагирующих газов не менее 100 мс;
- снижать температуру реакционной зоны до 527. 727 С необходимо за время не более чем 10 мс. При использовании воздуха в качестве окислителя должно быть 0,4. 0,45 и воздух должен быть нагрет не ниже 400 С;
- при использовании воздуха в качестве окислителя для подавления образования углерода (сажи) необходим предварительный нагрев воздуха до 327. 427 °С;
- введение в высокотемпературную зону воды будет приводить к увеличению отношения Н2 : СО и подавлению образования углерода (сажи) за и счет реакций:
- в одном агрегате удается совместить компрессор для сжатия рабочей смеси, камеру сгорания и реактор, в котором осуществляется конверсия метана, охладитель получившегося синтез-газа от температуры 1927 С до 347. 477 C с одновременной выработкой электроэнергии электрогенератором, находящимся на валу дизеля. Высокие параметры процесса: давление до 10. 15 МПа и температура свыше 1927 С - обеспечивают скорость прохождения парциального окисления метана за 10 -2 . 10 -3 с. В этом плане рабочий цилиндр двигателя получается совершенно уникальным элементом по своей универсальности, так как в нем происходят все вышеперечисленные процессы;
- модельный ряд (типоразмеры) производимых сегодня в России и в мире дизельных двигателей настолько велик, что на их базе можно создавать XPC с производительностью по синтез-газу oт 10 нм 3 /ч до 10. 20 тыс. нм 3 /ч, не создавая новых специальных агрегатов;
- использование тепла экзотермической химической реакции парциального окисления осуществляется в самой удобной форме - выработке электроэнергии. Таким образом, за вычетом механических потерь, потерь тепла в систему охлаждения и затрат энергии на сжатие вся энергия газа идет на совершение полезной работы и выработку целевого продукта - синтез-газа. Поскольку все это происходит в одном агрегате, потери минимальны. Весь процесс от подачи топливовоздушной смеси до выхлопа готового синтез-газа происходит при скорости вращения вала двигателя 1500 оборотов в минуту и даже более, поэтому процесс близок к адиабатическому;
- дизель может в режиме XPC работать как с наддувом, так и без него; это дает возможность использовать газ любого давления от 0,1. 0,5 МПа до 10 МПа;
- даже самые крупные транспортные дизельные агрегаты достаточно компактны по сравнению с традиционными установками по получению синтез-газа.
Превращение синтез-газа в высшие углеводороды на железных и кобальтовых катализаторах было открыто в 1925 году в лаборатории исследования топлив Института угля в Мюльгейме (Германии) Францем Фишером и Гансом Тропшем и носит их имена.
Продуктами реакции являются алканы, алкены и кислородсодержащие соединения, т.е. образуется сложная смесь продуктов, характерная для реакции полимеризации. Первичными продуктами синтеза Фишера-Тропша являются - и -олефины, которые превращаются в алканы в результате их последующего гидрирования. Природа применяемого катализатора, температура, соотношение СО и Н2 существенно сказываются на распределении продуктов. Так, при использовании железных катализаторов велика доля олефинов, тогда как в случае кобальтовых катализаторов, обладающих гидрирующей активностью, преимущественно образуются насыщенные углеводороды.
Со времени открытия синтеза было предложено три механизма их протекания. Первый механизм, называемый карбидным, впервые предложенный Фишером и Тропшем, предполагает образование С-С связей в результате олигомеризации метиленовых фрагментов на поверхности металла.
Второй механизм, названный гидроксикарбеновым, предполагает также гидрирование координированного на металле СО с образованием поверхностных гидроксикарбеновых фрагментов, в результате конденсации которых и происходит образование С-С связей.
Третий механизм, который можно назвать механизмом внедрения, предполагает образование С-С связей в результате внедрения СО по связи металл-углерод.
Предложенные три схемы механизма, в основном, различаются только промежуточно образующихся СН2-фрагментов. В схеме Фишера-Тропша СН2-фрагменты участвуют в стадии инициирования и роста цепи. В схеме второго механизма СН2-фрагменты являются только инициаторами.
В технологии, разработанной Ф. Фишером и Г. Тропшем, используются катализаторы на основе железа или кобальта. Реакцию ведут при температурах 180…360 С и давлении 1,0. 4,5 МПа. Природа применяемого катализатора, температура, соотношение СО и Н2 существенно сказываются на составе продуктов синтеза. В целом можно сказать, что продуктами синтeза являются парафины и -олефины основном линейного строения и широкого фракционного состава, от С1 до С100 и выше:
Экзотермический эффект этих реакций составляет 165 кДж/моль прореагировавшего СО. Также могут образовываться кислородсодержащие соединения - спирты, альдегиды, кетоны и карбоновые кислоты, а при высокой температуре - бензол и его гомологи.
Синтез Фишера -Тропша рассматривают как реакцию гидрополимеризации СО, в ходе которой образуется широкая углеводородная фракция. В рамках этой модели молекулярно-массовое распределение продуктов однозначно определяется соотношением констант скорости роста и обрыва цепи, т.е. величиной вероятности роста цепи .
Величина может находиться в пределах от 0 до 1 и отражает весовой состав продуктов: при низких значениях образуются преимущественно легкие углеводороды, при высоких - тяжелые. Так, из всех углеводородов только метан может быть получен со 100%-ной селективностью. Селективность по бензиновой фракции С5…С10 не может превысить 45%, по дизельной фракции С11…С18 - 30%. Важно отметить, что твердые парафины могут быть получены с селективностью, приближающейся к 100% при стремлении к единице.
Из всех металлов, которые проявляют высокую активность в синтезе Фишера-Тропша, в промышленности применяют железо и кобальт. На никелевых катализаторах образуется в основном метан, на рутениевых катализаторах только алканы с высокой молекулярной массой (полиметилен). Другие металлы VIII группы проявляют низкую активность.
Основным отличием кобальтовых систем является их большая по сравнению с железом гидрирующая активность и инертность в реакции водяного газа:
Это предопределяет условия эксплуатации и спектр получаемых продуктов. Кобальтовые катализаторы могут использоваться в низкотемпературном процессе при 180…240 С. В этих условиях продукты состоят главным образом из алканов линейного строения, с незначительным содержанием -олефинов (в основном в легких фракциях) и изоалканов. Повышение температуры приводит к резкому росту выхода метана по реакции (3) и поэтому недопустимо.
Железные катализаторы могут работать в более широком температур ном интервале, до 320. 350 С, давая при высокой температуре в основном легкие продукты с вероятностью роста цепи 0,67. 0,68. При этом даже при 340 С cелективность по метану невысока. В продуктах обнаруживается значительное количество олефинов и кислородсодержащих соединений - спиртов, альдегидов, кетонов и карбоновых кислот. Железо катализирует реакцию водяного газа, поэтому часть СО непроизводительно конвертирует в СО2. С другой стороны, эта реакция служит дополнительным источником водорода, так что железные катализаторы предпочтительнее кобальтовых для работы на бедном синтез-газе с низким содержанием водорода.
Вода, образующаяся в синтезе в стexиометрических количествах, оказывает сильное негативное влияние на кинетику реакции в присутствии железных катализаторов, тогда как кобальтовые лишены этого недостатка. Высокая степень превращения СО ведет к увеличению парциального давления реакционной воды, что снижает скорость реакции. Как следствие, конверсия СО за проход в реакторах с кобальтовым катализатором может быть выше, чем с железным при прочих равных условиях. Дешевизна железных катализаторов по сравнению с кобальтовыми в известной степени компенсируется большей стабильностью последних.
Синтетическая нефть и моторные топлива. Продукт синтеза Фишера-Тропша в общем случае - широкая фракция углеводородов преимущественно линейного строения, которую и называют синтетической нефтью. Непредельные углеводороды представлены главным образом -oлефинами, содержание ароматических углеводородов минимально. Однако имеется возможность варьировать фракционный состав в довольно широких пределах. Главным управляющим параметром здесь является температура синтеза. В низкотемпературном процессе содержание твердых парафинов в катализате может составлять 50% и выше, в высокотемпературном преобладают углеводороды бензиновой фракции, причем содержание олефинов в них достигает 70% (табл.2).
Таблица 2. Состав продуктов синтеза Фишера-Тропша на железном катализаторе
Читайте также:

