Шартты патогенді энтеробактериялар реферат
Обновлено: 02.07.2024
Для цитирования: Шульпекова Ю.О. Избыточный бактериальный рост в кишечнике: патогенетические особенности и лечебные подходы. РМЖ. 2003;5:281.
ММА имени И.М. Сеченова
Основная часть микроорганизмов поступает в просвет желудочно–кишечного тракта из ротоглотки и с пищей.
В составе нормальной микрофлоры желудочно–кишечного тракта выделено более 400 видов непатогенных аэробных и факультативно анаэробных бактерий.
Состав микрофлоры неодинаков на всем протяжении желудочно–кишечного тракта. В верхнем и среднем отделах тонкой кишки популяция микроорганизмов сравнительно небольшая (в начале тощей кишки их содержание не более 100 микроорганизмов на 1 мл содержимого) и включает преимущественно грамположительные факультативные аэробы, небольшое количество анаэробов, дрожжей и грибов.
По мере приближения к илеоцекальному клапану состав микролоры начинает все более походить на популяцию толстой кишки. В дистальном отделе подвздошной кишки содержание микробов составляет 10 5 –10 8 /г кишечного содержимого.
Наибольшее содержание микроорганизмов наблюдается в толстой кишке. Здесь их концентрация достигает 10 10 –10 11 и более на 1 г содержимого.
Микробная популяция играет важнейшую роль во внутрипросветном пищеварении, в частности, участвует в переваривании пищевых волокон (целлюлозы), ферментативном расщеплении белков, высокомолекулярных углеводов, жиров и в процессе метаболизма вырабатывает ряд полезных для организма веществ.
Главный представитель анаэробной кишечной микрофлоры – бифидобактерии – синтезируют аминокислоты, белки, витамины В1, В2, В6, В12, викасол, никотиновую и фолиевую кислоты. Выдвинуто предположение, что некоторые вещества, вырабатываемые бифидобактериями, обладают антиоксидантными свойствами и способствуют снижению риска заболеваемости раком толстой кишки.
Среди аэробных микроорганизмов важнейшая роль в метаболических процессах принадлежит кишечной палочке, обладающей большим спектром функциональных свойств. E.coli вырабатывает несколько витаминов (тиамин, рибофлавин, пиридоксин, витамины В12, К, никотиновую, фолиевую, пантотеновую кислоты), участвует в обмене холестерина, билирубина, холина, желчных и жирных кислот, и, опосредованно влияет на всасывание железа и кальция.
Образующиеся под влиянием микрофоры продукты метаболизма белка (индол, фенол, скатол) оказывают регулирующее воздействие на перистальтическую активность кишечника.
В последнее время интенсивно изучается роль кишечной микрофлоры в формировании иммунологической реактивности и иммунологической толерантности организма.
Представители нормальной кишечной микрофлоры вырабатывают вещества с антибактериальной активностью (такие как бактериокины и короткоцепочечные жирные кислоты, лактоферрин, лизоцим), которые предотвращают внедрение патогенных микроорганизмов и подавляют избыточное размножение условно–патогенной флоры. Кишечные палочки, энтерококки, бифидобактерии и лактобациллы обладают наиболее выраженными антагонистическими свойствами в отношении патогенных штаммов.
Продуктами метаболизма молочнокислых бактерий (бифидобактерий, лактобацилл) и бактероидов являются молочная, уксусная, янтарная, муравьиная кислоты. Это обеспечивает поддержание показателя рН внутрикишечного содержимого на уровне 4,0–3,8, благодаря чему тормозится рост и размножение патогенных и гнилостных микроорганизмов в ЖКТ.
Микрофлора желудочно–кишечного тракта активно участвует в химических превращениях многих веществ эндогенного и экзогенного происхождения, в частности, лекарств. В процессе кишечно–печеночной циркуляции вещества, поступающие из просвета кишечника в печень, подвергаются конъюгации с глюкуронатом, сульфатом и другими молекулярными остатками, и многие из них затем вновь выделяются с желчью. В просвете кишечника под действием ферментов кишечной микрофлоры они подвергаются деконъюгации и другим изменениям, после чего вновь всасываются и возвращаются в печень по воротной вене.
Количественный и качественный состав кишечной микрофлоры может изменяться под воздействием различных факторов эндогенного или экзогенного происхождения. Однако это изменение следует рассматривать как вторичное по отношению к первопричинному фактору.
Избыточный бактериальный рост в кишечнике (в англоязычной литературе – bacterial overgrowth) – обусловлен нарушением качественного и количественного состава микробного биоценоза кишечника, размножением условно–патогенных бактерий в количестве, не свойственном здоровому человеку. Нельзя забывать, что избыточный бактериальный рост в кишечнике и связанные с ним клинические проявления представляет собой не самостоятельную нозологическую форму, а синдром.
Фоном для развития синдрома избыточного бактериального роста служат различные состояния, сопровождающиеся нарушением переваривания пищи, пассажа внутрипросветного содержимого; изменением иммунологической реактивности организма, ятрогенные воздействия на микрофлору кишечника.
При различных состояниях, сопровождающихся нарушением переваривания и всасывания пищи (врожденный дефицит ферментов, панкреатит, глютеновая энтеропатия, энтериты), невсосавшиеся питательные вещества служат питательной средой для избыточного размножения бактерий.
При анацидных состояниях и иммунодефицитах утрачивается регулирующее влияние со стороны организма на поддержание состава кишечной микрофлоры.
Применение антибиотиков, кортикостероидов, цитостатиков, особенно у ослабленных и пожилых пациентов, сопровождаются вмешательством во взаимоотношения микрофлоры и макроорганизма.
Пожалуй, в качестве единственной самостоятельной нозологической формы избыточного бактериального роста в кишечнике выступает псевдомембранозный колит, который обусловлен избыточным размножением Clostridium difficile – облигатно–анаэробной грамположительной спорообразующей бактерии, обладающей природной устойчивостью к большинству широко применяемых антибиотиков. Популяция C.difficile в составе нормальной микрофлоры кишечника составляет примерно 0,01–0,001%; она существенно возрастает (до 15–40%) при приеме антибиотиков, угнетающих рост штаммов кишечной флоры, которые в норме подавляют жизнедеятельность C.difficile (в первую очередь, клиндамицина, ампициллина, цефалоспоринов).
Избыточное размножение бактерий в тонкой кишке является дополнительным фактором, поддерживающим воспаление слизистой оболочки, снижающим продукцию ферментов (в наибольшей степени – лактазы) и усугубляющим нарушение переваривания и всасывания. Эти изменения обусловливают развитие таких симптомов, как коликообразные боли в околопупочной области, метеоризм, диарея, похудание.
При преимущественном вовлечении в процесс толстой кишки пациенты предъявляют жалобы на неоформленный стул, метеоризм, ноющие боли в животе.
Диагностика синдрома избыточного бактериального роста подразумевает анализ картины основного заболевания, с выявлением возможной причины нарушения микробного биоценоза кишечника. Проводится дополнительное обследование, которое может включать эндоскопическое, рентгенологическое исследование кишечника для выявления нарушений анатомического строения, оценки перистальтики желудочно–кишечного тракта; биопсию тонкой кишки – для установления диагноза энтерита, энтеропатии, диагностики ферментопатий (к сожалению, возможности проведения этого исследования в нашей стране ограничены) и др. Мало доступными на сегодняшний день, но точными методами диагностики избыточного бактериального роста являются аспирация содержимого тонкой кишки с немедленным посевом аспирата на питательную среду, а также неинвазивный дыхательный водородный тест с лактулозой. Посев кала, ранее использовавшийся в нашей стране как метод оценки микробного биоценоза кишечника, признан неинформативным, поскольку даже при максимальном приближении к правилам проведения микробиологических исследований может дать представление лишь о микробном составе дистального отдела толстой кишки.
Перед тем как непосредственно приступить к лечению синдрома избыточного бактериального роста, необходимо определить причину развития нарушений микробного биоценоза и, по возможности, устранить влияние данного фактора. Например, назначить пациенту противовоспалительную, заместительную ферментную терапию, использовать возможности по нормализации перистальтической активности кишечника.
Изменение характера питания позволяет воздействовать на микрофлору физиологическим путем. Однако диетические предписания необходимо давать с учетом основного заболевания. В любом случае, при избыточном бактериальном росте в кишечнике показано ограничение потребления легкоусвояемых углеводов и исключение потребления молока (особенно пресного). При отсутствии противопоказаний целесообразно потребление овощей, фруктов и ягод, обладающих бактерицидным действием (редька, редис, лук, чеснок, хрен, морковь, малина, клубника, земляника, черника, абрикосы, яблоки, черноплодная рябина, сок граната, гвоздика, корица, лавровый лист).
Однако при тяжелых формах избыточного бактериального роста в кишечнике показана антибактериальная терапия (назначение метронидазола по 400 мг 3 раза в день в течение недели; при неэффективности метронидазола к лечению целесообразно добавить тетрациклин по 250 мг 4 раза в день в течение 2 недель). Антибиотики резерва – ципрофлоксацин (по 500 мг 2 раза в день) и ванкомицин (по 125 мг 4 раза в день). Лечение псевдомембранозного колита проводится по определенным схемам и не рассматривается в данной статье вследствие обособленности этого заболевания.
В ряде случаев для подавления условно-патогенных микроорганизмов используются бактериофаги (стафилококковый и коли–протейный) по 50 мл 2 раза в день за час до еды в течение 3–4 дней, проводится 2–3 курса с 3–дневным перерывом.
Не менее важным и, зачастую, основным направлением лечения является воссоздание условий, благоприятных для восстановления нормальной микрофлоры. Лекарственные препараты, обладающие подобными свойствами, носят название пробиотиков.
Некоторое время назад в качестве пробиотиков особенно широко использовались биологические препараты для перорального приема, содержащие в своем составе бифидобактерии, лактобациллы, кишечные палочки с полезными сойствами. Необходимо учитывать, что микробы, вводимые в составе лекарственных препаратов, сами по себе надолго не приживаются в кишечнике и элиминируются спустя 2–3 недели. Основой лечебного действия подобных препаратов является их способность временно поддерживать ферментативную активность и защитные свойства (колициногенность) собственной микрофлоры кишечника. Ниже охарактеризованы некоторые из наиболее известных препаратов.
Благоприятные условия для размножения бифидобактерий создает дисахарид лактулоза, обладающий также слабительными и аммонийсвязывающими свойствами. Он служит питательной средой для размножения молочнокислых бактерий и источником выработки ими молочной кислоты, снижающей рН кишечного содержимого. К существенным недостаткам лактулозы относятся нередко развивающиеся вздутие живота и диарея с потерей электролитов (поэтому назначение лактулозы предпочтительно пациентам, страдающим запором). Лактулоза противопоказана при галактоземии. Доза сиропа лактулозы для взрослых варьирует от 15 до 45 мл в сутки (в 2–3 приема).
Начальная доза для взрослых составляет по 40–60 капель 3 раза в день; для детей – по 20–40 капель 3 раза в день; для детей грудного возраста – по 15–30 капель 3 раза в день. По мере клинического улучшения доза может быть уменьшена наполовину.
1. Вудли М., Уэлан А., ред. Терапевтический справочник Вашингтонского университета. Пер. с англ. – М.: Практика, 1995г.
2. Гребенев А.Л., Мягкова Л.П. Болезни кишечника. – М.: Медицина, 1994 г.
3. Денисов И.Н., Кулаков В.И., Хаитов Р.М., гл. ред. Клинические рекомендации для практикующих врачей, основанные на доказательной медицине. – М.: ГЭОТАР–МЕД, 2001г.
5. Котельников Г.П., Яковлев О.Г., ред. Практическая гериатрия: Руководство для врачей. – Самара: Самарский Дом печати, 1995г.
6. Fauci A.S., Braunwald E., Isselbacher K.J. et al., ed. Harrison’s Principles of Internal Medicine. 14th edition – Copyright (c) 1998 by The McGraw–Hill Companies, Inc., USA.
7. Herfindal Е.Т., Gourley D.R., ed. Textbook for therapeutics: drug and disease managment – 6th ed. – Copyright (c) 1996 Williams & Wilkins, Baltimore, USA.
.jpg)
В ближайших статьях мы постараемся осветить все оставшееся семейство, как, во-первых, одно из самых проблемных в плане развития резистентности к антимикробным препаратам, а во-вторых – как возбудителей, наиболее часто являющихся причиной внутрибольничных инфекций.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор: врач – клинический фармаколог Трубачева Е.С.
Morganella spp. и Proteus spp.
Особо выдающихся представителей семейства Enterobacteriaceae мы уже разбирали в отдельных статьях, а именно представительницу рода Esherichia – кишечную палочку E.coli, а также одну из представительниц клебсиелл – Klebsiella pneumonia. В ближайших статьях мы постараемся осветить все оставшееся семейство, как, во-первых, одно из самых проблемных в плане развития резистентности к антимикробным препаратам, а во-вторых – как возбудителей, наиболее часто являющихся причиной внутрибольничных инфекций.
Микробиологические аспекты
Основными клинически значимыми представителями родов семейства Enterobacteriaceae, вызывающими заболевания у человека, являются:
Естественно совсем уж экзотику мы рассматривать не станем, но по наиболее часто встречающимся представителям обязательно пробежимся.
Клинические аспекты
Почему данное семейство так актуально? Наверное, потому, что почти ни одна нозология не обходится без его представителей. В самом широком смысле семейство Enterobacteriaceae является причиной следующих заболеваний:
- со стороны нервной системы: менингит, энцефалит, множественный неврит;
- со стороны мочевыводящих путей –пиелит, пиелонефрит, цистит;
- со стороны желудочно-кишечного тракта – аппендицит, холецистит, панкреатит, которые со своей стороны могут осложниться перитонитом;
- пневмонии, в основном связанные с медицинскими вмешательствами;
- со стороны ЛОР-органов: отиты, назофарингиты;
- со стороны глаз – конъюнктивиты;
- сепсис, как исход всех вышеуказанных состояний, чаще всего уже носящий полимикробный характер.
Как мы видим, наши знакомые отметились практически везде. Но надо обязательно помнить, что выявление вышеуказанных представителей у здоровых людей из респираторного тракта, урогенитального и уж тем более желудочно-кишечного ни в коем случае не говорит о том, что человек чем-то болен, так как в большинстве своем эти микробы являются представителями нормальной микрофлоры, а не все люди умеют мыть руки, особенно летом.
Когда можно думать о наличии бактериальной патологии? Во-первых, когда имеется четкая клиника, во-вторых, когда микробы выделены из стерильных в норме сред, таких как кровь и ликвор, брюшная или плевральная полость, точнее, экссудат оттуда и, в-третьих, когда микроорганизмы выделены в клинически значимых концентрациях (тут в помощь будет ваша бак. лаборатория).
Стоит отметить еще один немаловажный момент – не все представители семейства Enterobacteriaceae умеют жить вне организма человека, и поэтому не размножаются во внешней среде, а потому обнаружение оных на пищевых продуктах и всевозможных поверхностях в лечебных учреждениях говорит о фекальном загрязнении, проще говоря, о неумении обрабатывать руки после посещения туалетной комнаты. Одним из таких микробов-детекторов является кишечная палочка, и стоит ее поймать даже не на руках персонала, а, например, на компьютерной мышке, как дальше можно уже ничего не искать, а начинать очередной этап избиения младенцев, пардон, обучения правилам асептики и антисептики, в частности, обработки рук.
Но давайте перейдем к частностям – и первым микроорганизмом, который будем сегодня рассматривать, станет:
Morganella spp.
Зверюшка названа так в честь своего первооткрывателя Гарри Р. Моргана.
Начнем традиционно с микробиологических аспектов
Семейство морганелл включает единственный вид M. morganii, включающий два подвида M. morganii и M. sibonii, которые различаются только ферментацией трегалозы.
Морганеллы являются представителями нормальной микрофлоры как человека, так и животных, а потому могут присутствовать в качестве сапрофитов в окружающей (внебольничной!) среде.
Морганеллы имеют довольно сложные отношения с антибактериальными препаратами и обладают природной резистентностью к:
- пенициллинам,
- цефалоспоринам 1 и 2 поколения,
- макролидам, .
Проявляют высокую чувствительность к:
- аминогликозидам, ,
- цефалоспоринам 3 и 4-го поколения,
- карбопенемам,
- фторхинолонам
Клинические аспекты
Как говорилось выше, морганеллы являются частью нормальной микрофлоры человека, крайне редко вызывая инфекционные заболевания. Чаще всего они являются возбудителями осложненных инфекций мочевыводящих путей.
Факторами риска развития инфекции являются:
- пожилой возраст,
- иммунодефициты любой этиологии,
- длительное лечение в стационаре,
- установленные мочевые катетеры.
В качестве механизмов резистентности морганеллы способны продуцировать бета-лактамазы, чем и объясняется их природная устойчивость к пенициллинам и цефалоспоринам 1-2 поколений. При нерациональном использовании антибиотиков они начинают вырабатывать бета-лактамазы расширенного спектра и факторы устойчивости к фторхинолонам, которыми довольно бодро делятся с соседями по семейству Enterobacteriaceae. Отдельно стоит отметить способность отдельных штаммов морганелл к резистентности к имипенему.
Какие заболевания вызывают чаще всего:
- инфекции мочевыводящих путей,
- сепсис, чаще всего уросепсис полимикробной этиологии,
- хирургические инфекции, связанные с оказанием медицинской помощи (они же нозокомиальные),
- редко, но вызывают септические артриты,
- крайне редко вызывают менингиты, эндофтальмиты, перикардиты,
- неонатальный сепсис и хориоамнионит.
Терапевтические аспекты
Антибактериальная терапия будет полностью зависеть от результата из микробиологической лаборатории. Повторимся еще раз, микроб изначально умеет вырабатывать бета-лактамазы, а потому в случае развития осложненных инфекции мочевыводящих путей, которые чаще всего уже не связанны с кишечной палочкой, препаратами выбора становятся карбопенемы (имипенем, если штамм к нему чувствителен, или меропенем), дозирование которых проводится с учетом клиренса креатинина. Длительность лечения должна быть не менее 7 дней. В качестве альтернативы можно использовать цефалоспорин 4-го поколения Цефипим каждые 8 часов или фторхинолоны.
Аминогликозиды, несмотря на чувствительность к оным, при лечении заболеваний мочевыводящих путей лучше не применять в виду их нефро- и отоксичности, и по этой же причине их невозможно будет использовать около трех месяцев после проведенной терапии, например, в лечении синегнойной инфекции. Цефалоспорины третьего поколения тоже применять не стоит, так как морганеллы довольно быстро обзаводятся бета-лактамазами расширенного спектра, которые, как мы помним, эту генерацию препаратов быстро инактивируют.
Proteus spp.
Микробиологические аспекты
Протей долгое время был практически родным отцом морганеллы, так как последняя рассматривалась как один из видов рода протей. Этот род примечателен тем, что занимает почетное второе место по выявляемости после кишечной палочки в семействе Enterobacteriaceae.
В данный момент представителями рода протей являются P. mirabilis, вызывающий порядка 90% инфекционных заболеваний, а также P. vulgaris и P. penneri.
Клинические аспекты
Протеи выступают возбудителями порядка 10% неосложненных инфекций мочевыводящих путей, с чем могут быть связаны неудачи в лечении последних с использованием аминопенициллинов.
Как и все клинически значимые возбудители семейства Enterobacteriaceae, протей является возбудителем нозокомиальных инфекций, таких как пневмония, вплоть до сепсиса. Кроме того выступает возбудителем интраабдоминальных, а также хирургических инфекций кожи и мягких тканей, сепсиса, связанного с медицинскими вмешательствами как последствий нозокомиальной пневмонии в результате недостаточной дезинфекции, например, бронхоскопов.
Таким образом, мы видим, что, как и в предыдущем случае, проще правильно помыть руки и обработать инструменты, чем лечить это все с учетом природной и приобретенной резистентности.
Терапевтические аспекты
Как и в случае с морганеллой, нам просто необходим результат микробиологического исследования с определением чувствительности по МПК возбудителя либо результаты микробиологического мониторинга, которые помогут предположить зверей в случае неудачи ранее проводимого лечения.
В случае ампициллин-чувствительного P.mirabilis именно ампициллин может выступать препаратом первой линии. Кроме того, возможно использование цефуроксима и фторхинолонов. Обязательным аспектом лечения является его длительность. В случае неосложненных инфекций мочевыводящих путей (цистита) – не менее 3 дней, пиелонефрита – 10-14 дней, осложненных инфекций – 10-21 день. Сепсис является состоянием, требующим индивидуального подхода, но лечим не менее 14 дней.
На этом на сегодня мы закончим, но повторим одну базовую и, чего уж, наиважнейшую истину: в лечении инфекций, связанных с любым представителем семейства Enterobacteriaceae, самым главным будет являться профилактика. А именно правильное и тщательное мытье рук. Обеспечим мытье рук, не будет большинства проблем с инфекциями, вызванными указанным семейством.
Что такое дизентерия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
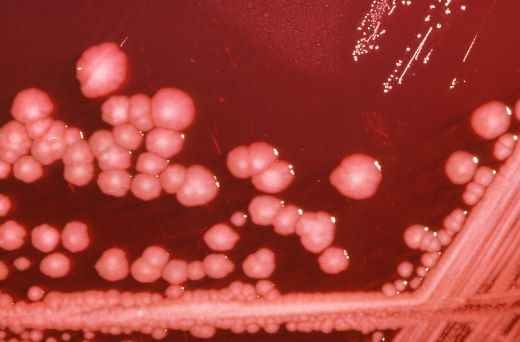
Шигеллёзы, или дизентерия — это группа острых/хронических заболеваний, вызываемых бактериями рода Шигелла, которые поражают желудочно-кишечный тракт (преимущественно дистальный отдел толстой кишки). Манифестные формы (клиническая картина) дизентерии: синдром общей инфекционной интоксикации, синдром поражения желудочно-кишечного тракта (дистальный колит), синдром обезвоживания. При отсутствии адекватного лечения приводит к серьёзным осложнениям и хронизации.
Возбудитель дизентерии
семейство — кишечные бактерии (Enterobacteriaceae)
род — Шигелла (Shigella)
виды — 4 основных:
- Dysenteriae (серовары — шигелла Григорьева-Шига, Штутцера-Шмитца, Ларджа-Сакса);
- Flexneri (Флекснера);
- Boydii (Боудии);
- Sonnei (Зонне).
Являются факультативно-анаэробными (способны существовать как при наличии, так и при отсутствии кислорода), граммотрицательными, неподвижными палочками. Хорошо растут на обычных питательных средах.
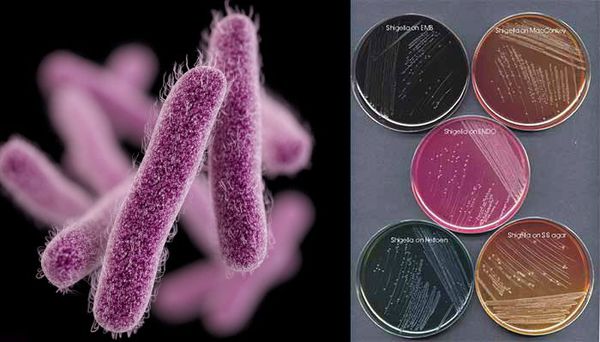
Имеют О-антиген (серологическая специфичность) и К-антиген (оболочечная структура). Клеточная стенка частично состоит из эндотоксина (липополисахарида), высвобождающегося при гибели микроорганизма. Бактерии вида Shigella Dysenteriae серовара Григорьева-Шига продуцируют высокоактивный цитотоксин, который нарушает синтез белка рибосомами клеток кишечного эпителия. Цитотоксин в совокупности с энтеротоксином (усиливающим секрецию жидкости и солей в просвет кишки) и нейротоксином (оказывающим нейротоксическое действие на сплетения Ауэрбаха) образует экзотоксином — токсин, выделяемый в процессе жизнедеятельности шигелл (Цитотоксин + энтеротоксин + нейротоксин = экзотоксин). Также у данной группы микроорганизмов происходит выделение гемолизинов — веществ, разрушающих эндотелий капилляров и вызывающий ишемию в тканях кишечника).
Факторы патогенности шигелл (механизм приспособления бактерий):
- адгезия (прикрепление к слизистой оболочке кишечника);
- инвазия (проникновение в эпителиальные клетки слизистой оболочки толстого кишечника);
- токсинообразование;
- внутриклеточное размножение.
Тинкториальные свойства (особенности микроорганизмов при окрашивании): быстро изменяют чувствительность к антибактериальным препаратам. Характерна высокая выживаемость во внешней среде (в воде, почве и пище при комнатной температуре сохраняются до 14 дней, в канализационных стоках — до 30 дней, при благоприятных условиях могут быть жизнеспособны до 4 месяцев). Способны к размножению в пищевых продуктах. При воздействии УФО (ультрафиолетового облучения) погибают за 10 минут, в 1% феноле — за 30 минут, при кипячении — мгновенно.
Интересная особенность: чем выше ферментативная активность возбудителя дизентерии, тем ниже вирулентность (минимальная доза возбудителя, способная заразить человека) и наоборот. [3] [6]
Эпидемиология
Антропоноз (повсеместное распространение).
Источник инфекции — человек (больной, носитель и лица с субклинической формой заболевания).
Минимальная инфицирующая доза для бактерии Григорьева-Шига — 10 микробных тел в 1 грамме вещества, для Флекснера — 10 2 бактерий, для Зонне — от 10 7 .
Длительное время в РФ превалировали случаи заражения, вызванные шигеллой Флекснера 2а, однако в настоящее время ввиду широкого развития туризма длительного преобладания какой-либо формы нет.
Механизм передачи — фекально-оральный (пищевой, водный, контактно-бытовой), из них преимущественно:
- Григорьева-Шига (контактно-бытовой путь);
- Зонне (с молоком и молочными продуктами);
- Флекснера (водный путь);
- Дизентериа (пищевой путь).
Наибольшую опасность представляют работники питания и водоснабжения. Больные заразны с начала болезни (конца инкубационного периода) и до трёх недель болезни.
Иммунитет непродолжителен и моноспецифичен (вырабатывается только к одному серотипу, который вызвал заболевание). [1] [4] [5]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы дизентерии
Инкубационный период — от 1 до 7 дней.
Начало заболевания острое (развитие основных синдромов наблюдается в первые сутки заболевания), характерна лихорадка постоянного типа.
Еще не так давно считалось, что гастрит вызывают неправильное питание, еда всухомятку, стрессы и отсутствие горячего супа на обед. Потом ученые обнаружили связь этой болезни с бактерией хеликобактер пилори — и с тех пор подход к лечению заболеваний ЖКТ кардинально изменился.
Можно ли заразиться через посуду в ресторане, вызывает ли хеликобактер рак и нужно ли избавляться от бактерии, которая живет в организме 80% белорусов, рассказал врач-гастроэнтеролог с 40-летним опытом работы Георгий Матвеевич Усов.

Георгий Усов,
врач-гастроэнтеролог высшей категории
Минского клинического консультативно-диагностического центра,
кандидат медицинских наук
— Что такое хеликобактер? Это патогенная бактерия или условно-патогенная?
— Хеликобактер пилори (Helicobacter pylori) — бактерия, которая была открыта австралийскими учеными Робином Уорреном и Барри Маршаллом. За это открытие в 2005 году они получили Нобелевскую премию.
Хеликобактер — патогенная бактерия. Наличие ее в организме человека приводит к поражению слизистой оболочки желудка и двенадцатиперстной кишки и развитию таких заболеваний, как хронический гастрит, язва желудка и двенадцатиперстной кишки, рак желудка, мальтома желудка.
Сегодня хеликобактер — самая распространенная хроническая инфекция в мире.
— Какие факторы в таком случае провоцируют развитие гастрита, язвы, рака? И могут ли эти болезни возникнуть без участия хеликобактера?
— При наличии хеликобактера у всех людей выявляется какое-либо заболевание желудка. Выявление конкретного заболевания зависит от штамма хеликобактера. Штаммы H. руlori, имеющие в своем составе определенные генотипы, предрасполагают к развитию язвенной болезни и рака желудка. И если язвой желудка и двенадцатиперстной кишки или онкологическими заболеваниями заболевают не все инфицированные люди, то гастритом — все.

Верно и то, что данные болезни могут возникать и без хеликобактер пилори.
- Кроме гастритов, связанных с хеликобактером, имеются гастриты, связанные с забросом содержимого двенадцатиперстной кишки в желудок, так называемые рефлюксные (химические) гастриты, гастриты, связанные с образованием антител к слизистой оболочке желудка (аутоиммунные гастриты).
- Причиной язв может быть прием нестероидных противовоспалительных препаратов, ацетилсалициловой кислоты, изредка нервные факторы, погрешности в еде.
- Причиной раковых заболеваний могут быть погрешности в питании, канцерогенные вещества, поступающие в пищу, курение, наследственная предрасположенность и др.
— Как передается эта бактерия человеку? Можно ли заразиться от животных? А в ресторане через посуду?
— Путь передачи хеликобактера контактно-бытовой. Бактерия передается:
- через недостаточно чистую посуду, когда люди едят из одной тарелки или пьют из одной чашки, едят пищу друг у друга;
- в семье, когда родители пробуют пищу перед тем, как дать ее ребенку, или облизывают соску малыша;
- в случае использования людьми одной зубной щетки;
- через губную помаду;
- при отсутствии мытья рук после туалета и перед едой;
- через сексуальные поцелуи.
Хеликобактер также выявлен у кошек и собак, вследствие чего существует возможность заражения человека от них. Что касается ресторана, то, если грязная посуда плохо обрабатывается, появляется высокая возможность заражения хеликобактером.
— Какой процент людей в Беларуси живет с хеликобактером? Почему этот показатель выше, чем в Западной Европе и США?
— Качественных эпидемиологических исследований по распространению хеликобактера среди населения Беларуси не проводилось. Проводились лишь относительно небольшие исследования среди населения отдельных областей и отдельных групп населения.
Считается, что распространенность хеликобактера среди белорусов составляет около 70-80%.
Среди населения РФ по ряду исследований в отдельных российских регионах распространенность составляет от 65 до 90%. Данный показатель выше, чем в Западной Европе и США, в связи с недостаточно качественным соблюдением гигиены в нашей стране.

— Какие симптомы должны заставить человека сдать анализ на хеликобактер? Какие из них неочевидные, не связанные напрямую с ЖКТ?
— Диспепсические расстройства (боли, жжение в эпигастральной области — верхних отделах живота, тошнота, плохой аппетит, тяжесть в эпигастральной области, рвота и т. д.) требуют обследования на хеликобактер.
В некоторых случаях хеликобактер может быть причиной также:
- железодефицитной анемии;
- халитоза (плохого запаха изо рта);
- крапивницы.
Однако следует помнить, что данные заболевания могут возникать и по множеству других причин.
— Какие анализы на выявление хеликобактер существуют? Какие из них самые объективные?
— Существует несколько разновидностей анализов.
- Гистологическое исследование биопсийного материала из слизистой желудка, причем следует исследовать слизистую как антрального отдела, так и тела желудка.
- Быстрый уреазный тест. Тест выполняется в момент гастроскопии. Биопсия слизистой берется из полости желудка, помещается в среду, содержащую мочевину и такой индикатор, как феноловый красный. Уреазы преобразуют мочевину в аммиак, вследствие чего повышается рН среды, и желтый цвет образца (отрицательный) меняется на красный (положительный).
- С13-уреазный дыхательный тест на немецкой аппаратуре, достоверность которого более 92%.
- Российская модификация дыхательного теста — хелик-тест, достоверность которого, по данным ряда российских авторов, составляет от 30 до 80%.
- Определение антител к хеликобактеру IgM и IgG в крови.
- Исследование антигенов хеликобактера в кале.

Самыми объективными из анализов являются гистологический тест, С13-уреазный дыхательный тест на аппаратуре немецкой фирмы FAN, исследование антигенов хеликобактера в кале и быстрый уреазный тест. Исследование крови на антитела к хеликобактер пилори приемлемо при первичном исследовании до лечения хеликобактера. В то же время для контрольного исследования оно не годится, так как антитела к хеликобактеру остаются повышенными в течение нескольких лет в крови после излечения от хеликобактера, давая ложноположительный результат.
Хелик-тест из-за низкой достоверности нигде в мире, кроме нескольких стран СНГ, не применяется.
— Что делать, если анализ положительный? Влияет ли, например, количественное значение антител в крови на степень опасности бактерии для здоровья?
— При положительном анализе на хеликобактер решается вопрос о проведении антихеликобактерной терапии. На степень опасности для здоровья количественное значение хеликобактера существенного значения не имеет, ибо высокая обсемененность хеликобактером в ряде случаев в наших исследованиях приводила к значительно меньшим изменениям слизистой оболочки, чем низкая, или существенно не отличалась. Причина — в индивидуальной резистентности (восприимчивости) организма к хеликобактеру.
При незначительных превышениях IgA желательно провести другой метод исследования хеликобактера, например С13-уреазный дыхательный тест или исследование кала на антигены хеликобактера, чтобы подтвердить или опровергнуть положительный результат.

— Всегда ли положительный анализ говорит о необходимости лечения? В каких случаях хеликобактер не лечат?
— Раньше считалось, что лечение хеликобактера следует проводить, только если имеются клинические проявления заболевания. Сейчас в связи с выявлением существенной роли хеликобактера в развитии рака желудка лечение рекомендуют проводить всем больным с хеликобактерной инфекцией.
В некоторых странах, в частности, Японии, лечение хеликобактера проводится всем больным бесплатно. При этом тем людям, которые отказываются лечиться от хеликобактера, при развитии у них рака желудка не оплачивают страховку.
У лиц с язвами желудка и двенадцатиперстной кишки санация хеликобактера приводит к уменьшению появления новых язв в три раза.
Лечение хеликобактера НЕ проводят:
- больным с аллергией и/или непереносимостью препаратов, предназначенных для лечения хеликобактера;
- тем, у кого все схемы лечения оказались неэффективными;
- отказывающимся от лечения пациентам.
На мой взгляд, больным с хроническим гастритом, у которых имеются лишь незначительные изменения слизистой оболочки желудка, от лечения можно временно воздержаться.
Лечение детей не проводят: существует большая вероятность повторного заражения из-за нахождения в детском коллективе и развития ряда побочных реакций, особенно при повторном лечении. Для детей желательно выделение отдельной посуды и соблюдение правил личной гигиены.

— Какое лечение назначается?
— Излечиться от хеликобактера полностью возможно только при назначении антибиотиков и блокаторов протоновой помпы (антисекреторных лекарственных средств — прим. ред.), усиливающих эффект антибиотиков, в ряде случаев в сочетании с препаратами висмута.
В последнее время выявлено бактерицидное действие некоторых пробиотиков в отношении хеликобактера.
Например, существует препарат, содержащий инактивированные бактерии пробиотического штамма Lactobacillus reuteri. Однако подобные препараты полностью от хеликобактера не излечивают.
— Должны ли параллельно лечиться домашние? Может ли такое быть, что у одного из членов семьи есть хеликобактер, а у остальных — нет?
— Да, лечение взрослых членов семьи при наличии у них хеликобактера должно проводиться, детям из-за указанных выше причин — нет. При этом наличие хеликобактера у всех членов одной семьи необязательно. Это зависит от индивидуальной резистентности организма к бактерии. В исследованиях и клинической практике неоднократно были случаи, когда хеликобактер не обнаруживался у отдельных членов семьи. Поэтому лечению всегда должны предшествовать анализы.
Читайте также:

