Роль сурфактантной системы в патологии легких реферат
Обновлено: 04.07.2024
(англ. surfactant поверхностно-активное вещество) — внеклеточные компоненты и клетки, продуцирующие поверхностно-активные вещества легкого (ПАВЛ), выводящие их на альвеолярную поверхность эпителия и обеспечивающие элиминацию отработанных сурфактантов.
Внеклеточные компоненты представлены выстилающим комплексом, состоящим из мономолекулярного слоя строго ориентированных молекул ПАВЛ расположенные на границе раздела фаз газ-жидкость, и гипофазы внеклеточной жидкости, расположенной между плазматической мембраной альвеолярного эпителии, и .монослоем. В гипофазе в форме мицелл и трабокул содержится резервное количество ПАВ. По химической природе ПАВ,, относятся к фосфолипидам и белкам, формирующим белково-липидные комплексы. Клетки легкого, входящие в С. с. л, представлены пневмоцитами I, II и III типов, макрофагами: пневмоциты I и II обеспечивают синтез фосфолипидов и белков, III и альвеолярные макрофаги удаляют отработанные сурфактанты, возвращая продукты их разложения в метаболический круговорот. Согласованная деятельность всех компонентов С. с. л. обеспечивает физиологическое функционирование и стабильность легкого.
СУРФАКТАНТЫ ЛЕГКОГО — Создают возможность расправления легкого при первом вдохе новорожденного, препятствуют развитию ателектазов при выдохе, обеспечивают до 1 1з эластичпости тканей легкого взрослого человека, стабильность структуры респираторной зоны, регулируют смену дежурных респиронов, скорость абсорбции кислорода на границе раздела фаз газ — жидкость и интенсивность испарения воды с альвеолярной поверхности. Очищают поверхность альвеол от инородных частиц и белковых тел, обладают бактериостатической активностью. Снижение активности С. л. часто предшествует развитию различных форм патологии.
Пневмография
Спирометрия — метод определения жизненной емкости легких (ЖЕЛ) и составляющих ее объемов воздуха.
Пневмография- метод регистрации дыхательных движений человека и животного.
Дыхательные движения записывают с помощью пневмографов. Эти приборы позволяют регистрировать движение стенки грудной клетки, изменение ее окружности при дыхании или колебание давления в трахее, носовой и ротовой полости и плевральной щели.
Пневмографию можно осуществлять с применением различных датчиков - реостатных, тензометрических, емкостных и др. При этом необходимо использовать электронные усилительные и регистрирующие устройства. Наиболее простым и доступным является пневмодатчик с капсулой Марэ. Принцип его действия состоит в том, что дыхательные движения изменяют давление воздуха, находящегося в системе замкнутого пространства. Эти изменения регистрируют с помощью капсулы и писчика на кимографе.
45. Газообмен в лёгких. Диффузная способность лёгких.
Газообменная функция легких
Газовая смесь в альвеолах, участвующих в газообмене, обычно называется альвеолярным воздухом или альвеолярной смесью газов. Содержание кислорода и углекислого газа в альвеолах зависит прежде всего от уровня альвеолярной вентиляции и интенсивности газообмена.
Содержание О2 в альвеолярной смеси – 14 об. %.
Содержание СО2 в альвеолярной смеси – 5,6 об. %. Оставшаяся часть альвеолярной газовой смеси приходится на долю азота и очень небольшого количества инертных газов.
В атмосферном воздухе содержится 20,9 об. % кислорода, 0,03 об. % углекислого газа и 79,1 об. % азота.
В выдыхаемом воздухе содержится 16 об. % кислорода,4,5 об. % углекислого газа и 79,5 об. % азота.
Состав альвеолярного воздуха при нормальном дыхании остается постоянным, так как при каждом вдохе обновляется лишь 1/7 часть альвеолярного воздуха. Кроме того газообмен в легких протекает непрерывно, при вдохе и при выдохе, что способствует выравниванию состава альвеолярной смеси.
Парциальное давление газов в альвеолах составляют: 100 мм рт.ст. для О2 и 40 мм рт.ст. для СО2. Парциальные давления кислорода и двуокиси углерода в альвеолах зависят от отношения альвеолярной вентиляции к перфузии легких (капиллярный кровоток). У здорового человека в покое это отношение равно 0,9-1,0. В патологических условиях это равновесие может претерпевать значительные сдвиги. При увеличении этого отношения парциальное давление кислорода в альвеолах увеличивается, а парциальное давление углекислого газа – падает и наоборот.
Нормовентиляция – парциальное давление углекислого газа в альвеолах поддерживается в пределах 40 мм рт.ст.
Гипервентиляция – усиленная вентиляция, превышающая метаболические потребности организма. Парциальное давление углекислого газа меньше 40 мм рт.ст.
Гиповентиляция сниженная вентиляция по сравнению с метаболическими потребностями организма. Парциальное давление СО2 больше 40 мм рт.ст.
Повышенная вентиляция – любое увеличение альвеолярной вентиляции по сравнению с уровнем покоя независимо от парциального давления газов в альвеолах (например: при мышечной работе).
Эупноэ – нормальная вентиляция в покое, сопровождающаяся субъективным чувством комфорта.
Гиперпноэ – увеличение глубины дыхания, независимо от того, повышена или снижена частота дыхания.
Тахипноэ – увеличение частоты дыхания.
Брадипноэ – снижение частоты дыхания.
Апноэ – остановка дыхания, обусловленная отсутствием стимуляции дыхательного центра (например: при гипокапнии).
Диспноэ – неприятное субъективное ощущение недостаточности дыхания или затрудненного дыхания (одышка).
Ортопноэ – выраженная одышка, связанная с застоем крови в легочных капиллярах в результате сердечной недостаточности. В горизонтальном положении это состояние усугубляется и поэтому лежать таким больным тяжело.
Асфиксия – остановка или угнетение дыхания, связанные главным образом с параличом дыхательного центра. Газообмен при этом резко нарушен: наблюдается гипоксия и гиперкапния.
Диффузия газов в легких
Парциальное давление кислорода в альвеолах (100 мм рт.ст.) значительно выше, чем напряжение кислорода в венозной крови, поступающей в капилляры легких. Градиент парциального давления углекислого газа направлен в обратную сторону (46 мм рт.ст. в начале легочных капилляров и 40 мм рт.ст. в альвеолах). Эти градиенты давлений являются движущей силой диффузии кислорода и двуокиси углерода, т.е. газообмена в легких.
Согласно закону Фика диффузный поток прямо пропорционален градиенту концентрации. Коэффициент диффузии для СО2 в 20-25 раз больше, чем кислорода. При прочих равных условиях углекислый газ диффундирует через определенный слой среды в 20-25 раз быстрее, чем кислород. Именно поэтому обмен СО2 в легких происходит достаточно полно, несмотря на небольшой градиент парциального давления этого газа.
При прохождении каждого эритроцита через легочные капилляры время, в течение которого возможна диффузия (время контакта) относительно невелико (около 0,3 с). Однако этого времени вполне достаточно для того, чтобы напряжения дыхательных газов в крови и их парциальное давление в альвеолах практически сравнялись.
Диффузионную способность легких, как и альвеолярную вентиляцию, следует рассматривать в отношении к перфузии (кровоснабжению) легких.
Состояние сурфактантной системы легких и причины ее нарушений были изучены на модели такой разновидности РДС, как постперфузионный легочный синдром, развивающийся после операций на открытом сердце с искусственным кровообращением. Для этого была отработана методика прямого измерения поверхностного натяжения по методу J. Clements. При этом экстракт помещался в специальную кювету, площадь поверхности которой могла ступенеобразно уменьшаться от 100% до 20%, что давало возможность записать петлю гистерезиса поверхностного натяжения, которое измерялось по силе втягивания кварцевой пластинки на весах Вильгельми-Лонгмюра. Наибольшую информативность имело поверхностное натяжение при сокращении площади кюветы до 20%, что отражало максрмально возможную активность сурфактанта в данном экстракте, или "минимальное поверхностное натяжение" (в норме - 2-6 дин/см).
Изучение активности сурфактанта легких больных, умерших после операций на открытом сердце, показало значительное возрастание поверхностного натяжения экстрактов, взятых из наиболее измененных участков легких в стадии их "опеченения" (23,37±1,48 дин/см, максимально до 32 дин/см), в то время как в участках с сохранением воздушности угнетение сурфактанта было менее выраженным (14,41±1,29 дин/см). Такое различие активности сурфактанта в разных участках легких одного и того же больного могло зависеть от дополнительной его ингибиции в местах, где происходил максимальный выход в альвеолы токсичных компонентов из плазмы крови при токсическом отеке легких.
Возможность прямой ингибиции сурфактанта какими-то веществами, циркулирующими в крови, на первый взгляд может показаться маловероятной, поскольку сурфактант, выстилающий альвеолу изнутри, защищен от воздействия этих веществ альвеолокапиллярной мембраной. Однако при развитии РДС проницаемость этой мембраны нарушается, что и позволяет проникать в альвеолу вместе с отечной жидкостью и таким токсичным субстанциям. В этом случае и возможен прямой их контакт с сурфактантом.
Для исследования такой возможности проводились измерения поверхностного натяжения экстрактов легких здоровых животных (собак) после добавления к ним крови больных, взятой на разных этапах операции на открытом сердце.
Первоначально было установлено, что кровь здоровых животных и людей (доноров) не подавляла активность сурфактанта. В то же время кровь больных людей с тяжелыми поражениями легких - острыми пневмониями, абсцессами и гангреной легких вызывала угнетение активности сурфактанта, степень которого нарастала при увеличении тяжести состояния этих больных. Поскольку в этих опытах in vitro использовались экстракты легочной ткани, то подавление активности сурфактанта в этих случаях зависело не столько от какой-то "дезорганизации" поверхностно-активного слоя альвеол или механического смывания сурфактанта отечной жидкостью, а от прямой ингибиции активности сурфактанта токсичными субстанциями крови.
Таким образом, проведенные исследования показывают, что в патогенезе острых поражений легких расстройства сурфактантной системы играют вторичную роль, являясь не столько причиной, сколько следствием этих поражений.
Развитие эндотоксемии при описанных критических состояниях нередко характеризуют как "синдром системной воспалительной реакции" (systemic inflammatory response syndrome - SIRS), который может быть ответом не только на инфекцию, но и на любые травматические агрессии и стрессы. При этом на первый план выходят провоспалительные медиаторы, главным образом такие цитокины, как IL-1 и TNF-a, а также продукты деградации нейтрофилов, тромбоцитов и факторов коагуляции, фрагментов комплемента, эйкосаноиды, "гранулоцит-колонии-стимулирующий фактор".
Чрезмерные реакции SIRS могут оказаться контрпродуктавными и сами по себе способствовать развитию септического шока, РДС и мультиорганной дисфункции. В плазме крови быстро нарастает содержание острофазовых белков, синтезируемых главным образом в печени. Они влияют на гемостаз (фибриноген), фагоцитоз и бактерицидностъ (комплемент, С-реактивный белок), и кроме того, могут быть антитромбогенными (а-1-кислый гликопротеин), аитипротеазными (ос-1-антитрипсин, a-1-химотрипсин), антиоксидантами (церулоплазмин, глютатион). Концентрация С-реактивного белка, в норме чрезвычайно низкая, при SIRS быстро возрастает в 10-100 раз, что часто отражает масштаб проявлений этой патологии.
Следует отметить, что само развитие острого инфекционного процесса могло происходить вследствие изначального иммунодефицита, развившегося в результате недавно перенесенных других заболеваний (даже обычных респираторных вирусных инфекций), неблагоприятных экологических или социальных факторов, хрониоинтоксикаций (алкоголь, наркотики и т. п.), не говоря уже о классической ВИЧ-инфекции. Подтверждением этому является зачастую наблюдаемая на начальном этапе болезни лейкопения и лимфопения.
Далее развивается цепь взаимоусугубляемых событий. Иммунная система мобилизует все свои резервы для борьбы с инфекционными и иными агентами, которые далеко не беспредельны, и в конечном итоге наступает ее истощение. Нарастание эндотоксикоза действует подавляюще на все компоненты клеточного и гуморального иммунитета, приводя к еще более глубокой иммунодепрессии, которую можно охарактеризовать как "иммунный дистресс-синдром".
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
ЗАПИСЬ НА ПРИЕМ
Введение.
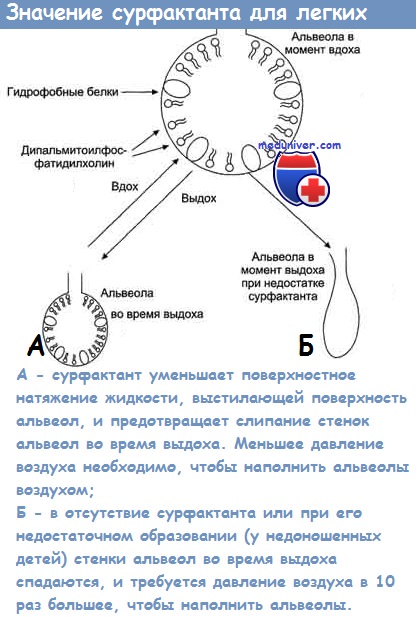
Специальные исследования показали нарушения активности сурфактанта при развитии острых поражений лёгких (ОПЛ), таких как шоковые лёгкие, респираторный дистресс-синдром (РДС), пневмонии, что играет существенную роль в развитии и тяжести течения заболевания [1]. Сурфактант, уменьшая поверхностное натяжение в альвеолах и обеспечивая тем самым их стабильность на выдохе, снижает и гидростатическое давление в легочных капиллярах, предотвращая транссудацию жидкости из них [2]. Таким образом, отсутствие сурфактанта приводит как к ателектазу, так и к отёку лёгких. Главным действующим началом сурфактанта является фосфолипид дипальмитил-фосфатидил холин, но существуют и белковые его компоненты, т.е. сурфактант представляет собой липопротеид, синтез которого происходит в альвеолоцитах II типа.
Существует несколько попыток объяснить снижение активности сурфактанта. В частности, считается, что жидкость и белок, поступающие в альвеолу при отёке, дезорганизуют слой сурфактанта, смывают его. Возможна и прямая ингибиция сурфактанта под воздействием каких-то токсичных субстанций, среди которых выделяются свободные жирные кислоты. Гистохимические исследования показали, что уже через 15 минут после внутривенного введения олеиновой кислоты наступают изменения поверхностно-активной плёнки альвеол, её фрагментация. И есть прямые свидетельства, что при септических осложнениях нарастает уровень свободных жирных кислот, прямо коррелирующий с летальностью. Подавлять активность сурфактанта с развитием РДС может и нарастание уровня эндотоксина в крови [3, 4].
Всё это явилось основанием для использования экзогенного сурфактанта в лечении ОПЛ и РДС [5]. Тем не менее, раздавались и голоса о неспособности экзогенного сурфактанта корригировать дыхательную недостаточность при РДС, особенно у взрослых [6, 7]. Однако и у новорождённых использование сурфактанта обеспечивало более быстрое снижение FiO2 до 40% и сокращение продолжительности ИВЛ, но увеличения выживаемости к 7 и 28 дням достигнуто не было [8]. А.В.Власенко и соавт. [9] также отмечали, что использование сурфактанта давало лишь временный эффект. Это позволяло сократить длительность ИВЛ и сроки пребывания в отделении реанимации, однако достоверного снижения уровня летальности не происходило.
Целью настоящей работы являлось выяснение причин нарушений активности сурфактанта и возможностей их коррекции у больных с ОПЛ.
Материал и методы.
Активность сурфактанта определялась по измерению поверхностного натяжения экстрактов лёгких, полученных у 12 больных, погибших при явлениях РДС на почве острых пневмоний и инфекционных деструкций лёгких.
За норму активности сурфактанта брали поверхностное натяжение в аналогичных кусочках ткани лёгких 20 здоровых собак, которым под интратрахеальным наркозом производилась торакотомия и последующие эксперименты, не связанные с текущими задачами, с дальнейшим выведением из опыта.
Для выяснения причин нарушения активности сурфактанта, чтобы было исключено влияние целостного организма, были поставлены специальные опыты invitro, когда к экстрактам лёгких собак добавлялось по 10 мл крови здоровых собак (5), здоровых доноров (5) и 10 больных, страдавших ОПЛ (РДС, пневмония, абсцесс или гангрена лёгких).
Результаты.
В опытах invitro первоначально было установлено отсутствие какого-либо ингибирующего действия на активность сурфактанта крови здоровых животных и людей (доноров крови). В то же время, добавление крови больных людей существенно подавляло активность сурфактанта (табл. 1).
Активность сурфактанта после добавления к экстракту здорового лёгкого крови здоровых животных, здоровых доноров и больных
| № | Объект исследования | Исходный уровень | После добавления крови |
| 1 | Здоровые собаки | 5, 2±0,7 | 5,7±1,1 |
| 2 | Здоровые люди | 5,2±0,7 | 5,4±0,9 |
| 3 | Больные с ОПЛ | 5,2±0,7 | 25,08±3,76* |
Примечание: значком * отмечена достоверность отличий от исходного уровня (Р
Автором данных статей является: Воинов Валерий Александрович, (I Ленинградский медицинский институт имени акад. И.П.Павлова)
Поверхность альвеолярного эпителия в лёгких покрыта сурфактантом, необходимым для обеспечения дыхания и адекватной иммунной защиты. Лёгочный сурфактант состоит из липидов (90%) и ряда белков, имеющих различные функции. Сурфактантные белки представлены белками SP-A, SP-D, SP-B и SP-C. В данном обзоре обсуждаются основные функции сурфактантных белков.
Ключевые слова
Обзор
Лёгкие выполняют две главные функции в организме: обеспечение дыхания и функционирование механизмов иммунной защиты. Корректное выполнение данных функций связано с лёгочным сурфактантом.
Сурфактант в лёгких синтезируется альвеолярными клетками II типа и секретируется в альвеолярное пространство. Сурфактант покрывает поверхность альвеолярного эпителия и состоит из липидов (90 %) и белков (10 %), составляя липопротеидный комплекс. Липиды представлены в основном фосфолипидами. Дефицит и/или качественные изменения состава легочного сурфактанта описаны при туберкулезе, респираторном дистресс-синдроме новорожденных, пневмонии и других заболеваниях. 1.
Сурфактантные белки представлены белками SP-A, (Surfactant Protein A, 5,3%), SP-D (0,6 %), SP-B (0,7 %), и SP-C (0,4%). 6.
Функции гидрофильных белков SP-A и SP-D связаны с иммунной защитой в легких. Эти белки связывают липополисахарид грамотрицательных бактерий и агрегируют различные микроорганизмы, влияют на активность тучных, дендритных клеток, лимфоцитов и альвеолярных макрофагов. SP-A ингибирует созревание дендритных клеток, тогда как SP-D увеличивает способность альвеолярных макрофагов к захвату и презентации антигенов, стимулируя адаптивный иммунитет [7,8].
Сурфактантный белок А является наиболее обильным белком лёгочного сурфактанта. Он обладает выраженными иммуномодулирующими свойствами. Белок SP-A воздействует на рост и жизнеспособность микроорганизмов, повышая проницаемость их цитоплазматической мембраны. Более того, SP-A стимулирует хемотаксис макрофагов, влияет на пролиферацию клеток иммунного ответа и на продукцию цитокинов, повышает продукцию реактивных оксидантов, повышает фагоцитоз клеток, подвергшихся апоптозу и стимулирует фагоцитоз бактерий. SP-A человека состоит из двух генных продуктов - SP-A1 и SP-A2, структура и функция которых различна. Наиболее важное различие в структуре SP-A1 и SP-A2- аминокислотная позиция 85 коллагеноподобного региона белка SP-A, где SP-A1 имеет цистеин, а SP-A2 – аргинин. Функциональные различия между SP-A1 и SP-A2 включают их способность стимулировать фагоцитоз, ингибировать секрецию сурфактанта.[7]. Во всех этих случаях SP-A2 обладает большей активностью, чем SP-A1. [8].
Функции гидрофобных белков SP-B и SP-C связаны с обеспечением возможности дыхания. Они снижают поверхностное натяжение в альвеолах и способствуют равномерному распределению сурфактанта на поверхности альвеол. [9].
Читайте также:

