Реферат водородные связи кислотность и основность спиртов
Обновлено: 02.07.2024
Спирты классифицируются следующим образом (в скобках приведены примеры):
По числу гидроксильных групп:
— одноатомные спирты (метанол);
— двухатомные спирты (этиленгликоль);
— трехатомные спирты (глицерин);
— четырёхатомные спирты (пентаэритрит);
— многоатомные спирты (пятиатомный спирт: ксилит).
В зависимости от насыщенности углеводородного заместителя:
— предельные (насыщенные) спирты (бутанол);
— непредельные (ненасыщенные) спирты (аллиловый спирт, пропаргиловый спирт);
— ароматические спирты (бензиловый спирт).
В зависимости от наличия или отсутствия цикла в углеводородном заместителе:
— ациклические (алифатические) спирты (этанол);
— алициклические спирты (циклогексанол).
В зависимости от числа заместителей при α-углеродном атоме:
— первичные спирты (этанол);
— вторичные спирты (пропанол-2);
— третичные спирты (2-метилпропанол-2).
Номенклатура спиртов.
Правила построения названий спиртов:
1. Выбирают родительский углеводород по самой длинной непрерывной углеводородной цепи, содержащей гидроксильную группу. Он формирует базовое название (по числу атомов углерода).

2. Родительский углеводород нумеруют в таком направлении, чтобы гидроксильная группа получила наименьший номер в названии. (Если в соединении имеются функциональные группы старше гидроксильной, то это правило применяется к старшей функциональной группе.)
3. Старшая функциональная группа обозначается в виде суффикса (для гидроксильной — -ол), а остальные заместители — в виде приставок в алфавитном порядке. Их положение в углеводородной цепи обозначается при помощи цифр — локантов, помещаемых после суффиксов и перед приставками. Для многоатомных спиртов перед суффиксом -ол указывается число гидроксильных групп (-диол, -триол, -тетраол и т. д.).

4. Если при различных вариантах нумерации цепи гидроксильная группа получает один и тот же локант, то цепь нумеруют в том направлении, при котором другой заместитель получает наименьший локант.
Радикало-функциональная номенклатура. В рамках данной номенклатуры название образуется от названия класса соединения (спирт) с добавлением названий радикалов, присоединённых к гидроксильной группе, например: этиловый спирт C2H5OH, гексиловый спирт C6H13OH, аллиловый спирт СH2=CH-CH2OH.
Рациональная номенклатура (карбинольная номенклатура) спиртов рассматривает их как производные метанола CH3OH, называемого в данном случае карбинолом: диметилкарбинол (СH3)2CНOH, трифенилкарбинол (С6H5)3COH.
Тривиальная номенклатура. В популярной и научной литературе можно нередко встретить исторические, или тривиальные, названия спиртов, которые вследствие сложившейся традиции используются вместо систематических названий[11]. Тривиальные названия обычно происходят от названия природного источника получения того или иного спирта. Так, например, метанол называют древесным спиртом, этанол — винным спиртом, гераниол содержится в гераниевом масле, а цетиловый спирт ранее получали из жира кашалотов[12] (лат. cetus — кит). Некоторые спирты получили тривиальные названия из-за своих физических свойств (глицерин от др.-греч. glykeros, сладкий)[1]. Спирты, производные от природных углеводов, сохраняют корень тривиального названия соответствующих углеводов (маннит, ксилит, сорбит).
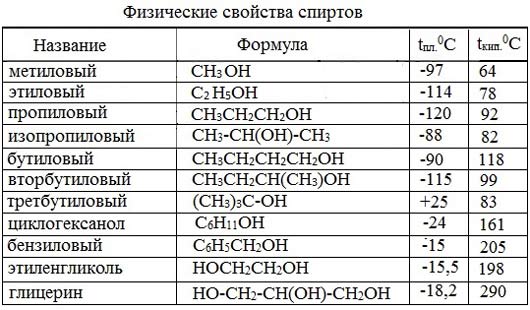
Физические свойства.
Спирты имеют существенно более высокие температуры плавления и кипения, чем можно было бы предполагать на основании физических свойств родственных соединений. Так, из ряда монозамещённых производных метана, метанол имеет необычно высокую температуру кипения, несмотря на относительно небольшую молекулярную массу.
Высокие температуры кипения спиртов объясняются наличием межмолекулярных водородных связей. Энергия водородной связи значительно ниже, чем энергия ковалентной химической связи. Тем не менее, влияние водородных связей на физические свойства спиртов весьма значительное.
Молекулы спирта, имея две полярных связи C−O и O−H, обладают дипольным моментом (~5,3—6,0·10−30 Кл·м). Следует отметить, что влияние гидроксильной группы особенно велико на соединения с небольшой углеводородной цепочкой. Так, например, метанол и этанол неограниченно смешиваются с водой и имеют довольно высокие плотности и температуры кипения для своей молекулярной массы, в то время как высшие спирты гидрофобны и мало отличаются по свойствам от соответствующих углеводородов.
Кислотные свойства спиртов.
Как слабые кислоты, спирты диссоциируют по связи O–H с образованием алкоксид-иона. Кислотные характеристики спиртов оценивают по константе кислотности Ka.



В водном растворе кислотность спиртов снижается с увеличением молекулярной массы и разветвлённости углеводородной цепи. Это связывают с увеличением положительного индуктивного эффекта алкильных заместителей в данном ряду и уменьшением устойчивости образующегося алкоксид-иона за счёт локализации отрицательного заряда на атоме кислорода.
В целом, электроноакцепторные заместители (–NO2, –CN, –F, –Cl, –Br, –I, –OR и др.) увеличивают кислотность спиртов (уменьшают pKa). Напротив, электронодонорные заместители (например, алкильные заместители) уменьшают кислотность спиртов (увеличивают pKa). Сравнительная кислотность спиртов и соединений других классов схематически представлена на рисунке.


Как слабые кислоты, спирты вступают в реакции с щелочными, щелочноземельными и некоторыми другими металлами, и с сильными основаниями, например, гидридами или амидами металлов, реактивами Гриньяра.

.
Образование алкоголятов Водородный атом гидроксильной группы при действии щелочных металлов способен заменяться на атомы этих металлов, причем получаются твердые, растворимые в спирте соединения, называемые алкоголятами:

Последняя реакция обратима.
Кроме алкоголятов щелочных металлов, известны также алкоголяты щелочноземельных металлов, алюминия и других металлов.
Осно́вные свойства спиртов.
Спирты могут также вести себя как слабые основания Льюиса, образовывая с сильными минеральными кислотами соли алкоксония, а также давая донорно-акцепторные комплексы с кислотами Льюиса. Обычно подобные реакции не останавливаются на указанной стадии и ведут к нуклеофильному замещению гидроксильной группы или отщеплению воды.


.
Количественно основность спиртов оценивают по константе основности pKb или связанной с ней константе кислотности сопряжённой кислоты pKaH+:



Спирты являются слабыми основаниями, и их основность возрастает с увеличением длины или разветвлённости углеводородного радикала при гидроксильной группе. Данный эффект наблюдается из-за роста положительного индуктивного эффекта радикала в данном ряду, за счёт которого увеличивается отрицательный заряд на атоме кислорода гидроксильной группы.
Образование оксониевых солей(см. учебник том 1, стр. 346)
Образование Н-связей с молекулами растворителя способствует улучшению растворимости. Так, метиловый и этиловый спирты (CH3OH, С2Н5ОН), образуя Н-связи с молекулами воды, неограниченно в ней растворяются.
На сегодняшний день современный мир сложно представить без применение различных химических соединений, которые так или иначе применяются во всех сферах человеческой жизни. Среди всего многообразия применяемых соединений особое место отводится спиртам, которые находят широкое применение, как в быту, так и промышленности. Данная группа соединений применяется в медицине, производстве лекарственных средств, пищевой промышленности итд.
Давно известно что свойства соединений определяется особенностями их строения и в первую очередь особенностями химических связей в них. Существенную роль на свойства спиртов оказывает наличие в них водородных связей. Поэтому понимание особенностей водородных связей помогает более четко определить свойства спиртов, что открывает новые возможности для их применения, что делает тему данной работы актуальной.
При выполнении работы была поставлена следующая цель: Особенности водородной связи и ее влияние на свойства спиртов
Объект исследования: Спирты как отдельная группа органических соединений
Задачи:1 Изучить механизм образования водородной связи и ее влияние на свойства спиртов 2. Изучить основные свойства спиртов 3. изучить закономерности изменения свойств спиртов . 4.Изучить литературные источники по данному вопросу 5. изучить интернет и прочие цифровые ресурсы по данному вопросу.
Методы: Сбор, сопоставление, анализ информации полученной из различных источников.
Общее понятие о спиртах
С точки зрения химии спирты это соединения содержащие одну или несколько гидроксильных групп ОН- связанные с углеводородным радикалом. С этой точки зрения все спирты можно рассматривать, как производные предельных углеводородов в котором 1 или несколько атомов водорода замещены группами ОН-
В зависимости от количества групп Он все спирты делятся на одноатомные (содержат 1 группу ОН-), двух атомные (гликоли) и трех атомные. Химические и физические свойства спиртов определяются количеством ОН групп.
Так же спирты можно разделить на основе строения углеводородного радикала. По этому признаки все спирты можно разделить на предельные- не содержат кратных связей в молекуле
Не предельные радикал содержит двойные или тройные связи
Ароматические содержат в своем составе бензольное кольцо, которое связано с ОН группой не напрямую а через другие атомы углерода.
В зависимости от того от какого атома углерода отходят функциональные группы все спирты так же можно поделит на первичные вторичные, третичные итд [4]
Если говорить об одноатомных спиртах то это вещества с общей формулой СnH2n+1OH (n-число атомов углерода) чаще всего по своим физическим свойствам это легко испаряющиеся жидкости с характерным резким запахом. Причем чем с увеличением молярной массы спирта возрастает температура плавления и кипения. Например, температура кипения метанола 64,7 градуса, этанола 78,3 Спирты имеющие в своем составе более 9 атомов углерода являются твердыми веществами.
Так же надо отметить, что у многоатомных спиртов температуры плавления и кипения значительно выше чем у соответствующих им одноатомных.
В химическом отношении спирты проявляют следующие свойства:
Реагируют между собой реакция приводит к образованию эфиров
С2Н5ОН+СН3ОН=С2Н5-О-СН3+Н2О
Реакция отщепления воды (дегидратации) С2Н5ОН=С2Н4+Н2О
Реакции окисления: С2Н5ОН+СuO=Cu+CH3 COH реакция приводит к образованию альдегидов
Проявляют амфотерные свойства при реакциях с кислотами и основаниями
Кислотные свойства спиртов: реакция с металлами
С2Н5ОН+Na=C2H5ONa+H2
Реакция с основаниями: для одноатомных спиртов не возможна так как образующиеся соединения хорошо растворимы в воде
Основные свойства: Реакция с кислотами С2Н5ОН+HCl=C2H5Cl+H2O
Характерной особенностью кислотных свойств спиртов является с одной стороны уменьшение кислотных свойств с увеличением молярной массы. С другой стороны у многоатомных спиртов кислотные свойства выражены сильнее.
Подобные свойства спиртов обусловлены наличием в них водородной связи.
Краткая характеристика водородной связи и ее роль.
Понятию водородной связи в химии есть несколько определений, одно из самых распространенных: Водородная связь- это связь, которая образуется между атомов водорода одной молекулы и атомом сильно электроотрицательного элемента (O, N, F) другой молекулы.
Впервые идеи о существовании особых связей которые обусловливают свойства некоторых веществ (воды) в 1920 году высказали В. Латимер и В.Родебуш,
Именно они предложили объяснять аномальные свойства воды за счет взаимодействия атома водорода одной молекулы с электронной парой атома кислорода другой молекулы. При этом атом водорода становится одновременно связанным с двумя атомами кислорода ковалентной и водородной связью (рис1) Так как в образовании связи принимают участие атомы водорода она получила название водородной.
Рис1 образование водородной связи
В основе образования водородной связи лежат силы электростатического притяжения атома водорода (несущим положительный заряд +) к атому более электроотрицательного элемента, имеющего отрицательный заряд. [7]
В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи
Зарегистрируйся, чтобы продолжить изучение работы
На сегодняшний день современный мир сложно представить без применение различных химических соединений, которые так или иначе применяются во всех сферах человеческой жизни. Среди всего многообразия применяемых соединений особое место отводится спиртам, которые находят широкое применение, как в быту, так и промышленности. Данная группа соединений применяется в медицине, производстве лекарственных средств, пищевой промышленности итд.
Давно известно что свойства соединений определяется особенностями их строения и в первую очередь особенностями химических связей в них. Существенную роль на свойства спиртов оказывает наличие в них водородных связей. Поэтому понимание особенностей водородных связей помогает более четко определить свойства спиртов, что открывает новые возможности для их применения, что делает тему данной работы актуальной.
При выполнении работы была поставлена следующая цель: Особенности водородной связи и ее влияние на свойства спиртов
Объект исследования: Спирты как отдельная группа органических соединений
Задачи:1 Изучить механизм образования водородной связи и ее влияние на свойства спиртов 2. Изучить основные свойства спиртов 3. изучить закономерности изменения свойств спиртов . 4.Изучить литературные источники по данному вопросу 5. изучить интернет и прочие цифровые ресурсы по данному вопросу.
Методы: Сбор, сопоставление, анализ информации полученной из различных источников.
Общее понятие о спиртах
С точки зрения химии спирты это соединения содержащие одну или несколько гидроксильных групп ОН- связанные с углеводородным радикалом. С этой точки зрения все спирты можно рассматривать, как производные предельных углеводородов в котором 1 или несколько атомов водорода замещены группами ОН-
В зависимости от количества групп Он все спирты делятся на одноатомные (содержат 1 группу ОН-), двух атомные (гликоли) и трех атомные. Химические и физические свойства спиртов определяются количеством ОН групп.
Так же спирты можно разделить на основе строения углеводородного радикала. По этому признаки все спирты можно разделить на предельные- не содержат кратных связей в молекуле
Не предельные радикал содержит двойные или тройные связи
Ароматические содержат в своем составе бензольное кольцо, которое связано с ОН группой не напрямую а через другие атомы углерода.
В зависимости от того от какого атома углерода отходят функциональные группы все спирты так же можно поделит на первичные вторичные, третичные итд [4]
Если говорить об одноатомных спиртах то это вещества с общей формулой СnH2n+1OH (n-число атомов углерода) чаще всего по своим физическим свойствам это легко испаряющиеся жидкости с характерным резким запахом. Причем чем с увеличением молярной массы спирта возрастает температура плавления и кипения. Например, температура кипения метанола 64,7 градуса, этанола 78,3 Спирты имеющие в своем составе более 9 атомов углерода являются твердыми веществами.
Так же надо отметить, что у многоатомных спиртов температуры плавления и кипения значительно выше чем у соответствующих им одноатомных.
В химическом отношении спирты проявляют следующие свойства:
Реагируют между собой реакция приводит к образованию эфиров
С2Н5ОН+СН3ОН=С2Н5-О-СН3+Н2О
Реакция отщепления воды (дегидратации) С2Н5ОН=С2Н4+Н2О
Реакции окисления: С2Н5ОН+СuO=Cu+CH3 COH реакция приводит к образованию альдегидов
Проявляют амфотерные свойства при реакциях с кислотами и основаниями
Кислотные свойства спиртов: реакция с металлами
С2Н5ОН+Na=C2H5ONa+H2
Реакция с основаниями: для одноатомных спиртов не возможна так как образующиеся соединения хорошо растворимы в воде
Основные свойства: Реакция с кислотами С2Н5ОН+HCl=C2H5Cl+H2O
Характерной особенностью кислотных свойств спиртов является с одной стороны уменьшение кислотных свойств с увеличением молярной массы. С другой стороны у многоатомных спиртов кислотные свойства выражены сильнее.
Подобные свойства спиртов обусловлены наличием в них водородной связи.
Краткая характеристика водородной связи и ее роль.
Понятию водородной связи в химии есть несколько определений, одно из самых распространенных: Водородная связь- это связь, которая образуется между атомов водорода одной молекулы и атомом сильно электроотрицательного элемента (O, N, F) другой молекулы.
Впервые идеи о существовании особых связей которые обусловливают свойства некоторых веществ (воды) в 1920 году высказали В. Латимер и В.Родебуш,
Именно они предложили объяснять аномальные свойства воды за счет взаимодействия атома водорода одной молекулы с электронной парой атома кислорода другой молекулы. При этом атом водорода становится одновременно связанным с двумя атомами кислорода ковалентной и водородной связью (рис1) Так как в образовании связи принимают участие атомы водорода она получила название водородной.
Рис1 образование водородной связи
В основе образования водородной связи лежат силы электростатического притяжения атома водорода (несущим положительный заряд +) к атому более электроотрицательного элемента, имеющего отрицательный заряд. [7]
В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи .
По современной терминологии, образование водородной связи наступает при взаимодействии кислоты Бренстеда- Лоури с акцептором протонов (основанием, донором протонов). Для схематичного представления обсуждаемых процессов молекулу донор протона обозначим А-Н (а для случаев, когда необходимо указать природу атома, связанного с водородом, R-X-H ковалентной связью). Акцептор протона обозначим: В (символическое обозначение как основания в целом, так и атома с не поделенной парой электронов) или B-Y. С учетом принятой символики водородную связь можно представить как не валентное взаимодействие между группой Х-Н одной молекулы и атомом В другой, в результате которого образуется устойчивый комплекс А-Н…В с межмолекулярной водородной связью, в котором атом водорода играет роль мостика, соединяющего фрагменты А и В. Отметим, что до настоящего времени нет однозначного подхода, какую конкретно связь называть водородной. Большинство авторов к понятию водородной связи относят дополнительное взаимодействие, которое возникает между атомом водорода и донором электронов В, то есть связь Н…В. Другие авторы к понятию водородной связи относят всю цепочку Х-Н…В, то есть связь между атомами Х и В через водородный мостик. Ориентируясь на большинство, характеристики водородной связи (длина, энергия) будем относить к связи Н…В, сознавая, что образование последней не может не сказаться на состоянии ковалентной связи Х-Н.
На ранних этапах изучения водородной связи полагали, что водородный мостик образуется только между атомами с высокой электроотрицательностью (F, O, N). В последние десятилетия, когда в руках исследователей появилось более совершенное оборудование, круг атомов — партнеров по водородному связыванию значительно расширен (Cl, S и некоторые другие). В качестве атома Х может фигурировать любой атом, более электроотрицательный по сравнению с атомом водорода и образующий с последним обычную химическую связь (например, атом углерода). В роли акцептора атома водорода могут выступать как атомы с не поделенными парами электронов (в отдельных случаях даже аргон и ксенон), так и соединения, имеющие π-связи.
Одним из признаков водородной связи может служить расстояние между атомом водорода и другим атомом, ее образующим. Оно должно быть меньше, чем сумма радиусов этих атомов. Чаще встречаются несимметричные водородные связи, является не семеричной то есть расстояние между атомами и водорода и другим атомом (длинна связи) принимающим участие в ее образование значительно больше.
Однако в редких случаях (фтороводород, некоторые карбоновые кислоты) водородная связь является симметричной.
Образование водородной связи сопровождается следующими признаками:
1 При образовании водородных связей выделяется теплота – котроая характеризует энергию связи. Эту характеристику используют для калибровки спектральных методов изучения водородных связей.
2. Расстояние между соседними атомами, участвующими в образовании водородной связи, значительно меньше суммы их ванн-дер-ваальсрвых радиусов. Последнее обстоятельство является одним из критериев, указывающих на образование между молекулами водородных связей.
3. Водородная связь увеличивает длину связи Х-Н
Для образования водородной связи, кроме электроотрицательности имеет значение и размер атома. Так, например, электроотрицательности хлора и азота близки (~ 3). Но малый размер атома азота позволяет ему подойти ближе к ядру водорода по сравнению с атомом хлора, атомный радиус которого больше, чем у азота. Поэтому хлор проявляет меньшую склонность к образованию водородной связи, чем азот.
Важнейшая характеристика водородной связи – это энергия водородного связывания (R–X–H… B–Y), которая зависит как от природы атомов Х и В, так и общего строения молекул RXH и BY. Большей частью она составляет 10–30 кДж/моль, но в некоторых случаях может достигать 60–80 кДж/моль и даже выше. По энергетическим характеристикам различают сильные и слабые водородные связи. Сильными водородные связи считаются если их энергия составляет 15–20 кДж/моль и более. К ним относят связи О–H… О в воде, спиртах, карбоновых кислотах, связи О–Н… N, N–H… O и N–H… N в соединениях, содержащих гидроксильные, амидные и аминные группы, например в белках. Если связи имеют энергию образования менее 15 кДж/моль то они считаются слабыми. Нижним пределом энергии водородной связи является 4–6 кДж/моль, например связи С–Н… О в кетонах, эфирах, водных растворах органических соединений.[3]
Наиболее прочные водородные связи образуются в случаях, когда маленький водород (жесткая кислота) одновременно связан с двумя малыми по размеру сильно электроотрицательными атомами (жесткие основания). Орбитальное соответствие обеспечивает лучшее кислотно-основное взаимодействие и приводит к образованию более прочных водородных связей. То есть образование сильных и слабых водородных связей можно объяснить с позиций концепции жестких и мягких кислот и оснований (принцип Пирсона, принцип ЖМКО).
Энергия Н-связи возрастает с увеличением положительного заряда на атоме водорода связи Х-Н и с повышением способности отдавать протон атома В (увеличивает основные свойства)
Метиловый спирт (метанол, карбинол, древесный спирт) – простейший одноатомный спирт, бесцветная жидкость (tкип= 64,5; tпл= -97; ρ= 0,793г/см 3 ), с запахом алкоголя, хорошо растворяется в воде, горюч. Пары метанола взрывоопасны. Пары метанола взрывоопасны. Сильный яд!
Метанол вызывает слепоту (достаточно 10 мл). При употреблении внутрь 70 мл и более наступает летальный исход. Смерть наступает от паралича верхних дыхательных путей.

Этиловый спирт (этанол, винный спирт) – бесцветная жидкость, с запахом спирта, хорошо смешивается с водой, ядовитое наркотическое вещество. Кипит при 78,3 0 С, замерзает при -114 0 С. Горит слабо светящимся пламенем. В виде ректификата (спирта, очищенного перегонкой) он содержит 95,6 % спирта и 4,4% воды.
Винный спирт – исторически сложившееся название, которое отражает, что этанол является основным компонентом винной продукции.
Этиловый спирт разрушает кровеносную, нервную, пищеварительную системы. Вызывает сильное привыкание и деградацию личности. При употреблении 300 мл, в перерасчете на чистый спирт, может вызвать смертельный исход.
Так как метанол и этанол фактически не отличить друг от друга, то большинство отравления суррогатным алкоголем связано с употреблением продукции, содержащей метиловый спирт вместо этилового.
А знаете ли вы?
Одноатомным спиртом является и холестерин. Его еще называют холестеролом. Холестерин – компонент желчи, играет важную роль в организме, из него синтезируются многие биологически активные соединения. Он участвует в обмене желчных кислот, в синтезе гормонов коры надпочечников и половых желез. Отложение холестерина на стенках сосудов приводит к атеросклерозу, а в желчном пузыре – к образованию желчных камней.
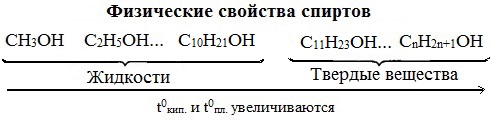
Низшие члены ряда предельных одноатомных спиртов, содержащие от одного до десяти атомов углерода, — жидкости. Высшие спирты (начиная с С11Н23ОН) при комнатной температуре — твёрдые вещества. Все алканолы легче воды, бесцветны. Низшие спирты имеют характерный алкогольный запах и жгучий вкус.
Полярность связи О-Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов.
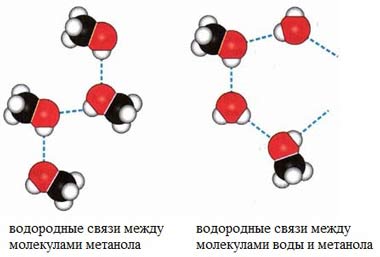
Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
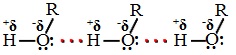
Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы.
Ассоциация молекул R-OH
Из-за способности образовывать водородные связи в гомологическом ряду спиртов нет газообразных веществ.
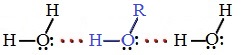
В водных растворах водородные связи образуются не только между молекулами спиртов, но также между молекулами спиртов и воды. Образованием водородных связей между молекулами спирта и воды объясняется их хорошая растворимость в воде.
Гидратация молекул R-OH
Водородные связи не прочны и при испарении спиртов легко разрываются.
С увеличением углеводородного радикала растворимость спиртов в воде уменьшается. Высшие спирты практически нерастворимы в воде. Метиловый, этиловый, н-пропиловый, изопропиловый спирты, а также этиленгликоль и глицерин смешиваются с водой в любых отношениях. Растворимость фенола в воде ограничена.
Современные представления о кислотах и основаниях, сопряженные кислоты и основания, теория Бренстеда-Лоури. Основные свойства органических соединений, п- и n-основания, теория Льюиса. Факторы, влияющие на реакционную способность кислот и оснований.
| Рубрика | Химия |
| Вид | лекция |
| Язык | русский |
| Дата добавления | 16.05.2014 |
| Размер файла | 105,7 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Тема: Кислотность и основность органических соединений
Цель занятия:
1. Сформировать у студентов представление о влиянии кислотно-основных свойств органических соединений на многие физико-химические и биологические процессы, протекающие в условиях организма.
2. Научить студентов определять кислотно-основные свойства спиртов, фенолов, тиолов, и аминов в зависимости от их строения.
Студент должен знать: типы кислот и оснований Бренстеда.
Студент должен уметь: определять кислотные и основные свойства органических соединений.
1. Современные представления о кислотах и основаниях Бренстеда и Лоури
Важными аспектами реакционной способности органических соединений является их кислотные и основные свойства. Для описания кислотных и основных свойств химических соединений существует несколько теорий - теория Бренстеда и Лоури, теория Льюиса и ряд других. Наиболее распространенной является теория Бренстеда и Лоури, или протолитическая теория.
По теории Бренстеда-Лоури кислоты - это нейтральные молекулы или ионы, способные отдавать протон (доноры протона), а основания - это нейтральные молекулы или ионы, способные присоединять протон (акцепторы протона).
По теории Льюиса кислоты - это нейтральные молекулы или ионы, способные присоединять электронную пару (акцепторы электронной пары), а основания - это нейтральные молекулы или ионы, способные отдавать электронную пару (доноры электронной пары).
Из этого следует, что теоретически любое соединение, в состав которого входит атом водорода может его отдавать в виде протона и, проявлять свойства кислоты. Способность отдавать протон могут проявлять не только нейтральные молекулы, но заряженные частицы - катионы (NH4 + ) и анионы кислот, например HCl, ROH, HSO4 - и др.
В роли оснований могут выступать анионы - частицы, несущие отрицательный заряд, например С1 - , OH - , HSO4, NH3. Основаниями могут быть и нейтральные молекулы, в состав которых входит гетероатом, например, азот, сера, кислород, содержащие неподелённую пару электронов, например спирты ROH. кислота основание сопряженный органический
Нейтральные молекулы или заряженные ионы, способные в зависимости от природы второго компонента проявлять свойства кислот или оснований называются амфотерными.
2. Теория Бренстеда-Лоури. Сопряженные кислоты и основания
Кислоты и основания проявляют свои свойства только в присутствие друг друга, Ни одно вещесвто не будет отдавать протон, если в системе нет акцептора протона - основания, и наоборот.т.е. они образуют сопряжённую кислотно-основную пару в которой чем сильнее кислота, тем слабее сопряженное ей основание, и чем сильнее основание, тем слабее сопряженная ему кислота.
Кислота, отдавая протон, превращается в сопряженное основание, а основание приняв протон, превращается в сопряженную кислоту. Кислоту обычно обозначают АН, а основание - В
Например: НС1- Н + + С1 - , НС1 - сильная кислота; С1 - ион - сопряженное слабое основание;
СН3СООН - СН3СОО - + Н + , СН3СООН - слабая кислота, а СН3СОО - - ион сопряженное сильное основание.
Общий вид можно представить так:
Н + ¦ : А + В - Н:В + + А: -
к-та основ сопр. сопр.
Мы уже сказали, что кислотные свойства соединений обнаруживаются только в присутствие основания, а основные свойства - в присутствие кислоты, т.е. в соединениях существует определённое кислотно - основное равновесие, для изучения которого в качестве растворителя используется Н2О. По отношению к Н2О как к кислоте или как основанию определяют кислотно-основные свойства соединений.
Для слабых электролитов кислотность количественно оценивается Крав реакции, которая заключается в переносе Н + от кислоты к Н2О как основанию.
к-та основ-е основание кислота
СН3СОО - - ацетат ион, сопряженное основание;
Н3О + - ион гидроксония, сопряженная кислота.
Используя значение константы равновесия этой реакции и учитывая, что концентрация Н2О практически постоянна, можно определить произведение К ?[H2O] называемое константой кислотности К кислотности (Ка).
Чем больше Ка, тем сильнее кислота. Для СН3СООН Ка = 1,75 · 10 -5 . такие малые величины неудобны в практической работе, поэтому Ка выражают через рКа (рК = -?g Ка). Для СН3СООН рКа = 4,75. Чем меньше величина рКа, тем сильнее кислота.
Сила оснований определяется величиной рКВН + .
Кислотные свойства органических соединений с водородосодержащими функциональными группами (спирты, фенолы, тиолы, карбоновые кислоты, амины).
В органических соединениях в зависимости от природы элемента, с которым связан Н + , различают следующие кислоты:
ОН - кислоты (карбоновые кислоты, фенолы, спирты)
СН - кислоты (углеводороды и их производные)
NH - кислоты (амины, амиды, имиды)
SH - кислоты (тиолы).
Кислотным центром называется элемент и связанный с ним атом водорода.
Сила кислоты будет зависеть от стабильности аниона, т.е. от сопряженного основания, которое образуется при отрыве Н + от молекулы. Чем стабильнее анион, тем выше кислотность данного соединения.
Стабильность аниона зависит от ряда факторов, которые способствуют делокализации заряда. Чем выше делокализация заряда, тем устойчивее анион, тем сильнее кислотные свойства.
Факторы, оказывающие влияние на степень делокализации:
1. Природа гетероатома в кислотном центре
2. Электронные эффекты атомов углеводородных радикалов и их заместителей
3. Способность анионов к сольватации.
1. Зависимость кислотности от гетероатома.
Под природой гетероатома понимают его электроотрицательность (Э.О.) и поляризуемость. Чем больше (Э.О.) тем легче осуществляется гетеролитический разрыв в молекуле. В периодах слева направо с ростом заряда ядра растет (Э.О), т.е. способность элементов удерживать отрицательный заряд. В результате смещения электронной плотности связь между атомами поляризуется. Чем больше электронов и чем больше радиус атома, тем дальше электроны внешнего энергетического уровня расположены от ядра, тем выше поляризуемость и выше кислотность.
Пример: СН- NH- OH- SH-
увеличение Э.О. и кислотности
С, N,О - элементы одного периода. Э.О. по периоду растет, кислотность увеличивается. В этом случае поляризуемость влиять на кислотность не будет.
Поляризуемость атомов в периоде изменяется незначительно, поэтому главным фактором определяющим кислотность является Э.О.
Теперь рассмотрим ОН- SH-
О, S - находятся в одной группе, радиус в группе сверху вниз увеличивается, следовательно растет и поляризуемость атома, что ведет к увеличению кислотности. У S радиус атома больше, чем у О, поэтому тиолы проявляют более сильные кислотные свойства по сравнению со спиртами.
Сравнить три соединения: этанол, этантиол и аминоаэтанол:
1. Сравним по радикалу - они одинаковые;
2. По природе гетероатома в функциональной группе: S и О находятся в одной группе, но у S радиус атома больше, поляризуемость выше, следовательно этантиол обладает более сильными кислотными свойствами
3. Теперь сравним О и N. О обладает более высокой Э.О., следовательно кислотность у спиртов будет выше.
2. Влияние углеводородного радикала и присутствующих в нем заместителей
Необходимо обратить внимание студентов, что сравниваемые соединения должны иметь одинаковый кислотный центр и один растворитель.
Электроноакцепторные (Э.А.) заместители способствуют делокализации электронной плотности, что ведёт к стабильности аниона и соответственно увеличению кислотности.
Электронодонорные (Э.Д.) заместители наоборот способствуют концентрации электронной плотности в кислотном центре, что ведет к понижению кислотности и увеличению основности.
Например: одноатомные спирты проявляют более слабые кислотные свойства по сравнению с фенолами.
1. Кислотный центр один и тот же
2. Растворитель один и тот же
В одноатомных спиртах электронная плотность смещается от углеводородного радикала к группе ОН, т.е. радикал проявляет +I эффект, тогда на группе ОН сосредотачивается большое количество электронной плотности в результате чего Н + более прочно связан с О и разрыв связи О-Н происходит трудно, поэтому одноатомные спирты проявляют слабые кислотные свойства.
У фенола наоборот бензольное кольцо является Э.А., а группа ОН - - Э.Д.
За счет того, что гидроксильная группа входит в общее р-р сопряжение с бензольным кольцом, в молекуле фенола происходит делокализация электронной плотности и кислотность увеличивается, т.к. сопряжение всегда сопровождается усилением кислотных свойств.
Увеличение углеводородного радикала в монокарбоновых кислотах также влияет на изменение кислотных свойств и при введении заместителей в углеводородный происходит изменение кислотных свойств.
Пример: в карбоновых кислотах при диссоциации образуются карбоксилат-ионы - самые стабильные органические анионы.
В карбоксилат-ионе отрицательный заряд за счет р, р-сопряжения распределён поровну между двумя атомами кислорода, т.е. он делокализован и соответственно менее концентрирован, поэтому в карбоновых кислотах кислотный центр более сильный, чем в спиртах и фенолах.
С увеличением углеводородного радикала, который выполняет роль Э.Д. кислотность монокарбоновых кислот снижается за счет уменьшения д + на атоме углерода карбоксильной группы. Поэтому в гомологическом ряду кислот самой сильной является муравьиная кислота.
При введении Э.А. заместителя в углеводородный радикал, например хлора - кислотность соединения увеличивается, т.к. за счет -I эффекта происходит делокализация электронной плотности и д + на атоме С карбоксильной группы увеличивается, поэтому в данном примере трихлоруксусная кислота будет самой сильной.
3. Влияние растворителя.
Взаимодействие молекул или ионов растворенного вещества с растворителем называется процессом сольватации. Стабильность аниона существенно зависит от его сольватации в растворе: чем больше ион сольватирован, тем он устойчивее, а сольватация тем больше, чем меньше размер иона и чем меньше делокализация в нем отрицательного заряда.
3. Основные свойства органических соединений. р-основания и n-основания
Основность органических соединений.
Органические соединения, в состав молекулы которых входят атомы азота, кислорода, серы, могут выступать в роли оснований, присоединяя протон водорода за счет неподеленной пары электронов на внешнем энергетическом уровне. Гетероатом в молекуле органического вещества, присоединяющий протон, называется центром основности.
Основания по Бренстеду делятся на n - основания и р - основания.
n - Основания могут быть нейтральными или отрицательно заряженными частицами. К ним относятся:аммониевые (R3N, R=NH, RCN), оксониевые (RC(O)R 1 , R-O-R 1 ), сульфониевые (R-S-R 1 , RC(S)R 1 )
р-основания (алкины, алкены, диены, арены) в них центром основности являются электроны р-связи. Это очень слабые основания, так как протонируемые электронные пары несвободны.
Сила основания определяется стабильностью образующегося катиона (сопряженной кислоты). Чем стабильнее катион, тем сильнее основание.
Для количественной характеристики основности обычно используют величину pK BH+ - показатель константы основности сопряженной кислоты. Чем больше pK BH+, тем сильнее основание.
Факторы, влияющие на основность
1. Природа гетероатома в основном центре
Сила оснований зависит от электроотрицательности гетероатома в основном центре. Чем больше ЭО атома, тем слабее основные свойства, поэтому спирты и простые эфиры являются более слабыми основаниями по сравнению с аминами.
2. Строение радикала, связанного с основным центром.
Алифатические амины проявляют более выраженные основные свойства, чем ароматические, так как электронная плотность от углеводородного радикала смещается к NH2, а чем больше электронной плотности на основном центре, тем лучше присоединяется Н + . в ароматических аминах NH2 входит в общее сопряжение с бензольным кольцом и отдает электронную плотность на кольцо, поэтому Н + присоединяется труднее, основные свойства слабее.
3. Влияние заместителей. Электронодонорые заместители усиливают основные свойства, а электроноакцепторные - уменьшают, например:
4-хлоранилин анилин 4-нитроанилин
4. Влияние растворителя
В водной среде важную роль играет уменьшение пространственных препятствий для гидратации, поэтому вторичные амины лучше гидратируются, чем третичные, которые пространственно труднодоступны.
В газовой среде основность возрастает с увеличением углеводородных радикалов, так как усиливается их стабилизирующее действие за счет +I-эффекта на катион сопряженной кислоты, поэтому третичные амины проявляют более сильные основные свойства по сравнению с другими аминами.
4. Теория Льюиса
Дж. Льюисом (1923) была предложена более общая теория кислот и оснований, опирающаяся на строение внешних электронных оболочек атомов. По теории Льюиса кислотные и основные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием связи.
Кислотами Льюиса могут быть атом, молекула или катион, обладающие вакантной орбиталью и способные принимать пару электронов с образованием ковалентной связи. Примерами аогут служить галогениды элементов второй и третьей групп ПСЭ ( BF3, AlCl3, FeCl3, ZnCl2, катионы металлов, Н + . кислоты Льюиса в гетеролитических реакциях участвуют как электрофильные реагенты.
Основаниями Льюиса могут быть атом, молекула или анион, имеющие пару валентных электронов, которые они должны предоставить партнеру для образования ковалентной связи. Основания Льюиса представляют собой нуклеофильные реагенты. К ним относятся амины, спирты, простые эфиры, тиолы, тиоэфиры, соединения, содержащие р-связи или систему сопряженных р-связей.
Важным следствием теории Льюиса является то, что любое органическое соединение можно представить как кислотно-основной комплекс. Например, этилиодид можно рассматривать как комплекс, состоящий из этил-катиона С2Н5 + (кислота Льюиса) и иодид иона -I (основание Льюиса). Отсюда большинство реакций с этилиодидом можно классифицировать как обмен иодид-иона на другие основания Льюиса (ОН - , СN - , NH2 - , H3C-O - ) или как обмен этил-катиона на другие кислоты Льюиса (К +, Н + и др.).
Вопросы для самоконтроля
1. Современные представления о кислотах и основаниях.
2. Теория Бренстеда-Лоури. Сопряженные кислоты и основания.
3. Кислотные свойства органических соединений с водородосодержащими функциональными группами (спирты, фенолы, тиолы, карбоновые кислоты, амины).
4. Основные свойства органических соединений. р-основания и n-основания. Теория Льюиса.
5. Факторы, влияющие на реакционную способность кислот и оснований.
6. Объясните, какое из соединений проявляет более сильные кислотные свойства и почему?
7. Какая кислота является более сильной и почему?
8. Объясните, почему анилин проявляет более слабые основные свойства, по сравнению с этиламином.
9. Напишите какая из реакций доказывает более сильные кислотные свойства фенола по сравнению со спиртами:
10. В качестве антидота при отравлении солями мышьяка был предложен 2,3-димеркаптопропанол. Объясните, чем определяется его большая кислотность в сравнении с пропантриолом.
Рекомендуемая литература
Подобные документы
Электронная теория кислот и оснований Льюиса. Теория электролитической диссоциации Аррениуса. Протонная теория, или теория кислот и оснований Бренстеда. Основность и амфотерность органических соединений. Классификация реагентов органических реакций.
презентация [375,0 K], добавлен 10.12.2012
Понятие оснований, как класса неорганических соединений. Основания в теориях Дж. Бренстеда и Г. Льюиса. Физические свойства оснований. Основные способы получения оснований. Химические свойства. Использование оснований в химии и промышленности.
курсовая работа [2,4 M], добавлен 24.06.2008
Краткие исторические сведения о происхождении представлений о кислотах и основаниях. Теория электрической диссоциации Аррениуса-Оствальда. Протолитическая теория кислот и оснований Брёнстеда-Лоури. Бикарбонатная и гемоглобиновая буферная система крови.
презентация [1,0 M], добавлен 17.11.2012
Понятие кислот по Бренстеду, способных отдавать протон, а оснований - его присоединяющих. Химизм кислотно-основных взаимодействий растворения серной кислоты в воде, способность к автопротолизу. Константа основности в оценке кислотности растворов.
доклад [18,4 K], добавлен 15.12.2009
Эволюция представлений о кислотах и основаниях. Взаимодействие паров соляной кислоты и аммиака. Электролитическая диссоциация Аррениуса-Оствальда. Протонная теория Брёнстеда-Лоури. Сравнение окислительно-восстановительной активности различных веществ.
Читайте также:

