Реферат правило фаз гиббса
Обновлено: 05.07.2024
Предположим, что гетерогенная система состоит из ф фаз, в каждую из которых входят к компонентов. В дальнейшем нижними индексами будем обозначать компоненты системы, а верхними фазы (так как это сделано в выражении (5.1) для обозначения химических потенциалов).
При равновесии многокомпонентной гетерогенной системы должны выполняться следующие условия.
а) условие термического равновесия:
T 1 = T 2 = … = T ф (5.2)
б) условие механического равновесия:
p 1 = p 2 = … = p ф (5.3)
в) условие химического равновесия:
Выражения (5.2) и (5.3) представляют собой ряды тождеств, так как температура и давление являются независимыми переменными. Химические потенциалы представляют собой функции, зависящие от температуры, давления и концентраций. Общий вид этих функций может быть выражен, например, таким образом:
При переходе от одной фазы к другой вид функции (5.5) меняется, поэтому равенства типа
= ; = и т.д. представляют собой уравнения.
Каждая cтрока системы (5.4) позволяет составить ( ф - 1 ) независимых уравнений. Число cтрок в системе равно к, поэтому общее число независимых уравнений
к ( ф - 1 ) (5.6)
В число независимых переменных входят температура, давление и концентрации компонентов. В каждой фазе к компонентов, но при заданных температуре и давлении выбрать произвольно к концентрации нельзя. Например, для смеси не реагирующих между собой идеальных газов согласно закону Дальтона:
При заданном общем давлении p можно произвольно менять парциальные давления кроме одного. Следовательно, независимых переменных в этой случае (к - 1 ).
Другой пример: жидкий раствор, в состав которого входят к компонентов с концентрациями x1, x2, … xк, выраженные в мольных долях. Ясно, что x1 + x2 + … + xк = 1, и, следовательно, при произвольной изменении (к - 1) концентрации, выбор последней концентрации определится уравнением = 1.
Для каждой фазы можно записать уравнение состояния, которое связывает температуру, давление и концентрации компонентов, поэтому число независимых концентраций в каждой фазе (к - 1). Общее число независимых переменных с учетом температуры и давления будет:
ф(к - 1) + 2 (5.7)
Если число независимых переменных (5.7) больше числа независимых уравнений (5.6), то разность этих двух чисел
С = ф(к - 1) + 2 - к( ф - 1 )
представляет собой число переменных, которым можно придавать произвольные значения при данном числе фаз.
С – число степеней свободы
С = к + 2 - ф (5.8)
Соотношение (5.8) называется законом фазового равновесия или правилом фаз Гиббса.
Число степеней свободы - число независимых переменных (давление, температура, концентрации), которые можно менять в некоторых пределах без изменения числа фаз. Система, имеющая две степени свободы, называется бивариантной, а имеющая одну степень свободы - моновариантной. Если числи степеней свободы равно нулю, то такая система инвариантна.
Фазовое равновесие в однокомпонентных системах.
Уравнение Клапейрона-Клаузиуса
Рассмотрим закономерности, связанные с превращением одной фазы чистого вещества в другую: испарение, плавление, переход твердого тела из одной модификации в другую. Для примера возьмем равновесие между жидкостью и её паром при постоянных температуре и давлении. Для этого поместим жидкость на дно цилиндра, погруженного в термостат. Давление пара, находящегося в равновесии с жидкостью, уравновешено внешним давлением ( Рис.10 ).
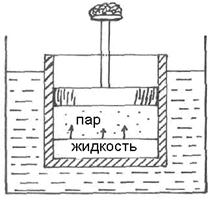
Условие равновесия такой системы согласно (4.12):
В силу постоянства состава в однокомпонентной системе химический потенциал тождественен мольному термодинамическому потенциалу ().
Следовательно, условие равновесия может быть записано так:
При повышении давления на бесконечно малую величину dp мольные изобарно-изотермические потенциалы жидкости и пара изменяются также на бесконечно малую величину:
dG = - SdT + Vdp
При Т =const для одного моля жидкости и пара соответственно получим:
Так как мольный объем пара () больше мольного объема жидкости () , то при установлении нового состояния равновесия часть пара должна превратиться в жидкость. Этот вывод согласуется с принципом Ле Шателье-Брауна, согласно которому под воздействием внешних сил система должна так изменить свое состояние, чтобы уменьшить это воздействие. Если при постоянном давлении повысим температуру на dТ, то изменение изобарно-изотермических потенциалов жидкости и пара будет иметь вид:
Ясно, что ,так как мольная энтропия пара () больше мольной энтропии жидкости (). Следовательно, при установлении нового состояния равновесия часть жидкости должна будет испаряться. Это также подтверждается принципом Ле Шателье-Брауна, так как при повышении температуры в системе должны идти процессы с поглощением тепла.
В самом общем случае при постоянных температуре и давлении равновесие двух фаз однокомпонентной системы:
можно записать, как
После одновременного изменения температуры на dT и давления на dp установится новое состояние равновесия:
Запишем уравнения полных дифференциалов для изобарно-изотермических потенциалов 1 и 2 фаз:
Для разновесных изотермических фазовых переходов
где – мольная теплота фазового перехода,
– температура фазового перехода.
Подставим (5.11) в уравнение (5.10), получим
Уравнение (5.12) называется уравнением Клапейрона-Клаузиуса.
Фазовые переходы 1 рода.
Фазовые переходы, характеризующиеся равенством изобарно-изотермических потенциалов равновесных фаз и скачкообразным изменением энтропии и объема при переходе вещества из одной фазы в другую, называется фазовыми переходами первого рода.
Энтропия и объем являются первыми производными изобарно-изотермического потенциала по соответствующим переменным ( см. раздел Термодинамика):
Поэтому фазовые переходы 1 рода характеризуются скачкообразным изменением первых производных изобарного потенциала.
Испарение - пример фазового перехода 1 рода:
Переход жидкой фазы в газообразную сопровождается поглощением тепла (). Мольный объем газа всегда больше соответствующего объема жидкости Поэтому при фазовом переходе в уравнении Клапейрона-Клаузиуса. (5.12) производная всегда положительна. Следовательно, температура испарения всегда повышается с ростом давления.
При температурах, далеких от критической, мольной объем пера всегда во много раз превосходит мольный объем жидкости. Поэтому можно пренебречь мольным объемом жидкости в уравнении (5.12), которое принимает вид:
Если пар вдали от критической точки считать идеальным газом, то
Подставим (5.14) в уравнение (5.13) и проинтегрируем полученное выражение, считая постоянной величиной в небольшом интервале температур:
Представив зависимость давления насыщенного пара от температуры в координатах , можно найти мольную теплоту испарения (Рис.11).
 |
В действительности теплота испарения в области температур далекой от критической, немного уменьшается с ростом температуры и сильно убывает вблизи критической точки, при которой .Аналогичным уравнением описывается сублимация твердого тела.
Теплоты испарения различных жидкостей связаны с температурами кипения эмпирическим правилом Трутона: изменение мольной энтропии испарения различных жидкостей при нормальной температуре кипения одинаковы:
Это правило не выполняется для ассоциированных и полярных жидкостей.
Плавление является также примером фазового перехода 1 рода и к нему применимо уравнение Клапейрона-Клаузиуса:
Для этого процесса

Теплота плавления - теплота перехода твердой фазы в жидкую – положительна . Мольные объемы твердого тела и жидкости сравнимы между собой. Для большинства веществ мольный объем жидкости больше мольного объема твердого тела (). В этом случае из уравнения (5.16) следует, что производная положительна, а это значит, что с повышением давления увеличивается температура плавления. Для таких веществ, как вода, висмут и некоторых других при температуре плавления мольный объем жидкости меньше мольного объема твердого тела (). Следовательно,
Изучение вклада У. Гиббса, американского физика-теоретика, одного из создателей термодинамики и статистической механики в мировую науку. Описание сущности термодинамического потенциала, правила фаз, распределения Гиббса, энтальпии, энтропии и энергии.
| Рубрика | Физика и энергетика |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 07.11.2015 |
| Размер файла | 22,0 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
В своем реферате я расскажу об энергии Гиббса.
Гиббс Джозайя Уиллард (1839-1903), американский физик-теоретик, один из создателей термодинамики и статистической механики. Разработал теорию термодинамических потенциалов, открыл общее условие равновесия гетерогенных систем -- правило фаз, вывел уравнения Гиббса -- Гельмгольца, Гиббса -- Дюгема, адсорбционное уравнение Гиббса. Установил фундаментальный закон статистической физики -- распределение Гиббса. Предложил графическое изображение состояния трехкомпонентной системы (треугольник Гиббса). Заложил основы термодинамики поверхностных явлений и электрохимических процессов. Ввел понятие адсорбции. энергия гиббс термодинамика физик
В начале своей работы я думаю необходимо представить основные понятия теории Гиббса.
ПРАВИЛО ФАЗ ГИББСА в термодинамике: число равновесно сосуществующих в какой-либо системе фаз не может быть больше числа образующих эти фазы компонентов плюс, как правило, 2. Установлено Дж. У. Гиббсом в 1873-76.
ГИББСА ЭНЕРГИЯ (изобарно-изотермический потенциал, свободная энтальпия), один из потенциалов термодинамических системы. Обозначается G, определяется разностью между энтальпией H и произведением энтропии S на термодинамическую температуру Т:
Изотермический равновесный процесс без затраты внешних сил может протекать самопроизвольно только в направлении убывания энергии Гиббса до достижения ее минимума, которому отвечает термодинамическое равновесное состояние системы. Названа по имени Дж. У. Гиббса.
ПОТЕНЦИАЛЫ ТЕРМОДИНАМИЧЕСКИЕ, функции объема, давления, температуры, энтропии, числа частиц и других независимых макроскопических параметров, характеризующих состояние термодинамической системы. К потенциалам термодинамическим относятся внутренняя энергия, энтальпия, изохорно-изотермический потенциал (Гельмгольца энергия), изобарно-изотермический потенциал (Гиббса энергия). Зная какие-либо потенциалы термодинамические как функцию полного набора параметров, можно вычислить любые макроскопические характеристики системы и рассчитать происходящие в ней процессы.
РАСПРЕДЕЛЕНИЕ ГИББСА каноническое, распределение вероятностей различных состояний макроскопической системы с постоянным объемом и постоянным числом частиц, находящейся в равновесии с окружающей средой заданной температуры; если система может обмениваться частицами со средой, то распределение Гиббса называется большим каноническим. Для изолированной системы справедливо Гиббса распределение микроканоническое, согласно которому все микросостояния системы с данной энергией равновероятны. Названо по имени открывшего это распределение Дж. У. Гиббса.
Реакции присоединения радикалов к непредельным соединениям лежат в основе современной технологии получения полимеров, сополимеров и олигомеров. Эти реакции протекают при крекинге углеводородов, галоидировании олефинов, окислении непредельных соединений. Они широко используются в синтезе разнообразных соединений и лекарственных препаратов. Реакции присоединения атомов водорода и гидроксильных соединений к непредельным и ароматическим соединениям сопровождают фотолиз и радиолиз органических материалов и биологических объектов.
В реакции радикального присоединениятипа
X*+ CH2=CHY ® XCH2C*HY
рвется двойная С=С-связь и образуется связь С- X. Как правило, образующаяся
s -связь прочнее рвущейся p -С- С-связи, и поэтому реакция присоединения экзотермична. Это четко видно из сравнения энтальпии реакции DН и прочности образующейся связи D (Et-X).
Другой важный фактор, влияющий на энтальпию реакции, -энергия стабилизации образующегося радикала XCH2C*H2Y: чем больше эта энергия, тем больше теплота присоединения радикала X* к олефину. Энергию стабилизации можно охарактеризовать, например, разницей прочности связей C- H в соединениях Pr- H и EtYHC- H. Ниже приведены данные, характеризующие вклад энергии стабилизации радикала CH3CH2C* H2Y, образующегося в результате присоединения метильного радикала к мономеру CH2=CHY, в энтальпию этой реакции.
Видно, что чем больше энергия стабилизации радикала, тем меньше энтальпия реакции.
Все реакции присоединения протекают с уменьшением энтропии, т. к. происходит соединение двух частиц в одну. В силу этого для реакций присоединения энергия Гиббса, и при достаточной высокой температуре экзотермическая реакция присоединения является обратимой, т. к.
На любой процесс (реакцию) действуют два фактора:
Энатльпийный (экзо- или ендо) - Д H;
При объединении этих двух факторов получаем:
G = H - TS - Энергия Гиббса.
Физический смысл Энергии Гиббса:
Ш если изменения ДGр,т меньше нуля - то самопроизвольно идет процесс в заданном направлении;
Ш если изменения ДGр,т больше нуля - самопроизвольно идет обратный процесс, а прямая реакция не идет совсем;
если изменения ДGр,т равна нулю - это важнейшее термодинамическое равновесие.
Вывод: состояние термодинамического равновесия чрезвычайно устойчиво, так как при постоянстве Р, Т система выйти из равновесного состояния не может, так как выход равен возрастанию энергии Гиббса.
Чтобы система вышла из состояния равновесия необходимо изменить какие-либо внешние факторы (Р, Т, концентрация и так далее).
Есть понятие стандартное состояние Гиббса:
ДGf0 298 [кДж / моль] - справочная величина.
Пользуясь справочными данными можно рассчитать изменение энергии Гиббса любого процесс.
ДG 298 = УniД * ДGf0 298 - УnjД * ДGf0 298
большинство процессов протекает при t более высоких чем стандартная (298). Для пересчета энергии Гиббса на более высокие температуры необходимы справочные данные по теплоемкостям, данные представленные в виде зависимости от температуры.
В справочниках эти данные обычно представлены в виде степенного ряда.
Cp0 = a + bT + cT2 + c'Т-2
где a, b, c, c' - для каждого вещества свои.
Когда необходимо рассчитать для процесса
ДCp0 = Дa + ДbT + ДcT2 + Дc'Т-2
Где Дa, Дb, Дc, Дc' - будучи функциями состояния, рассчитываются по формулам:
Термодинамика фазовых равновесий. Фазовые равновесия в гетерогенных системах. Правило фаз Гиббса.
К фазовым равновесиям относятся переходы типа:
Ш Твердая фаза в равновесии с жидкостью (плавление - кристаллизация);
Ш Жидкая фаза в равновесии с паром (испарение - конденсация);
Ш Твердая фаза в равновесии с паром (возгонка - сублимация).
Основные понятия правила фаз:
Фаза (Ф) - это часть системы, имеющая границы раздела с другими ее частями.
Компонент (к) - это химически однородная составляющая системы, обладающая всеми ее свойствами.
Число степеней свободы (С) - это число независимых переменных которые можно произвольно менять не меняя числа фаз в системе.
(С, Ф, К) С = К - Ф +2
Существует правило фаз Гиббса.
Различают однокомпонентные, двухкомпонентные, трехкомпонентные системы (К=1, К=2, К=3).
Сmin = 1 - 3 + 2 = 0
Cmax = 1 - 1 + 2 = 2
Для описания однокомпонентных систем выбрали координаты:
Р (давление насыщенного пара) Т (температура)
dP / dT = ДHф.п. / (Tф.п. * ДV)
эта зависимость сохраняется в силе для абсолютно всех фазовых переходов.
Каждая линия диаграммы отвечает своему фазовому переходу:
Поля диаграммы: твердая фаза, жидкая фаза, пар.
С = 2 (на полях Сmax)
Точка О - отвечает равновесию трех фаз: Тв. - Ж - Пар.
С = 0 - это значит, что нельзя менять ни температуру ни давление.
Остановимся теперь на химическом потенциале -- величине, определяющей термодинамические характеристики не системы в целом, а одной молекулы в этой системе.
Если добавлять в систему молекулу за молекулой при постоянном давлении, то на добавление каждой новой частицы надо затратить в точности ту же работу, что на добавление любой предыдущей: объем системы будет расти, а плотность системы -- и интенсивность взаимодействий в ней -- меняться не будет. Поэтому термодинамическое состояние молекулы в системе удобно определять величиной свободной энергии Гиббса G, деленной на число молекул N,
Химический потенциал -- или, что то же самое, свободная энергия Гиббса в расчете на одну молекулу -- нам пригодится во второй части сегодняшней лекции, когда речь пойдет о распределении молекул между фазами. Дело в том, что молекулы перетекают из той фазы, где их химический потенциал выше, в ту, где их химический потенциал ниже, -- это понижает общую свободную энергиюсистемы и приближает ее к равновесию. А в равновесии химический потенциал молекул в одной фазе равен химическому потенциалу тех же молекул в другой фазе.
В последнее время при изучении свойств пластифицированных систем были обнаружены экспериментальные факты, противоречащие общепринятым представлениям и в ряде случаев не получившие должного объяснения. Это касается термодинамики пластифицированных систем, определения температуры стеклования (Тс) и оценки свойств систем, содержащих относительно небольшие количества пластификатора. Факты эти имеют большое значение для практики и теории, они связаны с метастабильностью пластифицированных систем и с неправильным использованием некоторых методов изучения их свойств.
Известно, что все системы делятся на устойчивые или стабильные, неустойчивые или лабильные и метастабильные, которые наиболее распространены. Поэтому изучение теплофизических свойств метастабильных систем имеет большое значение.
Метастабильная система устойчива по отношению ко всем системам, бесконечно мало отличающимся от нее, но имеется по крайней мере одна система, по отношению к которой она неустойчива. Состояние А, обладающее наименьшей энергией Гиббса, является истинно устойчивым, а состояние Б, обладающее большей энергией Гиббса, - метастабильным состоянием по отношению к состоянию А. Однако для перехода системы из состояния Б в состояние А требуется преодолеть потенциальный барьер. Если энергия возмущения меньше потенциального барьера, то система остается в состоянии Б.
Стабильность таких систем зависит от соотношения времени релаксации (р) и времени опыта (оп); под временем опыта подразумевается не только время лабораторного опыта, но и время хранения и эксплуатации изделия. Если р >> оп, то система может находиться в метастабильном состоянии неограниченное время и она ничем не отличается от истинно устойчивой системы. Поэтому к ней не следует применять термин "неравновесная". Наоборот, в настоящее время широко распространен термин "метастабильное равновесие". Система в состоянии А находится в истинном равновесии, а система в состоянии Б - в метастабильном равновесии.
Метастабильное состояние является типичным для полимерных систем вследствие очень большого размера макромолекул полимеров и значительных р. Такие системы, например, можно получить закалкой, т.е. быстрым охлаждением полимера или полимерной смеси до температуры значительно ниже их Тс. При этом не изменяется структура системы и сохраняется приданная ей при более высокой температуре структура. Это означает, что система "помнит" свое прошлое. Такие системы называют системами с "памятью". Исследованию их свойств посвящено много работ, разрабатывается термодинамика этих систем. Эти свойства зависят от предыстории систем. К системам с памятью относятся все полимеры и полимерные композиции, находящиеся при температуре намного ниже их Тс. Время релаксации происходящих в них процессов очень велико, в связи с чем стеклообразные полимеры при Т

Гиббс Джозайя Уиллард (1839-1903), американский физик-теоретик, один из создателей термодинамики и статистической механики. Разработал теорию термодинамических потенциалов, открыл общее условие равновесия гетерогенных систем — правило фаз, вывел уравнения Гиббса — Гельмгольца, Гиббса — Дюгема, адсорбционное уравнение Гиббса. Установил фундаментальный закон статистической физики — распределение Гиббса. Предложил графическое изображение состояния трехкомпонентной системы (треугольник Гиббса). Заложил основы термодинамики поверхностных явлений и электрохимических процессов. Ввел понятие адсорбции.
ЭНЕРГИЯ ГИББСА
В начале своей работы я думаю необходимо представить основные понятия теории Гиббса.
ПРАВИЛО ФАЗ ГИББСА в термодинамике: число равновесно сосуществующих в какой-либо системе фаз не может быть больше числа образующих эти фазы компонентов плюс, как правило, 2. Установлено Дж. У. Гиббсом в 1873-76.
ГИББСА ЭНЕРГИЯ (изобарно-изотермический потенциал, свободная энтальпия), один из потенциалов термодинамических системы. Обозначается G , определяется разностью между энтальпией H и произведением энтропии S на термодинамическую температуру Т : G = H — T·S . Изотермический равновесный процесс без затраты внешних сил может протекать самопроизвольно только в направлении убывания энергии Гиббса до достижения ее минимума, которому отвечает термодинамическое равновесное состояние системы. Названа по имени Дж. У. Гиббса.
ПОТЕНЦИАЛЫ ТЕРМОДИНАМИЧЕСКИЕ, функции объема, давления, температуры, энтропии, числа частиц и других независимых макроскопических параметров, характеризующих состояние термодинамической системы. К потенциалам термодинамическим относятся внутренняя энергия, энтальпия, изохорно-изотермический потенциал (Гельмгольца энергия), изобарно-изотермический потенциал (Гиббса энергия). Зная какие-либо потенциалы термодинамические как функцию полного набора параметров, можно вычислить любые макроскопические характеристики системы и рассчитать происходящие в ней процессы.
РАСПРЕДЕЛЕНИЕ ГИББСА каноническое, распределение вероятностей различных состояний макроскопической системы с постоянным объемом и постоянным числом частиц, находящейся в равновесии с окружающей средой заданной температуры; если система может обмениваться частицами со средой, то распределение Гиббса называется большим каноническим. Для изолированной системы справедливо Гиббса распределение микроканоническое, согласно которому все микросостояния системы с данной энергией равновероятны. Названо по имени открывшего это распределение Дж. У. Гиббса.
Реак ции присоединения радикалов к непредельным соединениям лежат в основе современной технологии получения полимеров, сополимеров и олигомеров. Эти реакции протекают при крекинге углеводородов, галоидировании олефинов, окислении непредельных соединений. Они широко используются в синтезе разнообразных соединений и лекарственных препаратов. Реакции при с оединения атомов водорода и гидроксильных соединений к непредельным и ароматическим соединениям сопровождают фотолиз и радиолиз органических материалов и биологических объектов.
рвется двойная С=С-связь и образуется связь С- X. Как правило, образующаяся
s -связь прочнее рвущейся p -С- С-связи, и поэтому реакция присоединения экзотермична. Это четко видно из сравнения энтальпии реакции DН и прочности образующейся связи D (Et-X) в табл. 1.
Другой важный фактор, влияющий на энтальпию реакции, -энергия стабилизации образующегося радикала XCH2 C · H2 Y: чем больше эта энергия, тем больше теплота присоединения радикала X · к олефину. Энергию стабилизации можно охарактеризовать, например, разницей прочности связей C- H в соединениях Pr- H и EtYHC- H. Ниже приведены данные, характеризующие вклад энергии стабилизации радикала CH3 CH2 C · H2 Y, образующегося в результате присоединения метильного радикала к мономеру CH2 =CHY, в энтальпию этой реакции.
Энтальпия, энтропия и энергия Гиббса присоединения атомов и радикалов X · к этилену.
Дж моль - 1 К - 1
Видно, что чем больше энергия стабилизации радикала, тем меньше энтальпия реакции.
Все реакции присоединения протекают с уменьшением энтропии, т. к. происходит соединение двух частиц в одну (см. табл. 8.1). В силу этого для реакций присоединения энергия Гиббса, и при достаточной высокой температуре экзотермическая реакция присоединения является обратимой, т. к. DG = DH -T D S .
На любой процесс (реакцию) действуют два фактора:
Энатльпийный (экзо- или ендо) – Δ H;
При объединении этих двух факторов получаем:
G = H – TS – Энергия Гиббса.
Физический смысл Энергии Гиббса:
-если изменения ΔGр,т меньше нуля – то самопроизвольно идет процесс в заданном направлении;
-если изменения ΔGр,т больше нуля – самопроизвольно идет обратный процесс, а прямая реакция не идет совсем;
 |
если изменения ΔGр,т равна нулю – это важнейшее термодинамическое равновесие.
Вывод: состояние термодинамического равновесия чрезвычайно устойчиво, так как при постоянстве Р, Т система выйти из равновесного состояния не может, так как выход равен возрастанию энергии Гиббса.
Чтобы система вышла из состояния равновесия необходимо изменить какие-либо внешние факторы (Р, Т, концентрация и так далее).
Есть понятие стандартное состояние Гиббса:
ΔGf 0 298 [кДж / моль] – справочная величина.
Пользуясь справочными данными можно рассчитать изменение энергии Гиббса любого процесс.
ΔG 298 = Σni Δ * ΔGf 0 298 – Σnj Δ * ΔGf 0 298
большинство процессов протекает при t более высоких чем стандартная (298). Для пересчета энергии Гиббса на более высокие температуры необходимы справочные данные по теплоемкостям, данные представленные в виде зависимости от температуры.
В справочниках эти данные обычно представлены в виде степенного ряда.
Cp 0 = a + bT + cT 2 + c’Т -2
где a, b, c, c’ – для каждого вещества свои.
Когда необходимо рассчитать для процесса
ΔCp 0 = Δa + ΔbT + ΔcT 2 + Δc’Т -2
Где Δa, Δb, Δc, Δc’ - будучи функциями состояния, рассчитываются по формулам:
Термодинамика фазовых равновесий. Фазовые равновесия в гетерогенных системах. Правило фаз Гиббса.
К фазовым равновесиям относятся переходы типа:
-Твердая фаза в равновесии с жидкостью (плавление – кристаллизация);
-Жидкая фаза в равновесии с паром (испарение – конденсация);
-Твердая фаза в равновесии с паром (возгонка – сублимация).
Основные понятия правила фаз:
Фаза (Ф) – это часть системы, имеющая границы раздела с другими ее частями.
Компонент (к) – это химически однородная составляющая системы, обладающая всеми ее свойствами.
Число степеней свободы (С) – это число независимых переменных которые можно произвольно менять не меняя числа фаз в системе.
(С, Ф, К) С = К – Ф +2
Существует правило фаз Гиббса.
Различают однокомпонентные, двухкомпонентные, трехкомпонентные системы (К=1, К=2, К=3).
Сmin = 1 – 3 + 2 = 0
Cmax = 1 – 1 + 2 = 2
Для описания однокомпонентных систем выбрали координаты:

Р (давление насыщенного пара)

Т (температура)
эта зависимость сохраняется в силе для абсолютно всех фазовых переходов.
![]()
![]()
![]()
![]()
Р c
Тв. Ж. a





b Пар
 |
Каждая линия диаграммы отвечает своему фазовому переходу:
Поля диаграммы: твердая фаза, жидкая фаза, пар.
С = 2 (на полях Сmax )
Точка О – отвечает равновесию трех фаз: Тв. – Ж – Пар.
С = 0 – это значит, что нельзя менять ни температуру ни давление.
Остановимся теперь на химическом потенциале — величине, определяющей термодинамические характеристики не системы в целом, а одной молекулы в этой системе.
Если добавлять в систему молекулу за молекулой при постоянном давлении , то на добавление каждой новой частицы надо затратить в точности ту же работу, что на добавление любой предыдущей: объем системы будет расти, а плотность системы — и интенсивность взаимодействий в ней — меняться не будет. Поэтому термодинамическое состояние молекулы в системе удобно определять величиной свободной энергии Гиббса G, деленной на число молекул N,
Химический потенциал — или, что то же самое, свободная энергия Гиббса в расчете на одну молекулу — нам пригодится во второй части сегодняшней лекции, когда речь пойдет о распределении молекул между фазами. Дело в том, что молекулы перетекают из той фазы, где их химический потенциал выше, в ту, где их химический потенциал ниже, — это понижает общую свободную энергию системы и приближает ее к равновесию. А в равновесии химический потенциал молекул в одной фазе равен химическому потенциалу тех же молекул в другой фазе.
В последнее время при изучении свойств пластифицированных систем были обнаружены экспериментальные факты, противоречащие общепринятым представлениям и в ряде случаев не получившие должного объяснения. Это касается термодинамики пластифицированных систем, определения температуры стеклования (Тс ) и оценки свойств систем, содержащих относительно небольшие количества пластификатора. Факты эти имеют большое значение для практики и теории, они связаны с метастабильностью пластифицированных систем и с неправильным использованием некоторых методов изучения их свойств.
Известно, что все системы делятся на устойчивые или стабильные, неустойчивые или лабильные и метастабильные, которые наиболее распространены. Поэтому изучение теплофизических свойств метастабильных систем имеет большое значение.
Метастабильная система устойчива по отношению ко всем системам, бесконечно мало отличающимся от нее, но имеется по крайней мере одна система, по отношению к которой она неустойчива. Состояние А, обладающее наименьшей энергией Гиббса, является истинно устойчивым, а состояние Б, обладающее большей энергией Гиббса, - метастабильным состоянием по отношению к состоянию А. Однако для перехода системы из состояния Б в состояние А требуется преодолеть потенциальный барьер. Если энергия возмущения меньше потенциального барьера, то система остается в состоянии Б.
Стабильность таких систем зависит от соотношения времени релаксации (р ) и времени опыта (оп ); под временем опыта подразумевается не только время лабораторного опыта, но и время хранения и эксплуатации изделия. Если >> оп , то система может находиться в метастабильном состоянии неограниченное время и она ничем не отличается от истинно устойчивой системы. Поэтому к ней не следует применять термин "неравновесная". Наоборот, в настоящее время широко распространен термин "метастабильное равновесие". Система в состоянии А находится в истинном равновесии, а система в состоянии Б - в метастабильном равновесии.
Метастабильное состояние является типичным для полимерных систем вследствие очень большого размера макромолекул полимеров и значительных р . Такие системы, например, можно получить закалкой, т.е. быстрым охлаждением полимера или полимерной смеси до температуры значительно ниже их Тс . При этом не изменяется структура системы и сохраняется приданная ей при более высокой температуре структура. Это означает, что система "помнит" свое прошлое. Такие системы называют системами с "памятью". Исследованию их свойств посвящено много работ, разрабатывается термодинамика этих систем. Эти свойства зависят от предыстории систем. К системам с памятью относятся все полимеры и полимерные композиции, находящиеся при температуре намного ниже их Тс. Время релаксации происходящих в них процессов очень велико, в связи с чем стеклообразные полимеры при Т 0 , когда все величины энтропии приняты без нулевых слагаемых. Это может привести к ошибкам. Из изложенного следует, что необходимо развивать различные методы, которые должны давать одинаковые результаты. Для этого необходимо результаты, полученные разными методами, сопоставлять и систематически обсуждать.
В своей работе я рассмотрела энергию Гиббса и относящиеся к этой теории понятия. Я рассказала о термодинамические потенциалы, правила фаз, распределение Гиббса, энтальпию, энтропию и конечно саму энергию Гиббса.
Вклад Джозайи Уилларда Гиббса в науку имеет большое значение. Его труды и исследования послужили основой для научных разработок его последователей, а так же имеют практическое значение.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ:
1. Теплофизика метастабильных жидкостей. Свердловск, УНЦ АН СССР, 1987.
2. Пригожин И., Дефей Р. Химическая термодинамика. Пер. с англ. Под ред. В.А. Михайлова. Новосибирск, Наука, 1966.
3. Кубо Р. Термодинамика. Пер. с англ. Под ред. Д.М. Зубарева, Н.М. Плакиды. М. Мир, 1970.
Диаграмма, выражающая зависимость состояния системы от внешних условий или от состава системы, называется фазовой диаграммой. Соотношение между давлением (р), температурой (7) и объемом (V) фазы можно представить трехмерной фазовой диаграммой. Каждая точка (се называют фигуративной точкой) на такой диаграмме изображает некоторое равновесное состояние. Обычно удобнее работать с сечениями этой… Читать ещё >
Правило фаз Гиббса ( реферат , курсовая , диплом , контрольная )
Правило фаз Гиббса утверждает, что число степеней свободы С равновесной термодинамической системы равно разности между числом компонентов К и числом фаз Ф, плюс число факторов п, влияющих на равновесие:

(5.1).
Правило фаз позволяет, но числу степеней свободы предсказывать поведение системы при изменении одного, двух или более внешних условий и вычислить максимальное число фаз, которые могут находиться в равновесии при данных условиях. При помощи правила фаз можно предсказать термодинамическую возможность существования системы.
Обычно величина п = 2, так как учитываются только два фактора: температура и давление. Другие факторы (электрические, магнитные, гравитационные) учитываются, но мере необходимости. Тогда число степеней свободы равно.

Если в системе температура (или давление) сохраняется постоянной, то число параметров состояния снижается еще на единицу.

Если же в системе поддерживаются постоянными температура и давление (п = 0), то число степеней равно.

Число степеней свободы для однокомпонентной двухфазной системы (например, кристалл — жидкость, кристалл — пар, жидкость — пар) равно.

Это означает, что каждой температуре отвечает одно единственное значение давления и, наоборот, любое давление в двухфазной однокомпонентной системе реализуется только при строго определенной температуре.
Следовательно, нагревание любых двух сосуществующих фаз должно сопровождаться одновременно строго определенным изменением давления, т. е. температура и давление двух фаз связаны функциональной зависимостью P=f (Т).
Пример 5.1. Определить наибольшее число фаз, которые могут находиться в равновесии в системе, состоящей из воды и хлорида натрия.
Решение. В этой системе число компонентов (К) равно двум. Следовательно, С = = 4 — Ф. Наибольшее число фаз отвечает наименьшему числу степеней свободы. Так как число степеней свободы не может быть отрицательным, то наименьшее значение С равно нулю. Следовательно, наибольшее число фаз равно четырем. Этому условию заданная система удовлетворяет, когда раствор хлорида натрия в воде находится в равновесии одновременно со льдом, твердой солью и водяным паром. В таком состоянии система безвариантна (инвариантна), т. е. это состояние достигается только при строго определенных температуре, давлении и концентрации раствора.
Однокомпонентные системы
При К = 1 уравнение правила фаз примет вид.

Если в равновесии одна фаза, то С = 2. В этом случае говорят, что система бивариантна;
две фазы — С = 1, система моновариантна;
три фазы — С = 0, система инвариантна.
Диаграмма, выражающая зависимость состояния системы от внешних условий или от состава системы, называется фазовой диаграммой. Соотношение между давлением (р), температурой (7) и объемом (V) фазы можно представить трехмерной фазовой диаграммой. Каждая точка (се называют фигуративной точкой) на такой диаграмме изображает некоторое равновесное состояние. Обычно удобнее работать с сечениями этой диаграммы плоскостью р — Т (при V = const) или плоскостью р — V (при Т = const). Разберем более детально случай сечения плоскостью р — Т(при V = const).
Рассмотрим в качестве примера фазовую диаграмму одиокомпонентной системы — воды (рис. 5.1).
Фазовая диаграмма воды
Фазовая диаграмма воды в координатах р — Т представлена на рис. 5.1. Она составлена из трех фазовых полей — областей различных (р, Т) значений, при которых вода существует в виде определенной фазы — льда, жидкой воды или пара (обозначены буквами Л, Ж и П соответственно). Для этих однофазных областей число степеней свободы равно двум, равновесие бивариантно (С = 3 — 1 = 2). Это означает, что для описания системы необходимы две независимые переменные — температура и давление. Эти переменные могут изменяться в данных областях независимо, и при этом не произойдет изменения вида и числа фаз.
Фазовые поля разделены тремя граничными кривыми.

Рис. 5.1. Фазовая диаграмма воды.
Кривая AВ — кривая испарения, выражает зависимость давления пара жидкой воды от температуры (или представляет зависимость температуры кипения воды от давления). Другими словами, эта линия отвечает двухфазному равновесию жидкая вода — пар, и число степеней свободы, рассчитанное по правилу фаз, составляет С = 3 — 2 = 1. Такое равновесие моновариаптно. Это означает, что для полного описания системы достаточно определить только одну переменную — либо температуру, либо давление. Вторая переменная является зависимой, она задается формой кривой ЛВ. Таким образом, для данной температуры существует только одно равновесное давление или для данного давления пара — только одна равновесная температура.
При давлениях и температурах, соответствующих точкам ниже линии АВ, жидкость будет полностью испаряться, и эта область является областью пара.
При давлениях и температурах, соответствующих точкам выше линии AВ, пар полностью сконденсирован в жидкость (С = 2). Верхний предел кривой испарения AВ находится в точке В, которая называется критической точкой (для воды 374 °C и 218 атм). Выше этой температуры фазы жидкости и пара становятся неразличимыми (исчезает четкая межфазная граница жидкость/ пар), поэтому Ф = 1.
Линия АС — это кривая возгонки льда (иногда ее называют линией сублимации), отражающая зависимость давления водяного пара надо льдом от температуры. Эта линия соответствует моновариаптному равновесию лед — пар (С = 1). Выше линии АС лежит область льда, ниже — область пара.
Линия AD кривая плавления, выражает зависимость температуры плавления льда от давления и соответствует моновариаптному равновесию лед — жидкая вода. Для большинства веществ линия AD отклоняется от вертикали вправо, но поведение воды аномально: жидкая вода занимает меньший объему чем лед. На основании принципа Ле-Шателье можно предсказать, что повышение давления будет вызывать сдвиг равновесия в сторону образования жидкости, т.e. точка замерзания будет понижаться.
Исследования, проведенные ГТ.-У. Бриджменом для определения хода кривой плавления льда при высоких давлениях, показали, что существует семь различных кристаллических модификаций льда, каждая из которых, за исключением первой, плотнее воды. Таким образом, верхний предел линии AD — точка Д где в равновесии находятся лед I (обычный лед), лед III и жидкая вода. Эта точка находится при -22°С и 2450 атм.
Тройная точка воды (точка, отражающая равновесие трех фаз — жидкости, льда и пара) в отсутствии воздуха находится при 0,0100°С и 4,58 мм рт. ст. Число степеней свободы С = 3 — 3 = 0, и такое равновесие называют инвариантным. При изменении любого параметра система перестает быть трехфазной.
В присутствии воздуха три фазы находятся в равновесии при 760 мм рт. ст. и 0 °C. Понижение температуры тройной точки на воздухе вызвано с л еду ющи м при ч и нам и:
- 1) растворимостью газообразных компонентов воздуха в жидкой воде при 1 атм, что приводит к снижению тройной точки на 0,0024°С;
- 2) увеличением давления от 4,58 мм рт. ст. до 1 атм, которое снижает тройную точку еще на 0,0075°С.
Фазовая диаграмма серы
Кристаллическая сера существует в виде двух модификаций — ромбической (Sр) и моноклинной (SМ). Поэтому возможно существование четырех фаз: ромбической, моноклинной, жидкой и газообразной (рис. 5.2).
Сплошные линии ограничивают четыре области: пара, жидкости и двух кристаллических модификаций. Сами линии отвечают моновариантным равновесиям двух соответствующих фаз. Заметьте, что линия равновесия моноклинная сера — расплав отклонена от вертикали вправо (сравните с фазовой диаграммой воды). Это означает, что при кристаллизации серы из расплава происходит уменьшение объема. В точках А, В и С в равновесии сосуществует три фазы (точка А ромбическая, моноклинная и пар, точка В — ромбическая, моноклинная и жидкость, точка С — моноклинная, жидкость и пар). Легко заметить, что есть еще одна точка О, в которой существует равновесие трех фаз — перегретой ромбической серы, переохлажденной жидкой серы и пара, пересыщенного относительно пара, равновесного с моноклинной серой. Эти три фазы образуют метастабилъную систему, т. е. систему, находящуюся в состоянии относительной устойчивости. Кинетика превращения метастабильных фаз в термодинамически стабильную модификацию крайне медленна, однако при длительной выдержке или внесении кристаллов-затравок моноклинной серы все три фазы все же переходят в моноклинную серу, которая является термодинамически устойчивой в условиях, отвечающих точке О. Равновесия, которым соответствуют кривые ОА, ОВ и ОС (кривые возгонки, плавления и испарения соответственно), являются метастабильными.

Рис. 5.2. Фазовая диаграмма серы.
Уравнение Клаузиуса — Клапейрона
Движение вдоль линий двухфазного равновесия на фазовой диаграмме (С = 1) означает согласованное изменение давления и температуры, т. е. Р = f (T). Общий вид такой функции для однокомпонентных систем был установлен Клапейроном.

Допустим, мы имеем моновариантное равновесие вода — лед (линия AD на рис. 5.1). Условие равновесия будет выглядеть так: для любой точки с координатами (р, Г), принадлежащей линии AD.

Для однокомпонентной системы р = dG/dv, где G— свободная энергия Гиббса, a v — число молей. Нужно выразить Формула ?G =
= ?Н — T?S для этой цели не годится, так как выведена для р, Т = const. В соответствии с уравнением (4.3) ["https://referat.bookap.info", 29].

Согласно первому закону тегшолинамики а согласно второму закону термодинамики _ , причем ж Тогда.


Очевидно, что в равновесии
так как количество образовавшегося льда в состоянии равновесия равно количеству образовавшейся воды). Тогда
— мольные (т.е. деленные на количество молей) объемы воды и льда; Sводы, Sльда — мольные энтропии воды и льда. Преобразуем полученное выражение в

(5.2).
где ?Sф, ?Vф п — изменение мольных энтропии и объема при фазовом переходе (лед -> вода в данном случае).

Поскольку то чаще применяют следующий вид уравнения:

где ?Hф п — изменение энтальпии при фазовом переходе; ?V п — изменение мольного объема при переходе; ?Tф п — температура, при которой происходит переход.
Уравнение Клапейрона позволяет, в частности, ответить на следующий вопрос: какова зависимость температуры фазового перехода от давления? Давление может быть внешним или создаваться за счет испарения вещества.

Подставим (из уравнения Менделеева — Клапей рона) в уравнение Клапейрона:

Разделяя переменные, получим.

(5.4).
Это уравнение можно проинтегрировать, если известна зависимость? HИС11 от Т. Для небольшого температурного интервала можно принять? HНСП постоянной, тогда.

(5.5).
где С — константа интегрирования.
Проинтегрируем левую часть уравнения (5.4) в пределах от р до р2, а правую — от Г, до Т2> т. е. от одной точки (р, 7,), лежащей на линии равновесия жидкость — пар, до другой — (р2, Т2):

Результат интегрирования запишем в виде.

(5.6).
называемым иногда уравнением Клаузиуса — Клапейрона. Оно может быть использовано для расчета теплоты испарения или возгонки, если известны значения давлений пара при двух различных температурах.
Энтропия испарения
Мольная энтропия испарения равна разности
Поскольку то можно полагать
Следующее допущение состоит в том, что пар считают идеальным газом. Отсюда вытекает приблизительное постоянство мольной энтропии испарения жидкости при температуре кипения, называемое правилом Трутона.
Правило Трутона: мольная энтропия испарения любой жидкости составляет величину порядка 88 ДжДмоль • К).
Если при испарении разных жидкостей не происходит ассоциации или диссоциации молекул, то энтропия испарения будет приблизительно одинакова. Для соединений, образующих водородные связи (вода, спирты), энтропия испарения больше 88 ДжДмоль • К). Правило Трутона позволяет определить энтальпию испарения жидкости по известной температуре кипения, а затем, но уравнению Клаузиуса — Клапейрона определить положение линии моновариантного равновесия жидкость — пар на фазовой диаграмме.
Пример 5.3. Оценить давление пара над диэтиловым эфиром при 298 К, зная его температуру кипения (308,6 К).
Решение. Согласно правилу Трутона AS.rn = 88 ДжДмоль • К), с другой стороны,.

Применим уравнение Клаузиуса — Клапейрона (5.6), учитывая, что при кипении (T = 308,6 К) давление паров эфира р = 1 атм. Тогда имеем: In /; - In 1 = 27,16 х х 10 3 /8,31(1/308,6 — 1/Т), или In р = -3268/7' + 10,59 (и это является уравнением линии моновариантного равновесия жидкость — пар па фазовой диаграмме эфира). Отсюда, при Т = 298 К (25°С), р = 0,25 атм.
Энтропия плавления не так постоянна для разных веществ, как энтропия испарения. Это связано с тем, что беспорядок (мерой которого является энтропия) возрастает при переходе от твердого к жидкому состоянию не столь сильно, как при переходе в газообразное состояние.

ГОСТ
Гетерогенное состояние
Состояние системы, в котором в равновесии находятся несколько фаз, называется гетерогенным. Такое равновесие возможно, если температуры, давления и химические потенциалы фаз одинаковы.
Пусть в систему входит K компонент, и эта система находится в A -- фазах, в таком случае вопрос о количестве независимых параметров, которые необходимы для однозначного описания системы, решает правило, которое получил Гиббс и которое носит его имя.
Допустим, что наша система находится при постоянных давлении и температуре, в таком случае условие равновесие для каждой фазы запишем в виде:
где $Ф=H-TS=U+pV-TS$ -- энергия Гиббса (изобарно -- изотермический потенциал), $<\mu >_i$- химический потенциал компоненты с номером i, $n_i$- концентрация i -- компоненты системы. Общее количество уравнений вида (1) равно числу фаз А. Всего в эти уравнения входит $(K\cdot A)$ величин $<\mu >_i$, но не все из них являются независимыми. Так как состав каждой фазы не изменяется, то возникает одна связь между химическими потенциалами, соответственно таких условий-связей всего (А). Химические потенциалы каждой компоненты во всех фазах должны быть одинаковы, то есть:
Для каждого i есть A-1 равенство, для всех компонент получается K(A-1) условие. Из вышесказанного следует, что количество независимых $<\mu >_i$ равно:
\[K\cdot A-A-K\left(A-1\right)=K-A\ \left(3\right).\]
Конечно, давление и температура так же являются независимыми параметрами. Получается, что количество независимых параметров ($f$), которые необходимы для однозначного описания системы, которая состоит из K компонент и находится в A фазах, запишется так:
Вспомним, что идеальный газ мы описывали с помощью двух параметров, например, давления и температуры, а объем находили из уравнения состояния. Уравнение (4) называется правилом фаз Гиббса.
Возможна ситуация, когда на равновесие системы влияют не только такие внешние параметры как давление и температура, а, например, электрические поля, магнитные поля и т.д. В этом случае внешних факторов буде не 2 как в (4), а B (в общем случае), тогда выражение запишется как:
где B -- количество внешних независимых параметров.
Иногда, например, так часто делают в металлургии при рассмотрении конденсированных систем можно считать давление постоянным, и влиянием его пренебрегают, в таком случае считается, что правило фаз Гиббса записывается:
Другими словами, можно сказать, что если какой либо из внешних параметров системы фиксируется, (например условием p=const или T=const), то выполняется правило фаз в виде (6).
Выражения (4), (5), (6) показывают, что число степеней свободы не может быть отрицательным, не имеет физического смысла. Так как $f\ge 0$, то число существующих фаз системы удовлетворяет неравенству:
\[A\le K+2\ \left(7\right).\]
Неравенство (7) означает, что число фаз, которые могут находиться в равновесии между собой не может превышать число компонент более чем на две. Это утверждение еще одна формулировка правила фаз Гиббса.
В однокомпонентной системе $1\le A\le 3$. При $A=3,\ f=0$, это означает, что может равновесно существовать три фазы вещества (к примеру, газ, жидкость и твердое вещество) только в одном определенном состоянии, которое называют тройной точкой.
Правило фаз Гиббса
Согласно правилу Гиббса получается, что с увеличением количества компонентов в системе, увеличивается число степеней свободы, с другой стороны, если увеличивается количество фаз системы, уменьшается число необходимых переменных.
Правило фаз Гиббса применяется в металлургии, химических технологиях, материаловедении. Оно позволяет рассчитать число фаз в многокомпонентных системах и число термодинамических степеней свободы.
Если в многофазной системе происходят химические реакции, необходимо учитывать количество химических уравнений. В состав таких уравнений войдут уравнения связи концентраций веществ, уравнения материального баланса. Дополнительные уравнения следует вычесть из правой части уравнения (4) или просто учесть через количество компонентов. Использовать $K'=K-l$ вместо K, где $l$ -- число дополнительных уравнений.
Задание: Определить $А,\ K\ и\ f$ для системы жидкость -- ее пар используя правило Гиббса. Как на термодинамической диаграмме отображается состояние такой системы?
Так как в условии сказано, что система жидкость и ее пар, то количество имеющихся фаз -- две. Это значит, что A=2, система имеет одну компоненту K=1. Тогда в соответствии с правилом Гиббса количество уравнений, однозначно описывающих состояние системы, будет равно:
Подставляем соответствующие величины, получаем:
Так как количество уравнений, которое необходимо, для описания системы равно одному, то на термодинамической диаграмме, например в осях (p,T) однокомпонентная система из двух фаз будет изображена как линия АК (фазовая диаграмма перехода жидкости в пар рис. 1).

Ответ: $А=2,\ K=1\ и\ f=1$. Состояние такой системы отображается кривой на фазовой диаграмме рис. 1.
Готовые работы на аналогичную тему
Задание: Чему равно число степеней свободы трехфазного состояния системы с одной компонентой. Что можно сказать о параметрах такой системы в состоянии равновесия?
В соответствии с правилом фаз Гиббса, запишем:
Система имеет одну компоненту: K=1, фазы в системе три, следовательно A=3, найдем число необходимых уравнений f по правилу Гиббса:
Проведем подстановку данных:
Ответ: Так как $f=0$ это означает, что три фазы однокомпонентной системы могут находиться в равновесии только при единственном соотношении параметров системы. Такая точка называется тройной на термодинамической диаграмме. На диаграмме в тройной точке пересекаются кривые плавления, испарения и сублимации.
Читайте также:




