Реферат на тему атрезия пищевода у детей
Обновлено: 06.07.2024
Атрезия пищевода сопровождается полной непроходимостью, симптомы которой зависят от вида атрезии п от наличия пищеводно-трахеального или пищеводно-бронхиального свища.
Ребенок с самого начала не может проглатывать слюну. При попытке кормления он захлебывается, отмечается триада симптомов: удушье, кашель, цианоз. Трахеобронхиальная секреция усилена. Временное облегчение дыхания наступает после откашливания мокроты и пищи. При аускультации слышны обильные влажные хрипы.
Если дистальная (нижняя, аборальная) часть пищевода и желудок не сообщаются с трахеей, то живот впалый, ладьевидный, с тупым звуком при перкуссии. При наличии свища трахеи с дистальной частью пищевода желудок вздут, перкуторный звук живота тимпанический. Вздутие живота особенно выражено в надчревной области, сопровождается высоким стоянием диафрагмы и затруднением дыхания.
Диагноз атрезии подтверждается путем введения через нос резинового катетера в пищевод. Следует брать не очень тонкий и не слишком мягкий катетер или зонд, чтобы он не согнулся и не симулировал прохождение. Он останавливается, упираясь концом в дно слепого мешка, обычно на расстоянии 9—11 см. Через введенный катетер производится отсасывание секрета из слепого мешка пищевода, что предупреждает асфиксию и развитие аспирационной пневмонии. Во время операции введенный катетер служит ориентиром расположения проксимального конца пищевода.
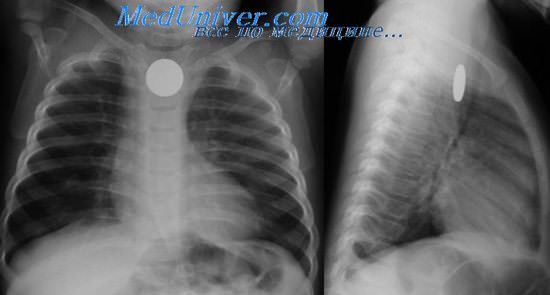
С целью уточнения вида и размеров атрезии допустимо капельное введение (инстилляция) небольшого количества контрастного вещества, которое обязательно отсасывается перед удалением катетера. Рекомендуется водный раствор контрастного вещества, раствор кардиотраста, с желатиной, а также липиодол, но не взвесь бария.
В вертикальном положении ребенка при контрастном рентгенологическом исследовании можно получить представление о проксимальном (верхнем, краниальном) отрезке пищевода в виде слепого мешка, более или менее растянутого. Обнаруживаются также верхние пищеводно-трахеальные свищи, если они имеются.
Следует помнить, что контрастное изображение дыхательных путей может возникнуть и в результате срыгивания и аспирации контрастного вещества.
При врожденном сужении (стенозе) пищевода у некоторых детей вскоре после рождения, у других на 2—3-й неделе появляются затруднения проглатывания. Если сужение менее выражено, то эти затруднения появляются не сразу после рождения, а позднее, с переходом при кормлении на более густую пищу.
При рентгенологическом исследовании с контрастной взвесью (барием) обнаруживается задержка прохождения в дистальной (нижней) или средней части пищевода. Эзофагоскопией выявляется сужение, иногда заслонка круговой или полулунной формы. Нередко наслаиваются воспалительные явления.
Дифференцировать врожденный стеноз пищевода приходится с рубцовым сужением, врожденным расширением пищевода и грыжей пищеводного отверстия.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Атрезия пищевода – врожденный порок развития с частичным отсутствием пищевода, представленным разобщенными между собой проксимальным и дистальным сегментами. Атрезия пищевода в педиатрии относится к наиболее тяжелым порокам, несовместимым с жизнью без раннего хирургического вмешательства. Атрезия пищевода наблюдается у 0,1-0,4% новорожденных (13,5% всех случаев пороков развития ЖКТ). Соотношение мужского и женского пола среди больных с атрезией пищевода составляет 1:1.
Атрезия пищевода часто сочетается с врожденными пороками других органов и систем: атрезией хоан, пилоростенозом, агенезией желчного пузыря, синдромами VATER и VACTERL ( пороками развития позвоночника, атрезией заднего прохода, ВПС, трахеопищеводным свищом, дисплазией лучевых костей, аномалиями почек, пороками развития конечностей). В 5% случаев атрезия пищевода сопутствует хромосомной патологией (синдрому Патау, Эдвардса или Дауна). До 30-40% новорожденных с атрезией пищевода имеют различную степень недоношенности и внутриутробную задержку развития. Течение беременности плодом с атрезией пищевода часто сопровождается угрозой выкидыша в I триместре и многоводием.
Атрезия пищевода: понятие, причины, классификация
Атрезия пищевода - врожденное недоразвитие пищевода с полным отсутствием физиологического просвета и эзофагеальной непроходимостью. Атрезия пищевода проявляется сразу после рождения ребенка ложной гиперсаливацией, нарушением дыхания, невозможностью приема пищи ввиду ее регургитации, вздутием или западением живота, развитием аспирационной пневмонии. Диагностика атрезии пищевода включает интраназальное зондирование пищевода, эзофагоскопию, бронхоскопию, рентгенографию грудной клетки и брюшной полости. Атрезия пищевода требует проведения экстренного оперативного вмешательства: торакотомии с закрытием свища и наложением прямого эзофагоэзофагоанастомоза или формирования гастростомы (эзофагостомы) и реконструктивной пластики пищевода.
Причины атрезии пищевода:
Возникновение атрезии связано с нарушениями формирования (закладки) пищевода на ранних стадиях (с 4 по 12 недели) внутриутробного развития плода. Пищевод и трахея, развиваются из одного общего зачатка – краниального отдела первичной кишки и в раннем эмбриогенезе сообщаются друг с другом. Атрезия пищевода может появиться в процессе их разделения при нарушении направления и скорости роста трахеи и пищевода, неполной отшнуровке дыхательной трубки от пищевода и нарушении его питания, а также при неправильном процессе реканализации, который проходят все образования кишечной трубки.
Классификация атрезии пищевода:
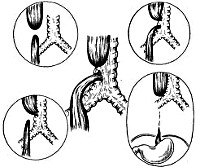
атрезия со свищем между дистальным отделом пищевода и трахеей (85-90% случаев);
атрезия со свищем между проксимальным отделом пищевода и трахеей (0,8% случаев);
атрезия со свищем между обоими концами пищевода и трахеей (0,6 % случаев);
изолированная атрезия пищевода без свища (8%).
Возможно формирование трахеопищеводного свища без атрезии. При полном отсутствии пищевода говорят о его полной атрезии (аплазии).
Атрезия пищевода обычно располагается на уровне бифуркации трахеи. Отрезок пищевода, не соединенный свищевым ходом с трахеей, имеет слепой конец. При изолированной атрезии пищевода слепые концы его отрезков могут соприкасаться друг с другом или заходить один за другой. Размеры свищевых ходов могут быть различны[1].
Клинические симптомы, диагностика, лечение, прогноз.
При этом часть слизи аспирируется, появляются приступы цианоза. После отсасывания содержимого наступает временное улучшение, а затем вновь появляются пенистые выделения и приступы цианоза. Это позволяет заподозрить непроходимость пищевода еще до первого кормления.
Второй основной симптом обнаруживается при первом же кормлении ребенка или питье жидкости. Пища илижидкость сразу выделяется обратно при полной атрезии, а при трахеопищеводном свище, попадая вдыхательные пути, вызывает поперхивание и тяжелый приступ кашля с нарушением дыхания и появлением цианоза. Регургитация при приеме пищи и жидкости отличается от рвоты тем, что она возникает после одного – двух глотков.
Появление этих симптомов требует немедленной проверки проходимости пищевода. Для этого используют зондирование (катетеризацию) пищевода резиновым катетером № 8 –10 , который вводится через нос. При атрезии катетер не удается провести глубже 10-12 см от края десен, так как он упирается в слепой отрезок атрезированного пищевода. При наличии пищеводно-трахеального свища катетер не удается провести в желудок. А. П. Биезинь , С. Я. Долецкий, А. Г. Пугачев рекомендуют этот метод при подозрении на атрезию уже после первого осмотра больного.
Достаточно информативной является проба по Elephant . сущность пробы заключается в том , что в катетер, находящийся в пищеводе и проведенный до упора, с помощью шприца вводят воздух в количестве 10-15 см . При атрезии вдуваемый воздух тут же с шумом выходит обратно через рот и нос больного.
Уже через несколько часов жизни у ребенка с атрезией пищевода в тех случаях , когда имеются пищеводно – трахеальные свищи , развивается синдром дыхательной недостаточности , которая усугубляется попаданием в дыхательные пути желудочного содержимого.
При осмотре ребенка отмечается изменение конфигурации верхней половины живота : западение или уплощение ее , характерное для полной атрезии, или выбухание в случае атрезии с пищеводно –трахеальным свищем . очень быстро развиваются дыхательные расстройства в виде одышки , расстройства ритма дыхания , перемежающегося , а затем и постоянного цианоза , в легких появляются влажные хрипы. Характерно усиление этих расстройств после каждого приема пищи и жидкости. После рождения у ребенка с атрезией пищевода первые 24 – 28 ч бывает мекониевый стул, а затем появляются запоры.
В течение 2 – 3 суток после рождения состояние ребенка резко ухудшается, развиваются тяжелые осложнения, важнейшим среди которых является аспирационная пневмония , обусловленная попаданием пищи и слизи в дыхательный тракт через свищевые ходы. При полной атрезии наблюдается не менее серьезное осложнение – обезвоживание и истощение. Дыхательные расстройства приводят к респираторному ацидозу , полицитемии, повышению гематокрита.
Окончательная диагностика атрезии пищевода и уточнение ее формы возможны с помощью рентгенологического исследования. Единого мнения о методике проведения этого исследования пока нет. Ю. Ф. Исаков, И. В. Бурков, Н. В. Ситковский рекомендуют проводить его с не тугим заполнением пищевода контрастным веществом. В. Д. Тихомирова считает более целесообразным использовать в качестве контрастного вещества йодолипол.
Рентгенологическое исследование начинают с обзорного снимка грудной клетки , а затем переходят к рентгеноскопии органов брюшной полости. При наличии пищеводно – трахеального свища в нижнем отрезке пищевода обнаруживается воздух в желудке и кишечнике. В последующем производят контрастное исследование пищевода обязательно в вертикальном положении исследуемого с целью предупреждения аспирации контрастного вещества. Целесообразно в качестве последнего использовать водорастворимые препараты йода. Рентгеновские снимки делают в прямой и боковой проекциях.
После окончания рентгенологического исследования контрастное вещество тщательно отсасывают . Преимущество водорастворимых йодистых препаратов перед барийсодержащими контрастными веществами заключается в легкости и полноте отсасывания. На рентгеновском снимке выявляется заполнение контрастным веществом слепого отрезка пищевода или проникновение его непосредственно в легкие ( при наличии пищеводно – трахеального свища ). Однако и при полной атрезии пищевода контрастное вещество может оказаться в легочной ткани вследствие регургитации его, но в гораздо меньшем количестве. Для предупреждения подобного явления используемое для контрастирования пищевода количество йодолипола не должно превышать 2 мл.
Для уточнения диагноза необходимо применение эзофагоскопии, трахеобронхоскопии . W. Holzgreve сообщает о диагностическом значении при распознавании атрезии пищевода определения ацетилхолинэстеразы в амниотической жидкости в пренатальном периоде [2].
По данным большинства авторов, заподозрить наличие патологии при проведении УЗИ можно только по косвенным признакам:
многоводие, связанное со снижением оборота околоплодных вод из-за непроходимости пищевода плода;
невозможность визуализации желудка или значительное уменьшение его размеров;
визуализация периодически наполняющегося и опорожняющегося слепо заканчивающегося проксимального отдела пищевода;
задержка внутриутробного развития.
Но такие же отклонения характерны и для других патологий, в частности, врождённой микрогастрии (патологически малого объёма желудка) и лицевых расщелин. Причём иногда желудок не видно на УЗИ и у абсолютно здоровых детей, но при проведении череды УЗИ он всё-таки обнаруживается в типичном месте и нормального размера.
Также женщины, вынашивающие плод с атрезией пищевода, часто сталкиваются с угрозой выкидыша в I триместре. Поскольку атрезия пищевода часто сочетается с другими пороками развития, при их наличии назначаются дополнительные ультразвуковые исследования с целью выявить эту аномалию [3].
Атрезия пищевода приводит к гибели ребенка в самые ранние сроки, и спасти ему жизнь можно только с помощью экстренной операции, выполненной не позднее 36 ч после рождения. Уже в родильном доме начинается комплексная предоперационная подготовка, заключающаяся в придании ребенку специальной позы, устраняющей рефлюкс желудочного сока через дистальный трахеопищеводный свищ; полное исключение кормления через рот; частую аспирацию слюны и слизи из полости рта, носоглотки и дыхательных путей; непрерывную ингаляцию увлажненного кислорода; проведение инфузионной, антибактериальной и симптоматической терапии. Если вес новорожденного составляет менее 2 кг, и атрезия пищевода сопровождается осложнениями или другими пороками развития, требуется дополнительная коррекция выявленных аномалий.
В первую неделю после операции кормление производят через зонд; после проверки состоятельности анастомоза и при отсутствии осложнений ребенка начинают кормить через рот антирефлюксными смесями. Через 2-3 недели выполняют контрольную фиброэзофагогастроскопию или рентгенологическое исследование пищевода. При рубцовом стенозе (стриктурах), развивающемся после операции в 30-40% случаев, проводится эндоскопическое бужирование анастомоза.
При запоздалой диагностике атрезии пищевода дети умирают от тяжелой аспирационной пневмонии. Прогноз при ранней хирургической коррекции неосложненных форм атрезии пищевода – благоприятный. При изолированной форме атрезии пищевода выживаемость составляет 90-100%, при наличии тяжелых сочетанных пороков и недоношенности – 30-50%.
Даже при успешно выполненной хирургической коррекции атрезии пищевода и относительно удовлетворительном трансэзофагеальном пассаже, нормальная моторика дистального участка пищевода полностью не восстанавливается. В течение года после операции по поводу атрезии пищевода ребенок находится под диспансерным наблюдением детского хирурга и детского гастроэнтеролога . При развитии дисфагии, нарушении проходимости пищевода, недостаточности кардии и гастроэзофагеальном рефлюксе показано дополнительное обследование[4].
Изучение эпидемиологический характеристик атрезии пищевода, по данным мониторинга ВПР в регионах РФ, за период с 2000 по 2012 гг.
Для анализа были взяты данные эпидемиологического мониторинга ВПР 30 региональных регистров: Архангельская область, Башкортостан, Брянская область, Волгоградская область, Иркутская область, Калужская область, Кировская область, Красноярский край, Курская область, Липецкая область, Московская область, Нижегородская область, Новосибирская область, Омская область, Оренбургская область, Пермская область, Рязанская область, Самарская область, Самарская область, Санкт-Петербург, Саратовская область, Саха (Якутия), Сахалинская область, Свердловская область, РСО-Алания, Ставропольский край, Тамбовская область, Тюменская область, Удмуртская Республика, Чувашская Республика, Ярославская область. Все регистры используют множественные источники регистрации: роддома, детские поликлиники и стационары, патологоанатомические отделения. Учитывались случаи атрезии пищевода как среди живорожденных, так и среди мертворожденных детей.
В исследование включались только случаи АП без свища и АП с трахеопищеводным свищом. Основные анализируемые параметры: пол ребенка, масса тела при рождении, возраст матери при рождении больного ребенка и порядковый номер родов.
Общая частота АП составила 1,96 на 10 000 рождений или 1 случай на 5099 рождений. Отмечаются различия в частоте порока между отдельными регионами. Минимальная частота наблюдалась в Сахалинской области – 1,37, максимальная – в Пермском крае – 2,84. Значимость этого различия составляет р=0,03.
Преимущество системы мониторинга ВПР заключается в том, что при стандартизированном сборе материала возможно объединение региональных данных, что позволяет изучать эпидемиологические характеристики пороков развития, в том числе и редких форм.
По данным мониторинга ВПР одним из наиболее важных факторов риска АП является возраст матери (старше 35 лет): в этой группе выявлены значимые отличия в частоте порока по отношению к другим возрастным группам. В связи с этим, поскольку, возраст матери связан с повышением риска порока развития у ребенка, очевидно, что женщины откладывающие деторождение до более позднего возраста, должны быть предупреждены о повышенном риске не только хромосомной патологии, но и пороков развития нехромосомной этиологии, для которых выявлены ассоциации с материнским возрастом. Повышение относительного риска наблюдается при первых родах ( RR =1,36), максимальная оценка относительного риска получена для низкой массы тела новорожденных ( R =4,82).
Таким образом, дальнейшее изучение эпидемиологии атрезии пищевода в рамках мониторинга ВПР может явиться основой понимания клинико-демографических феноменов, связанных с редкими ВПР, приносящими значительный вклад в структуру смертности, заболеваемости и инвалидизации детского населения стран, благодаря выявлению особенностей распределения случаев атрезии пищевода в зависимости от приведенных выше параметров параметров, таких как: пол ребенка, масса тела при рождении, возраст матери при рождении больного ребенка и порядковый номер родов[5].
Список литературы
Демикова Н.С., Выдрыч Ю.В., Подольная М.А., Лапина А.С., Асанов А.Ю. Описательная эпидемиология атрезии пищевода (По данным мониторинга ВПР). Медицинская генетика . 2015;14(1):25-31
Атрезия пищевода - врожденное недоразвитие пищевода с полным отсутствием физиологического просвета и эзофагеальной непроходимостью. Атрезия пищевода проявляется сразу после рождения ребенка ложной гиперсаливацией, нарушением дыхания, невозможностью приема пищи ввиду ее регургитации, вздутием или западением живота, развитием аспирационной пневмонии. Диагностика атрезии пищевода включает интраназальное зондирование пищевода, эзофагоскопию, бронхоскопию, рентгенографию грудной клетки и брюшной полости. Атрезия пищевода требует проведения экстренного оперативного вмешательства: торакотомии с закрытием свища и наложением прямого эзофагоэзофагоанастомоза или формирования гастростомы (эзофагостомы) и реконструктивной пластики пищевода.
Общие сведения
Атрезия пищевода – врожденный порок развития с частичным отсутствием пищевода, представленным разобщенными между собой проксимальным и дистальным сегментами. Атрезия пищевода в педиатрии относится к наиболее тяжелым порокам, несовместимым с жизнью без раннего хирургического вмешательства. Атрезия пищевода наблюдается у 0,1-0,4% новорожденных (13,5% всех случаев пороков развития ЖКТ). Соотношение мужского и женского пола среди больных с атрезией пищевода составляет 1:1.
Атрезия пищевода часто сочетается с врожденными пороками других органов и систем: атрезией хоан, пилоростенозом, агенезией желчного пузыря, синдромами VATER и VACTERL (пороками развития позвоночника, атрезией заднего прохода, ВПС, трахеопищеводным свищом, дисплазией лучевых костей, аномалиями почек, пороками развития конечностей). В 5% случаев атрезия пищевода сопутствует хромосомной патологией (синдрому Патау, Эдвардса или Дауна). До 30-40% новорожденных с атрезией пищевода имеют различную степень недоношенности и внутриутробную задержку развития. Течение беременности плодом с атрезией пищевода часто сопровождается угрозой выкидыша в I триместре и многоводием.

Причины атрезии пищевода
Возникновение атрезии связано с нарушениями формирования (закладки) пищевода на ранних стадиях (с 4 по 12 недели) внутриутробного развития плода. Пищевод и трахея, развиваются из одного общего зачатка – краниального отдела первичной кишки и в раннем эмбриогенезе сообщаются друг с другом. Атрезия пищевода может появиться в процессе их разделения при нарушении направления и скорости роста трахеи и пищевода, неполной отшнуровке дыхательной трубки от пищевода и нарушении его питания, а также при неправильном процессе реканализации, который проходят все образования кишечной трубки.
Классификация атрезии пищевода
- атрезия со свищем между дистальным отделом пищевода и трахеей (85-90% случаев);
- атрезия со свищем между проксимальным отделом пищевода и трахеей (0,8% случаев);
- атрезия со свищем между обоими концами пищевода и трахеей (0,6 % случаев);
- изолированная атрезия пищевода без свища (8%).
Возможно формирование трахеопищеводного свища без атрезии. При полном отсутствии пищевода говорят о его полной атрезии (аплазии).
Атрезия пищевода обычно располагается на уровне бифуркации трахеи. Отрезок пищевода, не соединенный свищевым ходом с трахеей, имеет слепой конец. При изолированной атрезии пищевода слепые концы его отрезков могут соприкасаться друг с другом или заходить один за другой. Размеры свищевых ходов могут быть различны.
Симптомы атрезии пищевода
Клинические симптомы атрезии пищевода проявляются уже в первые часы после рождения ребенка. Типичным признаком данного порока является непрекращающееся выделение обильной пенистой слюны изо рта и носа новорожденного (ложная гиперсаливация). В результате аспирации ребенком части слизи в трахею нарастают признаки нарушения дыхания: хрипы, приступы кашля, тахипноэ, одышка, цианоз, асфиксия. После повторного отсасывания слизи из носоглотки и трахеальной аспирации наступает временное улучшение, но вскоре пенистые выделения появляется вновь. Уже при первом кормлении ребенка грудью после 1-2 глотков наблюдается регургитация пищи: постоянное и немедленное срыгивание нествороженным молоком, рвота.
При сочетании атрезии пищевода с нижним трахеопищеводным свищом возникает заброс содержимого желудка в дыхательные пути, и каждая попытка кормления вызывает у ребенка поперхивание и тяжелый приступообразный кашель с появлением цианоза и удушья. У части детей с атрезией и дистальным трахеопищеводным свищом отмечается вздутие живота, особенно в эпигастрии, за счет попадания воздуха через свищ в пищевод и желудок. При отсутствии дистального свища у ребенка с атрезией пищевода наблюдается запавший живот.
Повторяющаяся рвота при атрезии пищевода быстро приводит к обезвоживанию и истощению. Вдыхание новорожденным слизи и пищи часто вызывает развитие аспирационной пневмонии, сопровождающейся лихорадкой, нарастанием симптомов дыхательной недостаточности и летальным исходом.
Диагностика атрезии пищевода
Атрезия пищевода требует немедленной диагностики (в первые 12-24 часа после рождения) до развития аспирационной пневмонии. При малейшем подозрении на атрезию пищевода новорожденным с признаками дыхательных расстройств выполняют интраназальное зондирование пищевода с помощью резинового катетера. При атрезии зонд невозможно провести в желудок, он упирается в слепой конец пищевода или заворачивается и выходит обратно. В сомнительных случаях проводят пробу Элефанта с введением в пищевод через катетер порции воздуха, который при наличии атрезии с шумом выходит из носоглотки.
Иногда целесообразно выполнение эзофагоскопии и бронхоскопии, позволяющих установить вид атрезии, визуализировать слепой конец пищевода, протяженность его проксимального сегмента, наличие свищевого хода с трахеей и бронхами. Наличие дистального трахеопищеводного свища подтверждается интраоперационной эзофагоскопией через гастростому под контролем рентгена. Окончательно подтвердить диагноз атрезии помогают результаты рентгенографии с введением в пищевод рентгенконтрастного катетера.
На обзорной рентгенограмме органов грудной клетки и брюшной полости при атрезии пищевода определяется его слепой проксимальный отрезок, наличие воздуха в желудке и кишечнике при дистальном трахеопищеводном свище, и отсутствие их газонаполнения при изолированной форме заболевания. Использование в диагностике атрезии пищевода бариевой взвеси крайне нежелательно из-за высокого риска респираторных осложнений и летального исхода.
При атрезии пищевода необходимо дифференцировать бессвищевую форму от свищевой, исключить стеноз пищевода, эзофагоспазм, врожденный пилоростеноз, изолированную трахеопищеводную фистулу, расщелину гортани и другие аномалии.
Лечение атрезии пищевода
Атрезия пищевода приводит к гибели ребенка в самые ранние сроки, и спасти ему жизнь можно только с помощью экстренной операции, выполненной не позднее 36 ч после рождения. Уже в родильном доме начинается комплексная предоперационная подготовка, заключающаяся в придании ребенку специальной позы, устраняющей рефлюкс желудочного сока через дистальный трахеопищеводный свищ; полное исключение кормления через рот; частую аспирацию слюны и слизи из полости рта, носоглотки и дыхательных путей; непрерывную ингаляцию увлажненного кислорода; проведение инфузионной, антибактериальной и симптоматической терапии. Если вес новорожденного составляет менее 2 кг, и атрезия пищевода сопровождается осложнениями или другими пороками развития, требуется дополнительная коррекция выявленных аномалий.
В первую неделю после операции кормление производят через зонд; после проверки состоятельности анастомоза и при отсутствии осложнений ребенка начинают кормить через рот антирефлюксными смесями. Через 2-3 недели выполняют контрольную фиброэзофагогастроскопию или рентгенологическое исследование пищевода. При рубцовом стенозе (стриктурах), развивающемся после операции в 30-40% случаев, проводится эндоскопическое бужирование анастомоза.
Прогноз при атрезии пищевода
При запоздалой диагностике атрезии пищевода дети умирают от тяжелой аспирационной пневмонии. Прогноз при ранней хирургической коррекции неосложненных форм атрезии пищевода – благоприятный. При изолированной форме атрезии пищевода выживаемость составляет 90-100%, при наличии тяжелых сочетанных пороков и недоношенности – 30-50%.
Даже при успешно выполненной хирургической коррекции атрезии пищевода и относительно удовлетворительном трансэзофагеальном пассаже, нормальная моторика дистального участка пищевода полностью не восстанавливается. В течение года после операции по поводу атрезии пищевода ребенок находится под диспансерным наблюдением детского хирурга и детского гастроэнтеролога. При развитии дисфагии, нарушении проходимости пищевода, недостаточности кардии и гастроэзофагеальном рефлюксе показано дополнительное обследование.
Атрезия пищевода относится к тяжелым порокам развития. Эта патология часто сочетается с другими пороками: врожденными пороками сердца, желудочно-кишечного тракта, мочеполовой системы и другими. В данной статье приводится результат опыта лечения 123 новорожденных с атрезией пищевода. Атрезия пищевода с нижним трахеопищеводным свищом диагностирована у 109 детей (88,6 %), атрезия с нижним и верхним свищами-3 (2,4 %), бессвищевая форма атрезии выявлена у 11 (9 %). В 42 наблюдениях атрезия пищевода сочеталась с другими пороками. Хирургическое вмешательство выполнено у 115 новорожденных (93,5 %). Всем детям проводилась сопутствующая поддерживающая терапия. 8 детей умерло от тяжелой сопутствующей патологии без оперативного лечения. Из числа оперированных новорожденных умерло 12 детей (9,8 %).

2. Атлас детской оперативной детской хирургии под редакцией П. Пури, М. Говарта. Пер. проф. Т.К. Немиловой. – Москва: МЕДпресс-информ, 2009. – С.43-62.
3. Детская хирургия. Учебник под редакцией Ю.Ф. Исакова, А.Ю. Разумовского. –Москва: ГЭОТАР-Медиа, 2014. – С.216-221.
4. Пренатальная эхография / под редакцией М.В. Медведева. Реальное время. – Москва, 2005. – С.439-442.
5. Разумовский А.Ю., Мокрушина О.Г., Ханвердиев Р.А. Торакоскопическая коррекция атрезии пищевода и трахеопищеводного свища из внеплеврального доступа // Детская хирургия. – 2011. – № 2. – С. 4-6.
6. Разумовский А.Ю., Мокрушина О.Г., Ханвердиев Р.А. и др. Эволюция метода торакоскопической коррекции атрезии пищевода у новорожденных // Российский вестник детской хирургии, анестезиологии и реаниматологии. – 2012. – № 1. – С. 92-98.
7. Фокер Дж., Козлов Ю.А. Процедура Foker – стратегия индукции роста пищевода путем его вытяжения. // Российский вестник детской хирургии, анестезиологии и реаниматологии. – 2016. – № 1. – С. 51-57.
Атрезия пищевода относится к тяжелым порокам развития. Эта патология часто сочетается с другими пороками: врожденными пороками сердца, желудочно-кишечного тракта, мочеполовой системы и другими. Атрезия пищевода входит в ассоциации VATER, VACTER и VACTERL. Ассоциации образованы из первых букв соответствующих английских терминов (Vertebraldefects, Analatresia, Tracheoesophagealfistula, Esophagealatresia, Rendysplasy, Radialdysplasy, Cardiacmalformations, Limbanomalies – врожденные пороки развития позвонков, атрезия ануса, трахеопищеводный свищ, или атрезия пищевода, пороки развития почек или дефекты лучевой кости, пороки сердца, аномалии конечностей). Если у новорожденного диагностирована одна из перечисленных аномалий, входящая в названные ассоциации, следует искать и другие пороки [3].
Несмотря на то, что благодаря совершенствованию оперативной техники и внедрению новых технологий достигнуты определенные успехи в лечении атрезии пищевода [5, 6], хирургическое лечение новорожденных с данным пороком по-прежнему остается сложной задачей [2,4]. Летальность при атрезии пищевода даже при оптимальной организации перинатальной помощи остается около 10 %, а при сочетании с другими аномалиями, особенно при пороках сердца, летальность может быть значительно выше [1].
Цель исследования – проведение анализа результатов лечения новорожденных с атрезией пищевода.
Материалы и методы исследования
В исследование были включены новорожденные с атрезией пищевода и сопутствующей патологией (123 ребенка), находившиеся на лечении в ГБУЗ СО ДГКБ № 1 им. Н.Н. Ивановой за период с 1996 по 2015 год.
В программу исследования входило: анализ пренатальной диагностики порока, первичный осмотр детей в родильном доме, клиническое исследование в специализированном лечебно-профилактическом учреждении, диагностика атрезии пищевода и сопутствующей патологии, определение длительности и качества предоперационной подготовки, определение объема оперативного вмешательства при коррекции порока, оценка результатов лечения, в том числе и отдаленных. В работе использовались клинические, рентгенологические, эндоскопические, ультразвуковые и лабораторные методы исследования.
Результаты исследования и их обсуждения
Все новорожденные с атрезией пищевода (123) поступали в отделение реанимации новорожденных ДГКБ № 1 им. Н.Н. Ивановой г. Самары из родильных домов и родильных отделений города и области в сроки от нескольких часов после рождения до 3-х суток. Следует отметить, что в Самарской области хирургическая помощь новорожденным с врожденной и приобретенной патологией оказывается только в этом лечебно-профилактическом учреждении.
По данным М.В. Медведева (2005), пренатальная диагностика атрезии пищевода основывается на таких косвенных признаках, как многоводие, связанное со снижением оборота околоплодных вод вследствие непроходимости пищевода, отсутствие эхографического изображения желудка или микрогастрия. При этом чувствительность эхографии в диагностике этого порока не превышает 40–50 %. В наших наблюдениях вышеназванные признаки атрезии пищевода выявлены пренатально лишь в 40 % при скрининговом обследовании беременных, родивших детей с атрезией пищевода. При выявлении пренатально косвенных признаков атрезии пищевода у плодов родоразрешение беременных, проживающих в г. Самаре и Самарской области, проводилось только в родильных домах г. Самары, что способствовало сокращению времени транспортировки новорожденных с атрезией пищевода в специализированное ЛПУ (ДГКБ № 1 им. Н.Н. Ивановой г. Самары).
При выявлении в родильном доме в первые часы после рождения ребенка признаков атрезии пищевода (появление обильных пенистых выделений изо рта и носовых ходов) проводилась аспирация содержимого рото- и носоглотки, которая повторялась каждые 15–20 минут, полностью исключалось кормление через рот, начиналась оксигенотерапия. Транспортировка новорожденного с атрезией пищевода в ДГКБ № 1 им. Н.Н. Ивановой г. Самары осуществлялась реаниматологом-неонатологом специализированным автотранспортом. Дети транспортировались в кювезе, во время транспортировки проводилась аспирация слизи из рото- и носоглотки.
Новорожденных доставляли в отделение реанимации новорожденных, где наряду с диагностическими методами, направленными на подтверждение диагноза атрезии пищевода и выявление сопутствующих пороков, начиналась предоперационная подготовка.
Для уточнения диагноза атрезии пищевода проводилась катетеризация пищевода рентгенконтрастным катетером с закругленным концом (уретральным катетером). Катетер вводили через нос на глубину до 8 см. Катетер или упирался в слепой конец пищевода или выходил через рот новорожденного. Через катетер отсасывали слизь, а затем проводили пробу Элефанта (при введении воздуха в слепой конец пищевода из носоглотки с шумом выделяется воздух). В некоторых наблюдениях выполнялась эзофагография с водорастворимым контрастом, который вводился в слепой конец пищевода в количестве не более 1 мл.
Атрезия с нижним трахеопищеводным свищом диагностирована в 112 (91 %) наблюдениях, бессвищевая форма – в 11 (9 %).
Из сопутствующих аномалий развития у 18 (14,6 %) новорожденных диагностирована атрезия двенадцатиперстной кишки, у 12 (9,8 %) – врожденные пороки сердца, у 12 (9,8 %) – атрезия прямой кишки, у 13 (10,6 %) – патология мочевыводящей системы. В 9 (7,3 %) наблюдениях диагностирован синдром Дауна.
Предоперационная подготовка проводилась длительностью от одних до четырех суток в зависимости от состояния ребенка, сроков поступления, наличия сопутствующей патологии. Ребенок обязательно помещался в кювез. В предоперационном периоде выполнялась аспирация слизи изо рта и носа ребенка, оксигенотерапия. При имеющемся нарушении дыхания, пневмонии, ателектазах, вызванных аспирацией слизи, проводилась ларингоскопия для санации дыхательных путей. Если предпринятые меры оказывались неэффективными, обязательным являлось выполнение бронхоскопии с тщательной аспирацией содержимого трахеи и бронхов. При состояниях, требующих респираторной поддержки, проводилась интубация трахеи и искусственная вентиляция легких. При этом эндотрахеальную трубку проводили ниже трахеопищеводного свища, что позволяло избежать такого тяжелого осложнения, как разрыв желудка за счет инсуффляции воздуха в желудок.
Всем детям назначалась инфузионная, антибактериальная и симптоматическая терапия.
Из 123 новорожденных с атрезией пищевода оперативное вмешательство выполнено у 115 пациентов. 8 неоперированных детей умерли в связи с наличием у них тяжелой сопутствующей патологии.
Метод хирургической коррекции атрезии пищевода зависел от формы порока. У пациентов с наиболее частой формой атрезии, при которой имелся дистальный трахеопищеводный свищ, с диастазом между отрезками пищевода не более 2,5 см, ликвидировался свищ и накладывался прямой анастомоз.
При большом диастазе прямой анастомоз наложить сложно. Для осуществления этой цели используются такие хирургические подходы, как циркулярная или спиральная миотомия, расширение отверстия в диафрагме и перемещение части желудка в грудную клетку. Кроме того, в настоящее время появились работы, в которых описывается опыт применения процедуры Фокера, индуцирующей рост пищевода путем вытяжения отрезков пищевода [7]. Но все же чаще всего при большом диастазе между отрезками пищевода накладывается шейная эзофагостома и гастростома. При бессвищевой форме порока, сопровождающейся большим диастазом, также первым этапом выполняется наложение шейной эзофагостомы и гастростомы [3, 5].
В наших наблюдениях прямой анастомоз наложен у 112 пациентов с атрезией пищевода при наличии нижнего трахеопищеводного свища. При этом у двух новорожденных при диастазе между отрезками пищевода от 2,5 до 3,5 см использовано удлинение проксимального отрезка пищевода в виде циркулярной миотомии по Livaditis [2].
Перед операцией проводилась периоперационная антибиотикопрофилактика. Оперативное вмешательство выполнялось под интубационным наркозом с вентиляцией мануально низким давлением на вдохе и небольшими объемами. Это позволяло избежать гипервентиляции, раздувания желудка, а также способствовало стабилизации трахеи. Для облегчения поиска хирургом верхнего отрезка пищевода в последний обязательно вводился зонд. Доступ – правосторонняя экстраплевральная торакотомия. Полунепарная вена по возможности не пересекалась. Выделение отрезков пищевода проводилось тщательно, чтобы избегать даже малейшей травмы его стенки и сохранить все волокна блуждающего нерва, сопровождающие нижний сегмент пищевода. После отведения трахеи обнаруживался трахеопищеводный свищ. После наложения швов-держалок на трахеальный и эзофагеальный концы свища свищ отсекался от трахеи, и дефект трахеи ушивался отдельными швами в один ряд мононитью 6/0. На верхний сегмент пищевода накладывалось два тракционных шва, служащих для облегчения его мобилизации. Далее трахея отделялась от пищевода. После мобилизации верхнего отрезка пищевода сегменты органа сближались и накладывался анастомоз конец-в-конец. Наложению анастомоза предшествовало рассечение верхушки верхнего отрезка точно над концом продвинутого в сегмент зонда. Анастомоз формировался отдельными рассасывающимися швами мононитью 6/0. Во всех наблюдениях проводился назогастральный зонд и выполнялось дренирование средостения.
У двух детей с большим диастазом сегментов, как уже было сказано, применена циркулярная миотомия по Livaditis, которая позволила удлинить проксимальный отрезок пищевода и наложить анастомоз конец-в-конец.
После операции продолжалась интенсивная терапия. При благоприятном течении послеоперационного периода кормление через зонд начиналось через 3–5 суток после операции. На 8–9 сутки проводилась эзофагография с целью определения состоятельности анастомоза. Для этого под контролем рентгеновского экрана через рот ребенку вводилось 1–2 мл водорастворимого контрастного вещества. Оценивалась проходимость анастомоза пищевода, исключались затеки контрастного вещества в средостение. При отсутствии осложнений ребенок начинал кормиться через рот.
Несостоятельность анастомоза выявлена у 6 детей (4,9 %). Ранним диагностическим признаком несостоятельности анастомоза являлось появление слюны по плевральному дренажу. У 3 новорожденных несостоятельность была частичной. На фоне консервативной терапии на 16–20 день наступило заживление зоны несостоятельности, что было подтверждено рентгенконтрастным исследованием пищевода. В этой группе больных в последующем сформировались стенозы пищевода с явлениями дисфагии, что потребовало бужирования пищевода. В трех наблюдениях отмечена несостоятельность анастомоза, при которой пришлось накладывать верхнюю эзофагостому и гастростому.
У 26 детей в послеоперационном периоде отмечались явления дисфагии, обусловленные мобилизацией сегментов пищевода. При рентгенологическом и эндоскопическом исследованиях анастомоза не выявлено сужения зоны. На фоне проведенной консервативной терапии явления дисфагии полностью купировались.
7-ми новорожденным с бессвищевыми формами атрезии пищевода (из 11 детей с бессвищевыми формами 4 умерли без операции в связи с тяжелой сочетанной патологией) выполнены шейная эзофагостомия и гастростомия. Этим детям через 10–12 месяцев была произведена загрудинная эзофагопластика левой половиной толстой кишки на левой ободочной артерии. Трансплантат располагали в изоперистальтической позиции. Операция завершалась дренированием средостения. После операции дети получали интенсивную терапию в отделении реанимации. Дренаж из плевральной полости удалялся через 2–3 дня. Через 7–10 дней проводилось рентгенконтрастное исследование для исключения несостоятельности анастомозов, и при отсутствии осложнений назначалось кормление через гастростому. Гастростомическая трубка удалялась через 3 месяца. Один ребенок оперирован повторно в связи с выявлением избыточных петель трансплантата.
Данный вид пластики пищевода был выполнен и у 3 пациентов, которым были наложены эзофаго- и гастростома в связи с полной несостоятельностью пищеводного анастомоза.
После операции по поводу атрезии пищевода умерло 12 детей. Следует отметить, что у всех умерших новорожденных отмечались сочетанные аномалии.
Таким образом, летальность составила 9,8 %. Стенозы пищевода, потребовавшие длительного бужирования, выявлены у 11 пациентов.

История атрезии пищевода насчитывает почти 350 лет, из которых на протяжении 280 лет не удавалось получить благоприятного исхода в лечении этой аномалии. По данным литературы, в последние 70 лет развитие технологий и кооперация детских хирургов позволили снизить летальность в 50 раз, соответственно со 100 до 2 % при традиционном методе лечения (торакотомии) и 2,8 % -торакоскопическом лечении.
Причины атрезии пищевода:
Развитие этого порока связано с нарушением на стадии развития эмбриона, во время внутриутробного развития в первый триместр беременности.
Факторы из сведений, получаемых при обследовании матери: многоводие; экологические факторы; несбалансированное питание матери во время беременности; инфекции у матери; ионизирующее излучение; вредные привычки; генетические факторы.
Симптомы атрезии пищевода:
О наличии порока свидетельствует сильное слюнотечение, сопровождающиеся синюшной окраской кожи, эти признаки указывают на то, что ребенок не может проглотить слюну. Первое кормление будет сопровождаться сильным кашлем.
Классификация атрезии пищевода:
Атрезия со свищем между дистальным отделом пищевода и трахеей (87 %):
– дистальный отдел пищевода соединен с трахеей, а проксимальный конец имеет незамкнутое отверстие;
– атрезия со свищем между проксимальным отделом пищевода и трахеей (1 %), проксимальный отдел пищевода соединен с трахеей, а дистальный конец имеет замкнутое отверстие;
– атрезия со свищем между обоими концами пищевода и трахеей, по-другому это явление можно назвать атрезия с двойным свищем, когда проксимальный и дистальный концы соединены с трахеей (0,7 %);
– изолированная атрезия пищевода без свища, то есть весь пищевод представляет собой тяж без просвета (9 %).
Диагностика атрезии пищевода:
При наличии гипотезы на порок выполняют интраназальное зондирование пищевода с помощью резинового катетера. Если при проведении трубки, зонд упирается в слепой конец пищевода и возвращается наружу, то диагностируют наличие атрезии пищевода. С помощью рентгена находят местоположение слепого проксимального сегмента, определяют наличие воздуха в желудке и кишечнике при трахеопищеводном свище, и отсутствие газонаполнения при изолированной форме заболевания.
Некоторые статистические данные, приведенные висследованиях вРоссийской Федерации:
Врождённые пороки развития (ВПР) являются одной из основных причин перинатальной и ранней детской смертности, вызывая серьёзные медико-социальные проблемы в обществе. Врождённые пороки развития встречаются у 5 % младенцев, но их вклад в структуру детской смертности достигает 20 % и выше.
В структуре ВПР аномалии желудочно-кишечного тракта (ЖКТ) занимают третье место составляя от 21,7 %-25 % от всех пороков. Врождённые пороки развития желудочно-кишечного тракта встречаются с частотой 13–26,4 на 10000 живорожденных.
За 2018–2019 года в г.Оренбург родились 493 новорождённых с врождёнными пороками развития. Среди них с атрезией пищевода 10 новорожденных родилось в 2018 году, 8 — в 2019 году.

Рис. 1. Динамика выявленных пороков у новорожденных г. Оренбурга
При статистическом анализе вычисляли среднюю арифметическую величину (М), ошибку репрезентативности (± т), вычислялась встречаемость 1 случая на 10000 новорождённых и достоверность. Результаты исследования и их обсуждение. За период 2018 по 2019 года по городу Оренбург было выявлено 493 случаев рождения новорождённых с различными врождёнными пороками развития плода, что составило 1,9 случая на 10000 новорождённых. Среди них на пороки со стороны желудочно-кишечного тракта приходится 18 случаев. Встречаемость порока атрезии пищевода на 10000 новорождённых по городу Оренбургу составило 0,3 случая, что свидетельствует об актуальности данной проблемы. Аномалии развития ЖКТ в 59 % наблюдались среди мальчиков и 41 % случаев приходилось на девочек.

Рис. 2. Распределение по полу атрезии пищевода
Среди новорождённых детей с пороками развития ЖКТ: 63,1 % родились с весом от 3000–4000 гр, 30,4 % новорождённых с весом от 2500–2900 гр, 4,3 % новорождённых детей с весом от 2000–2500 гр с массой тела больше 4000 гр-2,2 %, т. е. пороки развития ВПР ЖКТ в основном наблюдались среди доношенных новорождённых.

Рис. 3. Распределение детей по весу с пороками ЖКТ
В 2019 году по сравнению с 2018 годом наблюдалось снижение уровня смертности от внешних причин смерти (на 12,5 %), от болезней органов дыхания (на 11,1 %), болезней органов пищеварения (на 3,4 %).
Смертность среди детей с атрезией пищевода составляет 12–55 %. Хотя история изучения врождённых пороков развития ЖКТ насчитывает несколько столетий и данной проблеме посвящены множество научных трудов, но её частота не имеет тенденции к снижению.
Таким образом, актуальность данной темы не подлежит сомнению, так как врождённые пороки развития желудочно-кишечного тракта среди новорожденных являются не только одной из причин высокой смертности, но инвалидизации детей в будущем.
Операции:
Существует две техники выполнения операции:
Техника анастомоза пищевода с использованием торакотомии
Техника анастомоза пищевода с использованием торакоскопии
Хирург располагался с левой стороны от пациента, а видеомонитор размещался с правой стороны больного. Первая канюля вместе с телескопом вводилась в плевральную полость. Два инструментальных порта помещались в грудную клетку сбоку от предыдущего торакопорта через симметричные разрезы выше и ниже на одно межреберье. Следующий шаг — пересечение дистального трахеопищеводного свища и мобилизация нижнего отдела пищевода с сохранением питающих сосудов и ветвей блуждающего нерва.
Первые швы накладывались на заднюю стенку анастомоза с латеральной стороны. Нити задней стенки предпочтительно завязывались внутрь просвета соустья. В общей сложности для соединения эзофагеальных сегментов применялось от 10 до 12 швов.
Послеоперационный период:
В период после операции ребенок находится в реанимационном отделении, где продолжают интенсивную терапию. Внутривенно вводят раствор глюкозы и электролиты. Питание ребенка осуществляется с помощью зонда или гастростомы для восстановления перистальтики кишечника.
По истечению недели проверяют анастомоз с помощью рентгеновского метода с введением Йодлипола. Наличие дыхательной трубки в трахее может вызвать отек, поэтому за короткий промежуток времени ребенка пытаются перевести на естественное дыхание. Можно начать питание через рот, если не намечаются пластические операции. На 2–3 неделе проводится эзофагогастроскопию, визуально оценивается зона анастомоза, смежных отделов желудка.
Прогноз:
Атрезия пищевода — одна из редких врожденных аномалий, встречающихся у 1 из 3000 новорожденных. Методы лечения порока и техника торакоскопии совершенствуются с течением времени, в результате чего устраняются недостатки предыдущих способов, что приводит к уменьшению летальных исходов и вреда, наносимого во время операции.
При раннем обнаружении порока и незамедлительном хирургическом вмешательстве коррекция атрезии пищевода положительна. Использование торакоскопии у детей с атрезией пищевода является реальной альтернативой открытой операции и имеет перед ней некоторые преимущества. При несвоевременной диагностике атрезии пищевода дети умирают от тяжелой аспирационной пневмонии — воспаления легких.
Основные термины (генерируются автоматически): врожденный порок развития, атрезия пищевода, желудочно-кишечный тракт, Оренбург, ребенок, дистальный конец, дистальный отдел пищевода, использование торакоскопии, порок развития, проксимальный отдел пищевода.
Читайте также:

