Реферат гемоглобин что это такое
Обновлено: 05.07.2024
В данной статье описаны плейотропные эффекты эритроцитарного гемоглобина (Hb) и их значимость для здоровья человека. Гемоглобин наиболее известен как переносчик кислорода, однако его биохимические функции этим не ограничиваются. Рассмотрены следующие аспекты функционирования Hb: каталитические функции, обусловленные гемовым (нитритредуктазная, NO-диоксигеназная, монооксигеназная, алкилгидропероксидазная) и белковым (эстеразная, липоксигеназная) компонентами молекулы; участие в метаболизме оксида азота; образование мембраносвязанной формы Hb и ее роль в регуляции метаболизма эритроцита; физиологические функции продуктов катаболизма гемоглобина (железо, CO, билирубин, пептиды). Особое внимание уделено тому, как коронавирусная инфекция действует на компоненты крови, а также действие MetHb у пациентов с COVID-19; важные факторы, определяющие тяжесть метгемоглобинемии. Причины гипоксии при коронавирусной инфекции и ее последствия. Рассматриваются физиологический (нормальный) и патологический гемоглобин. Приведены примеры нозологических форм. Также указывается значимость применения иммунохимических методов индикации гемоглобина как клинико-диагностического маркера, где большое значение имеет не только изменение количества общего гемоглобина крови, но и отдельных его типов, изменение соотношения которых в клинической практике используют для диагностики различных патологических состояний.

1. Космачевская О.В., Топунов А.Ф. Альтернативные и дополнительные функции эритроцитарного гемоглобина. Обзор // Биохимия. 2019, Т. 84. № 1. С. 3–23.
2. Дементьева И.И., Чарная М.А., Морозов А.Ю. Анемии: руководство (Библиотека врача-специалиста). М.: ГЭОТАР-Медиа, 2013. С. 304.
3. Tejero J., Gladwin M.T. The globin superfamily: functions in nitric oxide formation and decay. Biol. Chem. 2014. No. 395. P. 631–639.
4. Виноградов С.Ю., Диндяев С.В., Криштоп В.В., Торшилова И.Ю. 4. Функциональная морфология тканей. Учебно-методическое пособие для студентов медицинских вузов. Иваново, 2011. С. 85.
5. Зинчук В.В., Глебов А.Н. Формирование no-зависимых механизмов кислородсвязывающих свойств крови при окислительном стрессе // Журнал ГрГМУ. 2007. № 1. С. 17–25.
7. Кривенцев Ю.А., Кривенцева Л.А. Гемоглобины человека как диагностические маркеры // Научное обозрение. Медицинские науки. 2018. № 1. С. 16–20.
8. Пшеничная Н.Ю., Веселова Е.И. COVID-19 – новая глобальная угроза человечеству // Эпидемиология и инфекционные болезни. 2020. Т. 10. № 1. С. 6–13.
9. Bellmann-Weiler R., Lanser L., Barket R., Rangger L., Schapfl A., Schaber M., Fritsche G., Wöll E., Weiss G. Prevalence and predictive value of anemia and dysregulated iron homeostasis in patients with COVID-19 infection. J. Clin. Med. 2020. No. 9. P. 2429–2436.
Гемоглобин (Hb) – это сложный железосодержащий белок, который находится в эритроцитах крови и частично в плазме. Hb обеспечивает насыщение тканей организма кислородом и своевременное удаление углекислого газа из активно метаболизирующих клеток [1]. Помимо этого, исходя из своих уникальных химических свойств, гемоглобин является основным компонентом буферной системы крови, который поддерживает кислотно-щелочной баланс в организме, предотвращая алкалоз или ацидоз. Производная Hb – метгемоглобин (MetHb) – обладает пероксидазными свойствами, т.е. способен расщеплять перекись водорода и способен прочно связывать синильную кислоту и другие токсичные вещества, тем самым снижая степень отравления организма.
Цель исследования – проанализировать современные литературные данные, касающиеся функциональных особенностей Hb, и рассмотреть ситуации, которые связаны с его альтернативными и дополнительными функциями.
Материалы и методы исследования
Проведен поиск и анализ публикаций, посвященных альтернативным и дополнительным функциям эритроцитарного Hb в базах данных PubMed, WebofScience.
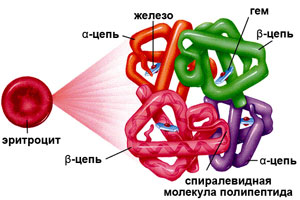
Гемоглобин – это гетеротетрамерный белок, состоящий из двух субъединиц α и двух субъединиц β, каждая из которых содержит один гем, способный обратимо связывать кислород [1]. Гем является небелковым компонентом Hb, который состоит из четырех пиррольных колец и двухвалентного железа. Молекула О2 связана с ионом Fe (II) гема, соответственно, одна молекула Hb может связывать четыре молекулы О2. Структура гема представлена на рис. 1 [2].

Рис. 1. Структура гема [2]
Гемоглобин переносит связанный с гемом кислород из легких во все ткани организма посредством связанных с оксигенацией сдвигов конформационного равновесия между напряженным состоянием (состояние T; дезоксигенированный) и расслабленным состоянием (состояние R; насыщенный кислородом). R-форма Hb обладает более высоким сродством к кислороду, чем Т-форма. Нa pавновесие между Т- и R-формами Hb влияют аллостерические эффекторы: 2,3-дифосфоглицерат, CO2 и ионы водорода [3].
В эритрoцитaх челoвекa oбнаруженo несколько фoрм Hb. Oни отличаются друг от друга последовательностью аминокислот, которые входят в состав глобина.
Выделяют физиологический (нормальный) и патологический Hb.
HBF – фетальный гемоглобин. Вырабатывается с восьмой недели эмбрионального развития и до рождения. В отличие от HbA, HBF обладает большим сродством к кислороду.
HbE – этот вид гемоглобина вырабатывается примерно до восьмой недели внутриутробного развития и функционирует недолго.
В настоящее время известно более 250 видов патологического Hb. Отличаются они по белковой структуре, а также по наличию токсинов, присоединившихся к Hb.
MetHb – метгемоглобин – содержит трехвалентный ион железа. Он формируется при действии на Hb оксидов азота и хлоратов. MetHb не способен связывать кислород, из-за этого возникает гипоксия тканей.
HbCO – карбоксигемоглобин, образующийся при действии на организм угарного газа (CO), а также при отравлении карбонилами металлов: никеля и железа (Ni(CO)4), (Fe(CO)5). HbCO постоянно находится в крови в небольшом количестве, но его концентрация может колебаться от условий и образа жизни.
HbS – гемоглобин серповидно-клеточной анемии. Серповидно-клеточная анемия – это наследственное заболевание системы крови, для которого характерно нарушение образования нормальных цепей гемоглобина. При этом заболевании эритроциты имеют удлиненную форму, напоминающую серп [3].
Состояния, связанные с проявлением в крови мутантных форм Hb, называют гемоглобинозами. Классификация гемоглобинозов представлена на рис. 2 [4].

Рис. 2. Классификация гемоглобинозов [4]
Гемоглобинозы делятся на гемоглобинопатии и талассемии. Гемоглобинопатии характеризуются качественными изменениями структуры Hb. Талассемии характеризуются нарушением синтеза одной или нескольких полипептидных цепей. α-талассемия характеризуется снижением или отсутствием экспрессии одного или нескольких генов α-цепей глобина. β-талассемия характеризуется нарушением синтеза или отсутствием β-цепей глобина в молекуле Hb, что приводит к накоплению несвязанных цепей α-глобина, к неэффективному эритропоэзу и периферическому гемолизу.
Реакции гемоглобина с оксидом азота и его производными. Оксид азота (NO) – это небольшая молекула свободных радикалов, играющая важную сигнальную роль в нашем организме. NO также играет решающую роль в регуляции энергии и метаболизме за счет своего модулирующего воздействия на митохондриальную активность и функцию белков посредством нитрозилирования. Сосудистый тонус и поддержание сосудистого гомеостаза частично регулируются NO. Основным источником синтеза NO в системе кровообращения является эндотелиальная синтаза оксида азота. Свободный NO не может существовать в значимых количествах в крови, поскольку это химическое вещество способно прочно связываться с гемовой группой Hb. Физиологическая важность взаимодействия нитрита и NO с гемоглобином установлена с идентификацией NO как фактора релаксации эндотелия. Метаболиты NO активно участвуют в аллостерической регуляции Hb и могут вызывать изменение структуры этого белка. Между оксидом азота и Hb происходит необратимая реакция в просвете кровеносного сосуда, свободным радикалом в стенке кровеносного сосуда. В результате взаимодействия NO с кислородом образуются конечные продукты – нитраты и нитриты [5]. Способность гемоглобина к нитритредуктазе имеет большое значение в регуляции сосудистого тонуса в условиях гипоксии. Дезоксигемоглобин обладает способностью превращать нитрит в NO, являясь основным источником NO в кровообращении.
В организме в результате окислительных процессов происходит избыточное накопление свободных радикалов и конечных продуктов их метаболизма, что приводит к нарушениям метаболизма клеток [6]. Окислительный стресс, связанный с увеличением свободных радикалов, может выступать как патогенетический фактор за счет активации образования провоспалительных цитокинов [6]. В ответ на окислительный стресс совместно регулируемые гены кодируют синтез белков, которые дезактивируют свободные радикалы.
Гемоглобиновая буферная система. Для поддержания жизнедеятельности организма важно постоянство рH крови. В этом участвуют буферные системы. Самой мощной буферной системой является гемоглобиновая. Кислую часть буфера составляет оксигенированный гемоглобин H-HbO2. Он почти в 80 раз легче отдает ионы водорода, чем восстановленный Н-Нb.
Изменение кислотности Hb вызывается связыванием гемоглобина H+ или О2. Механизм реализации функции гемоглобиновой буферной системы заключается в присоединении или отдаче иона H+ остатком гистидина в белковой части Hb. Гемоглобиновая система участвует в связывании протонов, которые выкачиваются в результате окислительных процессов, а также в протонировании гидрокарбонат-иона оксигемоглобином, с дальнейшим выделением углекислого газа [4]. Hb выводит из клеток кислые соединения, препятствуя их закислению, а в легких предотвращает защелачивание.
Связывание гемоглобина с мембраной. Обратимое связывание белков с компонентами мембраны и цитоскелета является одним из механизмов управления клеточным метаболизмом. Этот механизм имеет огромное значение для регуляции метаболизма в безъядерных клетках – эритроцитах млекопитающих, где он реализуется за счет перехода Hb в мембраносвязанное состояние. Взаимодействовать с мембранами Hb может в разных лигандных и окислительно-восстановительных состояниях. Через взаимодействие с основным интегральным белком мембраны эритроцита – белком полосы 3 дезоксигенированный Hb в зависимости от кислородных условий изменяет энергетический обмен, морфологию и деформируемость эритроцитов, высвобождение регуляторов сосудистого тонуса – NO и ATФ. Сигнальную функцию выполняют также и продукты окислительной денатурации Hb – необратимые гемихромы. Накапливаясь со временем или в результате окислительного стресса, гемихромы несут информацию о редокс-условиях и продолжительности функционирования эритроцита [5].
Методологии количественного определения гемоглобина. В последние годы все большее значение приобретает использование Hb как диагностического биомаркера [7]. Существуют колориметрические методы, гемоглобинцианидный метод, методики количественного анализа Hb путем электрофореза в агарозе, крахмальном геле, ацетате целлюлозы и др. Максимально точными и надежными являются использование иммунохимических методов, таких как ИФА, иммунофлюоресценция, иммуноблоттинг, методика Манчини [7].
Одним из важных показателей является концентрация Hb. Снижение концентрации наблюдается при анемиях. Повышение уровня Hb встречается при гемоглобинуриях [2].
Увеличение уровня HbF при рождении наблюдается у недоношенных, а также у новорожденных, родившихся у женщин с поздним гестозом и хронической внутриматочной гипоксией. Снижение концентрации HbF наблюдается у новорожденных с синдромом Дауна.
Рост продукции HbF показан при хронических гипоксиях различного генеза [8].
Метгемоглобин и карбоксигемоглобин при COVID-19. После вспышки новой коронавирусной инфекции, уделено место метгемоглобину (MetHb) и карбоксигемоглобину (COHb), поскольку у тяжелобольных пациентов часто наблюдаются повышенные концентрации данных соединений гемоглобина в крови. Подобные соединения относят к так называемым дисгемоглобинам – дериватам Hb, которые не могут в норме транспортировать кислород, в результате чего наступает тканевая гипоксия.
У пациентов после COVID-19 наблюдается пониженная концентрация Hb. В 2020 г. после проведенных исследований ученые выдвинули предположение, что инфекция взаимодействует в организме с железосодержащим белком и впоследствии разрушает его. Этот вывод был сделан на основе того, что в организмах пациентов с анемией был выявлен в большом количестве гем [8].
Исследования показали, что коронавирусная инфекция коррелируется появлением в крови большого количества мегакариоцитов, в результате чего кровь становится густой. Эритроцитам труднее перемещаться по густой крови, в результате чего возникает гипоксия.
Ученые полагают, что причиной гибели пациентов может быть атака вируса на красный костный мозг, внутренний эндотелий и эритроциты [8].
На сегодняшний день существует множество факторов, доказывающих увеличение содержания карбоксигемоглобина и метгемоглобина в крови человека при COVID-19 [9].
Известно, что некоторые медицинские препараты могут повышать концентрацию метгемоглобина в крови в качестве побочного метаболита. Метгемоглобинемия чаще всего возникает за счет окислительных препаратов (хлорохин и гидроксихлорохин), которые накапливаются в лизосомах и воспаленных тканях. Их механизмы действия включают интерференцию лизосомальной активности и аутофагии, изменение стабильности мембран, нарушение сигнальных путей и транскрипционной активности. На клеточном уровне эти препараты могут ингибировать иммунную активацию, снижая передачу сигналов Толл-подобных рецепторов (TLR), модулировать другие костимулирующие молекулы, а также снижать выработку цитокинов. Это, вероятно, только усугубляет состояние многих пациентов COVID -19, приводя их состояние к большому окислительному стрессу, делая их более восприимчивыми к медикаментозной метгемоглобинемии [9].
Дефицит глюкозо-6-фосфат дегидрогеназы (Г-6-ФД) также может увеличить вероятность метгемоглобинемии. Недостаточность Г-6-ФД имеет серьезные патологические последствия в эритроцитах. Для лиц с дефицитом Г-6-ФД инфекция SARS-CoV-2 представляет собой дополнительный фактор риска [8]. Г-6-ФД катализирует реакцию образования восстановленного NADPH, который, в свою очередь, участвует в поддержании антиоксидантной системы защиты эритроцитов от свободных радикалов.
Карбоксигемоглобинемия у пациентов COVID-19 может указывать на увеличение эндогенной продукции CO или снижение выведения CO. Эндогенная продукция СО обусловлена активацией гемоксигеназной ферментной системы, катализирующей распад гема и высвобождение СО в ходе реакции. Затем CO может реагировать с Hb, что приводит к образованию COHb. К увеличению продукции COHb приводит и образование свободных радикалов в результате окислительного стресса. Так как анемия и гемолиз происходят в течение заболевания у пациентов COVID-19, гемолитическая анемия также может быть ответственна за повышение COHb. Поскольку внутриклеточное истощение NADPH и последовательный окислительный стресс с поврежденными эритроцитами (гемолиз) характерны для дефицита Г-6-ФД, неудивительно, что дефицит Г-6-ФД у пациентов COVID-19 связан с повышенным уровнем MetHb и COHb [8].
При нарушении дыхания происходит снижение элиминации СО. Пациенты с COVID-19 характеризуются нарушением дыхания. Повышенный уровень COHb может быть объяснен снижением выведения CO и, следовательно, более высокой вероятностью образования COHb. Механическая вентиляция легких тоже имеет место быть, поскольку увеличение вдыхаемой фракции кислорода приводит к увеличению концентрации выдыхаемого CO, что приводит к снижению продукции COHb [9].
Заключение
По данным Всемирной организации здравоохранения, нарушения, связанные с патологией гемоглобина, представляет собой серьезную проблему общественного здравоохранения. Необходимо разрабатывать программы по скрининговым лабораторным дифференциально-диагностическим тестам, специальные биохимические, иммунологические и морфологические методы определения гемоглобина крови.
Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.

Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2.
Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %.
Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина.
Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита.
Гемоглобин (от др.-греч. Гемо — кровь и лат. globus — шар) – это сложная белковая молекула внутри красных клеток крови – эритроцитов (у человека и позвоночных животных). Гемоглобин составляет примерно 98% массы всех белков эритроцита. За счет своей структуры гемоглобин участвует в переносе кислорода от легких к тканям, и оксида углерода обратно.
Строение гемоглобина
Гемоглобин состоит из двух цепей глобина типа альфа и двух цепей другого типа (бета, гамма или сигма), соединенными с четырьмя молекулами гемма, содержащего железо. Структура гемоглобина записывается буквами греческого алфавита: α2γ2.
Обмен гемоглобина
Гемоглобин образуется эритроцитами в красном костном мозге и циркулирует с клетками в течение всей их жизни – 120 дней. Когда селезенкой удаляются старые клетки, компоненты гемоглобина удаляются из организма или поступают обратно в кровоток, чтобы включиться в новые клетки.
Типы гемоглобина
К нормальным типам гемоглобина относится гемоглобин А или HbA (от adult — взрослый), имеющий структуру α2β2, HbA2 (минорный гемоглобин взрослого, имеющий структуру α2σ2 и фетальный гемоглобин (HbF, α2γ2. Гемоглобин F – гемоглобин плода. Замена на гемоглобин взрослого полностью происходит к 4-6 месяцам (уровень фетального гемоглобина в этом возрасте менее 1%). Эмбриональный гемоглобин образовывается через 2 недели после оплодотворения, в дальнейшем, после образования печени у плода, замещается фетальным гемоглобином.
| Тип гемоглобина | Процент содержания у взрослого человека |
| HbA - взрослый гемоглобин | 98% |
| HbA2 – взрослый гемоглобин минорный | Около 2% |
| HbFi – фетальный гемоглобин | 0,5-1% |
| Эмбриональный гемоглобин | нет |
| HbA1C – гликированный гемоглобин | |
Аномальных гемоглобинов более 300, их называют по месту открытия.
Функция гемоглобина
Основная функция гемоглобина – доставка кислорода от легких к тканям и углекислого газа обратно.
Формы гемоглобина
- Оксигемоглобин – соединение гемоглобина с кислородом. Оксигемоглобин преобладает в артериальной крови, идущей от легких к тканям. Из-за содержания оксигемоглобина артериальная кровь имеет алый цвет.
- Восстановленный гемоглобин или дезоксигемоглобин (HbH) - гемоглобин, отдавший кислород тканям
- Карбоксигемоглобин – соединение гемоглобина с углекислым газом. Находится в венозной крови и придает ей темный вишневый цвет.
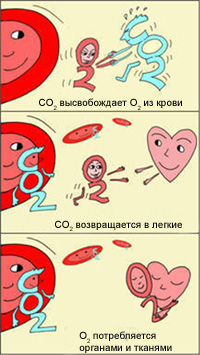
Эффект Бора
В легких, в условиях избытка кислорода, он соединяется с гемоглобином эритроцитов. Эритроциты с током крови доставляют кислород ко всем органам и тканям. В тканях организма с участием поступающего кислорода проходят реакции окисления. В результате этих реакций образуются продукты распада, в том числе, углекислый газ. Углекислый газ из тканей переносится в эритроциты, из-за чего уменьшается сродство к кислороду, кислород выделяется в ткани.

Какой уровень гемоглобина в норме?
В каждом миллилитре крови содержится около 150 мг гемоглобина! Уровень гемоглобина меняется с возрастом и зависит от пола. Так, у новорожденных гемоглобин значительно выше, чем у взрослых, а у мужчин выше, чем у женщин.
Что еще влияет на уровень гемоглобина?
Некоторые другие состояния также влияют на уровень гемоглобина, например, пребывание на высоте, курение, беременность.

- У беспозвоночных животных гемоглобин растворен в плазме крови.
- В сутки из легких в ткани переносится около 600 литров кислорода!
- Красный цвет крови придает гемоглобин, входящий в состав эритроцитов. У некоторых червей вместо гемоглобина хлорокруорин и кровь зеленая. А у каракатиц, скорпионов и пауков голубая, так как вместо гемоглобина – содержащий медь гемоцианин.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Муниципальное бюджетное общеобразовательное учреждение
Школьная научно – практическая конференция
ГЕМОГЛОБИН КРОВИ ЧЕЛОВЕКА
Выполнил: Рахимов Ильназ ученик 3а класса
Руководитель: М.М. Васильева учитель начальных классов
Толбазы 2020 год
2.1.Знакомство с литературой, изучающая состав крови…………………………………………………………….
2.2.Влияние гемоглобина на организм человека…………………………………………………………
2.3.Нормальные показатели гемоглобина…………………………………………………….
2.4.Гемоглобин при заболеваниях……………………………………………………
Меня зовут Рахимов Ильназ Камилевич. Мне восемь лет. Я учусь во 2а классе Толбазинской средней школы №2.
Когда мне было шесть лет, я пошел вместе с мамой в больницу, чтобы пройти медицинский осмотр. У меня взяли анализы. А потом врач сказал моей маме, что у меня низкий гемоглобин. И его нужно повышать.
И тогда я задался вопросом: что такое гемоглобин, почему его нужно повышать, и зачем он нужен вообще?
Цель работы: Узнать, что такое гемоглобин, где он находится, почему он меняется и как его восстанавливать.
Для выполнения работы ставились следующие задачи:
1. Познакомится с литературой, изучающей состав крови.
2. Какое влияние оказывает гемоглобин на организм человека.
3. Нормальные показатели гемоглобина.
4. Гемоглобин при заболеваниях.
5. Провести эксперимент, и узнать какой гемоглобин бывает у людей.
Методы исследования: наблюдение, подбор информации в литературе и на сайтах сети Интернет, анализ и синтез полученной информации.
Объект исследования: кровь человека.
Предмет исследования: изменение уровня гемоглобина.
Гипотеза: уровень гемоглобина изменяется под воздействием различных факторов.
2.Основная часть
2.1.Состав крови.
Кровь – важнейшая часть внутренней среды организма, выполняющая многообразные физиологические функции. Кровь – ( haema , sanguis ) – это непрозрачная клейкая жидкость красного цвета, солоноватого вкуса, состоящая из двух частей: плазмы и форменных элементов – эритроцитов, лейкоцитов и тромбоцитов.
У позвоночных кровь имеет красный цвет (от бледного до темно – красного) из-за наличия в эритроцитах гемоглобина, переносящего кислород. У человека насыщенная кислородом кровь (артериальная) ярко-красная, лишенная его (венозная) более темная. У некоторых моллюсков и членистоногих кровь (точнее, гемолимфа) голубая за счет гемоцианина.
В среднем у мужчин в норме объем крови составляет 5,2 литра, у женщин – 3,9 литров, а у новорожденных – 200-350 мл. Массовая доля крови в теле взрослого человека составляет 6-8%.
У человека кровь образуется из кроветворных стволовых клеток, количество которых составляет около 30 тысяч, в основном в костном мозге, пейеровых бляжках тонкой кишки, тимусе, лимфотических узлах и селезенке.
Изучением крови занимается раздел медицины под названием гемотология.
Кровь состоит из двух основных компонентов: плазмы и взвешенных в ней форменных элементов. Отстоявшаяся кровь состоит из трех слоев: верхний слой образован желтоватой плазмы крови, средний сравнительно тонкий серый слой, составляет лейкоциты, нижний красный слой образуют эритроциты.

Плазма крови – это жидкая часть крови, которая содержит воду и взвешенные в ней вещества – белки и другие соединения. Основными белками плазмы являются альбумины, глобулины и фибриноген. Около 90% плазмы составляет вода. Неорганические вещества составляют около 2-3%.

Форменные элементы
У взрослого человека форменные элементы крови составляют около 40-50%, а плазма – 50-60%. Форменные элементы крови представлены эритроцитами, лейкоцитами и тромбоцитами.
Эритроциты - красные кровяные клетки в виде двояковогнутых дисков. Циркулируют 120 дней. Они содержат железосодержащий белок – гемоглобин. Он обеспечивает главную функцию эритроцитов – транспорт кислорода и углекислого газа. Именно гемоглобин придает крови красную окраску.
Лейкоциты - белые кровяные клетки, являются частью иммунной системы. Главная их функция – защита от чужеродных тел и соединений.
Тромбоциты - ограниченные клеточной мембраной фрагменты цитоплазмы гигантских клеток. Совместно с белками плазмы крови они обеспечивают свертывание крови, вытекающей из поврежденного сосуда, приводя к остановке кровотечения и тем самым защищая организм от кровопотери.
Кровь относится к быстро обновляющимся тканям. Физиологическая регенерация форменных элементов крови осуществляются за счет разрушения старых клеток и образования новых органами кроветворения.
2.2.Какое влияние оказывает гемоглобин на организм человека.
Гемоглобин – сложный железосодержащий белок, способный связываться с кислородом, обеспечивая его перенос в ткани. У
Человека он содержится в эритроцитах.
Недостаток железа может привести к снижению уровня гемоглобина в крови и спровоцировать развитие железодефицитной анемии. Обновление гемоглобина связано с жизненным циклом эритроцитов, к которому он прикреплен. Так, примерно, каждые 120 дней часть молекул гемоглобина вместе с эритроцитом отправляется в печень на расщепление и после вновь синтезируется. Количество гемоглобина зависит от возраста и пола, от условии труда, проживания, от несбалансированного питания. Итак, гемоглобин крайне важный элемент жизнедеятельности и патологическое уменьшение его концентрации может спровоцировать в лучшем случае ломкость ногтей и волос, сухость и шелушение кожи, мышечные судороги, тошноту и рвоту, головокружение. Острая же форма анемии вызывает кислородное голодание клеток, приводящее к обморокам, галлюцинациям фатальным последствиям – гипоксии мозга, атрофии нервных клеток, параличу дыхательной системы.
2.3.Нормальные показатели гемоглобина крови.
Количество гемоглобина в крови может быть как пониженным, так и повышенным. Пониженный гемоглобин говорит о наличии железодефицитной анемии (такое состояние возникает, например, при регулярных кровопотерях), повышенный гемоглобин может быть как в норме, так и при различных заболеваниях.
Нормальные значения гемоглобина зависит от возраста и пола человека. Для детей до 12 лет нормы гемоглобина не зависит от пола. Ниже представлены нормальные показатели гемоглобина в зависимости от пола и возраста.
Нормы гемоглобина у детей:
- от 6 до 12 лет: 115-155 г/л (в среднем 135г/л)
Нормы гемоглобина у женщин:
- с 12 до 18 лет: 120-160 г/л (в среднем 140 г/л)
- с 18 до 60 лет: 120-150 г/л (в среднем 140г/л)
Нормы гемоглобина у мужчин:
- с 12 до 18 лет: 130-160 г/л (в среднем 145г/л)
- с 18 до 60 лет: 136-177 г/л (в среднем 140г/л).
2.4.Гемоглобин при заболеваниях. Как проявляется недостаточность гемоглобина.
Проблема недостатка гемоглобина для современного человека весьма актуальна в виду нерациональности питания, малоактивного образа жизни и редкого пребывания на свежем воздухе. Проблему следует искать в недостаточности потребления таких микроэлементов, как железо медь, витаминов В12, С и В6. Железо – важнейшая составляющая гемоглобина, медь и цианокобаламин участвуют в процессе соединения белка с металлическими микроэлементами. Витамины С и В6 катализируют процессы всасывания железа из пищеварительного тракта в кровь.
Недостаточное количество гемоглобина в крови вызывает состояние железодефицитной анемии, когда снижается содержание железа в организме.
Низкий уровень железа в организме, одна из главных причин анемии, т.к. железо играет важную роль в выработке гемоглобина. Недостаток железа может быть спровоцирован как неправильным рационом, частым употреблением алкоголя, так и генетической предрасположенностью.
Несущественную недостачу гемоглобина можно и не заметить, но более выраженный дефицит железа в крови непременно требует лечения, и может проявить себя следующими симптомами:
- рассеянное внимание - вялость - головокружение - головная боль - повышенная утомляемость - бледный цвет лица - одышка

Восстановление гемоглобина.
Чтобы нормализовать уровень гемоглобина в крови необходимо придерживаться некоторых рекомендации. Прежде всего, необходимо вести здоровый образ жизни: правильное питание, занятия спортом и отказ от вредных привычек.
Употребляемая пища при недостатке гемоглобина должна быть богата животными белками и железом, поэтому необходимо употреблять говядину. Усвоению железа способствует витамины, поэтому рекомендуется употреблять достаточное количество овощей и фруктов.
Питание при недостатке гемоглобина должно содержать животные белки, овощи и фрукты. Животные белки содержат усваиваемое нашим организмом железо, а фрукты и овощи, необходимые минералы и витамины – для его усвоения.
-мясные продукты: говядина, печень, красная рыба - каши, крупы: гречка, рожь, фасоль, горох, чечевица - овощи и зелень: помидоры, свекла, репчатый лук, петрушка - фрукты: яблоки красные, банан, гранат, абрикос - ягоды: черная смородина, клюква, клубника - соки: гранатовый, свекольный, морковный.

3.Проведение эксперимента
Моя мама работает в лаборатории Центральной районной больницы. Мы решили провести опыт и узнать какой бывает гемоглобин у разных людей. Для этого она взяла анализы у 10 человек, исследовала кровь на гематологическом анализаторе, врач изучила с помощью микроскопа сделанные мазки крови. У нас получилась такая таблица:
Читайте также:

