Растворы в природе реферат
Обновлено: 05.07.2024
Растворы в жизни человека имеют очень большое значение т.к.практически всё существование человека на них основано. Например вода, которая является очень разбавленным раствором. В ходе эволюции вода создала окружающую нас природу, живой мир, да и самого человека: именно водная среда (Мировой океан) могла обеспечить все требования к возникновению и развитию жизни. Именно она стала основателем, при специфических внешних условиях, жизни на Земле. Водаобеспечивает существование жизни на нашей планете: сложнейшие биохимические реакции в клетках животных и растительных организмов могут протекать только при наличии воды. С точки зрения химиков живое вещество – это водный раствор, и почти все процессы, обеспечивающие его жизнедеятельность, сводятся к химическим реакциям в водном растворе.
Человечество издавна уделяло большое внимание воде, поскольку было хорошоизвестно, что там, где нет воды, нет и жизни. Вода находится в постоянном и активном круговороте. Его движущей силой является Солнце, а основным источником воды – Мировой океан. Круговорот воды – исключительно важный процесс. Он обеспечивает сушу пресной водой, которая постоянно возобновляется, в процессе этого круговорота, вода разрушает и растворяет твердые породы на суши и переносит их в другиеместа, с образованием наносов.
Роль растворов в жизнедеятельности организмов
Вокруг нас нет практически чистых веществ - все они находятся в виде смесей, а чаще - растворов. Наш организм не исключение - все жизненно важные вещества, поступающие в организм, усваиваются после того , как будут растворены в жидких средах организма.
Именно поэтому изучение природы и свойстврастворов имеет огромное значение как с научной , так и с практической точки зрения; зная, какие процессы происходят в растворах внутри нас, можно научится управлять ими. Этот путь широко исследуется , в том числе и химиками, поскольку имеет большое значение для современной медицины.
Истинные растворы являются гомогенными; визуально разделить растворитель и растворенное веществоневозможно. На молекулярном уровне растворитель и растворенное вещество взаимодействуют между собой. Об этом свидетельствует изменение объема раствора (он не равен сумме объемов взятых для приготовления раствора веществ). Это, а также выделение или поглощение теплоты при растворении, говорит о том, что растворы нельзя считать механическими смесями. Для их компонентов характерно химическоевзаимодействие. Рассматривая свойства растворов, необходимо учитывать этот факт.
Как растворитель, так и растворенное вещество могут находиться в различных агрегатных состояниях. Однако наиболее часто встречаются и находят более широкое применение растворы в жидкостях, причем первое место по популярности среди растворителей занимает вода.
Вещества в различных агрегатных состояниях растворяютсяв воде при различных условиях. Если несколько различных веществ находятся в одинаковом агрегатном состоянии, то на их растворимость существенно влияет их природа.
Растворимость газов в воде обратно пропорциональна температуре растворителя. Кроме того, большая часть газов плохо растворяется в воде из-за того, что вода - полимерный растворитель.
Жидкости растворяются в воде вбольшинстве случаев ограниченно. Изменение температуры влияет на растворимость различных жидкостей по-разному.
Растворимость в воде твердых веществ также зависит от природы вещества, однако преимущественно с ростом температуры она увеличивается.
Важной характеристикой раствора является его кислотность (или щелочность). Эта величина отражает концентрацию.
Растворы и сам процесс растворения имеют большое значение в природе, в нашей жизни, в науке и технике. Чаще всего мы имеем дело не с чистыми веществами, а со смесями или растворами. Воздух - это раствор газов. Вода морей, рек, озер, грунтовые воды, питьевая вода - это растворы. Большинство минералов - это твердые растворы.
Прикрепленные файлы: 1 файл
Значение растворов в природе и жизни человека.docx
Значение растворов в природе и жизни человека
Растворы и сам процесс растворения имеют большое значение в природе, в нашей жизни, в науке и технике. Чаще всего мы имеем дело не с чистыми веществами, а со смесями или растворами. Воздух - это раствор газов. Вода морей, рек, озер, грунтовые воды, питьевая вода - это растворы. Большинство минералов - это твердые растворы.
Что такое растворы
При растворении веществ происходит их измельчение и рассеивание в объеме раствора. Растворимостью называется способность вещества растворяться в том или другом растворителе. Частицы одного вещества равномерно распределены между частицами другого. Если вещество растворено до уровня молекул, то раствор будет однородным, прозрачным и не будет отстаиваться. Такой раствор является истинным. Например, раствор соли в воде, столовый уксус, раствор сахара.
Растворитель - это компонент раствора, находящегося в таком же агрегатном состоянии, что и раствор, и количественно преобладает. Вода - растворитель для многих веществ. Хорошими растворителями так же являются спирт, ацетон, бензин, эфиры.
Растворенное вещество может быть в любом агрегатном состоянии: твердом (сахар, соль), жидком (спирт), газообразном (углекислый газ). Одновременно в растворе может быть растворено несколько веществ, например, в минеральной воде растворены различные соли. Количество растворенного вещества может быть различной. Растворы не имеют постоянного состава, и в этом заключается их основное отличие от химических соединений.
Абсолютно нерастворимых веществ не бывает. Даже когда мы наливаем воду в стеклянный сосуд, очень небольшое количество частиц стекла неизбежно переходит в раствор. По агрегатному состоянию выделяют твердые растворы (сплавы металлов, минералы), жидкие растворы (морская вода, чай, столовый уксус) и газообразные растворы (воздуха).
Растворимость различных веществ обусловливается многими причинами. Растворимость большинства твердых веществ с увеличением температуры увеличивается, а растворимость газов, наоборот, уменьшается. Давление не влияет на растворимость твердых веществ. Зато увеличение давления повышает растворимость газов.
По количеству растворенного вещества растворы бывают разведены или концентрированные. Если в определенном объеме раствора находится относительно небольшое количество растворенного вещества, то раствор называется разведенным, а если растворено много вещества, то раствор называется концентрированным. Раствор, в котором данное вещество еще может растворяться, называется ненасыщенным.
Примеры растворов в природе
В строении всех живых организмов присутствуют растворы. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа, внутриклеточные жидкости и т.д.). Процессы усвоения пищи человеком и животными, так же связаны с переводом питательных веществ в раствор.
Примеры растворов в жизни человека
Растворы широко применяют в быту, медицине, промышленности. Чай, кофе, соусы, супы и многие другие продукты являются растворами. Различные косметические и частящие средства: мыло, духи. Материалы для творчества: клей, краски.
Многие лекарственные вещества используются в медицине в виде растворов. Это перекись водорода, зеленка,
Растворы используют в строительстве: раствор штукатурки, затирки, бетона, монтажная пена.
Растворы играют исключительную роль в природе и жизнедеятельности. Все что нас окружает представляет собой растворы. Без них наша жизнь была бы невозможна.
Кристаллы любого вещества, например сахара или хлорида натрия, можно получить разного размера – крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещества внутреннюю структуру – молекулярную или ионную кристаллическую решетку.
Содержание
1. Дисперсные системы. Истинные растворы
2. Растворимость твёрдых веществ и жидкостей в жидкостях. Влияние природы веществ и температуры на растворимость
3. Способы выражения концентрации растворов: массовая – С%, молярная – С м и нормальная (эквивалентная) – С н
4. Растворы электролитов. Электролитическая диссоциация кислот, оснований, солей. Ступенчатая диссоциация
5. Классификация электролитов. Степень диссоциации. Сильные и слабые электролиты
6. Реакции обмена в растворах электролитов и условия их протекания. Ионные уравнения
7. Ионное произведение воды. Водородный показатель рН растворов. Индикаторы
8.Растворитель.
Работа содержит 1 файл
Химия.doc
1. Дисперсные системы. Истинные растворы:
Кристаллы любого вещества, например сахара или хлорида натрия, можно получить разного размера – крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещества внутреннюю структуру – молекулярную или ионную кристаллическую решетку.
При растворении в воде кристаллов сахара и хлорида натрия образуются соответственно молекулярные и ионные растворы. Таким образом, одно и то же вещество может находиться в различной степени раздробленности: макроскопически видимые частицы (>0,2 мм, разрешающая способность глаза), микроскопически видимые частицы (от 0,2-0,1мм до 400-300нм, разрешающая способность микроскопа при освещении белым светом) и в молекулярном (или ионном) состоянии.
Если толщина плёнок, поперечник волокон или частиц (корпускул) меньше разрешающей способности оптического микроскопа то они не могут быть обнаружены с его помощью. Такие невидимые в оптический микроскоп частицы называют коллоидными , а раздробленное (диспергированное) состояние веществ с размером частиц от 400-300нм до 1нм – коллоидным состоянием вещества.
Дисперсные (раздробленные) системы являются гетерогенными. Они состоят из сплошной непрерывной фазы – дисперсионной среды и находящихся в этой среде раздробленных частиц того или иного размера и формы – дисперсной фазы.
Поскольку дисперсная (прерывная) фаза находится в виде отдельных небольших частиц, то дисперсные системы, в отличие от гетерогенных со сплошными фазами, называют микрогетерогенными, а коллоиднодисперсные системы называют также ультрамикрогетерогенными, чтобы подчеркнуть, что в этих системах граница раздела фаз не может быть обнаружена в световом микроскопе.
Когда вещество находится в окружающей среде в виде молекул или ионов, то такие растворы называют истинными, т.е. гомогенными однофазными растворами.
Обязательным условием получения дисперсных систем является взаимная нерастворимость диспергируемого вещества и дисперсионной среды. Например, нельзя получить коллоидные растворы сахара или хлорида натрия в воде, но они могут быть получены в керосине или в бензоле, в которых эти вещества практически нерастворимы.
Дисперсные системы классифицируют по дисперсности, агрегатному состоянию дисперсной фазы и дисперсионной среды, интенсивности взаимодействия между ними, отсутствию или образованию структур в дисперсных системах.
Количественной характеристикой дисперсности вещества является степень дисперсности ( D ) – величина, обратная размеру ( а ) дисперсных частиц:
Здесь а равно либо диаметру сферических или волокнистых частиц, либо длине ребра кубических частиц, либо толщине плёнок.
Степень дисперсности численно равна числу частиц, которые можно плотно уложить в ряд (или стопку плёнок) на протяжении одного сантиметра.
Если все частицы дисперсной фазы имеют одинаковые размеры, то такие системы называют монодисперсны ми . Частицы дисперсной фазы неодинакового размера образуют полидисперсные системы.
С повышением дисперсности всё большее число атомов вещества находится в поверхностном слое, на границе раздела фаз, по сравнению с их числом внутри объёма частиц дисперсной фазы. Соотношение между поверхностью и объёмом характеризует удельная поверхность: S уд =S/V , которая для частиц сферической формы равна
а для частиц кубической формы
где r - радиус шара; d – его диаметр; l – длина ребра куба.
Следовательно, с повышением дисперсности вещества всё большее значение имеют его свойства, определяемые поверхностными явлениями, т.е. совокупностью процессов, происходящих в межфазовой поверхности. Таким образом, своеобразие дисперсных систем определяется большой удельной поверхностью дисперсной фазы и физико-химическим воздействием дисперсной среды на границе раздела фаз.
Многообразие дисперсных систем обусловлено тем, что образующие их фазы могут находиться в любом из трёх агрегатных состояний (Ж, Г, Т).
Дисперсные системы с газообразной дисперсной средой называют аэрозолями. Туманы представляют собой аэрозоли с жидкой дисперсной фазой, а пыль и дым – аэрозоли с твёрдой дисперсной фазой; пыль образуется при диспергировании веществ, а дым – при конденсации летучих веществ.
Пены – это дисперсия газа в жидкости, причем в пенах жидкость вырождается до тонких плёнок, разделяющих, разделяющих отдельные пузырьки газа. Эмульсиями называют дисперсные системы, в которых одна жидкость раздроблена в другой, не растворяющей её жидкость. Низкодисперсные системы твёрдых частиц в жидкостях, называют суспензиями, или взвесями , а предельно-высокодисперсные – коллоидными растворами, или золями, часто лизолями, чтобы подчеркнуть, что дисперсной средой является жидкость. Если дисперсной средой является вода, то такие золи называют гидрозолями, а если органическая жидкость – органозолями.
Дисперсные системы могут быть свободнодис персными и связнодисперсными в зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы. К свободнодисперсным системам относятся аэрозоли, лиозоли, разбавленные суспензии и эмульсии. Они текучи. В этих системах частицы дисперсной фазы не имеют контактов, участвуют в беспорядочном тепловом движении, свободно перемещаются под действием силы тяжести. Связнодисперсные системы – твердообразны, они возникают при контакте частиц дисперсной фазы, приводящим к образованию структуры в виде каркаса или сетки. Такая структура ограничивает текучесть дисперсной системы и придаёт ей способность сохранять форму. Подобные структурированные коллоидные системы называют гелями . Переход золя в гель, происходящий в результате понижения устойчивости золя, называют гелеобразованием (или желатинированием ). Сильно вытянутая и плёночно-листочковая форма дисперсных частиц повышает вероятность контакта между ними и благоприятствует образованию гелей при малой концентрации дисперсной фазы. Порошки, концентрированные эмульсии и суспензии (пасты), пены – примеры связнодисперсных систем. Почва, образовавшаяся в результате контакта и уплотнения дисперсных частиц почвенных минералов и гумусовых (органических) веществ, также представляет собой связнодисперсную систему.
Сплошную массу вещества могут пронизывать поры и капилляры, образующие капиллярнодисперсные системы. К ним относятся, например, дерево, разнообразные мембраны идиафрагмы, кожа, бумага, картон, ткани.
2. Растворимость твёрдых веществ и жидкостей в жидкостях. Влияние природы веществ и температуры на растворимость.
Раствором называется твёрдая или жидкая гомогенная система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах.
Всякий раствор состоит из растворённых веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. Если же оба компонента до растворения находились в одинаковом агрегатном состоянии, то растворителем считается компонент, находящийся в большем количестве.
Однородность растворов делает их очень сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ тоже указывает на химическое взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том что, состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения. Непостоянство состава растворов приближает их к механическим смесям, но от последних они резко отличаются своею однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит содержание его в насыщенном растворе. Поэтому численно растворимость может быть выражена теми же способами, что и состав, например, процентным отношением массы растворённого вещества к массе насыщенного раствора или количеством растворённого вещества, содержащимся в 1 л насыщенного раствора. Часто растворимость выражают также числом единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя; иногда выраженную этим способом растворимость называют коэффициентом растворимости.
Растворимость различных веществ в воде изменяется в широких пределах. Если в 100 г воды растворяется более 10 г вещества, то такое вещество принято называть хорошо растворимым; если растворяется менее 1 г вещества – малорастворимым и, наконец, практически нерастворимыми, если в раствор переходит менее 0,01 г вещества.
Принципы, позволяющие предсказать растворимость вещества, пока не известны. Однако обычно вещества, состоящие из полярных молекул, и вещества с ионным типом связи лучше растворяются в полярных растворителях (вода, спирты, жидкий аммиак), а неполярные вещества – неполярных растворителях (бензол, сероуглерод).
Растворение большинства твёрдых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической решётки твёрдого тела, что обычно не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольватов). Прилагая принцип Ле Шателье к равновесию между веществом в кристаллическом состоянии и его насыщенным раствором
Кристалл + Растворитель Насыщенный раствор ± Q
приходим к выводу, что в тех случаях, когда вещество растворяется с поглощением энергии, повышение температуры должно приводить к увеличению его растворимости. Если же, однако, энергия гидратации достаточно велика, чтобы образование раствора сопровождалось выделением энергии, растворимость с ростом температуры понижается. Это происходит, например, при растворении в воде многих солей лития, магния, алюминия.
При растворении твёрдых тел в воде объём системы обычно изменяется незначительно. Поэтому растворимость веществ, находящихся в твёрдом состоянии, практически не зависит от давления.
Жидкости также могут растворяться в жидкостях. Некоторые из них неограниченно растворимы одна в другой, т.е. смешиваются друг с другом в любых пропорциях, как, например, спирт и вода, другие – взаимно растворяются лишь до известного предела. Так если взболтать диэтиловый эфир с водой, то образуется два слоя: верхний представляет собой насыщенный раствор воды в эфире, а нижний – насыщенный раствор эфира в воде. В большинстве подобных случаев с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются любых пропорциях.
Температура, при которой ограниченная взаимная растворимость жидкостей переходит в неограниченную, называется критической температурой растворения .
Как и в случае растворения твёрдых тел, взаимное растворение жидкостей обычно не сопровождается значительным изменением объёма. Поэтому взаимная растворимость жидкостей мало зависит от давления и заметно возрастает лишь при очень высоких давлениях (порядка тысяч атмосфер).
Если в систему, состоящую из двух несмешивающихся жидкостей, ввести третье вещество, способное растворяться в каждой из этих жидкостей, то растворённое вещество будет распределяться между обеими жидкостями пропорционально своей растворимости в каждой из них. Отсюда вытекает закон распределения , согласно которому вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остаётся постоянным, независимо от общего количества растворённого вещества:
Здесь С 1 и С 2 – концентрации растворённого вещества в первом и втором растворителях; К – так называемый коэффициент распределения .
3. Способы выражения концентрации растворов: массовая – С%, молярная – С м и нормальная (эквивалентная) – С н .

Значение растворов в природе
и жизни человека.
Понятие о дисперсных системах.
г. Донецк – 2020 г.
Цели: 1) Познакомить учащихся с растворами, указать их значение в природе и жизни человека; 2)

1) Познакомить учащихся с растворами,
указать их значение в природе и жизни
человека;
2) Дать понятие дисперсным системам;
3) Развивать логическое мышление, память,
умение сравнивать, развивать умения и
навыки в познавательной деятельности
учащихся;
4) Тренировать внимание в процессе
демонстрации химических опытов;
5) Повышать интерес учащихся к предмету.
Тип урока: урок усвоения новых знаний

Тип урока: урок усвоения новых знаний.
Элементы новых педагогических
технологий:
1. Использование коммуникативной
компетентности;
2. Включение учащихся в активную речевую
деятельность;
3. Стремление к грамотному общению.
Методы и формы обучения: рассказ
учителя, фронтальная беседа, демонстрация
опытов, рассказ с элементами беседы.
Оборудование и реактивы: 1. Периодическая система химических элементов

Оборудование и реактивы:
1. Периодическая система
химических элементов
Д. И. Менделеева;
3. Набор химических реактивов:
вода, мел, песок, сахар , NaCl,
подсолнечное масло,
яичный белок.
Литература: 1 Рудзитис Г.Е., Фельдман

Литература:
1 Рудзитис Г.Е., Фельдман Ф.Г. Химия. 8 класс. – 4-е изд. – М.: Просвещение, 2016.
2. Рудзитис Г.Е., Фельдман Ф.Г. Химия. 9 класс. – 2-е изд. – М.: Просвещение, 2016.
Ход урока l. Организационный момент

l. Организационный момент.
Из курса природоведения и из повседневной жизни вам
известно, что в воде растворяются многие вещества. При этом
образуются растворы.
ll. Актуализация опорных знаний.
lll. Мотивация учебной деятельности.
А что же представляют собой растворы и каково их значение
в природе и жизни человека? Нам это предстоит узнать на
данном уроке.
V. Изучение нового материала.
Вам известно, что при сме- шивании веществ с водой образуются однородные системы – растворы

Вам известно, что при сме-
шивании веществ с водой
образуются однородные
системы – растворы.
Примеры. Соль или сахар
растворяются в воде.
Образуется однородная
система – раствор.
Растворы – однородные системы, состоящие из молекул растворителя и частиц растворённого вещества, между которыми происходят физические и химические взаимодействия

Растворы – однородные системы,
состоящие из молекул растворителя
и частиц растворённого вещества,
между которыми происходят
физические и химические
взаимодействия.
Наибольшее значение имеют дисперсные системы, в которых средой является вода и др

Наибольшее значение имеют
дисперсные системы, в которых
средой является вода и др. жидкости.
Презентация по теме: "Значение растворов в природе и жизни человека. Понятие о дисперсных системах."
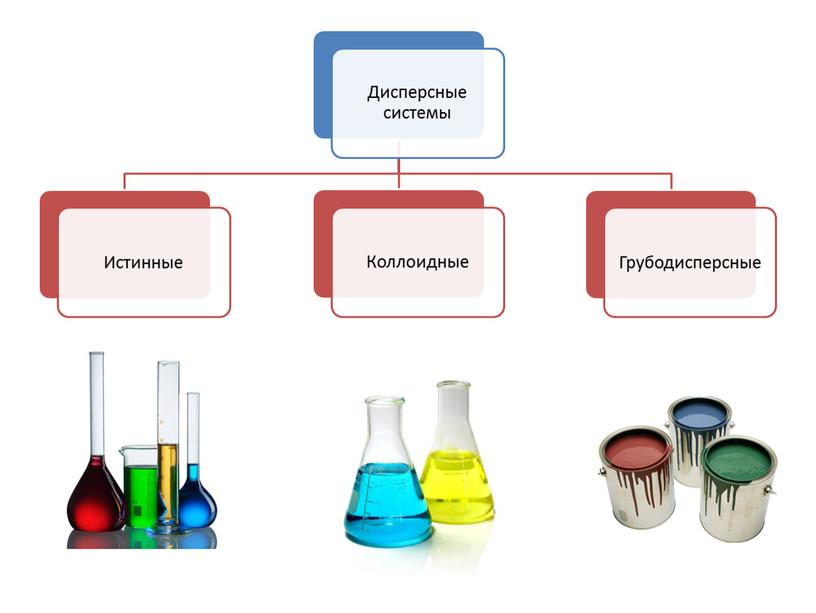
Истинные растворы однородны, частицы растворённого вещества меньше 1 нм (1 нм = 10^-9 м), их нельзя обнаружить даже при помощи ультрамикроскопа

l. Истинные растворы однородны, частицы
растворённого вещества меньше 1 нм
(1 нм = 10^-9 м), их нельзя обнаружить
даже при помощи ультрамикроскопа.
Задание. Привести примеры.
К истинным растворам
относятся растворы соли
и сахара в воде.
Коллоидные растворы прозрачны, как истинные, но размер частиц растворённого вещества боль- ше – от 1 до 100 нм

ll. Коллоидные растворы прозрачны, как истинные,
но размер частиц растворённого вещества боль-
ше – от 1 до 100 нм. Эти частицы состоят из мно-
жества молекул, способных рассеивать проходя-
щий через раствор свет. Отдельные частицы об-
наруживаются с помощью ультрамикроскопа.
Слипание коллоидных частиц называется коагу-
ляцией. При этом образуется гель – студнеобраз-
ная масса (желе, мармелад, студень).
Примеры. Растворы яичного
белка, силикатного клея.
Демонстрация.
Грубодисперсные системы. При смешива- нии некоторых веществ с водой образую- тся не растворы, а мутные смеси, кото- рые называют взвесями
lll. Грубодисперсные системы. При смешива-
нии некоторых веществ с водой образую-
тся не растворы, а мутные смеси, кото-
рые называют взвесями. Размеры частиц
растворённого вещества во взвесях пре-
шают 100 нм.
Взвеси делятся на суспензии, эмульсии и аэрозоли

Взвеси делятся на суспензии, эмульсии и аэрозоли.
Суспензии – взвеси, в которых мелкие частицы твёрдого
вещества равномерно распределены между молекулами
воды.
Примеры: глина, песок с водой.
Эмульсии – взвеси, в которых мелкие капельки жидкости
равномерно распределены между молекулами другой жи-
дкости.
Примеры: растительное масло с водой, керосин с водой.
Аэрозоли – взвеси, в которых частицы твёрдого вещества
равномерно распределены в газовой среде.
Примеры: пыль в воздухе, туман.
Растворы распространены в: - быту (растворы соли, сахара, уксусной кис- лоты в воде, газированная вода – раствор

Растворы распространены в:
- быту (растворы соли, сахара, уксусной кис-
лоты в воде, газированная вода – раствор
СО2 в H2O и т.д.);
- медицине (растворы лекарственных препа-
ратов для инъекций, микстуры и т.д.);
- различных отраслях промышленности;
- парфюмерии (эмульсии, аэрозоли);
- строительстве (грубодисперсные системы –
растворы песка, мела, цемента и т.д.), а
также во многих других сферах.
V. Закрепление. Изучив данную тему, повторим некоторые важные моменты

Изучив данную тему, повторим некоторые важные моменты.
Вопросы учащимся:
1) Что такое растворы?
2) Основные компоненты растворов.
3) Почему основным компонентом растворов чаще явяляется
вода?
4) Какие вещества могут быть использованы в качестве
растворителей?
Читайте также:

