Особенности кровотока в скелетных мышцах его регуляция и методы оценки реферат
Обновлено: 02.07.2024
Сосуды скелетных мышц иннервируются симпатическими волокнами. Многие авторы признают, что это адренергические волокна, которые за счет воздействия на альфа-адренорецепторы вызывают спазм сосудов скелетных мышц. Полагают также, что в скелетных мышцах имеются и симпатические холинергические волокна, за счет которых (ацетилхолин + М-холинорецепторы) происходит дилатация сосудов мышц. Такие волокна идут от пирамидных клеток коры больших полушарий и обеспечивают начальную дилатацию сосудов мышц при работе. Однако такие сосуды выявлены лишь у некоторых животных (кошки, собаки), но пока не выявлены у человека.
Одновременно в неработающих мышцах происходит спазм сосудов: это возникает за счет активации симпатических влияний, в том числе в отношении сосудов неработающих мышц. Кроме того; возбуждение хеморецепторов работающих мышц вызывает поток импульсов в ЦНС, в результате чего дополнительно активируются симпатические нейроны спинального сосудодвигательного центра, в результате чего к сосудам еще в большей степени идут активирующие воздействия (растет интенсивность эфферентной импульсации).
Подобная ситуация имеет место во всех остальных регионах (сосуды чревной области, сосуды кожи, сосуды почек), т. е. там, где в ГМК сосудов преобладают альфа-адренорецепторы. Особо следует остановиться на поведении кожных сосудов: они выполняют роль обменника тепла. При интенсивной физической нагрузке, кроме снабжения скелетных мышц кровью, требуется отдать избыток тепла, который образуется в результате мышечных сокращений. Для этого надо раскрыть сосуды кожи, дать возмножность крови пройти через теплообменник. Но в то же время надо отдать лишнюю кровь мышцам — задача, которая требует для своего решения два взаимоисключающих процесса. Реально ситуация такова. Вначале при повышении нагрузки сосуды кожи спазмируются, а потом, когда кровоток через скелетные мышцы будет обеспечен, они расширяются, способствуя отдаче тепла. Если нагрузка достигает максимальных возможностей для человека, то кожные сосуды вновь спазмируются, т. е. отдают кровь скелетным мышцам.
При статической работе кровоток ниже, чем при динамической. Поэтому статическая работа является более утомительной.
Кожные сосуды, таким образом, предназначены, главным образом, для реализации терморегуляции и выполняют роль депо крови. Поэтому как депо кожные сосуды часто участвуют в реализации системных реакций: когда общее давление в крупных артериях падает— кожные сосуды спазмируются и это повышает артериальное давление: бледность кожных покровов указывает на гипотонию, а гиперемия кожного покрова указывает на явления гипертонии.
Кожные сосуды участвуют в так называемых сопряженных системных рефлексах: при возбуждении ноцицепторов кожи сосуды кожи спазмируются, и это приводит к росту системного давления. Раздражение тепловых рецепторов кожи вызывает снижение системного артериального давления, а раздражение Холодовых рецепторов приводит, наоборот, к прессорной реакции (росту артериального давления).
Регуляция тонуса кожных сосудов осуществляется преимущественно за счет симпатических нервов. У сосудов акральных областей (дистальные области) тонус очень высок за счет постоянной импульсации, идущей по симпатическим волокнам. Поэтому тонус этих сосудов легко регулируется: интенсивность импульсации возрастает — спазм сосудов еще больше повышается, снижается интенсивность потока импульсов — происходит расширение сосудов.
Сосуды проксимальных областей имеют слабую симпатическую импульсацню. Расширение сосудов этих областей происходит под влиянием брадикинина, который накапливается в этих местах при потоотделении (под влиянием ацетилхолина, выделяемого из холи* нергических симпатических волокон, иннервирующих потовые железы).
Следует также иметь в виду, что в коже хорошо развиты шунтирующие сосуды, поэтому для отдачи тепла кровь сразу из артерий может переходить в вены, не проходя через капилляры. Таким образом увеличивается скорость отдачи тепла в окружающую среду.
Кровоток в печени, селезенке, желудочно-кишечном тракте принято называть чревным, т. к. сосуды, идущие к этим областям, в основном иннервируются чревным симпатическим нервом.
В целом, за 1 минуту печень потребляет в расчете на 100 г ткани до 100 мл крови (больше, чем в сердце и мозге). А с учетом общей массы печени (около 1400 г) печеночный кровоток составляет 1400 мл крови в 1 минуту — около 25% МОК.
За 1 минуту через почки проходит около 400 мл крови в расчете на 100 г ткани, а с учетом массы почки (300 г) почечный кровоток достигает 1200 мл крови в 1 минуту. Удельный кровоток почки (в расчете на 1 г массы) — самый большой в организме — превышает в 4 раза интенсивность кровотока, к примеру, в печени. Это, конечно, связано не с потребностями почки в кислороде и питательных веществах, а обусловлено функцией почки — она очищает кровь, и скорость этого, процесса адаптирована к потребностям удаления шлаков и регуляции водно-электролитного баланса.
Принято делить почечные сосуды на 2 типа, обеспечивающих соответственно корковый и мозговой кровоток. На долю коркового кровотока в почках приходится около 80—90%,
остальное — на долю мозгового кровотока. Корковый кровоток обеспечивает процесс фильтрации в почечных клубочках, а мозговой кровоток, в основном, способствует процессу реабсорбции. Все сосуды почки получают симпатические нервы, однако вазокоцстрикция под влиянием симпатических воздействий наступает лишь при экстренных ситуациях, когда требуется перераспределение кровотока — например, при нарушении сердечного кровотока. В этом случае кровоток через почки резко снижается и наступает временная анурия. Однако такая ситуация не может продолжаться длительное время, иначе может наступить азотемия и, в конечном итоге — смерть.
В обычных условиях жизнедеятельности главную роль в регуляции почечного кровотока играет миогенный механизм, а также ренин-ангиотензиновый, простагландиновый и кал- ликреин-кининовый механизм. Миогенный механизм в основном присущ сосудам коркового вещества: когда возрастает артериальное давление в сосудах почки, гладкие мышцыих сокращаются и просвет сосуда остается постоянным, когда же давление падает — тонус мышц снижается, а в результате — просвет сосуда остается постоянным. Благодаря этому почечный кровоток (в основном корковый, в меньшей степени — мозговой) сохраняется стабильным, несмотря на колебания давления в области почечной артерии от 70 до 180 мм рт. ст. (подобно мозговому кровотоку). Благодаря такому постоянству сохраняются условия для высокой фильтрационной способности почки (образуется до 120 мл/мин первичной мочи). Когда давление в почечных сосудах все же падает (становится меньше 70—80 мм рт. ст.), начинает функционировать ренин-ангиотензиновая система. Ренин вырабатывается в клетках юкстагломерулярного аппарата и выбрасывается из этих клеток внутрь приносящих артерий. Здесь же в почках может образоваться ангиотензин-1, а затем ангиотензин-И, который вызывает спазм гладких мышц. Этот эффект намного сильнее симпатического. Обычно повышается, главным образом, тонус выносящих артерий — поэтому давление в капиллярах клубочков возрастает, скорость фильтрации повышается, хотя объем почечного кровотока, в целом, снижается.
Ангиотензин-И в свою очередь повышает синтез простагландинов в почках, которые, как правило, вызывают дилатацию сосудов почки (простагландины являются антагонистами ангиотензина-П). Благодаря этому снимается спазм сосудов в других регионах организма и частично возрастает почечный кровоток. В тех случаях, когда продукция простагландинов недостаточна, развивается почечная артериальная гипертензия. Одновременно под влиянием антиотензина-Н или под влиянием условий, при которых он образуется (недостаточность почечного кровотока), в почках возрастает синтез еще одного мощного вазодилататора — брадикинина (за счет активации калликреина, который участвует в образовании каллидина и брадикинина). Брадикинин вызывает повышение почечного кровотока, особенно коркового, и тем самым способствует эффективному образованию мочи.
Таким образом, регуляция почечного кровотока осуществляется за счет местных (мио- генные, гормональные механизмы) и нервных механизмов, при явном доминировании местных.
КРОВООБРАЩЕНИЕ В МАЛОМ КРУГЕ
Малый круг кровообращения имеет ряд особенностей, значение которых дает возможность понять этиологию и патогенез ряда заболеваний. В нормальных условиях давление в правом желудочке достигает 30, в легочной артерии — 20, легочных капиллярах ~ 6, а в левом предсердии — 4—8 мм рт. ст. В среднем, в малом круге кровообращения может накапливаться (депонироваться) 500—1500 мл крови — за счет большой емкости венозного русла малого круга кровообращения. При повышении тонуса гладких мышц легочных вен венозный приток к левому предсердию возрастает, что при необходимости способствует сохранению давления в большом круге кровообращения (системного давления).
Для малого круга крообращения характерна низкая величина периферического сопротивления, поэтому необходимость в большой силе сокращения, как правило, отсутствует. Однако у горцев, постоянно живущих в условиях пониженного напряжения кислорода, возникает гипертензия малого круга и это приводит к гипертрофии правого желудочка.
В малом круге кровообращения различают 5 отделок 1) крупные артерии эластического типа (Легочная артерия), которые аккумулируют энергию сердца и делают кровоток в малом круге кровообращения непрерывным; 2) средние артерии мышечно-эластического типа, которые регулируют степень упругости; 3) легочные артериолы, имеющие гладкие мышцы, благодаря которым их просвет может полностью перекрываться; 4) легочные капилляры, диаметр которых около 0,4—4 мкм, а общая площадь достигает 140 м 2 ; 5) мелкие, средние и крупные легочные вены, имеющие мощно выраженный гладкомышечный слой.
Одновременно компонентом рефлекса Китаева являются еще 2 механизма: рефлексы Гауэра-Генри и Парйна. Рефлекс Гауэра-Генри возникает в результате растяжения левого предсердия и приводит к тому, что в гипоталамусе снижается продукция вазопрессина, уменьшается его выделение из задней доли гипофиза, что приводит к повышению диуреза. Это вызывает, в свою очередь, уменьшение объема внеклеточного пространства, выход жидкости из кровеносных сосудов, а в целом — уменьшение объема циркулирующей крови и освобождение большого круга для того, чтобы можно было освободить малый круг кровообращения от избытка крови. Одновременно возникает рефлекс Ларина — спазм легочных артерий, в результате чего приток крови в легочные сосуды снижается, что также уменьшает вероятность развития отека легких.
Рефлекс Ларина может возникнуть и самостоятельно, т. е. до появлений избыточного накопления крови в легочных венах. Он возникает в том случае, если давление в легочных артериях достигает 60 мм рт. ст. и выше. В этом Случае за счет потоков импульсов отбаро- рецепторов легочных артерий возбуждается депресеорный отдел вазомоторного центра и повышается активность кардиоингибирующего центра. В результате, как и при рефлексе Китаева, снижается артериальное давление в большом круге, увеличивается емкость этого круга кровообращения, повышается количество крови в кровяных депо
Помимо рефлекторной регуляции кровотока в малом круге кровообращения существует и местный механизм, играющий исключительно важную роль. Проявляется он в том, что открытие капилляра зависит от функции легочной альвеолы. Если альвеола содержит кислород в больших Количествах (рО2 до 100 мм рт. ст.), т. е. вентилируется, то капилляр, окружающий эту альвеолу, будет открыт; если же альвеола не содержит кислорода в доста-
точных количествах, т. е. она не вентилируется, то капилляр закрыт. Этот удивительный по экономии механизм позволяет рационально использовать кровоток через малый круг кровообращения: направлять кровь лишь к тем альвеолам, которые функционируют. Механизм этот обусловлен, очевидно, прямым влиянием кислорода на состояние прекапиллярных сфинктеров: когда много кислорода — сфинктер расслаблен и капилляр открыт, когда его напряжение в ткани снижено — сфинктер закрывается. Аналогично влияет на состояние сфинктера уровень напряжения углекислого газа. В условиях покоя только 1/6—1/7 часть капилляров открыта, так как не все альвеолы вентилируются. При гипервентиляции, когда открывается дополнительное количество альвеол, число функционирующих капилляров существенно возрастает, что повышает возможности дыхания.
Все легочные сосуды, имеющие гладкие мышцы, снабжены симпатическими адренергическими волокнами, вызывающими при возбуждении симпатических нейронов повышение тоиусасосудов.__________________
Кровоснабжение мышц. Интенсивность кровотока в сосудах мышц. Миогенная, гуморальная регуляция кровотока в мышцах.
Большая масса скелетных мышц (около 40 % массы тела) обусловливает необходимость обеспечения значительного кровотока в мышцах при их работе. В покое интенсивность кровотока в скелетных мышцах колеблется от 2 до 5 мл/100 г/мин, что составляет 15—20 % величины сердечного выброса. Функциональный резерв для увеличения кровотока в мышцах при физической работе обеспечивается высоким исходным базальным тонусом сосудов скелетных мышц. Кровоток в мышцах при их интенсивной работе может возрасти более чем в 30 раз, достигая величины 100—120 мл/100 г/ мин (80—90 % сердечного выброса). Потребление кислорода мышцами при этом увеличивается с 0,3 до 6 мл/100 г/мин. Возросшая интенсивность метаболических процессов обеспечивается значительным увеличением числа функционирующих капилляров. В покое открыто 20—30 % имеющихся в мышце капилляров. При работе скелетных мышц число функционирующих в них капилляров увеличивается в 2—3 раза.
Миогенная регуляция. Высокий исходный тонус сосудов скелетных мышцах обусловлен, главным образом, миогенной активностью сосудистой стенки и в меньшей степени — влиянием симпатических вазоконстрикторов (15—20 % тонуса в покое нейрогенного происхождения).
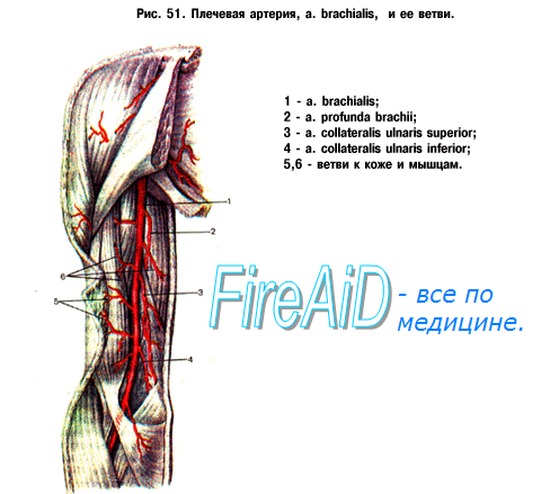
Нервная регуляция сосудов скелетных мышц осуществляется через симпатические адренергические вазоконстрикторы. В артериях скелетных мышц имеются α- и β-адренорецепторы, в венах — только α-адренорецепторы. Активизация α-адренорецепторов приводит к сокращению миоцитов и сужению сосудов, активизация β-адренорецепторов — к расслаблению миоцитов и расширению сосудов. Сосуды скелетных мышц иннервируются также симпатическими холинергическими нервными волокнами, возбуждение которых оказывает дилататорный эффект. В покое сосуды скелетных мышц находятся под тоническим влиянием симпатических вазоконст-рикторов.
Гуморальная регуляция. Наиболее мощным фактором гуморальной регуляции тонуса сосудов являются метаболиты, накапливающиеся в работающей мышце. В межклеточной жидкости и в оттекающей от мышцы венозной крови при этом резко падает содержание кислорода, растет концентрация угольной и молочной кислот, аденозина. Среди факторов, обеспечивающих снижение тонуса сосудов в мышце при ее работе, ведущими являются быстрое повышение внеклеточной концентрации ионов калия, гиперосмолярность, а также снижение рН тканевой жидкости.
Серотонин, брадикинин, гистамин оказывают сосудорасширяющее действие в скелетных мышцах. Адреналин при взаимодействии с α-адренорецепторами вызывает констрикцию, с β-адренорецепторами — дилатацию мышечных сосудов, норадреналин обладает сосудосуживающим действием через α-адренорецепторы. Ацетилхолин и АТФ приводят к выраженной дилатации сосудов скелетных мышц.
Мышечная и соединительная ткани очень хорошо кровоснабжаются. Помимо большого количества кровеносных сосудов эти ткани богаты также вегетативными симпатическими нервными волокнами. Хорошее кровоснабжение обеспечивает оптимальное снабжение мышц кислородом и, кроме этого, позволяет мышцам быстро восстанавливаться после повреждений. Кровеносные сосуды и нервы проникают в мышцу через так называемые ворота. Место входа и выхода сосудов расположено либо в центре мышцы, либо в области ее начала. Мышцы туловища и некоторые мышцы конечностей снабжаются многочисленными сосудами и нервами, поэтому нарушение кровоснабжения в них встречается реже, чем в мышцах с одним местом входа сосудов. Крупные кровеносные сосуды расположены вместе с пучками мышечных волокон вдоль продольной оси тела, а отходящие ветви следуют практически перпендикулярно направлению волокон. От поперечных ветвей отходят более мелкие сосуды, следующие опять в продольном направлении. Подобный характер ветвления повторяется вплоть до капилляров. Капилляры расположены преимущественно вдоль волокон. Их плотность составляет приблизительно 1,5 капилляра на мышечное волокно. Мышцы, имеющие большое количество волокон I типа и большую выносливость, содержат в 1,5 раза больше капилляров, причем эта цифра может увеличиваться до 1,7 раза при соответствующих тренировках (Seidenspinner, 2005).
Интересно, что вокруг толстых мышечных волокон расположено меньше капилляров, чем вокруг тонких (Forssmann, 1985). За счет своего волнообразного хода кровеносные сосуды могут растягиваться вместе с мышцей и сохранять ее оптимальное кровоснабжение. При сокращении мышцы происходит повышение давления внутри мышцы, что передается и на кровеносные сосуды (van den Berg, 1999). При сокращении на 30 % максимальной силы кровоток значимо уменьшается, а при сокращении на 50 % и выше — практически прекращается (Lindel, 2006).
Источник:
Эндокриная система, спорт и двигательная активность.
Перевод с англ./под ред. У.Дж. Кремера и А.Д. Рогола. - Э64
Издательство: Олимп. литература, 2008 год.
Кровеносные сосуды скелетных мышц формируют обширную сеть капилляров вокруг мышечных волокон. Капилляры состоят из одинарного слоя эндотелиальных клеток, которые со стороны просвета сосуда покрыты гликокаликсом (обогащенный углеводами периферический участок клеточной мембраны), а с обратной — несут базальную мембрану. Капиллярная сеть, которая представляет собой своеобразный “конец” сердечно-сосудистой системы, играет важную роль в обеспечении мышечных волокон питательными веществами и осуществлении обмена кислорода и диоксида углерода в мышцах. Показано, что при тренировке выносливости в различных скелетных мышцах человека происходит изменение расположения кровеносных сосудов (Andersen Р., Henriksson, 1977; Hudiicka et al., 1992; Wang et al., 1993; Kadi et al., 2000a; Charifi et al., 2003b).
Фактор роста сосудистого эндотелия (vascular endothelial growth factor, VEGF) представляет собой гепаринсвязывающий специфический для эндотелиальных клеток митоген, который стимулирует ангиогенез в различных тканях. Как физические нагрузки, так и гипоксия могут вызывать увеличение уровня мРНК VEGF в скелетной мышце человека (Gustafsson et al. 1999; Richardson et al., 1999). Повышение уровня мРНК VEGF у нормальных здоровых людей и страдающих заболеваниями почек происходит уже после одного занятия физическими упражнениями с нагрузкой, равной 50 % максимальной нагрузки (Wagner et al., 2001). Кроме того, при гипоксии и физической нагрузке наблюдается увеличение количества рецепторов VEGF (flt-1 и flk-1) (Tagaki et al., 1996; Gerber et al., 1997; Olfert et al., 2001). Таким образом, фактор роста сосудистого эндотелия VEGF и его рецепторы участвуют в увеличении плотности капиллярной сети в ответ на двигательную активность. У нетренированных людей уже после одного занятия физическими упражнениями наблюдается значительный рост уровня мРНК VEGF в скелетных мышцах (Richardson et al., 2000). Эти события могут отражать первоначальный интенсивный рост капилляров в нетренированных мышцах, происходящий в начале выполнения тренировочной программы, после чего процессы ангиогенеза замедляются и требуют для своей стимуляции увеличения тренировочной нагрузки, поскольку уровень тренированности мышцы повышается.
В число факторов, контролирующих экспрессию VEGF, входит составляющая индуцируемого гипоксией фактора 1 (hypoxia inducible factor 1, HIF-1), который в настоящий момент рассматривается в качестве основного фактора регуляции. Влияние кратковременной тренировки на VEGF и HIF-1 изучали у 8 здоровых мужчин. Несмотря на увеличение уровня VEGF после 7 тренировочных занятий, не было обнаружено никаких изменений уровня мРНК составляющей HIF-1 (Gustafsson et al., 2002). Это свидетельствует о том, что увеличение количества мРНК HIF-1, возможно, не единственный фактор регуляции содержания VEGF при занятиях физическими упражнениями. Вместе с тем воздействие различных факторов, контролирующих рост капиллярной сети, вероятнее всего, происходит в различные моменты времени, что существенно затрудняет оценку их вклада, если только исследователь не проводит наблюдения за этим адаптивным процессом в целом.
Предполагается, что факторы роста фибробластов (ФРФ) также играют роль в ангиогенезе в скелетных мышцах. Однако последние исследования показали, что их вклад в процесс роста капилляров гораздо менее значительный по сравнению с VEGF (Richardson et al., 2000; Wagner et al., 2001). В настоящий момент, хотя и считается, что VEGF — наиболее важный фактор ангиогенеза, принимающий участие в адаптации капиллярной сети в скелетных мышцах человека, необходимы дальнейшие исследования, направленные па расширение наших знаний о вкладе всех известных факторов ангиогенеза в формирование и рост кровеносной сети скелетной мышцы.
Кровоток в скелетной мышце, составляющий в состоянии покоя 2-4 мл/100 г в минуту, существенно увеличивается во время физической нагрузки. Сокращения мышц временно снижают мышечный кровоток, сдавливая внутримышечные кровеносные сосуды. Однако в ритмично сокращающихся мышцах мышечный кровоток увеличивается в 30 раз (90 мл/г2 в минуту у хорошо тренированного спортсмена). Нужно также помнить, что во время сильных тонических сокращений мышц скелетная мышца может быстро устать из-за недостаточного снабжения кислородом и питательными веществами, которое происходит из-за сжатия этих сосудов.
Начальное увеличение мышечного кровотока, вероятно, является нервно-опосредованной реакцией, так как иногда он увеличивается в самом начале или даже до начала физической нагрузки. Возможно, в этом задействованы импульсы симпатической сосудорасширяющей системы. Среди местных механизмов, поддерживающих высокий кровоток в работающей мышце, можно назвать повышение температуры в активных мышцах, снижение содержания в ткани Р02, повышение в ткани уровня РС02 и накопление К+ и других сосудорасширяющих метаболитов, таких как лактат и окись азота.
Температура в активной мышце повышается и еще больше расширяет сосуды. Расширение артериол и прекапиллярных сфинктеров приводит к 10-100-кратному увеличению количества открытых капилляров.
Умеренно повышенное артериальное давление во время физической нагрузки увеличивает внутрикапиллярное давление. Кроме того, повышение кровяного давления не только вызывает приток большего количества крови по кровеносным сосудам, но и растягивает стенки артериол, еще больше уменьшая сосудистое сопротивление. Накопление осмотически активных метаболитов в тканевой жидкости уменьшает осмотический градиент в стенках капилляров. Лимфоток также сильно увеличивается и улучшает обновление тканевой жидкости.
Снижение уровня pH, повышение температуры, а также увеличение концентрации 2,3-дифосфоглицерата в эритроцитах снижают тропность 02 к гемоглобину. Таким образом, кровь оставляет в мышечной ткани больше 02, что увеличивает артериовенозную разницу по 02 до трех раз. Транспорт С02 из мышечной ткани также облегчается. К+ расширяет артериолы в работающей мышце, особенно в начале физической нагрузки. В результате всех этих изменений потребление 02 скелетной мышцей во время физической нагрузки увеличивается, возможно, в 100 раз.
Нарушение венозного кровообращения нижних конечностей, возникающее вследствие длительного авиаперелета или переезда на автобусе, является потенциальной причиной снижения работоспособности спортсменов. В связи с этим разработан комплекс профилактических мероприятий (Л. В. Сафонов, 2004).
Все упражнения необходимо выполнять не менее 20 раз. При невозможности ходьбы данные упражнения необходимо выполнять каждые 2 ч. по 20—30 раз.
- Употребление разбавленных фруктовых соков и негазированной минеральной воды (по 2 л каждые 4—6 ч.) для профилактики дегидратации организма.
В качестве адекватной замены минеральной воды возможно употребление препарата МАГНЕ-В6 (из расчета по 1 таблетке каждые 6 ч.), начиная со дня перелета или переезда, при условии его приема не менее суток. При этом также обязательно употребление жидкости в указанной выше дозировке.
Препараты применяются из расчета 175-200 анти-Ха ED на 1 кг массы тела (при массе до 60 кг: Fraxiparin — 0,3 ml, Enoxparin — 50 mg; при массе более 60 кг: Fraxiparin — 0,4 ml, Enoxparin — 70 mg).
Введение препарата производится за 3—4 ч. до поездки однократно. Действие препарата проявляется примерно через 3 ч. после введения и сохраняется около 18 ч.
Чурсин В.В. Клиническая физиология кровобращения. Методические материалы к практическим и семинарским занятиям, – 2011. - 44 с.
Содержит информацию о физиологии кровообращения, нарушениях кровообращения и их вариантах. Также представлена информация о методах клинической и инструментальной диагностики нарушений кровообращения.
Данные материалы являются переработанным вариантом предыдущих изданий (1999г., 2003г.), первым автором которых являлся В.Ф.Туркин – доцент кафедры анестезиологии и реаниматологии АГИУВ.
Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Введение
Исходя из этого пояснения, можно отметить, что значение клинической физиологии любой системы предполагает:
Более образно это можно представить в следующем виде (рисунок 1).
Приспособительные реакции обеспечивают компенсацию, а патологические реакции обуславливают декомпенсацию страдающего органа или страдающей системы. В общем виде отличием (границей) между нормой и приспособлением является изменение свойств приспосабливающего органа или приспосабливающейся системы.
Границей между приспособлением и патологией является резкое изменение ("излом") приспособительной реакции по направлению и величине.
Различают срочные приспособительные реакции и долговременные. Врачам интенсивной терапии чаще приходится иметь дело с острыми расстройствами, поэтому необходимы знания срочных приспособительных реакций и их переход в патологические.
Кровообращение – определение, классификация
Кровообращение - это непрерывное движение (обращение) крови по замкнутой системе, именуемой сердечно-сосудистой.
- 2 - аорта и крупные артерии, имеют много эластических волокон, представляются как буферные сосуды, благодаря им резко пульсирующий кровопоток превращается в более плавный;
- 3 - прекапиллярные сосуды, это мелкие артерии, артериолы, метартериолы, прекапиллярные жомы (сфинктеры), имеют много мышечных волокон, которые могут существенно изменить свой диаметр (просвет), они определяют не только величину сосудистого сопротивления в малом и большом кругах кровообращения (поэтому и называются резистивными сосудами), но и распределение кровопотока;
- 4 - капилляры, это обменные сосуды, при обычном состоянии открыто 20-35% капилляров, они образуют обменную поверхность в 250-350 кв.м., при физической нагрузке максимальное количество открытых капилляров может достигать 50-60%;
- 5 - сосуды - шунты или артериоло-венулярные анастомозы, обеспечивают сброс крови из артериального резервуара в венозный, минуя капилляры, имеют значение в сохранении тепла в организме;
- 7 - вены, крупные вены, они обладают большой растяжимостью и малой эластичностью, в них содержится большая часть крови (поэтому и называются емкостными сосудами), они определяют "венозный возврат" крови к желудочкам сердца, их заполнение и (в определенной мере) ударный объём (УО).
Объем циркулирующей крови (ОЦК)
Вопрос объема имеет важное значение. Прежде всего потому, что определяет наполнение камер сердца и таким образом влияет на величину УО.
По классическому представлению ОЦК составляет у мужчин 77 и у женщин 65 мл/кг массы тела 10%. В среднем берётся 70 мл/кг.
Последствием этого является наиболее наблюдаемые недостаточности – церебральная, дыхательная и кишечная.
Физиологи на сегодняшний день считают, что практически у среднего человека номинальной величиной ОЦК принимается 5 литров или 5000 см 3 . В ОЦК различают две составных части: объем заполнения (U) и объем растяжения (V) сосудистой системы. U составляет 3300 см., V составляет 1700 см 3 . Последний, объем растяжения имеет непосредственное отношение к давлению крови и скорости объемного потока крови в сосудах.
Избыточная, особенно быстрая, инфузия растворов ведет к увеличению объема, прежде всего в сосудах легких, чем в других органах. При быстрой инфузии, особенно крупномолекулярных растворов (декстраны, ГЭК, СЗП, альбумин) жидкость не успевает переместиться в интерстиций, и при этом жидкость депонируется в первую очередь в легочных венах. Имеются сведения о том, что легочные вены могут дополнительно вместить еще примерно 53% общего легочного объема крови. При дальнейшей избыточной инфузии в действие вступает рефлекс Китаева. При этом рефлексе импульсы с рецепторов перерастянутых легочных вен, возбуждающе действуя на мускулатуру легочных артериол, суживают их, предотвращая таким образом переполнение легочных венозных сосудов.
Из-за спазма легочных артериол при дальнейшей избыточной инфузии наступает объемная перегрузка правых отделов сердца, в первую очередь правого желудочка. При его чрезмерной перегрузке в действие вступает рефлекс Ярошевича. Импульсы с рецепторов легочных артерий, возбуждающе действуя на мускулатуру в устьях полых вен, суживают их, предотвращая таким образом переполнение правых отделов сердца.
Здесь граница, за которой далее приспособление может перейти в патологию. В случае продолжения избыточной инфузии - вследствие избыточного давления в правом предсердии и его перерастяжения возникают следующие условия.
Во-первых ухудшается отток в правое предсердие значительной части крови из коронарных вен. Затруднение оттока по коронарным венам приводит к затруднению притока крови по коронарным артериям и доставки кислорода к миокарду (боль в области сердца).
Во-вторых, может возникнуть рефлекс Бейнбриджа (подробнее - раздел регуляции кровообращения), он вызывает тахикардию, которая всегда увеличивает потребность миокарда в кислороде.
У лиц со скрытой коронарной недостаточностью (что почти никогда не выявляется у больных перед операцией из-за недостаточного обследования) и у лиц с явной ишемической болезнью сердца (ИБС) все это может обусловить возникновение острой коронарной недостаточности вплоть до возникновения острого инфаркта миокарда (ОИМ) с дальнейшим развитием острой сердечной лево-желудочковой недостаточности (ОСЛН).
По современным представлениям отмечаются следующие приспособительные изменения функции сердечно-сосудистой системы.
Когда ОЦК снижается на 10-20%, то такая кровопотеря представляется компенсируемой. При этом первой приспособительной реакцией является уменьшение емкости венозных сосудов за счёт сдавления их окружающими тканями. Вены из округлых становятся сплющенными или почти полностью спадаются, и таким образом емкость сосудов приспосабливается к изменившемуся объему циркулирующей крови. Венозный приток крови к сердцу и его УО поддерживаются на прежнем уровне. Компенсаторную реакцию организма можно сравнить с ситуацией, когда содержимое неполной 3-х литровой банки переливают в 2-х литровую и она оказывается полной.
Компенсаторным механизмом является и перемещение жидкости из интерстиция за счёт уменьшения венозного давления и увеличения скорости кровотока (укорочения времени изгнания даже без развития тахикардии) – жидкость как бы засасывается из интерстиция. Этот компенсаторный механизм можно наблюдать у доноров при донации, когда экстракция 500 мл крови не приводит к каким-либо изменениям кровообращения.
С уменьшением ОЦК до 25-30% (а это уже потеря растягивающей части ОЦК - V) кровопотеря представляется не компенсируемой за счёт критического уменьшения ёмкости венозной системы. Начинает уменьшаться венозный приток к сердцу и страдает УО. При этом развивается приспособительная (компенсаторная) тахикардия. Благодаря ей поддерживается достаточный уровень сердечного выброса (СВ за минуту = МСВ) за счёт уменьшенного УО и более частых сердечных сокращений. Одновременно с тахикардией развивается сужение периферических артериальных сосудов – централизация кровообращения. При этом ёмкость сосудистой системы значительно уменьшается, подстраиваясь под уменьшенный ОЦК. При сниженном УО и суженных периферических артериальных сосудах поддерживается достаточный уровень среднего артериального давления (АДср) в сосудах, направляющих кровь к жизненно важным органам (мозг, сердце и лёгкие). Именно от величины АДср зависит степень перфузии того или иного органа. Таким образом, развивается приспособительная централизация кровообращения за счет уменьшения кровоснабжения периферических тканей (кожа, скелетные мышцы и т.д.). Эти ткани могут переживать ишемию (I фазу нарушения микроциркуляции) и кислородную недостаточность в течение более продолжительного времени.
Эта реакция аналогична процессу воспаления, при котором организм, образуя грануляционный вал и отторгая омертвевшее, жертвует частью во имя сохранения целого.
Когда ОЦК снижается более чем на 30-40% и восполнение кровопотери задерживается, то такая кровопотеря переходит в разряд некомпенсированной и может стать необратимой. При этом несмотря на тахикардию, СВ уменьшается и снижается АДср. Из-за недостаточного транспорта кислорода в организме усиливается метаболический ацидоз. Недоокисленные продукты метаболизма парализуют прекапиллярные сфинктеры, но периферический кровоток не восстанавливается из-за сохраняющегося спазма посткапиллярных сфинктеров.
Развивается II фаза нарушений микроциркуляции – застойной гипоксии. При этом за счёт ацидоза повышается проницаемость капилляров – плазматическая жидкость уходит в интерстиций, а форменные элементы начинают сладжироваться, образуя микротромбы – развивается ДВС-синдром. К моменту, когда на фоне нарастающего ацидоза парализуются и посткапиллярные сфинктеры (III фаза нарушений микроциркуляции) капиллярное русло уже необратимо блокировано микротромбами.
Наступает несостоятельность тканевой перфузии. Во всех случаях затянувшегося синдрома малого СВ присоединяется преренальная анурия. Всё это клиническая форма шока с классической триадой: синдром сниженного СВ, метаболический ацидоз, преренальная анурия. При этом во многих органах, как отмечает профессор Г.А.Рябов, "наступают необратимые изменения и даже последующее восполнение кровопотери и восстановление ОЦК не всегда предотвращает смертельный исход из-за осложнений, связанных с необратимыми изменениями в некоторых органах" – развивается полиорганная недостаточность (ПОН) или мультиорганная дисфункция (МОД).
Последовательность в нарушениях гомеостаза при кровопотере схематически представлена на рисунке 2 (Р.Н.Лебедева и сотр., 1979 г.).
Таким образом, при абсолютном снижении ОЦК практически любого происхождения границей перехода приспособления в декомпенсацию является увеличение частоты сердечных сокращений (ЧСС) с одновременным снижением СВ и АДср.
Данное положение не применимо к случаям, когда имеется относительное уменьшение ОЦК за счет патологической вазодилятации.
Следует учитывать и то, что очень часто острая кровопотеря сопровождается болью и это вносит разлад в последовательность компенсаторных механизмов – раньше чем нужно и в большем количестве выбрасываются эндогенные катехоламины. Централизация развивается быстрее и времени на спасение больного остается меньше.
Читайте также:

