Основные этапы орнитинового цикла реферат
Обновлено: 02.07.2024
Печень катаболизирует (превращает) токсический аммиак в мочевину в орнитиновом цикле, как показано на рисунке 1. Этот энергозависимый процесс происходит только в пределах митохондрий и цитоплазмы печени. Когда этот процесс не работает эффективно, токсический аммиак (NH3) накапливается в организме и может вызвать клинические проявления, такие как вялость, невнятная речь, отек головного мозга и астериксис.
Физиология: Цикл Мочевины
Здесь мы рассмотрим лежащую в основе физиологию цикла мочевины.
Ход протекания цикла синтеза мочевины
Цикл мочевины начинается в митохондриях гепатоцитов и заканчивается в цитоплазме. Следующие реакции будут показаны схематически под каждым описанным шагом. Обратите внимание, что фермент, ответственный за каждый соответствующий шаг, не будет показан, но его можно найти в предыдущем тексте.
Шаг 1
Первая стадия, которая также ограничивает скорость, включает преобразование СО2 и аммиака в карбамоилфосфат с помощью фермента карбамоилфосфатсинтетазы I (CPS I). Аммиак является источником первой аминной группы мочевины. Уникальность этого этапа заключается в том, что CPS I требует облигатного активатора, N-ацетил-глутамата (NAG). NAG возникает от глутамата + ацетил-КоА через фермент NAG-синтазу, которая может быть активирована аргинином. Следует отметить, что некоторые источники могут использовать NH и HCO+ в качестве исходных реагентов, но они эквивалентны CO2+ H2O + NH3.
CO2+ NH3+ 2 АТФ+H2O---карбамоилфосфат
Синтез NAG: глутамат + ацетил-КoA NAG
Шаг 2
Карбамоилфосфат и орнитин соединяются с образованием цитруллина через орнитин-транскарбамоилазу (OTC). Цитруллин после этого транспортирован от митохондрий гепатоцита в цитоплазму орнитин транслоказой.
Цитруллин в митохондриях---цитруллин в цитоплазме
Шаг 3
Цитруллин реагирует с аспартатом(аспарагиновая кислота) с образованием аргининосукцината. Эта реакция осуществляется ферментом аргининосукцинатсинтетазой, для которой требуется АТФ. Аспартат является источником второй аминной группы по мочевине. Напомним, что аспартат образуется в результате переаминирования оксалоацетата и глутамата через аспартаттрансаминазу, для чего необходим витамин В6.
Цитруллин + аспартат + АТФ---Аргининосукцинат
Оксалоацетат + глутамат(Глутаминовая кислота)---аспартат + Альфа-кетоглутарат
Шаг 4
Аргининосукцинат преобразуется в аргинин через аргининосукцинатную лиазу. Эта реакция также дает фумарат, который включается в митохондриальное образование НАДH в цикле ЦТК так же, как катаболизме тирозина.
Шаг 5
Аргинин подвергается гидролизу через аргиназу с образованием мочевины и орнитина. Уделите некоторое время рассмотрению шага 2. Обратите внимание, что регенерация орнитина в шаге 5 участвует в шаге 2.
Аргинин + H2O---мочевина + орнитин
Задействованные Системы Органов
Печень является единственным местом, где мочевина синтезируется и в конечном итоге выводится почками.
Функция
Цикл мочевины - это способ преобразования организмом токсичного аммиака в мочевину. Аммиак является следствием катаболизма протеина независимо от того, является ли он вторичным по отношению к высокобелковой диете, дезаминированию или в период длительного голодания. Аммиак также естественным образом вырабатывается кишечной микрофлорой. В мышцах и периферических тканях глутамат является той аминокислотой, которая принимает свободный аммиак, что приводит к образованию глутамина.
Глутамин после этого экспортируется от мышцы и периферийных тканей и используется печенью. Глутаминаза расщепляет глутамин на глутамат и аммиак. Глутамат также производит дополнительную мочевину через через фермент глутаматдегидрогеназу. Отсюда аммиак первоначально включается в митохондрии гепатоцитов и в конечном итоге приводит к образованию мочевины. Мочевина впоследствии выходит из цитоплазмы гепатоцитов и в конечном итоге выводится с мочой.
Связанное тестирование
Азот мочевины крови (АМК) - это обычно заказываемый тест, который измеряет уровень мочевины, обнаруженной в крови, и может оценить, насколько хорошо функционируют почки. Этот диапазон может незначительно отличаться в разных медицинских учреждениях, но АМК обычно составляет от 8 до 20 мг/дл. У пациентов с дисфункцией почек или высокобелковой диетой можно ожидать, что АМК будет повышена. Можно ожидать, что у пациентов с заболеванием печени или с нарушением цикла мочевины АМК будет уменьшен. Важно принять к сведению клиническую картину пациента, прежде чем предположить, что у пациента может быть почечная или печеночная дисфункция.
Сывороточный аммиак также может быть измерен и использован для оценки функционирования печени. Нормальный сывороточный аммиак обычно колеблется от 15 до 45 м / дл. Уровень аммиака в сыворотке крови может быть повышен у пациента с дисфункцией печени, нарушением цикла мочевины, избыточным ростом кишечной микрофлоры, катаболизмом белка и многими другими причинами. Опять же, важно оценить клиническую картину пациента, чтобы выявить причину повышенного содержания аммиака в сыворотке крови.
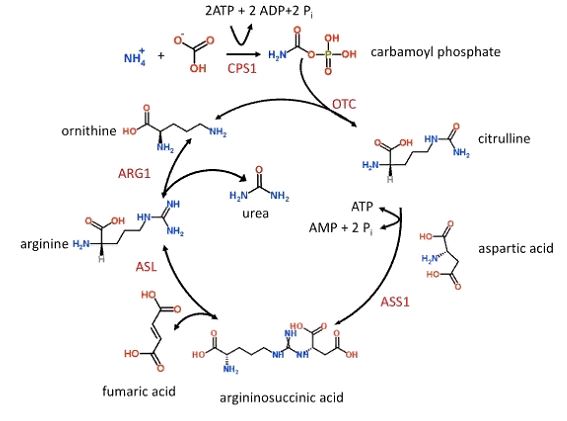
Рисунок 1. Ход протекания цикла синтеза мочевины
Патофизиология орнитинового цикла мочевины
Существует шесть клинически значимых расстройств. Поскольку все шесть из этих расстройств приводят к увеличению аммиака и снижению мочевины в крови, у каждого из них одинаковая клиническая картина. Гипераммонемия токсична для головного мозга и приводит к энцефалопатии, которая может проявляться отеком головного мозга, рвотой, помутнением зрения, астериксисом и судорогами. Избыток аммиака также приведет к повышенному образованию глутамина. Напомним, что глютаминсинтетаза использует реагенты NH3 и глутамат для получения глютамина. Глутамат является возбуждающим нейромедиатором, и поэтому снижение уровня глутамата вызовет подавленную нервную активность, которая проявляется в виде летаргии или коматозного состояния. Кроме того, избыток аммиака препятствует циклу ЦТК, вызывая образование Альфа-кетоглутарата глутамата.
Здесь мы обсудим наиболее распространенные нарушения цикла мочевины.
Дефицит орнитин-Транскарбамилазы (OTC)
Дефицит орнитинтранскарбамилазы является единственным Х-сцепленным рецессивным дефицитом фермента в цикле мочевины. Это также самый распространенный дефицит ферментов в цикле мочевины. Он приводит к повышению уровня карбамоилфосфата, который становится шунтированным в путь синтеза пиримидина, как только карбамоилфосфат попадает в цитоплазму. Карбамоилфосфат превращается в оротовую кислоту. Напомним, что оротовая кислота является предшественником всех пиримидинов. В результате этот дефицит приведет к повышению уровня оротовой кислоты в крови и моче. Оротическая ацидурия может проявляться в виде оранжевых кристаллов в подгузниках.
Дефицит Аргининосукцинатсинтетазы
Это расстройство является вторым наиболее распространенным дефицитом ферментов в цикле мочевины и является аутосомно-рецессивным. Из-за этого у пациентов будет повышен уровень цитруллина.
Дефицит Карбамоилфосфатсинтетазы I (CPS I)
Это расстройство также является аутосомно-рецессивным, но не приводит к повышению уровня оротовой кислоты. Дефицит CPS I часто приводит к летальному исходу в младенчестве.
При подозрении на дефицит фермента цикла мочевины ключ к выявлению источника проблемы основан на накоплении метаболитов. Например, дефицит OTC и дефицит CPS I приводят к снижению мочевины и повышенному аммиаку; однако дефицит OTC будет иметь повышенные уровни оротовой кислоты, тогда как дефицит CPS I не будет. Другой пример, дефицит OTC, и наследственная оротовая ацидурия оба имеют повышенную оротовую кислоту сыворотке крови и мочи. Одно различие между этими двумя состояниями вне их соответствующих ферментных дефицитов заключается в том, что дефицит OTC будет иметь повышенный уровень аммиака, в то время как наследственная оротическая ацидурия не будет.
Клиническое значение цикла синтеза мочевины
Понимая биохимические пути цикла мочевины, медицинские работники могут развивать свои знания и клинический подход в распознавании источника повышенного содержания аммиака и пониженного содержания мочевины у пациентов с возможным дефицитом ферментов цикла мочевины. При раннем выявлении дефицита цикла мочевины, пациенты, которые часто являются новорожденными и младенцами, могут быть “спасены” от возможных неврологических последствий. У пациентов с предполагаемым дефицитом мочевинного цикла дефицит орнитинтранскарбамилазы и дефицит аргининсукцинат-синтетазы должны быть в верхней части дифференциальных диагнозов.
Литература по физиологии и патологии цикла синтеза мочевины
Полезно знать
© VetConsult+, 2016. Все права защищены. Использование любых материалов, размещённых на сайте, разрешается при условии ссылки на ресурс. При копировании либо частичном использовании материалов со страниц сайта обязательно размещать прямую открытую для поисковых систем гиперссылку, расположенную в подзаголовке или в первом абзаце статьи.
Ферменты, уравнения реакций цикла мочевины. Сущность понятий "апофермент", "простетическая группа", "кофермент", "холофермент". Уравнение реакции декарбоксилирования пирувата с участием тиаминпирофосфата. Реакция цикла Кребса, сопряженная с синтезом ГТФ.
| Рубрика | Медицина |
| Вид | контрольная работа |
| Язык | русский |
| Дата добавления | 11.06.2009 |
| Размер файла | 18,7 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
12. В форме каких ионов находится гистидин, аланин, аргинин при значениях рН 7.1 и 7.4, характерных для плазы крови и межклеточной жидкости соответственно: рК1=2.1, рК2=9.0, рК3 (гис)=6.0, рК3 (арг)=12.5?
Величина рК - отрицательный десятичный логарифм константы диссоциации, рК1 - характеризует кислотные свойства б - СООН группы, рК2 - основные свойства б - NH2-группы, рК3 - кислотные и основные свойства ионизирующих групп радикала аминокислот.
Так как значение изоэлектрической точки гистидина находится в пределах рН 7.1 и 7.4, он находится в форме биполярных ионов.
Так как значения рН 7.1 и 7.4 превышают изоэлектрическую точку, то аланин имеет суммарный отрицательный заряд (находится в форме анионов).
Таким образом, поскольку значение рН 7.1 и 7.4 ниже изоэлектрической точки, то аргинин несет суммарный положительный заряд (находится в форме катионов).
16. В каком направлении (к катоду, аноду) будут перемещаться или оставаться на старте в процессе электрофореза при рН 6.8 следующие пептиды: а) сер-вал-арг, б) лиз-гли-асп, в) гли-лей-три, г) арг-вал-лиз-цис?
а) к катоду (пояснения на листочке)
40. Каковы основные этапы цикла мочевины? Где он локализован? Почему его называют орнитиновым циклом? Приведите уравнения реакций цикла мочевины, назовите ферменты?
Мочевина (карбамид) -- амид угольной кислоты, конечный продукт белкового обмена у уреотелических - животных и человека.
В 30-х годах Г. Кребс подробно исследуя цепь реакций образования мочевины, нашел, что эта цепь имеет циклический характер и существенную роль в процессе играет орнитин. В связи с последним весь процесс биосинтеза мочевины получил название орнитинового цикла.
Синтезируется мочевина в печени из СО2, аммиака и азота a-аминогрупп L-аспарагиновой кислоты в результате циклической последовательности биохимических реакций, получившей название цикла мочевины (цикл аргинина -- мочевины, орнитиновый цикл, цикл Кребса -- Хензелейта). В результате происходит обезвреживание токсического аммиака путем образования водорастворимой мочевины, выводимой из организма с мочой (пропорционально клубочковой фильтрации в почках).
На первом этапе цикла мочевины происходит образование карбамоилфосфата из СО2 и аммиака, эту реакцию катализирует карбамоилфосфатсинтаза в присутствии М-ацетилглутамата. Второй этап -- биосинтез L-цитруллина из L-орнитина и карбамоилфосфата, катализируемый орнитинтранскарбамилазой. Третьим этапом цикла является синтез аргининянтарной кислоты из L-цитруллина и L-аспарагиновой кислоты, катализируемый аргининосукцинатсинтетазой. Четвертый этап -- превращение аргининянтарной кислоты в L-аргинин и фумаровую кислоту, катализируемое аргининсукциназой. На пятом, заключительном этапе цикла мочевины осуществляется гидролитическое расщепление L-аргинина под действием фермента аргиназы с образованием мочевины и L-орнитина, который служит субстратом для реакции второго этапа цикла мочевины.
Цикл мочевины протекает в печени. Превращение L-орнитина в L-цитруллин и синтез карбамоилфосфата локализованы в матриксе митохондрий, а все другие реакции цикла -- в цитоплазме. Митохондрий клеток почек не содержат ферментов, необходимых для превращения L-орнитина в L-цитруллин и синтеза карбамоилфосфата. Однако в почках происходит синтез мочевины из цитруллина, поступающего из печени.
46. Что следует понимать под терминами апофермент, простетическая группа, кофермент, холофермент? Приведите примеры однокомпонентных и двукомпонентных ферментов?
В природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые, однокомпонентные белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др.
Большинство природных ферментов относится к классу сложных белков (двукомпонентных), содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности.
Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. Если константа диссоциации сложного фермента настолько мала, что в растворе все полипептидные цепи оказываются связанными со своими кофакторами и не разделяются при выделении и очистке, то такой фермент получает название холофермента (холоэнзим), а кофактор - простетической группы, рассматривающейся как интегральная часть молекулы фермента.
Полипептидную часть фермента принято называть апоферментом.
Ни кофактор, ни сам по себе апофермент каталитической активностью не наделены, и только их объединение в одно целое, протекающее не хаотично, а в соответствии с программой их структурной организации, обеспечивает быстрое протекание химической реакции.
61. Производное какого витамина участвует в реакции декарбоксилирования кетокислот? Приведите уравнение реакции декарбоксилирования пирувата с участием тиаминпирофосфата?
В реакции декарбоксилирования кетокислот принимает участие производное витамина В1 (тиамина). Тиамин - водорастворимый витамин, в чистом виде представляет собой мелкие бесцветные кристаллы горького вкуса. Тиамин участвует в тканевом дыхании и передаче возбуждения в нервной системе. Источниками тиамина служат дрожжи, хлеб из муки грубого помола, гречневая и овсяная крупа, картофель, печень.
Механизм действия витамина В1 состоит в том, что при посредстве тиамин-пирофосфокиназы, перносящей остаток пирофосфата с АТФ на тиамин, он превращается в тиаминпирофосфат.
Тиаминпирофосфат (кокарбоксилаза) - кофермент, участвующий в реакциях декарбоксилирования кетокислот и кетосахаров в живых клетках.
Образование промежуточного соединения пировиноградной и других б-кетокислот с тиаминпирофосфатом объясняется своеобразием его электронной структуры: второй углеродный атом тиазола обладает повышенной электронной плотностью вследствие диссоциации от негопротона, поэтому к нему легко присоединяется б-углеродный атом кетокислоты, характеризующийся дефицитома электронной плотности.
Оксиэтилтиаминпирофосфат в свою очередь распадается с высвобождением тиаминпирофосфата и продукта деструкции пировиноградной кислоты либо в виде ацетальдегида, который далее превращается в этиловый спирт, либо в виде ацетил-КоА.
89. Напишите уравнения реакций дегидратации рибозы и фруктозы в присутствии концентрированной соляной кислоты
Моносахариды устойчивы в горячих разбавленных растворах неорганических кислот. Под действием концентрированных кислот моносахариды дегидратируются и дают циклические альдегиды - фурфурали, при этом из пентоз образуется фурфурол, из гексоз - гидроксиметилфурфурол.
101. Напишите уравнения реакции цикла Кребса, сопряженная с синтезом ГТФ
Данная реакция - это реакция окислительного декарбоксилированияб-кетоглутаровой кислоты до янтарной кислоты.
Суммарное уравнение (на листочке).
Это сложная многоступенчатая реакция.
Первая стадия окислительного декарбоксилирования б-кетоглутаровой кислоты включает в себя окисление и декарбоксилирование:
б-кетоглутаровая кислота + НАД+ + КоА - Сукцинил -КоА +СО2 +НАДН + Н+
На следующем этапе сукцинил КоА утрачивает свою КоА группу, освобождающаяся энергия запасается в фосфатной связи ГТФ:
Сукцинил-КоА +Фн +ГДФ - Янтарная кислота + ГТФ + КоА-SH
Реакция катализируется ферментом сукцинил-КоА-синтетазой и относится к реакциям субстратного фосфорилирования.
114. Приведите схему превращений стеариновой кислоты по в-окислению. В чем отличие в-окисления высших жирных кислот от б -окисления?
в-окисление высших жирных кислот происходит в митохондриях живых организмов и является преобладающим механизмом их распада. Окисление происходит ступенчато, путем отщепления двухуглеродных фрагментов. В случае в-окисления на четвертой стадии распада жирных кислот происходит окисление в-углеродного атома путем отнятия двух атомов водорода. В нем принимают участие коэнзим А и специфические ферменты
б -окисление жирных кислот происходит в бесструктурной части клеточного содержимого растительных организмов. В случае б -окисления окислению подвергается б -углеродный атом. Жирные кислоты в своем составе должны иметь 15-18 углеродных атомов. В нем принимают участие перекись водорода и фермент - пероксидаза.
Адреналин и норадреналин относятся к катехоламинам. Катехоламины - это группа биогенных аминов производных пирокатехина (катехола), осуществляющая регуляцию функций эндокринных желез (надпочечники, щитовидная железа и др.) и передачу нервных импульсов. В первом случае катехоламины рассматривают как гормоны, во втором - как нейромедиаторы .
Норадреналин и адреналин образуются из тирозина в результате последовательных этапов синтеза, катализируемых ферментами. Синтез начинается с фенилаланина и ведет к образованию дофамина, норадреналина и адреналина через тирозин и ДОФА.
Превращение тирозина в норадреналин включает три последовательных этапа: 1)гидроксилирование бензольного кольца, 2)декарбоксилирование, 3)гидроксилирование боковой цепи.
Адреналин отличается от норадреналина наличием метильного радикала, замещающего атом водорода в аминогруппе. Превращение тирозина в адреналин включает четыре последовательных этапа:
1) гидроксилирование бензольного кольца,
3) гидроксилирование боковой цепи и
Таким образом, норадреналин является промежуточным продуктом для биосинтеза адреналина.
Первая реакция гидроксилирование кольца осуществляется с помощью тирозингидроксилазы, вторая - с помощью ДОФА-декарбоксилазы (дезоксифенилаланиндекарбоксилазы), третья - с помощью дофамин-бета-гидроксилазы (ДБГ), четвертая - с помощью фенилэтаноламин-N-метилтрансферазы.
Адреналин (эпинефрин)- катехоламин, который секретируется в корковом веществе надпочечников при стрессе и является медиатором в некоторых синапсах. При различных эмоциональных реакциях: боль, гнев, страх - в крови обязательно увеличивается содержание адреналина. Поэтому его еще называют гормоном стресса. Высвобожденный адреналин распространяется повсюду с током крови и адсорбируется на определенных рецепторах на поверхности клеток в различных тканях тела. Действуя как лиганд, он связывается с рецепторами, экспонированными на поверхности разнообразных типов клеток повсюду в организме. Эти рецепторы называются b-адренергическими.
Это приводит к увеличению частоты сердечных сокращений, оказывает мощное сосудосуживающее действие, вызывая повышение артериального давления, уменьшает отток крови к внутренним органам, увеличивает приток крови к скелетным мышцам.
Известно мощное регулирующее влияние адреналина на обмен углеводов в организме: он вызывает резкое повышение уровня глюкозы в крови, что обусловлено ускорением распада гликогена в печени под действием фермента фосфорилазы. Адреналин, как и глюкагон, активирует фосфорилазу не прямо, а через систему аденилатциклаза-цАМФ-протеинкиназа. Параллельно отмечаются накопление гексозофосфатов в тканях, в частности в мышцах, уменьшение концентрации неорганического фосфата и повышение уровня ненасыщенных жирных кислот в плазме крови. Имеются данные о торможении окисления глюкозы в тканях под влиянием адреналина.
144. Почему молочная кислота является причиной утомляемости организма? При каких обменных процессах происходит интенсивное накапливание молочной кислоты в мышцах?
Молочная кислота образуется в результате анаэробного гликолиза. Анаэробный гликолиз, несмотря на небольшой энергетический эффект, является основным источником энергии для скелетных мышц в начальном периоде интенсивной работы, т. е. в условиях, когда снабжение кислородом ограничено.
Анаэробный гликолиз - сложный ферментативный процесс распада глюкозы, протекающий в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется АТФ. Суммарное уравнение гликолиза можно представить следующим образом:
Боли в мышцах связаны именно с накоплением в них молочной кислоты.
Подобные документы
Серологические реакции как реакции между антигенами и антителами in vitro. Классификация серологических реакций в зависимости от характера и физического состояния антигена. Реакция преципитации в геле по Оухтерлони. Мктод иммуноферментного анализа.
презентация [2,3 M], добавлен 03.06.2015
Физиологический механизм аллергической реакции замедленного типа отличие от других типов аллергических реакций. Причины возникновения аллергии в организме. Основные проявления аллергии и характер аллергенов. Реакции гиперчувствительности четвертого типа.
реферат [17,2 K], добавлен 17.03.2011
Применение реакции связывания комплемента при идентификации антигенов и в серодиагностике инфекций. Постановка реакций связывания и длительного связывания комплемента: варианты и основные компоненты. Подготовка ингредиентов, контроли главного опыта.
доклад [790,4 K], добавлен 27.06.2011
Полноценные и неполноценные антигены. Нежелательные реакции на лекарственные средства. Классификация аллергических реакций на медикаменты по механизмам. Реакции немедленного типа. Механизмы цитотоксических, иммунокомплексных, псевдоаллергических реакций.
презентация [248,3 K], добавлен 27.10.2016
Описание фаз месячного цикла женщины: фолликулярной, разрыва главного фолликула и лютеиновой, понятие о менструации. Причины и факторы нарушения менструального цикла, его проявления в подростковом периоде и в пременопаузе. Проблемы гормонального сбоя.
презентация [1,1 M], добавлен 18.09.2017
Классификация аллергических реакций. Реагиновый механизм на поверхности мембран базофилов и тучных клеток. Реакции замедленного типа. Механизм воздействия попадающего в организм аллергена на сенсибилизированные лимфоциты с секрецией различных медиаторов.
презентация [84,2 K], добавлен 24.05.2014
Анафилактические реакции как гиперчувствительность немедленного типа, вызываемые экзогенными агентами. Патологические реакции организма. Случаи возникновения анафилактических реакций. Дифференциальная диагностика. Мероприятия немедленной терапии.
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80–85% от всего азота мочи. Основным и, возможно, единственным местом синтеза мочевины является печень. Впервые Г. Кребс и К. Гензеляйт в 1932 г. вывели уравнения реакций синтеза мочевины, которые представлены в виде цикла, получившего в литературе название орнитинового цикла мочевинообразования Кребса.
Следует указать, что в биохимии это была первая циклическая система метаболизма, описание которой почти на 5 лет опеределило открытие Г. Кребсом другого метаболического процесса – цикла трикарбоновых кислот. Дальнейшие исследования в основном подтвердили циклический характер биосинтеза мочевины в печени. Благодаря исследованиям Г. Коена, С. Ратнер и сотр. были уточнены промежуточные этапы и ферментные системы, катализирующие образование мочевины.
Таким образом, весь цикл мочевинообразования может быть представлен следующим образом. На первом этапе синтезируется макроэргическое соединение карбамоилфосфат – метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза пиримидиновых нуклеотидов (соответственно ДНК и РНК) и аргинина (соответственно белка и мочевины):
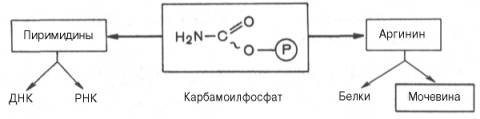
Мочевина – основной конечный продукт азотистого обмена, в составе которого из организма выводится избыток азота.
Орнитиновый цикл в печени выполняет две функции:
- превращение аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака;
- синтез аргинина и пополнение его фонда в организме.
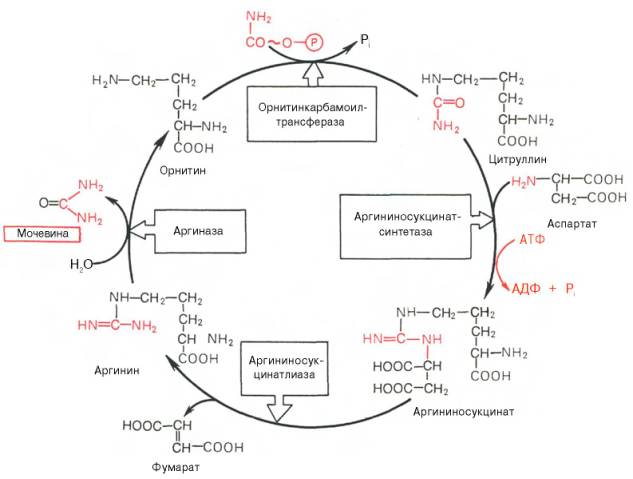
Рассмотрим цикл мочевины:
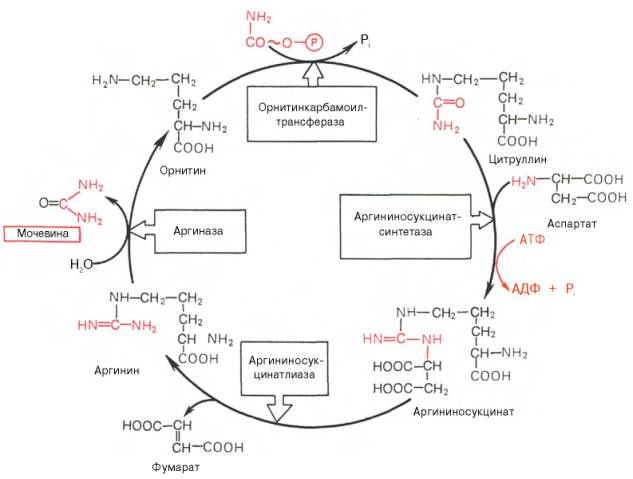
Рисунок 34 - Орнитиновый цикл синтеза мочевины в печени
Начинается он с образования карбамоилфосфата в митохондриях, где много АТФ.
1 Образование карбамоилфосфата. Ионы аммония, возникшие в результате окислительного дезаминирования глутаминовой кислоты, взаимодействуют с гидрокарбонат - анионом и АТФ при участии карбамоилфосфатсинтетазы, образуя карбамоилфосфат, содержащий макроэргическую связь:
О ~ Ф
2. Получение цитруллина. В матриксе митохондрий карбамоилфосфат конденсируется с аминокислотой орнитином, которая, являясь гомологом лизина, не входит в состав белков.
Реакция катализируется орнитинкарбамоилтрансферазой:
Орнитин Карбамоилфосфат цитруллин
Образующийся цитруллин переходит в цитозоль клеток печени, где и происходят остальные реакции цикла мочевины.
3. Получение аргининосукцината. Замещение карбонильной группы цитруллина на аминогруппу аспартата с образованием гуанидиновой группировки аргининосукцината происходит при участии АТФ и катализируется аргининосукцинатсинтетазой:
Реакция эндэргоническая, на протекание первой и третьей реакций цикла расходуется 4 молекулы АТФ.
4. Распад аргининосукцината. Под действием аргининосукцинатлиазы аргининосукцинат экзэргонически расщепляется с образованием аргинина и фумарата:
Н СОО - Н СОО - СОО - Н
Аргининосукцинат Аргинин Фумарат
5. Образование мочевины и регенерация орнитина. Гидролиз аргинина, катализируемый аргиназой, приводит к образованию мочевины и регенерации орнитина. Реакция экзэргонична.
Н СОО - Н СОО - NН2
Аргинин Орнитин Мочевина
Регенерированный орнитин может снова поступать в митохондрии и участвовать в новом обороте цикла мочевины. Образующуюся мочевину кровь переносит из печени в почки, где извлекается из крови и удаляется из организма с мочой.
В орнитиновом цикле расходуется 4 макроэргические связи трех молекул АТФ на каждый оборот цикла.
Однако процесс образования мочевины обеспечивает сам себя энергией:
- при регенерации аспартата из фумарата на стадии дегидрирования малата образуется НАДН, который может обеспечить синтез 3 макроэргических связей.
- при окислительном дезаминировании глутамата в разных органах тоже образуется НАДН, который может обеспечить синтез 3 макроэргических связей.
Из приведенных реакций видно, что токсичный аммиак превращается в безвредную мочевину. При этом один из атомов азота мочевины образуется из аммиака, другой – из аспартата.
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80–85% от всего азота мочи. Основным и, возможно, единственным местом синтеза мочевины является печень. Впервые Г. Кребс и К. Гензеляйт в 1932 г. вывели уравнения реакций синтеза мочевины, которые представлены в виде цикла, получившего в литературе название орнитинового цикла мочевинообразования Кребса. Следует указать, что в биохимии это была первая циклическая система метаболизма, описание которой почти на 5 лет опеределило открытие Г. Кребсом другого метаболического процесса – цикла трикарбоновых кислот (см. ранее). Дальнейшие исследования в основном подтвердили циклический характер биосинтеза мочевины в печени. Благодаря исследованиям Г. Коена, С. Ратнер и сотр. были уточнены промежуточные этапы и ферментные системы, катализирующие образование мочевины.
Таким образом, весь цикл мочевинообразования может быть представлен следующим образом. На первом этапе синтезируется макроэргическое соединение карбамоилфосфат – метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза пиримидиновых нуклеотидов (соответственно ДНК и РНК) и аргинина (соответственно белка и мочевины):
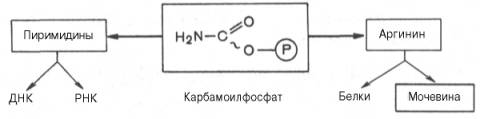
К настоящему времени открыты три разных пути синтеза карбамоил-фосфата de novo, катализируемые тремя разными ферментами. Первую необратимую реакцию катализирует регуляторный фермент – аммиакзави-симая карбамоилфосфатсинтетаза (КФ 6.3.4.16):

Реакция требует затраты двух молекул АТФ, открыта в митохондриях клеток печени и используется преимущественно для синтеза аргинина и мочевины. В этой реакции в качестве активного стимулирующего ал-лостерического эффектора действует N-ацетилглутамат.
Вторую, также необратимую, реакцию катализирует глутаминзависимая карбамоилфосфатсинтетаза (КФ 6.3.5.5):

Данная реакция открыта в цитозоле клеток животных и требует наличия ионов Mg 2+ . Следует указать, что благодаря включению гидролитической стадии она используется преимущественно для синтеза пиримидиновых нуклеотидов (см. далее). Фермент широко распространен в клетках животных.
Третью обратимую реакцию катализирует карбаматкиназа (КФ 2.7.2.2):

Реакция открыта у разных микроорганизмов и, возможно, используется скорее для ресинтеза АТФ, чем для синтеза карбамоилфосфата.
На втором этапе цикла мочевинообразования происходит конденсация карбамоилфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитин-карбамоилтрансфераза (КФ 2.1.3.3).
На следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них, энергозави-симая,– это конденсация цитруллина и аспарагиновой кислоты с образованием аргининосукцината (эту реакцию катализирует аргининосукцинат-синтетаза). Аргининосукцинат распадается в следующей реакции на аргинин и фумарат при участии другого фермента – аргининосукцинатлиазы. На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы.
Необходимо подчеркнуть, что аргиназа содержится в печени тех животных, которые экскретируют с мочой мочевину как основной и конечный продукт азотистого обмена. В печени птиц, например, аргиназа отсутствует, поскольку птицы вместо мочевины выделяют мочевую кислоту. Орни-тиновый цикл мочевинообразования с учетом новых данных представлен на рис. 12.5.
Суммарная реакция синтеза мочевины без учета всех промежуточных продуктов может быть представлена в следующем виде:

Данная реакция сопровождается снижением свободной энергии (ΔG 0 = –40 кДж), поэтому процесс всегда протекает в направлении синтеза мочевины. Следует указать, что синтез мочевины энергетически дорого обходится организму. На синтез одной молекулы мочевины требуется
затрата четырех высокоэнергетических фосфатных групп: две молекулы АТФ расходуются на синтез карбамоилфосфата и одна – на образование аргининоянтарной кислоты, при этом АТФ расщепляется на АМФ и РРi, который при гидролизе также образует две молекулы Рi.
Из приведенной схемы процесса мочевинообразования нетрудно видеть, что один из атомов азота мочевины имеет своим источником свободный аммиак (через карбамоилфосфат); второй атом азота поступает из ас-партата. Аммиак образуется главным образом в процессе глутаматде-гидрогеназной реакции. В процессе пополнения запасов аспартата участвуют три сопряженные реакции: сначала фумарат под действием фумаразы присоединяет воду и превращается в малат, который окисляется при участии малатдегидрогеназы с образованием оксалоацетата; последний в реакции трансаминирования с глутаматом вновь образует аспартат.
Учитывая известные фактические данные о механизмах обезвреживания аммиака в организме, можно сделать следующее заключение. Часть аммиака используется на биосинтез аминокислот путем восстановительного аминирования α-кетокислот по механизму реакции трансаминирования. Аммиак связывается при биосинтезе глутамина и аспарагина. Некоторое количество аммиака выводится с мочой в виде аммонийных солей. В форме креатинина, который образуется из креатина и креатинфосфата, выделяется из организма значительная часть азота аминокислот. Наибольшее количество аммиака расходуется на синтез мочевины, которая выводится с мочой в качестве главного конечного продукта белкового обмена в организме человека и животных. Подсчитано, что в состоянии азотистого равновесия организм взрослого здорового человека потребляет и соответственно выделяет примерно 15 г азота в сутки; из экскретируемого с мочой количества азота на долю мочевины приходится около 85%, креатинина – около 5%, аммонийных солей – 3%, мочевой кислоты – 1% и на другие формы – около 6%.
В процессе эволюции живые организмы выработали различные типы азотистого обмена. Это аммониотелический тип, при котором главным конечным продуктом азотистого обмена является аммиак; он свойствен преимущественно рыбам. При уреотелическом типе обмена основным конечным продуктом обмена белков является мочевина; такой тип характерен для человека и животных. Урикотелический тип характерен для птиц и рептилий; главным конечным продуктом данного типа обмена является мочевая кислота.
Читайте также:

