Окислы и гидроокислы реферат
Обновлено: 04.07.2024
Окислы - соединения элементов с кислородом, в гидроокислах присутствует также вода. В земной коре на долю окислов и гидроокислов приходится около 17%, из них на долю кремнезёма (SiO2) около 12.5%.
Наиболее часто встречаются окислы кремния, алюминия, железа, марганца, титана.
Окислы делятся на 3 подкласса:
1) Простые окислы - соединения катиона с анионом кислорода; соотношения между химическими элементами и кислородом изменяется от 2:1 до 1:2. Общие формулы минералов R2O, R2O3, RO2.
2) Сложные окислы - представляют собой двойные соли RO*R2O3
3) Гидроокислы - содержат группу -OH или молекулы H2O. К гидроокислам условно относят минерал опал.
Генезис окисов магматический, пегматитовый, гидротермальный, метаморфический, КМС в скарнах и грейзенах. Часто образуются в коре выветривания или накапливаются в россыпях.
Окислы имеют большое значение: являются породообразующими минералами, используются в ювелирном деле, являются важнейшими рудами меди, железа, алюминия, марганца, титана.
Наиболее распространёнными минералами этой группы являются окислы кремния, алюминия, железа, марганца и титана табл. 3.
Таблица 3. Главные минералы – оксиды
| Класс | Минерал | Формула минерала | Сингония | Твердость |
| Простые | Куприт Тенорит Корунд Гематит Уранинит Торианит Кварц Тридимит Кристобалит Стишовит Рутил Анатаз Кассситерит Пиролюзит | Cu2O CuO Al2O3 Fe2O3 UO2 ThO2 SiO2 SiO2 SiO2 SiO2 TiO2 TiO2 SnO2 MnO2 | Куб. Мон. Триг. - Куб. - Триг., гекс. Ромб., гекс. Тетр., куб. Тетр. - - - - | 3, 5 –4 3, 5 5, 5-6 5-6 6, 5 6-7 6, 5-7 - 5-6 6-7 5-6 |
| Сложные | Ильменит Шпинель Магнетит Хромит | FeTiO3 MgAl2O4 FeFe2O4 FeCr2O4 | Триг. Куб. - - | 5-6 5, 5-6 5, 5-7, 5 |
В кристаллических структурах минералов класса окислов катионы металлов находятся в окружении анионов кислорода (в окислах) или гидроксила (в гидроокислах). Среди окислов можно выделить простые окислы, в которых отношения между катионами и анионами изменяются в пределах от 2:1 до 1:2 (R2O, R2O3, RO2) и сложные окислы, для которых характерны двойные соединения.

Оксид железа. Фото: Bill Abbott
Происхождение минералов класса окислов различное - магматическое, пегматитовое, гидротермальное, но большинство окислов образовалось в результате экзогенных процессов в верхних слоях литосферы. Многие эндогенные минералы при выветривании разрушаются и переходят в окислы и гидроокислы.
Физические свойства окислов различны: для большинства из них характерна высокая твёрдость. Минералы класса окислов имеют большое практическое значение. Все устойчивые в условиях земной коры окислы нерастворимы в воде и слабо поддаются выветриванию. К ним относятся окислы железа, марганца, хрома, титана, олова, отчасти меди, циркония и др. Химически некоторые окислы различаются только по степени окисления соответствующих металлов.
Окислы, образующиеся в эндогенных условиях, обычно имеют высокую твердость, стойки к истиранию, характеризуются значительным удельным весом и поэтому часто накапливаются в россыпях (рутил, касситерит, хромшпинелиды, магнетит и др.). Этим минералам свойственна тенденция к образованию кристаллов. Окислы, образующиеся на поверхности, чаще бывают мягкими до сажистых, мажущихся масс и нередко встречаются в виде сплошных землистых скоплений, пленок, примазок и т.п.
Это минерал бериллия из подкласса сложных окислов состава BeAlO.
Сингония ромбическая. Кристаллы хризоберилла имеют толстотаблитчатый, иногда короткопризматический облик. Типичным является развитие закономерных сростков по призме, состоящих из трех индивидов, которые взаимно прорастают друг в друга.
Цвет хризоберилла зеленовато-желтый, реже минерал бесцветный. Блеск стеклянный. Спайность совершенная. Излом раковистый. Двухосный, положительный. Твердость 8,5. В кислотах не растворяется. Встречается в пегматитовых жилах и в контактово-пневматолитовых образованиях в ассоциации с бериллом, флюоритом, апатитом и др. минералами. Он известен в месторождениях Бразилии (Минас-Жерайс), Шри-Ланки, где встречается в аллювиальных отложениях, и на Мадагаскаре. В виде хорошо образованных кристаллов и друз хризоберилл найден в месторождениях Урала, Бразилии (Эспириту-Санто), а также в Колорадо, США (близ Голдена). На земной поверхности устойчив и попадает в россыпи. Хромосодержащая разность называется александритом. Александрит – очень редкий и дорогой драгоценный камень, отличающийся способностью менять окраску от зеленой при дневном свете до вишнево-красной или аметистовой при электрическом свете. Александрит имеет изумрудно-зеленую окраску, а при электрическом свете – фиолетово-красную. Это изменение цвета является важным признаком.





Na(Mg,Fe,Li,Al,)Al(BO)[SiO](OH,F).
Сингония тригональная. Кристаллы турмалина имеют призматическую, столбчатую, игольчатую форму. На гранях часто наблюдается вертикальная штриховка. Цвет минерала весьма разнообразен. Вследствие незначительных колебаний содержания элементов изменяется цвет минерала, редко окрашенного однородно. Твердость 7. Спайность отсутствует, излом неровный. Блеск стеклянный. Разности: шерл (Fe), дравит (Mg), эльбаит (Li, Al), индиголит, рубеллит.Турмалины добываются в пегматитовых жилах Урала. Малиновые турмалины найдены в Забайкалье, хромовые – на Среднем Урале. Существует поверье, что турмалин, как духовный камень, способен развивать творческие способности человека и оберегать людей искусства от всевозможных опасностей.
Минералы группы окислов и гидроокислов представляют собой соединения элементов с кислородом, в гидроокислах присутствует гидроксил или вода, или то и другое вместе. Окислы слагают около 17% от веса земной коры. Их общее количество — около 200 минералов. Наиболее распространены окислы и гидроокислы кремния (12,6%) и железа (4%). Наибольшее развитие среди остальных имеют окислы и гидроокислы алюминия, марганца, титана и хрома. Среди окислов выделяют простые и сложные. В простых окислах соотношение между катионами и анионами изменяется от 2 : 1 до 1:2 (R2O, R2O3, RO2). Для сложных окислов характерны двойные соединения типа RO • R2O3.
Для минералов данной группы преобладает ионный тип химической связи. Кристаллохимические структуры характеризуются обычно тетраэдрической или октаэдрической группировкой кислорода и гидроксильных групп. Катионы находятся, таким образом, в четверном или шестерном окружении кислорода. Следует отметить, что двухвалентные ионы кислорода и одновалентные ионы гидроксила имеют почти одинаковые размеры (О 2- 1,32 Å, ОН — 1,33 Å).
Окислы и гидроокислы различного происхождения, но большинство из них возникло при экзогенных процессах в верхних частях земной коры. Ряд эндогенных минералов в поверхностных условиях разлагается и переходит в окислы и гидроокислы. Некоторые окислы, благодаря своей устойчивости в окислительной обстановке и большой твердости, накапливаются в россыпях (рутил, касситерит, ильменит, магнетит).
Ниже рассматриваются наиболее распространенные и важные в промышленном отношении окислы и гидроокислы кремния, железа, алюминия, марганца, титана, хрома и олова.
Окислы и гидроокислы кремния
Кварц SiО2
Образует две модификации: α-кварц — низкотемпературный, устойчивый до 573° С, пригональной сингонии и β-кварц — высокотемпературный, устойчивый в пределах 573 —867° С, гексагональной сингонии. В природе наиболее распространен α-кварц. Последующее описание относится к этой низкотемпературной
разности, называемой в дальнейшем просто кварцем.
Химический состав: Si-46,7%, О — 53,3%. Твердость 7. Уд. вес 2,65. Морфология. Зернистые и кристаллические агрегаты, кристаллы, друзы, щетки, жеоды. Формы граней весьма разнообразны. Характерны грани призмы, тригональной дипирамиды, три-гонального трапецоэдра. Размеры кристаллов бывают весьма разнообразны: от микроскопических выделений до кристаллов-гигантов. Так, в Казахстане в 1961 г. был найден кристалл весом в 70 т, размером с двухэтажный дом.
По периметру он оброс кристаллами длиной в 1 м. Кристалл кварца показан на рис. 54, а также см. рис. 3, 11, 23. Нередко наблюдаются двойники, сростки (см. рис. 31). Спайность весьма несовершенная. И з л о м раковистый, неровный. Блеск стеклянный (на гранях) до алмазного, жирный, матовый (на изломе). Прозрачен. Цвет. Бесцветен. Окраска обусловлена наличием механических включений, дефектами В решетке, облучением. Молочно-белый, серый, фиолетовый, дымчатый, черный, синий, розовый, зеленый, бурый, желтый и др. Черта. Бесцветная. Разновидности. Горный хрусталь (прозрачный). Аметист (фиолетовый). Дымчатый кварц (раухтопаз). Морион (буро-черный). Цитрин (желтый). Розовый кварц. Молочный кварц. Празем (зеленый). Сагенит (волосатик) — кварц с включением игольчатых выделений рутила. Особые свойства.
Пропускает ультрафиолетовые лучи. Обладает свойством пьезоэлектризации: при механическом воздействии в нем возникают электрические заряды. Диамагнитен. С кислотами не реагирует, за исключением HF. Стоек к выветриванию: разрушается только механически и образует россыпи кварцевых песков. Часто имеет поперечную штриховку на гранях. Происхождение.Возникает в самых различных условиях: магматический (в изверженных горных породах), пегматитовый (в пегматитах), гидротермальный (жильный кварц), в метаморфических и осадочных породах. Парагенезис. Характерен для кислых и средних изверженных пород в ассоциации с полевыми шпатами, слюдой, роговой обманкой. В гидротермальных жилах выделяется с золотом, разнообразным сульфидами, вольфрамитом, касситеритом, топазом, бериллом, кальцитом, баритом и др. Месторождения. Горный хрусталь добывается на Урале, Алдане, Памире. Аметист — на Урале, Кольском полуострове, в Забайкалье, на Украине. Кварцевые пески разраба-Рис. 55. Прожилок халцедона в разрабатываются во многих районах страны. Зарубежом горный хрусталь добывается в Швейцарских Альпах, в Бразилии, на Мадагаскаре, аметист — в Уругвае. Значение. Для получения кремния. В стекловарении, огнеупорной и химической промышленности. При производстве фарфора и фаянса. В пьезо- и радиотехнике. В строительстве (пески), в абразивной промышленности. Ювелирное дело.
Халцедон — SiО2
Окрытокристалличеокая разновидность кварца. Твердость 7—8. Уд. вес 2,5—2,6. Морфология. Сплошные массы, натечные, почковидные, сталактитоподобные образования (рис. 55). Под микроскопом обнаруживает параллельно или радиаль-но-волокнистое, а также сферолитоподобное строение агрегатоз. Спайность отсутствует. Излом неровный, раковистый. Просвечивает. Блеск восковой, матовый. Цвет белый, серый, голубоватый, желтоватый, коричневатый и др. Черта бесцветная. Разновидное т и. Сердолик или карнеол — желто-красный, красный, восково-желтый. Сапфирин— голубовато-серый. Хризопраз — яблочно-зеленый.
Окислы – соединения катионов с кислородом, в гидроокислах присутствует группа (ОН) - и Н2О.
Наиболее распространенными минералами этой группы являются окислы кремния, алюминия, железа, марганца и титана.
С химической точки зрения окислы делят на три класса:
- простые окислы – соединения одного катиона с кислородом (кварц, халцедон, корунд, рутил, гематит, касситерит);
- сложные окислы – соединение нескольких катионов с кислородом (магнетит, ильменит, хризоберилл, хромит);
- гидроокислы – соединения элементов с группой (ОН) - или Н2О (лимонит, гётит, диаспор, опал).
К простым окислам также относится лед, твердая кристаллическая разновидность Н2О.
Общая характеристика. В большинстве своем окислы обладают относительно простыми кристаллическими решетками с ионными типами связи. Разнообразие структур кристаллов обусловлено размерами катионов, их зарядом и поляризационными свойствами.
Часто окислы и гидроокислы встречаются в виде отдельных кристалл-лов, форма которых является их диагностическим признаком. Одни и те же окислы, образуясь в разных геологических условиях, могут образовывать разные по форме минеральные индивиды, т.е обладают типоморфными признаками.
Прочность кристаллических построек оксидов обуславливает ряд их физических свойств – высокую твердость (6,0 – 9,0), химическую устойчи-вость, тугоплавкость и труднорастворимость.
Структуры гидроокислов намного сложнее, что обусловлено слоистым строением их кристаллических решеток, вызванным заменой ионов О 2- на анионные группы (ОН) - . Сложность структур гидроксилов заключается еще в смешанном типе химических связей (внутри слойков действует ионный тип связи, между слойками – вандерваальсовый). При замене ионов О 2- на анионные группы (ОН) – происходит снижение симметрии кристалла за счет изменения его структурных особенностей. Например, Аl2О3 (корунд) кристаллизуется в тригональной сингонии, а AlО(ОН) (диаспор) в ромбической.
Гидроокислы за счет менее прочных кристаллических решеток характеризуются низкими значениями твердости от 1,0 до 5,0 и совершенной спайностью, проходящей параллельно слойкам.
В подавляющем большинстве окислы и гидроокислы непрозрачны и имеют темную бурую или алую окраску за счет катионов железа, марганца, хрома и т.д. Окислы в составе которых присутствуют ионы типа благородных газов и другие (Аl 3+ , Mg 3+ и т.д.) бесцветны или имеют окраску, обусловленную различного рода включениями.
Некоторые окислы имеют несколько полиморфных модификаций и ряд минеральных разновидностей. Такими окислами являются кварц (около 12 полиморфных модификации и множество минеральных разновидностей), рутил (две полиморфные модификации), корунд (четыре минеральные разновидности).
Краткая характеристика минеральных видов и их разновидностей приведена в таблицах №№ 5 – 8.
Минеральные разновидности корунда. Появление минеральных разно-видностей корунда обусловлено изоморфными примесями, замещающими в кристаллической решетке ионы алюминия. Прозрачными драгоценными разновидностями корунда являются:
- лейкосапфир – бесцветный корунд;
- сапфир – синий корунд (за счет примеси ионов титана);
- рубин – красный, фиолетово-красный корунд (за счет примеси хрома);
Непрозрачная разновидность корунда называется наждаком.
Полиморфные модификации рутила. Полиморфными разновидностями рутила TiO2 являются брукит и анатаз.
Полиморфные модификации и минеральные разновидности минералов группы кварца (кварц, халцедон). Минералы группы кварца по своему кристаллическому строению занимают особое положение среди окислов. В химическом отношении являясь окислами, они имеют каркасную структуру, близкую к силикатам.
На сегодняшний день известно около 12 полиморфных модификаций кремнезема SiO2, но при атмосферном давлении устойчивыми являются только α-кварц (низкотемпературный – 0 – 573 0 С), β-кварц (высокотемпера-турный – 573 – 870 0 С), тридимит (870 – 1470 0 С) и кристобалит (1470 – 1710 0 С) (рис. 31). Полиморфные модификации коэсит и стишовит были получены экспериментальным путем при высоких давлениях.
Наиболее распространенной является низкотемпературная поли-морфная модификация кремнезема – α-кварц. В основе структуры α-кварца лежат кремнекислородные тетраэдры, где вокруг каждого атома кремния приблизительно на одинаковых расстояниях находятся четыре атома кислорода, а каждый атом кислорода соединяет два тетраэдра, т.е. размещается между двумя атомами кремния. Тетраэдры соединены между собой вершинами.
Окраска кварца бывает самой различной, в связи с чем выделяют ряд минеральных разновидностей (табл. 7):
- горный хрусталь – бесцветный прозрачный кварц;
- аметист – фиолетовый прозрачный кварц;
- цитрин – желтый прозрачный кварц;
- раухтопаз – прозрачный дымчатый кварц;
- морион – непрозрачный, полупрозрачный кварц;
- розовый полупрозрачный кварц;
- молочный непрозрачный, полупрозрачный кварц.
Фиолетовый цвет кварца обусловлен изоморфной примесью Fe 3+ и внедрившимися в межузельные пространства катионами щелочных металлов. Цвет мориона обусловлен такой же примесью Al 3+ и катионами Na + и Li + , а у цитрина – катионами Li + и Н + . Розовый цвет кварца устойчив до температуры 300 0 С и вызван примесью ионов Ti 3+ . Молочный цвет кварца обусловлен микроскопическими включениями жидкостей и газов.
Цвет кварца также может быть обусловлен всевозможными включениями и псевдоморфозами:
- празем – непрозрачный зеленый кварц. Цвет обусловлен тонкими включениями актинолита или хлорита (рис. 32);
- авантюрин – буровато-красный кварц с мерцающим золотым отливом, за счет включений слюды, гётита или магнетита (табл. 7);
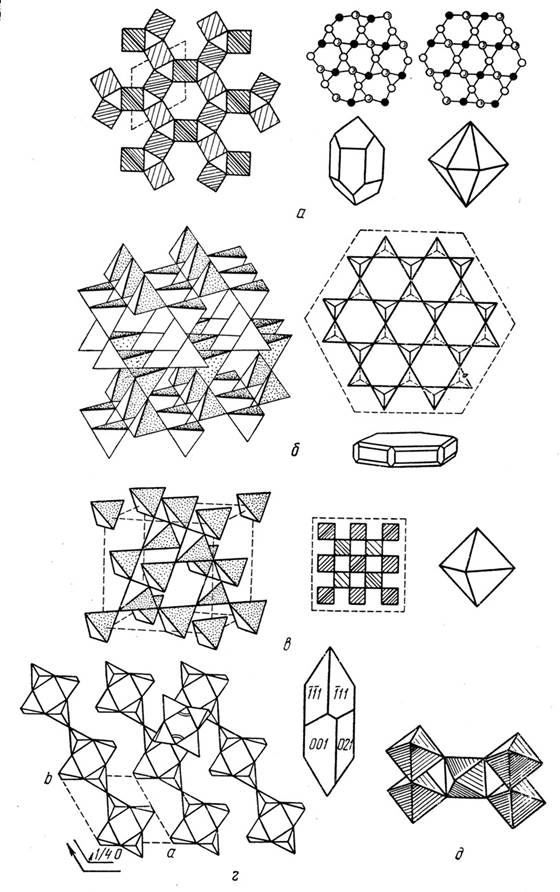
Рис. 31. Кристаллическая структура полиморфных модификаций кремнезема SiO2
(по Е.К. Лазаренко, 1971)
а – α-кварц и β-кварц, б – тридимит, в – кристобалит, г – коэсит, д – стишовит

Рис. 32 Празем. Сплошной агрегат



Скрытокристаллической волокнистой, радиально-концентрической, либо слоисто-концентрической разновидностью кварца является халцедон (табл. 8). По цвету и строению выделяют несколько его минеральных разновидностей:
- халцедон – серый, голубовато-серый;
- хризопраз – зеленый, яблочно-зеленый;
- карнеол – оранжево-красный до темного;
- сердолик – бледно-розовый до мясо-красного;
- гелиотроп – зеленый с ярко-красными пятнами;
- агат – различно окрашенный халцедон, часто полупрозрачный с чере-дующимися концентрическими светлыми и темными полосами;
- сардоникс – коричневато-красный и белый, полосчатый;
- оникс – черный и белый с чередующимися полосами.
Происхождение окислов и гидроокислов связано, главным образом, с экзогенными процессами. Образование окислов и гидроокислов происходит в корах выветривания, зонах окисления различных минеральных месторождений, а также в водных условиях, где формируются гидроокислы железа, марганца и алюминия.
В эндогенных условиях (магматических, гидротермальных, реже метаморфических) образуются лишь некоторые простые и сложные окислы (рутил, ильменит, магнетит, кварц, касситерит).
Карбонаты
Карбонаты – соединения катионов с анионным комплексом [СО3] 2- (соли угольной кислоты). Наиболее распространенными катионами являются Ca, Na, Mg, Cu, Fe.
С химической точки зрения карбонаты делят на несколько классов:
- безводные карбонаты – соединения одного или нескольких катионов с анионным комплексом [СО3] 2- (кальцит, арагонит, сидерит, магнезит, доло-мит, родохрозит);
- сложные карбонаты – соединения катионов с анионным комплексом и добавочными анионами (ОН) - , F - , Cl - (малахит, азурит).
Общая характеристика. В основе структуры карбонатов лежат плоские группы [СО3] 2- , в которых катион углерода симметрично окружен тремя ионами кислорода, размещенными в вершинах равностороннего треугольника. У кальцита все анионные группировки ориентированы параллельно друг другу, обусловливая резкую анизотропию строения кристаллической решетки минерала. А потому для бесцветных кристаллов кальцита характерно двойное светопреломление (рис. 36).
Карбонаты кристаллизуются в низших сингониях, главным образом, в ромбической, моноклинной, реже в средней сингонии – тригональной. У карбонатов тригональной сингонии отмечается совершенная спайность по ромбоэдру, такие карбонаты называют шпатами (исландский шпат, железный шпат, магнезиальный шпат). В исландском шпате по трещинам спайности наблюдается иризация (рис. 37).
В природе карбонаты встречаются в виде массивных, зернистых агрегатов, и в виде хорошо образованных кристаллов, реже в виде натечных масс (рис. 38). Окраска карбонатов, как правило, светлая: белая, серая, желтая, розовая. Исключение составляют карбонаты меди, они окрашены в зеленые и синие цвета. Твердость карбонатов обычно не превышает 5.
Важным диагностическим признаком карбонатов является вскипание под действием HCl и HNO3 с выделением углекислого газа.
Краткая характеристика карбонатов приведена в таблице № 9.
Происхождение карбонатов, как правило, экзогенное. Большинство карбонатов имеют осадочное хемогенное происхождение (кальцит, арагонит, доломит, сидерит). Кальцит и арагонит, слагающие раковины моллюсков и кости животных имеют биогенное происхождение. Арагонит также образуется в карстовых пещерах, образуя различные натечные тела (сталактиты, сталагмиты, пласты).
С зонами окисления медно-сульфидных месторождений связано образование малахита, азурита и арагонита.
В эндогенных условиях формирование карбонатов связано с низко-температурными гидротермальными жилами (кальцит, доломит, магнезит) и скарнами. Кальцит часто связан с продуктами регионального метаморфизма – мраморами, образованными за счет перекристаллизации известняков.

Рис. 36 Двойное светопреломление в кристалле кальцита

Рис. 37 Эффект иризации по трещине спайности в кристалле кальцита


Рис. 38 Натечные агрегаты карстовых пещер.
Полированные образцы мраморных ониксов
Сульфаты
Сульфаты – соединения катионов с анионным комплексом [SO4] 2- (соли серной кислоты). Главными катионами сульфатов являются Fe 3+ , Na, K, Al, Ca, Ba.
С химической точки зрения сульфаты делят на несколько классов:
- безводные сульфаты – соединения катионов с анионным комплексом [SO4] 2- (ангидрит, барит, целестин);
- водные сульфаты – соединения катионов с анионным комплексом [SO4] 2- и молекулой Н2О (гипс, гипс-селенит);
- сложные сульфаты - соединения катионов с анионным комплексом [SO4] 2- и добавочными анионами (ОН) – (алунит).
Общая характеристика. Основой структуры сульфатов является анионная группа [SO4] 2- , в которой ионы кислорода тетраэдрически окружают шестивалентный ион серы. В общую структуру такие группы соединяются с помощью добавочных катионов, анионов или молекул воды. Кристаллизуются сульфаты в низших сингониях, в моноклинной и ромбической.
Структура водного сульфата – гипса является более сложной. В ней два листа анионных групп [SO4] 2- , тесно связанные с ионами, образуют двойные слои, между которыми размещаются молекулы воды. Слоистое строение гипса обусловливает его физические свойства, совершенную спайность, проходящую между этими слоями, низкую твердость (1,5) и низкую плотность (2,3 г/см 3 ).
В природе сульфаты встречаются в виде хорошо образованных кристаллов, друз, волокнистых, лучистых, зернистых, реже сплошных агрегатов. Они имеют светлую окраску (желтоватую, зеленоватую, белую, серую) или бесцветны. Блеск сульфатов стеклянный, шелковистый. Твердость у безводных сульфатов 3,0 – 3,5, а у водных – 1,5. Спайность, как правило, совершенная в трех направлениях, из-за чего многие сульфаты называют шпатами (тяжелый шпат - барит, легкий шпат - гипс).
Краткая характеристика сульфатов приведена в таблице № 10.
Происхождение сульфатов в основном осадочное хемогенное. Гипсы и ангидриты выпадают из истинных растворов на дне морских водоемов. Целестин встречается в виде жеод и секреций в пустотах, образовавшихся в результате частичного растворения осадочных пород (доломитов, известня-ков, гипсоносных глин, мергелей) (рис. 39).
Барит образуется эндогенным путем в гидротермальных средне- и низкотемпературных жилах в ассоциации с флюоритом, кальцитом и некоторыми сульфидами (рис. 40). Ангидрит иногда ассоциирует с некоторыми метаморфическими и метаморфизованными породами.
Фосфаты
Фосфаты – соединение катионов с анионным комплексом [РО4] 3- (соли фосфорной кислоты). Наиболее распространенными катионами являются Fe, Al, Ca, Mn, U, Na.
С химической точки зрения фосфаты делят на несколько классов:
- безводные фосфаты - соединение катионов с анионным комплексом [РО4] 3- (апатит, монацит);
- водные фосфаты - соединение катионов с анионным комплексом [РО4] 3- и молекулами Н2О (бирюза, урановые слюдки).
Общая характеристика. Основой структуры фосфатов являются тетраэдрические радикалы [РО4] 3- , состоящие из четырех атомов кислорода, расположенных вокруг центрального катиона Р 5+ . Кислороднофосфорные радикалы связаны между собой посредством катионов. Кристаллизуются фосфаты в низших сингониях, в ромбической и моноклинной.
Структура водных фосфатов – урановых слюдок состоит из тетра-гональных гофрированных сеток [UO2(PO4)] 2- . Между сетками распола-

Рис. 39 Жеоды кристаллов целестина, заполняющие пустоту в осадочной породе

Рис. 40 Гидротермальный низкотемпературный барит в ассоциации с флюоритом (перьевидные сростки кристаллов барита с октаэдрическими кристаллами флюорита)
гаются молекулы Н2О. Объединяются сетки в общую структуру при помощи катионов. Сетчатое (слоистое) строение урановых слюдок обусловливает их совершенную спайность и низкую твердость (2,0 – 2,5), а также уплощенный, таблитчатый, реже изометричный облик кристаллов.
Фосфаты образуют как отдельные удлиненно-призматические, игольчатые и пластинчатые кристаллы (апатит), так и различные зернистые, волокнистые, лучистые агрегаты, корки и примазки (бирюза).
Окраска фосфатов пестрая, обычно оттенки синего, желтого и зеленого цветов. Значения твердости (от 2,0 до 6,0) и плотности (2,5 – 3,5 г/см 3 ) варьируют зависимости от состава.
Краткая характеристика фосфатов приведена в таблице № 11.
Происхождение фосфатов экзогенное. Осадочные биохемогенные месторождения фосфатов называют фосфоритами, они сложены, как правило, тонкодисперсным апатитом и кальцитом.
Образование бирюзы происходит при взаимодействии поверхностных вод с глиноземистыми, изверженными и осадочными породами.
Апатит может быть как экзогенным, так и эндогенным. Крупные место-рождения этого минерала связаны не только осадочными, но и с щелочными изверженными породами.
Урановые слюдки являются достаточно редкими минералами. Они образуются в зоне окисления гидротермальных и осадочных месторождений, а также встречаются в ураноносных пегматитах.
Рекомендуемая литература:
8. Бетехтин А.Г. Минералогия. М.: Изд-во геологической литературы, 1950. 956 с.
9. Булах А.Г. Общая минералогия. СПб: Изд-во С.-Петербургского университета, 1999. 356 с. Годовиков А.А., Рипинен О.И., Моторин С.Г. Агаты. М.: Недра, 1987. 368 с.
10. Корнилов Н.И., Солодова Ю.П. Ювелирные камни. М.: Недра, 1986. 282 с.
11. Лазаренко Е.К. Курс минералогии. М.: Высшая школа, 1971. 608 с.
12. Миловский А.В. Минералогия и петрография. М.: Недра, 1985. 432с.
13. О'Доноху М. Кварц. М.: Мир, 1990. 136 с.
14. Самсонов Я.П., Туринге А.П. Самоцветы СССР. М.: Недра, 1985. 335 с.
Читайте также:

