Нейтронная терапия в онкологических заболеваниях реферат
Обновлено: 07.07.2024
В данной статье представлены возможности протонной терапии как нового способа лечения злокачественных опухолей, который может обладать определенными преимуществами перед стандартной фотонной лучевой терапией. Это связано с возможностью создания максимальной дозы излучения в зоне мишени без превышения толерантных доз для нормальных тканей, даже если мишень вплотную прилежит к критическим структурам организма. Более высокая доза соответственно повышает вероятность гибели раковых клеток.
В настоящее время идет активное накопление опыта клинического применения протонной терапии. Представленные в данной статье исследования свидетельствуют о потенциальном преимуществе протонной терапии при лечении опухолей ЦНС, хордом и хондросарком основания черепа и скелета, опухолей головы и шеи, злокачественных опухолей у детей. Активно изучается роль протонов при раке прямой кишки, желудка, предстательной железы, поджелудочной железы. Полученные результаты должны помочь определить группы пациентов, для которых протонная терапия будет иметь решающее значение в улучшении контроля над заболеванием, повышении общей выживаемости и сохранении качества жизни.
Ключевые слова: протонная терапия, хордома, хондросаркома, злокачественные опухоли у детей, радиоиндуцированные опухоли.
Для цитирования: Воробьев Н.А., Михайлов А.В., Смирнова Е.В. и др. Возможности протонной терапии. Клинические аспекты. РМЖ. 2017;16:1175-1180.
Possibilities of proton therapy. Clinical aspects
Vorobiev N.A. 1 - 3 , Mikhailov A.V. 1 , Smirnova E.V. 1 , 3 , Gutsalo Yu.V. 1 , Martynova N.I. 1
1 Medical and Diagnostic Center of International Institute of Biological Systems named after Berezin Sergei, St. Petersburg
2 Saint Petersburg State University
3 North Western State Medical University named after I.I. Mechnikov, St. Petersburg
The article presents the possibilities of proton therapy as a new method of treating malignant tumors, which has certain advantages over standard photon radiation therapy. This is due to the possibility of creating the maximum dose of radiation in the target area without exceeding the tolerated dosages for normal tissues, even if the target is close to the critical structures of the body. A higher dose leads, respectively, to a greater probability of death of cancer cells.
Currently, there is an active accumulation of experience in the clinical use of proton therapy. The presented studies show the potential advantage of proton therapy in the treatment of CNS tumors, chord and chondrosarcoma of the skull and skeleton base, head and neck tumors, malignant tumors in children. The role of protons in cancer of the rectum, stomach, prostate, pancreas is actively studied. The results obtained should help to identify groups of patients for whom proton therapy will be crucial in improving disease control, overall survival and maintaining quality of life.
Key words: proton therapy, chordoma, chondrosarcoma, malignant tumors in children, radioinduced tumors.
For citation: Vorobiev N.A., Mikhailov A.V., Smirnova E.V. et al. Possibilities of proton therapy. Clinical aspects // RMJ. 2017. № 16. P. 1175–1180.
Статья посвящена возможностям и клиническим аспектам протонной терапии
Опухоли центральной нервной системы
У пациентов с опухолями центральной нервной системы (ЦНС) лучевая терапия может применяться на всех этапах лечения – в качестве самостоятельной методики, в послеоперационном периоде, в комбинации с химиотерапией, с радикальной и паллиативной целью. Особенности расположения опухоли существенно ограничивают возможности фотонной лучевой терапии. Доза, необходимая для достижения стойкого контроля над опухолью, зачастую превышает значения, допустимые для органов риска. В подобной ситуации радиотерапевту приходится принимать сложные клинические решения, делая выбор между подведением высокой дозы, способной обеспечить противоопухолевый эффект, и риском повреждения жизненно важных структур. Даже в том случае, если удастся избежать летальных лучевых повреждений, существует высокий риск развития тяжелых нейрокогнитивных расстройств, которые могут быть временными у взрослых пациентов, но у детей часто носят необратимый характер. В подобных случаях любые методики, повышающие конформность облучения и позволяющие снизить нагрузку на органы риска (IMRT, протонная терапия), являются предпочтительными. Исследования по сравнению протонной и фотонной лучевой терапии у пациентов с опухолями ЦНС показывают, что применение пучка протонов позволяет значительно снизить нагрузку на здоровые ткани [2].
Хордома, хондросаркома
Заболеваниями, при которых протонная терапия применяется наиболее широко, являются хордомы и хондросаркомы основания черепа. В редких случаях эти опухоли могут быть удалены хирургически. Применение лучевой терапии также ограничено из-за расположения опухоли в непосредственной близости от жизненно важных структур – ствола головного мозга, черепных нервов, спинного мозга. Конформная лучевая терапия в дозах 50–60 Гр не обеспечивает требуемого противоопухолевого эффекта, демонстрируя неудовлетворительные показатели безрецидивной выживаемости (5-летняя безрецидивная выживаемость Литература
Первый пучок нейтронов на нашей установке для бор-нейтронозахватной терапии рака (БНЗТ, BNCT) был получен в 2008 г. Главное достижение последних лет в том, что мы не только привели установку в рабочее состояние, но и поняли процессы, которые в ней происходят, и внесли соответствующие изменения в конструкцию. Это важно, потому что мы имеем дело с абсолютно новым типом ускорителя заряженных частиц.
Из России – с идеей
Все наши открытия и разработки запатентованы – российских патентов у нас более десятка. Пример наших разработок – нейтроногенерирующая мишень. Когда мы только начали заниматься созданием нашей установки, в одной научной статье уважаемых специалистов было сказано, что лучшей является литиевая мишень, но сделать ее не представляется возможным. У нас такая мишень прекрасно работает уже почти десять лет.
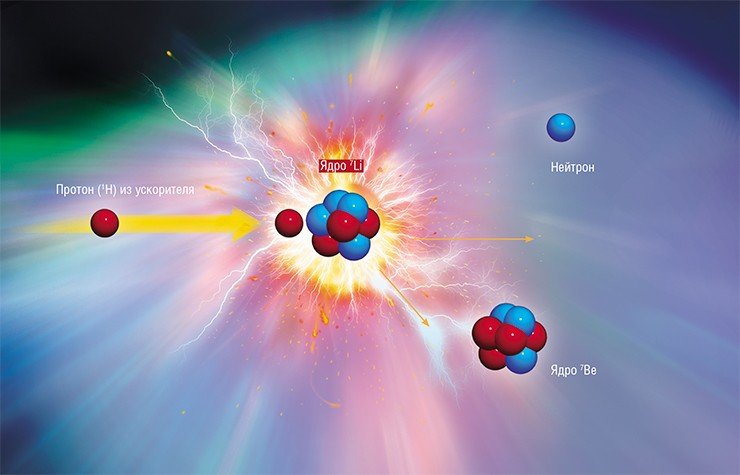
Недавно произошел примечательный казус, когда меня пригласили в Институт науки и технологий Окинавы – японский аналог нашего Сколково, в который были вложены безумные средства. Одна из задач лаборатории, которую возглавил бывший директор КЕКа (знаменитого японского ускорительного комплекса), – создание нейтроногенерирующей мишени. Изучив этот вопрос, японский руководитель также пришел к мысли, что такую мишень сделать невозможно, но мои друзья и его коллеги из КЕКа убедили его, что еще как можно! И я на их лабораторном семинаре рассказал, что есть совсем простая альтернативная идея, как ее сделать. До сих пор помню потрясенное выражение их лиц… Сейчас подобные мишени делаются во всем мире: в первой статье обычно ссылаются на наши работы, потом забывают. Это нормально: чтобы защитить свои идеи, надо не топтаться на месте, а придумывать что-то новое.
В октябре 2016 г. в г. Колумбия американского штата Миссури состоялся Конгресс по нейтрон-захватной терапии, который проводится раз в два года. Там собираются все – химики, биологи и физики, всего около 200 человек. В этот раз от России было два представителя – я и В. И. Брегадзе из Института элементоорганических соединений им. А. Н. Несмеянова РАН (Москва), который занимается созданием соединений адресной доставки бора. Это показывает, какие отечественные команды достигли реальных успехов в этой области.
Я знаю в мире еще лишь две группы, которые, как говорят, получили пучок с нужными параметрами на ускорителях другого типа, одна бельгийско-японская, другая американская, но только наши результаты на сегодняшний день опубликованы. На том же конгрессе от российской стороны было представлено 7 докладов, три из которых докладывали японцы. И на первом же выступлении прозвучал вопрос: зачем они вообще поехали в Сибирь? Ответ был прост: там единственный источник нейтронов, который реально работает.
Из российских специалистов я бы хотел отметить еще В. Н. Митина, руководителя ветеринарной клиники при Российском онкологическом научном центре им. Н. Н. Блохина, который с помощью БНЗТ довольно успешно лечил собак на учебном ядерном реакторе соседнего МИФИ. После его смерти 11 лет тому назад эти работы прекратились.
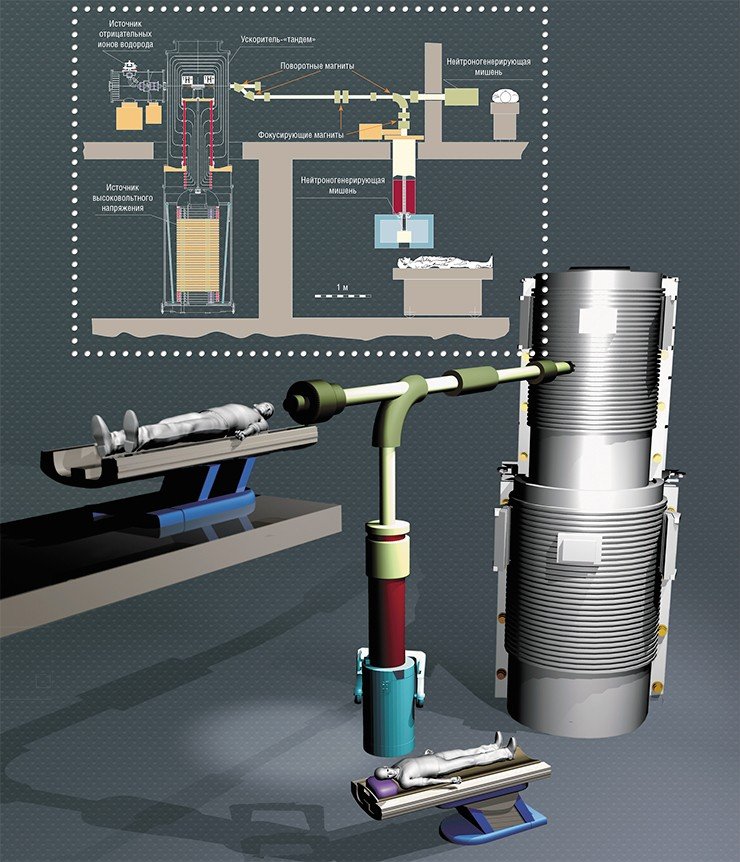
Кстати сказать, подобное лечение очень недешевое: стоимость препаратов адресной доставки бора довольно высока, так как при достаточно сложном производстве спрос невелик. Сегодня доза препарата, необходимая для лечения одного больного, обойдется в случае борфенилаланина примерно в 0,25 млн рублей, боркаптата – раза в 4 больше. Но 15 лет назад эти препараты стоили еще на порядок дороже, а сейчас на каждой конференции по БНЗТ предлагаются и обсуждаются сотни новых препаратов адресной доставки бора. Правда, каждый раз новые… В России таких соединений вообще не выпускают, мы используем препараты, произведенные чешской компанией Katchem.

Физики свое дело сделали
Когда мы еще только планировали свой ускоритель, мы поставили задачу достичь тока протонного пучка 10 мA, а получили поначалу в 100 раз меньше. Такая же история год назад приключилась с нашими японскими коллегами из Университета Цукубы, которым компания Mitsubishi делает подобную машину, но на другом типе ускорителя: при той же плановой цифре они вообще получили 0,1 % от желаемого.
Главная моя мечта тогда была – достичь хотя бы 3 мA, чтобы можно было начать лечить людей. И вот к началу 2015 г. мы получили сразу 5 мA, в 50 раз увеличив ток! Фактически сегодня уже не конструкция ускорителя лимитирует возможность дальнейшего увеличения тока. К тому же, по моему мнению, этих характеристик более чем достаточно для медицинских целей. Тем не менее в следующем году мы планируем достичь заявленной цифры – это уже дело принципа.

Следующей мечтой стало доказать пригодность нашей машины с точки зрения не только физики, но и потребителя. Для этого нужно было поработать с клеточными культурами и лабораторными животными. Чтобы решить первую задачу, мы завели дружбу с японским Университетом Цукуба, при котором есть известная медицинская клиника. О ней могу лишь сказать, что протонная терапия рака, которая в прошлом году заработала в подмосковном наукограде Протвино, о чем было гордо доложено В. В. Путину, в прайсе этой клиники появилась еще в 1983 г., т. е. 33 года назад! А в 2001 г. японцы заменили протонную установку на более современную.
И вот в июне 2015 г. я встретился с директором клиники Акиро Мацумура, который в числе прочего рассказал, что Mitsubishi никак не может запустить ускоритель для БНЗТ. Так мы договорились о совместной работе. Это сотрудничество – взаимовыгодное. У нас – установка, у японцев – большой опыт проведения подобных исследований и, более того, лечения людей методом БНЗТ на реакторе JRR-4 (Токай), который впоследствии закрыли.


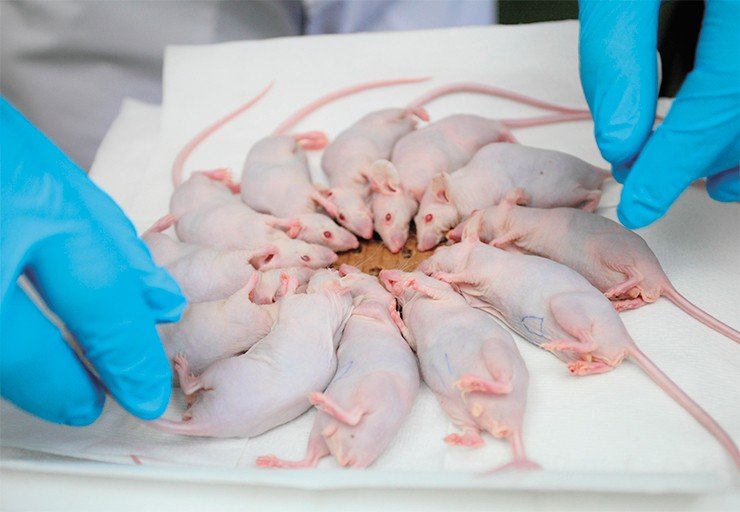
СТАДИЯ – ДОКЛИНИЧЕСКАЯ На ускорителе ИЯФ проводятся доклинические исследования влияния как нейтронного облучения, так и собственно бор-нейтронозахватной терапии на опухолевые клеточные культуры, а также на лабораторных животных (мышей с врожденным иммунодефицитом).
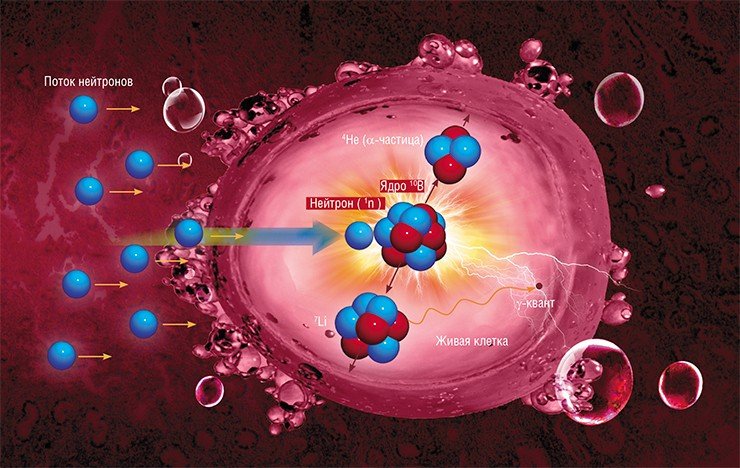
В исследованиях на клеточных культурах используются различные линии как здоровых, так и опухолевых клеток, которые представлены преимущественно опухолями головного мозга. Клетки инкубируют в среде, обогащенной изотопом бор-10, а после этого облучают на ускорителе. После облучения проводят клоногенный анализ: проверяется жизнеспособность клеток, в частности, их способность делиться и образовывать новые колонии.
На основе экспериментов по облучению животных уже дана оценка последствий воздействия бор-нейтронозахватной терапии в зависимости от дозы облучения. Задача измерения дозы, которую получает пациент при проведении БНЗТ, является одной из самых сложных, поскольку суммарная доза состоит из нескольких компонент, измерение каждой из которых затруднено: от сопутствующих гамма-квантов из литиевой мишени и ускорителя, от быстрых нейтронов, от тепловых нейтронов и от захвата нейтрона бором. Каждая из этих компонент зависит от текущей геометрии литиевой мишени, а также от параметров протонного пучка. Плюс к этому доза от захвата нейтрона бором также зависит еще и от типа, формы и расположения опухоли, а также от распределения бора в ней и в окружающих тканях.
Расчет всех четырех дозовых компонент и предсказание воздействия на здоровые и опухолевые ткани при проведении БНЗТ являются значительно более сложными задачами, чем определение доз в традиционной лучевой терапии, которое обычно опирается на полуэмпирические алгоритмы и измерения в водном фантоме. Одним из вариантов создания эмпирического алгоритма планирования терапии являются эксперименты на лабораторных животных, для которых хорошо известны кривые доза–эффект. То есть по биологическим последствиям облучения в тканях животных можно более точно определять полученную дозу, чем с помощью расчетов.
Все животные без опухоли после облучения остались живы, признаков патологического воздействия на здоровые ткани не обнаружено. Сейчас более углубленно изучается влияние облучения на клеточном уровне, включая процессы кроветворения, состояние тканей жизненно-важных органов и воздействия борсодержащих препаратов на организм животного, чтобы подобрать оптимальную дозу.
После окончательной отработки технологии на животных планируется перейти к клиническим испытаниям, т. е. терапии на пациентах, больных раком.
В самом удачном испытании у трех из пяти животных опухоль рассосалась полностью, что было подтверждено результатами томографии, и животные стали здоровыми – они прожили в виварии еще два месяца и были усыплены просто потому, что результат эксперимента был достигнут. Это поистине фантастический результат. Ведь борфенилаланин, который мы вкалываем, накапливается не только в опухоли, но и в печени и почках. При этом мышь – животное маленькое, поэтому, в отличие от человека, ее облучают целиком, из-за чего больше страдают здоровые ткани. Нужно еще учитывать, что на поздних стадиях развития опухоли в результате гибели раковых клеток может возникнуть масштабный некроз. Но даже при всех этих отягчающих обстоятельствах мы вылечили животных!
Пора внедрять!
БНЗТ на сегодня является новой для нашей страны, перспективной и, главное, проверенной методикой лечения раковых опухолей, так что со стороны государства и крупного бизнеса будет большой глупостью ее не поддержать. Та же Япония сейчас развивает пять вполне успешных проектов по БНЗТ на разных типах ускорителей в рамках сотрудничества государства и таких индустриальных гигантов, как Mitsubishi и Toshiba. Фактически, все это государственные вложения.

Самый короткий и простой для нас путь обеспечить финансирование строительства терапевтической установки БНЗТ – получить грант в рамках прорывного научного проекта на базе программы САЕ (стратегических академических единиц) Новосибирского государственного университета. Согласно проекту, в течение очень небольшого срока (государственное софинансирование рассчитано на 4 года) мы должны будем построить установку непосредственно для медицинского использования и пролечить не менее 10 пациентов. Это достаточно амбициозный план, который будет непросто выполнить, но нам не привыкать ставить перед собой цели, на первый взгляд кажущиеся невыполнимыми. Фактически подготовительная работа по реализации этого проекта уже началась.
В рамках проекта также планируется разработка улучшенного препарата адресной доставки бора – российского аналога борфенилаланина. Этим будет заниматься Институт органической химии СО РАН (Новосибирск), у которого есть свое опытное производство, совместно с Институтом элементоорганических соединений им. А. Н. Несмеянова РАН (Москва).
В беседах с нашими японскими коллегами родилась абсолютно новая идея дозиметрии для БНЗТ, на которую уже тоже получен патент. А однажды на лыжне мы разговорились с коллегой по институту Андреем Соколовым, в результате чего появился патент на генерацию монохроматических нейтронов для поиска темной материи. Сейчас вместе с Александром Шмаковым из Института катализа СО РАН и Сергеем Громиловым из Института неорганической химии СО РАН обсуждаем возможность приспособить нашу машину для нейтронной дифрактометрии, которая позволит определять структуру легких элементов вещества.
Все эти идеи, которые мы патентуем, по большому счету очень тривиальны, но почему-то они приходят в голову лишь тому, кто не обогащен грузом опыта, т. е. дилетанту. Как я уже упоминал, именно так была создана наша установка, и я, будучи изначально специалистом по плазме, а не ускорительщиком, честно говоря, до сих пор удивляюсь, как у нас все это получилось.
За последние пять лет мы из специалистов, потенциально привлекательных в области БНЗТ, превратились в реальных игроков на этом поле деятельности. Последний же год мы фактически работали на потребителя. И это очень важно, ведь физики часто думают: вот, мы сделали что-то очень хорошее, почему же пользователи не бегут и не отхватывают это с руками? С таким подходом ничего не получится: надо самому прикладывать много усилий, чтобы работа по внедрению в практику твоих идей и разработок принесла конкретные плоды.

На сегодня в мире с помощью БНЗТ пролечено около двух тыс. человек, для чего использовались уже существующие исследовательские и учебные ядерные реакторы, многие из которых уже не работают. Важность же подобной терапии не нужно объяснять: с ее помощью можно лечить такие практически неизлечимые на сегодня опухоли, как глиобластомы и раковые метастазы. Но до сих пор эта методика остается, по сути, экспериментальной, и специалисты должны приложить еще немало усилий по разработке адекватных стратегий и методик лечения.
Наша установка на сегодня является единственным в мире работающим компактным источником пучка нейтронов, пригодного для БНЗТ. Мы готовы создать действующий медицинский ускоритель, на котором можно будет лечить пациентов уже в ближайшие годы. Но оба наших гранта – от Минобрнауки России на усовершенствование установки и от РНФ для проведения биологических исследований – заканчиваются в декабре этого года. Что будет завтра?
Neutron Capture Therapy: Principles and Applications. Eds.: W. Sauerwein, A. Wittig, R. Moss, Y. Nakagawa. Springer, 2012. 533 p.
Таскаев С. Ю., Каныгин В. В. Бор-нейтронозахватная терапия. Новосибирск: Изд-во СО РАН, 2016. 216 с.
С развитием науки клинические онкологи все больше узнают о процессах формирования злокачественных новообразований. Понимание клеточных, молекулярных и генных механизмов дает возможность разрабатывать новые средства борьбы с опухолями. Несмотря на то, что сражение идет с переменным успехом, врачам удается отвоевать больше жизней, чем раньше.
Классическая триада лечения онкологии (хирургия, лучевая и химиотерапия) пополняются новыми, направленными на опухоль и более щадящими для организма, методами. К традиционным способам терапии формируются обновленные подходы.
Лечение онкологии в зависимости от стадии заболевания

Для классификации опухолевого процесса используют различные показатели, такие как структурные и анатомические особенности, размеры и скорость роста, локализацию и риск метастазирования.
Всего выделяют пять стадий развития онкозаболеваний. В зависимости от того, на какой стадии выявлено заболевание и начато лечение, составляется план лечебных мероприятий, а также определяется прогноз.
Чем в более ранней стадии начато лечение онкологии, тем выше шансы на полное выздоровление и тем менее агрессивной и масштабной будет терапия.
0 стадия — опухоли любой локализации. Границы очага не выходят за границу эпителиального слоя клеток, из которых произошла опухоль. Такой рак при своевременном адекватном лечении можно полностью вылечить.
I стадия — рак распространяется в границах органа. Если такую опухоль вовремя выявить и удалить, то прогноз в целом благоприятный.
II стадия — практически все опухоли на этой стадии в границах органа, но с большим проникновением вглубь или больших размеров. Здесь уже прогноз зависит от вида опухоли и ее расположения.
III стадия — опухоль и дальше прогрессирует, дает метастазы в регионарные лимфоузлы, но отдаленных метастазов, как правило, еще нет. Это может дать надежду на продление жизни. Но общий прогноз зависит от целого ряда факторов: типа опухоли, ее анатомических особенностей, нарушений функции соседних органов, сопутствующих заболеваний и общего состояния пациента.
IV стадия — распространенная. Первичные очаги большого размера, часто прорастающие в соседние органы, нарушение кровоснабжения, поражение регионарных и отдаленных лимфоузлов, общая интоксикация. Для облегчения состояния проводится паллиативное и симптоматическое лечение.
Лечение рака с помощью оперативного вмешательства: от радикальных операций к органосохраняющим
Хирургические вмешательства по-прежнему остаются стандартом лечения рака с вполне удовлетворительными результатами. В этой области онкологи достигли большого мастерства.
Операции при лечении опухолевых заболеваний могут быть:
- Радикальными. Предусматривается полное удаление первичного новообразования и его метастазов. После такого вмешательства в организме не остается очагов опухоли, которые можно определить каким-либо диагностическим методом.
- Паллиативными. После такого хирургического лечения в организме могут оставаться опухолевые очаги. Основная задача — предотвратить тяжелые осложнения, связанные с ростом опухоли (кровотечения, сдавливания соседних органов и сосудов, резкое сужение просвета или уменьшение полости органа).
Последние достижения хирургической (в т.ч. роботизированной) техники позволяют расширить количество органосохраняющих операций, число вмешательств, которые выполняются в один этап, уменьшить послеоперационные осложнения и сократить реабилитационный период.
Кроме того, в настоящее время до 54,3% увеличилось число случаев лечения рака, когда хирургический способ использовался как самостоятельный. Особенно эффективен он при раке почки, меланоме кожи, раке щитовидной железы.
В комбинации с другими методами в РФ оперативное лечение опухолей проводится в 85% случаев. Это говорит о том, что хирургия лидирует в лечении злокачественных новообразований. Намного чаще стали использоваться эндоскопические, в том числе лапароскопические методы, которые меньше травмируют ткани, окружающие опухоль, и дают возможность сохранить орган. Конечно, специалисты, в первую очередь, оценивают индивидуальную клиническую ситуацию, стадию, распространенность и тип рака, состояние пациента. И только потом коллегиально (на онкоконсилиуме) принимают решение в пользу открытой операции или эндоскопического вмешательства.
Также доказано, что результат лечения при меланоме кожи мало зависит от того, насколько широко иссекли ткани в районе опухоли, то есть достаточно отступить всего на 1–2 см (а не до 15 см, как было принято ранее).
Изменилось отношение и к лечению рака молочной железы — от радикальной мастэктомии (полного удаления вместе с группой лимфоузлов) до органосохраняющей операции и одномоментной пластики.
Используются инструменты (например, электронож), которые помогают более строго следовать таким принципам хирургического лечения, как
- Абластика — резекция (иссечение) пораженного органа в пределах здоровых тканей для уменьшения риска распространений опухолевых клеток по кровеносным сосудам.
- Антибластика — уничтожение раковых клеток, которые остались в зоне оперативного вмешательства с помощью промывания специальными растворами или облучения.
Хотите мы вам перезвоним?
Лучевая терапия в лечении онкологии
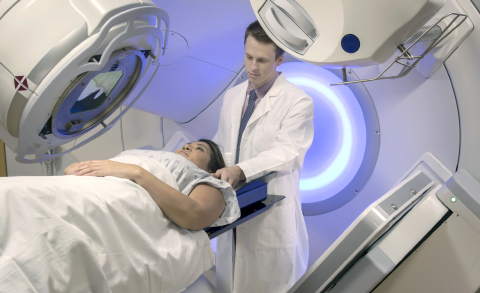
Лучевая терапия в составе комплексной или комбинированной применяется сейчас в 60–70% случаев онкозаболеваний и приводит к выздоровлению у половины пациентов. Методы постоянно совершенствуются, чтобы при минимальном воздействии на здоровые ткани достичь наибольшего результата по удалению опухоли.
Для лучевой терапии используют ионизирующее излучение. Оно может отличаться по механизму биологического действия, проникающей способности и распределению энергии. В клинической практике чаще других применяют фотонное излучение, к которому относится:
- Гамма-излучение — излучение от радионуклидов, проникающее на глубину до 1 м и больше.
- Рентгеновское (с помощью рентген-аппаратов) — излучение вследствие перехода электронов в ядре с орбиты на орбиту.
- Тормозное излучение — получают с помощью протонных ускорителей.
Также используется корпускулярное излучение (от ядерных частиц). Виды: бета-излучение, позитронное излучение, альфа-частицы.
Основные источники ионизирующего излучения — это естественные и искусственные радионуклиды (радиоактивные вещества) и специальные аппараты — ускорители, генераторы нейтронов, рентгеновские аппараты.
Возможно дистанционное, контактное и внутреннее облучение, при котором радионуклиды вводятся внутривенно или через рот.
При дистанционной лучевой терапии источник излучения (в основном фотонного) удален от опухоли на 80–100 см. При контактном облучении, которое называется брахитерапия, источник находится на близком расстоянии, до 30 см, от опухолевого очага или в непосредственном контакте. Это более щадящий вид терапии. Основные виды контактного облучения: внутриполостное, внутритканевое, аппликационное (на поверхности тела).
Под действием ионизирующего излучения образуются свободные радикалы, которые повреждают клетки, также нарушается воспроизведение ДНК и деление клеток, что приводит к уничтожению опухоли. При этом есть мгновенное действие и отсроченное.
В сочетании с хирургическими методами лечения рака применяется:
- предоперационная — для понижения жизнеспособности клеток опухоли перед операцией;
- интраоперационная — облучение зоны опухоли во время операции для предупреждения развития рецидивов и метастазов;
- послеоперационная лучевая терапия — для предупреждения метастазов после нерадикального удаления опухоли.
Для того чтобы общая реакция организма на лучевую терапию была менее выраженной, современные методики дополняются способами визуализации опухоли, в том числе 3D, а также фиксирующими приспособлениями. Это помогает наиболее точно воздействовать на опухоль.
Лучевая терапия хорошо сочетается и с лекарственными методами лечения онкологии.
Химиотерапия
Химиотерапевтические методы лечения рака (и монотерапия, и комбинированное применение средств) связаны с действием лекарственных препаратов на опухолевые клетки в определенных фазах их развития.
В зависимости от места химиотерапии в лечении опухолевого заболевания выделяют:
- Адъювантную химиотерапию — дополнение к основному (хирургическому или лучевому) методу лечения. Назначают при высоком риске развития метастазов или рецидива — повторной опухоли, когда первичный очаг уже удален.
- Неадъювантную химиотерапию, которая проводится перед удалением опухоли хирургическим или другим путем. Цель — уменьшить объем образования, чтобы выполнить менее травматичную операцию, возможно, органосохраняющую.
- Первичную химиотерапию при неоперабельном раке или развитии множественных метастазов. Задача — продлить жизнь пациента с сохранением ее качества. Используются наименее токсичные препараты, удобные для введения.
При полихимиотерапии подбираются препараты с различным механизмом действия.
Возможна цитостатическая терапия, когда препарат замедляет развитие опухоли и цитотоксическая, если раковые клетки уничтожаются.
В зависимости от того, на каком этапе и каким образом химиопрепарат действует на клетку, его относят к той или иной группе:
Гормонотерапия при лечении онкологии
Одним из направлений химиотерапии является терапия гормонами, которую еще называют эндокринотерапия. Дело в том, что отдельные опухоли растут из-за гормональной стимуляции, поэтому удалив источник гормонов, можно остановить развитие злокачественного процесса. При этом такого воздействия можно добиться хирургическим путем (удаление органа, в котором синтезируются гормоны), с помощью лучевой терапии и введением лекарственных препаратов (гормонов и антигормонов).
Главная цель введения гормонов — это блокировка патологических сигналов.
- Антиэстрогены — блокируют эстрогеновые рецепторы. Используют в лечении гормонзависимого рака молочной железы.
- Ингибиторы ароматазы — снижают количество эстрогенов у пациенток в менопаузе.
- Кортикостероиды — разрушают клетки лимфоидных опухолей, а также назначаются для уменьшения токсического действия прочих цитостатиков на печень и другие органы (при тошноте и рвоте).
- Андрогены — подавляют деление раковых клеток при метастазах рака молочной железы.
- Антиандрогены — не дают андрогенам связываться с рецепторами тканей при раке предстательной железы.
- Агонисты LH-RH — угнетают синтез тестостерона и эстрогена.
- Прогестины — при раке эндометрия блокируют развитие опухолевых клеток.
Иммунотерапия
Один из самых прогрессивных методов лечения онкозаболеваний, который позволяет действовать на раковые клетки высокоспецифическими механизмами. Применяется в комбинации с другими способами терапии.
Иммунотерапия дает возможность организму сформировать иммунный ответ на опухоль, проявить цитотоксическое действие, а также повысить иммунную защиту.
Применяются следующие группы препаратов:
- Иммуномодуляторы (пассивная иммунотерапия): цитокины (интерфероны, интерлейкины), иммуноглобулины, вещества микробного происхождения — для коррекции иммунитета.
- Моноклональные антитела (активная иммунотерапия) — для воздействия на поверхностные антигены опухолевых клеток, которое приводит к гибели клеток.
Таргетная терапия
Это новый метод лечения онкологии и метастазов. Он призван действовать только на определенные мишени. Это могут быть рецепторы гормонов, гены, ферменты. Также происходит повреждение структур, которые питают опухоль, или выключение внутриклеточных обменных процессов за счет нарушений в цепочке биохимических реакций.
В настоящее время применяется для лечения устойчивых к терапии видов рака, может значительно повысить эффект от лечения в сочетании с химиотерапией. С препаратами для таргетной терапии возможно лечение даже запущенных стадий.
Доказана эффективность для лечения рака молочной железы, рака легкого, меланомы и других.
Под контролем онкологов проходит не только терапия опухоли, но и лечение сопутствующих заболеваний, профилактика и уменьшение побочных эффектов, а также полный курс реабилитационных мероприятий.
Виды рака могут классифицироваться в зависимости от местонахождения опухоли, её размеров, причины возникновения и др. На развитие опухолевого процесса в организме могут влиять различные факторы, от неправильного питания до генетической наследственности. Все виды рака требуют определенной схемы лечения, что позволяет сохранить нормальное течение жизни.
Виды рака характеризуются отличием клеточного строения опухоли, динамикой развития, а также уровнем выживания во время лечения.
Онкологические заболевания могут возникать во всех системах и органах организма. Классификация видов онкологических заболеваний происходит в зависимости от места локализации опухоли и множества других факторов. Так процесс развития злокачественной опухоли может происходить в желудочно-кишечном тракте, мочеполовой системе, верхних дыхательных путях и грудной клетке, коже, скелете и мягких тканях, кровеносной и лимфатической системе, головном и спинном мозге. Рак представляет собой активное прогрессирующее патологическое разрастание атипичных клеток, заменяющих нормальные ткани.
Многие виды рака легко диагностируются на ранних стадиях, что позволяет победить онкологическое заболевание результативно и эффективно. В латентный период, когда симптомы и признаки рака еще не проявились у больного, но размножение раковых клеток уже происходит, выявляется форма и вид онкологического заболевания.
Все виды рака проявляются симптоматикой в зависимости от местонахождения опухоли и ее стадии. Болевые синдромы проявляется в месте роста онкологии, а также ухудшается общее состояние организма, незначительно повышается температура, снижается аппетит. Важным условием в эффективном лечении является ее выявление на ранних стадиях, когда раковые клетки еще не попали в кровь и лимфу.

Стадии развития онкологического заболевания
В зависимости от прогрессирования заболевания происходит деление онкологии на стадии. При первой стадии опухоль достигает небольших размеров и находится в пределах органа, вторая стадия отличается от первой увеличением опухоли в размерах, третья стадия - прорастание раковых клеток в ближайшие ткани и лимфу, четвертая стадия представляет собой активное прогрессирующие развитие опухоли и метастазирование в отдаленные органы.
Все виды рака классифицируются по единой системе измерения патологического процесса в организме, которая помогает сравнивать значения центрам по борьбе с раком по всему миру. Буквенное и цифровое обозначение стадий онкологического заболевания раскрывается международной системой клинической классификацией рака, и имеет обозначение вне зависимости от вида рака. Для определения значений существует три критерия - величина раковой опухоли, метастазирование в лимфу и наличие метастазов в других органах.
Что же такое метастазы?
Метастазирование - это перенос опухолевых клеток в организме, которые создают новые очаги в других органах. Виды рака не влияют на возможность появления множественных опухолей. Метастазы развиваются в три основных этапа:
- инвазия - перенос патогенных клеток в сосуды;
- течение этих клеток током крови, лимфы и полостных жидкостей,
- имплантация - приживание раковых клеток и образование вторичного опухолевого очага.
Диагностика заболевания методом компьютерной томографии помогает обнаружить вид онкологического заболевания и образование метастазов в организме и подобрать эффективное лечение для улучшения картины заболевания.
Виды раковых заболеваний
Виды рака определяются в зависимости от множества факторов. Онкологическое заболевание классифицируется по нескольким критериям:
- по месту локализации опухоли;
- по типу ткани, в которой развиваются раковые клетки,
- по строению раковых клеток,
- по принципу деления,
- по сложности развития.
Виды рака разделяются по месту нахождения опухоли. То есть органе или системе, где он развивается.
Также виды онкологических заболеваний разделяются по типу ткани. Раковые клетки активно размножаются в мышечной, эпителиальной, костной, сосудистой, нервной и соединительной ткани. Развитие злокачественного образования в нескольких видах тканей называется сложным.
По строению клеток опухоли различают:
- карциному - рак в эпителии,
- лейкоз - развитие ракового процесса в кроветворной системе,
- меланому - рак кожи,
- саркому - рак в соединительной ткани,
- лимфому - рак в лимфатической системе,
- глиому - рак головного мозга и др.
По принципу деления раковых клеток разделяют виды клинического, морфологического и гистологического рака.
Аденокарцинома и плоскоклеточный рак - виды рака, которые встречаются чаще всего. Они возникают в щитовидной, поджелудочной и молочной железе, на шейке матки и легких.
Факторы риска
Все виды рака возникают в организме под действием определенных факторов. Развитие онкологического заболевания в основном зависит от образа жизни. Неправильное питание некачественными продуктами с большим содержанием канцерогенов вызывают развитие злокачественных опухолей. Чрезмерное употребление алкоголя и курение также является фактором возникновения рака, а также работа на вредных производствах и предприятиях, где происходит накопление организмом ядовитых веществ.
Также на наличие в организме раковых клеток влияет наследственность. Патологические процессы в клетках могут происходить после их мутации во внутриутробном периоде и во время развития организма. Так некоторые виды рака развиваются у новорожденных детей вместе с ростом тканей организма.
Плохая экология и высокий уровень радиации также являются причинами возникновения рака.
Диагностика онкологических заболеваний
Раннее диагностирование заболевания позволяет подобрать эффективное лечение и повысить шансы на выздоровление и сохранение нормального течения жизни больного. Успешный метод лечения возможен только после обнаружения раковой опухоли и определения вида онкологического заболевания.
Диагностика лечения начинается с консультации специалиста и оценки симптомов заболевания, после чего назначается ряд исследований. Виды рака определяются после ультразвукового исследования и взятия биопсии. Полноценный подход к диагностике заболевания с учетом возраста, сопутствующих недугов и факторов риска помогает исключить ложные симптомы.
Методы лечения онкологических заболеваний
В зависимости от вида онкологического заболевания подбираются методы лечения. Наиболее эффективным является комбинированный или комплексный подход к избавлению от недуга.
К основному и радикальному методу лечения относится - хирургическое вмешательство. Некоторые виды рака позволяют удалить опухоль внутри органа или вместе с ним. Но не всегда операция это выход и тогда подбираются другие методы лечения.
От вида онкологического заболевания назначается дополнительное лечение, такое как, лучевая терапия и прием химиопрепаратов.
Успешный исход лечения, может быть достигнут, если пациент настроен на лечение и соблюдение врачебных рекомендаций, профилактическим мерам и наблюдению у врача-онколога. Ранняя диагностика онкологического заболевания позволяет избежать усугубления состояния, восстановлению нормального течения жизни, а также избежанию возможности рецидива.
Профилактика онкологических заболеваний
Профилактика раковых заболеваний - это, в первую очередь, ведение здорового образа жизни. Отказ от употребления алкоголя, табакокурения, вредной и жирной пищи, активный образ жизни и спокойное нервное состояние.
Виды рака должны контролироваться на протяжении всей жизни с использованием скрининговых исследований. Из-за скрытого течения онкологического заболевания симптомы могут проявиться уже в запущенной стадии, когда лечение может быть малоэффективно. Поэтому профилактические обследования и внимательный подход к опасным симптомам помогут сохранить здоровье на долгие годы, а если болезнь все-таки наступила, особенно, если учтены все факторы риска, то это позволит подобрать правильный метод лечения для любого вида онкологического заболевания.
Читайте также:

