Круговорот водорода в природе реферат
Обновлено: 05.07.2024
Водород — самый легкий химический элемент, занимающий в периодической таблице Менделеева начальное место.
Его атомный номер — единица. На одноатомную форму водорода приходится около 75% барионной массы, она считается самым распространенным веществом во всей Вселенной. Водородная плазма — основное вещество звезд, за исключением компактных.
У водорода три изотопа:
- протий (1H);
- дейтерий (2H);
- тритий (3H).
К общим характеристикам относятся следующие свойства: не имеет цвета запаха, вкуса. Двухатомная форма ( Н 2 ) нетоксична, однако в соединении с воздухом (или О 2 ) пожароопасна и склонна к взрывам. Взрывоопасность также проявляется в присутствии прочих газов-окислителей, например, фтора, хлора.
На Земле водород присутствует в составе молекулярных соединений, например, вода. Его роль в кислотно-основных реакциях трудно переоценить.
Нахождение в природе, изучение его свойств
Звездная температура позволяет существовать водороду в виде плазмы. Это примерно 6000оС. Однако пространство между звездами заполнено отдельными молекулами, атомами и ионами, которые зачастую образовывают молекулярные скопления различных размеров и форм — облака. Плотность вещества при этом не является постоянной величиной, как и его температура.
В коре Земли водород считается десятым по распространенности элементом. Его массовая доля равна 1%. В то же время по числу атомов он достигает 17%. Это второе место после кислорода, доля которого равна 52%. Отсюда и значительная роль водорода в природе, особенно в химических превращениях.
Водород, в отличие от кислорода, не может существовать в свободном состоянии, только в связанном. Исключение составляет атмосфера, в сухом остатке которой 0,00005% простого вещества — водорода.
Все органические вещества включают в свой состав водород. Велика его доля в живых клетках (по количеству атомов его удельный вес достигает 63%).
В составе воды водород имеет большое значение в протекании геохимических процессов. Так, вулканические газы вызывают истечение определенных количестве водорода вдоль разломов (причина — рифтогенез). По этой же причине часто обнаруживают водород в районе угольных месторождений.
Натуральные минералы могут содержать Н 2 в виде ионов аммония, гидроксил-ионов и воды.
Причина появления молекул Н 2 в атмосфере — разложение формальдегида — участника окисления метана и прочих органических соединений. Кроме того, причина его образования — неполное сгорание топлива и биомассы, фиксация азота некоторыми микроорганизмами, содержащимися в воздухе.
Молекулы водорода легкие, поэтому имеют высокую тепловую скорость. При попадании в верхние слои атмосферы такие молекулы часто улетают в космос, при этом их потери могут достигать 3 кг каждую секунду.
Химические и физические свойства
Начиная говорить о химических свойствах водорода, нужно отметить чрезвычайную прочность его двухатомной молекулы. Для того, чтобы она распалась и атомы могли провзаимодействовать с другими участниками химической реакции, необходима энергия:
1 2 H 2 → 2 H - 432 к Д Ж
Обычные температурные условия обеспечивают протекание реакций только с металлами высокой активности, к примеру, с кальцием:
1 2 C a + H 2 → C a H 2
Исключение составляет реакция с фтором, продуктом которой является фтороводород:
1 2 F 2 + H 2 → 2 H F
Если имеется возможность повышения температуры (либо при другом воздействии, к примеру, освещении), водород может вступать в реакцию с большинством металлов и неметаллов:
1 2 O 2 + 2 H 2 → 2 H 2 O
В реакциях с галогенами образуются галогеноводороды:
1 2 H 2 + F 2 → 2 H F (в темноте происходит взрыв)
1 2 H 2 + C l 2 → 2 H C l (на свету происходит взрыв)
В реакции с оксидами водород проявляет восстановительные свойства:
1 2 C u O + H 2 → H 2 O + C u
Высокая температура делает возможной реакцию с сажей:
1 2 C + 2 H 2 → C H 4
Когда активные металлы соединяются с водородом, образуются гидриды, например гидрид натрия (NaH), гидрид кальция ( C a H 2 ), гидрид магния ( M g H 2 ). Эти солеобразные твердые, легко гидролизирующиеся вещества:
1 2 C a H 2 + 2 H 2 → C a ( O H ) 2 + 2 H 2
Оксиды металлов, реагируя с водородом, восстанавливаются с выделением воды:
1 2 F e 2 O 3 + 3 H 2 → 2 F e + 3 H 2 O
Благодаря свойствам водорода, он нашел применение для восстановления органических веществ. Протекают реакции с участием катализатора, а также при высоких параметрах давления и температуры. К примеру, насыщенные алканы образуются в результате гидрирования ненасыщенных алкенов и алкинов.
Физические свойства водорода:
- В 14,5 раз легче воздуха. Поэтому молекулы движутся быстрее других молекул газов, передавая тепло.
- Имеет высокую теплопроводность (в 7 раз выше, чем у воздуха).
- Двухатомная молекула.
- Плотность — 0,08987 г/л, температура кипения-252,76оС, удельная теплота сгорания — 120,9*106Дж/кг, растворимость в воде — 18,8 мл/л
Хорошо растворяется в металлах, поэтому способен диффундировать в них. В серебре не растворим.
Получение водорода, как добыть вытеснением из воды
Потребление в мире водорода составляет порядка 75 млн т. Основная масса приходится на нефтепереработку и производство аммиака. Получение водорода для таких промышленных нужд происходит в основном из природного газа (его расход составляет 205 млрд м3). Оставшуюся часть берут из угля. Примерно 100 тыс т вырабатывают с помощью реакции электролиза.
Получение водорода сопровождается поступлением в атмосферу 830 млн т углекислого газа. Стоимость получения водорода из газа составляет от полутора до трех долларов за каждый кг.
Получение водорода методом электролиза в химии выглядит так:
1 2 2 N a C l + 2 H 2 O → 2 N a O H + C l 2 + H 2
Метод конверсии метана при температуре 1000оС с водяными парами:
1 2 C H 4 + H 2 O ↔ C O + 3 H 2
Следующий способ получения — пропускание водяных паров над горящим коксом (температура не менее 1000оС):
1 2 H 2 O + С ↔ С O + H 2
Свободный водород выделяется в результате реакции катализа окислением кислородом:
1 2 2 C H 4 + O 2 ↔ 2 C O + 4 H 2
В промышленности H2 часто получают путем электролиза водных растворов активных металлов:
1 2 2 H 2 O → 4 e - 2 H 2 ↑ + O 2 ↑
а также путем крекинга и риформинга углеводородов при переработке нефти.
Существуют способы получения Н2 лабораторными способами:
- Металл + разбавленная кислота: 1 2 Z n + H 2 S O 4 → Z n S O 4 + H 2 ↑
- Реакция кальция с водой: 1 2 C a + 2 H 2 O → C a ( O H ) 2 + H 2 ↑
- Гидролиз гидридов металлов: 1 2 N a H + H 2 O → N a O H + H 2 ↑
- Взаимодействие щелочи с цинком (алюминием): 1 2 2 A l + 2 N a O H + 6 H 2 O → 2 N a ( A l ( O H ) 4 ) + 3 H 2
- В результате электролиза водных растворов щелочей либо кислот: 1 2 2 H 3 O + + 2 e - → 2 H 2 O + H 2 ↑
В промышленности используется очистка водорода из сырья, которое содержит углерод (в частности — водородсодержащий газ ВСГ). Методы следующие:
- ВСГ придают температуру конденсации метана и этана -158оС и давление 4МПа. При концентрации в сырье 40% процент очищенного водорода доходит до 93-94%. Такой метод называется низкотемпературной конденсацией.
- Адсорбционное выделение на цеолитах.
- Абсорбционное выделение жидкими растворителями.
- Мембранное концентрирование.
- Селективное поглощение металлами.
Получение и собирание водорода в домашних условиях, техника безопасности
Чтобы образовавшийся водород собрать, можно закрыть банку крышкой, сделав в ней отверстие, в которое вставить трубку. Второй конец трубки закрепить в воздушном шарике.
Поскольку водород является взрывоопасным веществом, делать это нужно крайне осторожно, начиная от момента возможного вытеснения крышки до конца процесса. Попадание водорода в воду приведет к образованию вещества, способного вызвать обморожение.
Особенности применения водорода
Водород используется во многих производственных сферах, что отражено в таблице:
| Применение | Доля |
| Производство аммиака | 54 % |
| Нефтепереработка и химическая промышленность | 35 % |
| Производство электроники | 6 % |
| Металлургия и стекольная промышленность | 3 % |
| Пищевая промышленность | 2 % |
В химической промышленности активный водород идет на производство аммиака (50%), метанола (8%). В нефтеперерабатывающей — для гидрокрекинга и гидроочистки. На эти цели расходуется около 37% всего водорода, что производится.
Для химических лабораторий водород — газ-носитель для газовой хроматографии, а для метеорологии — наполнитель оболочек метеозондов.
Водород — ценное ракетное топливо, однако, ввиду незначительного диапазона температур, используется смесь жидкой и твердой фаз.
В электроэнергетике водород применяют для охлаждения электрогенераторов. Его высокая теплопроводность позволяет использовать газ для заполнения сфер гирокомпасов и колб LED-лампочек.

Водород (Н) очень легкий химический элемент, с содержанием в Земной коре 0,9% по массе, а в воде 11,19%.
Характеристика водорода
По легкости он первый среди газов. При нормальных условиях безвкусен, бесцветен, и абсолютно без запаха. При попадании в термосферу улетает в космос из-за малого веса.
Во всей вселенной это самый многочисленный химический элемент (75% от всей массы веществ). Настолько, что многие звезды в космическом пространстве состоят полностью из него. Например, Солнце. Его основной компонент - водород. А тепло и свет это итог выделения энергии при слиянии ядер материала. Так же в космосе есть целые облака из его молекул различной величины, плотности и температуры.
Физические свойства

Высокая температура и давление значительно меняют его качества, но при обычных условиях он:
Обладает высокой теплопроводностью, если сравнивать с другими газами,
Нетоксичен и плохо растворим в воде,
С плотностью 0,0899 г/л при 0°С и 1 атм.,
Превращается в жидкость при температуре -252,8°С
Становится твердым при -259,1°С.,
Удельная теплота сгорания 120,9.106 Дж/кг.
Для превращения в жидкость или твердое состояние требуются высокое давление и очень низкие температуры. В сжиженном состоянии он текуч и легок.
Химические свойства
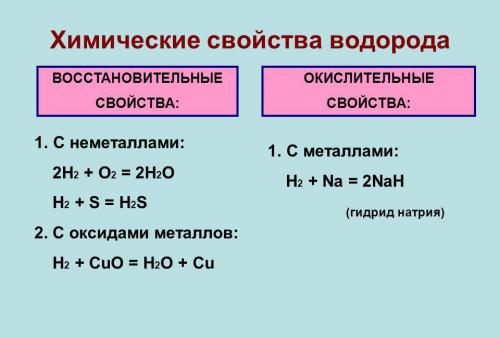
Под давлением и при охлаждении (-252,87 гр. С) водород обретает жидкое состояние, которое по весу легче любого аналога. В нем он занимает меньше места, чем в газообразном виде.
Он типичный неметалл. В лабораториях его получают путем взаимодействия металлов (например, цинка или железа) с разбавленными кислотами. При обычных условиях малоактивен и вступает в реакцию только с активными неметаллами. Водород может отделять кислород из оксидов, и восстанавливать металлы из соединений. Он и его смеси образуют водородную связь с некоторыми элементами.
Газ хорошо растворяется в этаноле и во многих металлах, особенно в палладии. Серебро его не растворяет. Водород может окисляться во время сжигания в кислороде или на воздухе, и при взаимодействии с галогенами.
Во время соединения с кислородом, образуется вода. Если температура при этом обычная, то реакция идет медленно, если выше 550°С - со взрывом (превращается в гремучий газ).
Нахождение водорода в природе
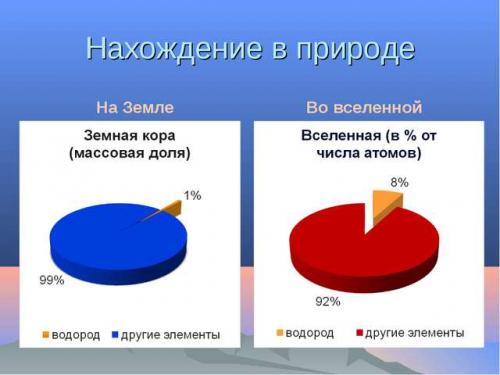
Хотя водорода очень много на нашей планете, но в чистом виде его найти нелегко. Немного можно обнаружить при извержении вулканов, во время добычи нефти и в месте разложения органических веществ.
Больше половины всего количества находится в составе с водой. Так же он входит в структуру нефти, различной глины, горючих газов, животных и растений (присутствие в каждой живой клетке 50% по числу атомов).
Круговорот водорода в природе
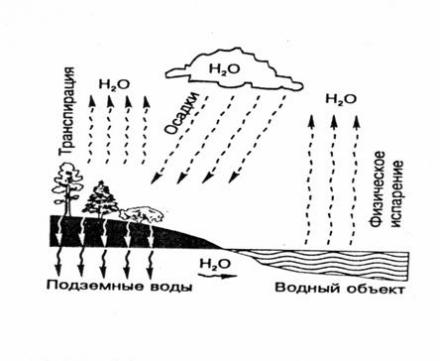
Каждый год в водоемах и почве разлагается колоссальное количество (миллиарды тонн) остатков растений и это разложение выплескивает в атмосферу огромную массу водорода. Так же он выделяется при любом брожении, вызываемом бактериями, сжигании и наравне с кислородом участвует в круговороте воды.
Области применения водорода
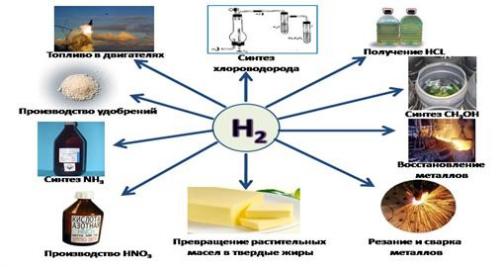
Элемент активно используется человечеством в своей деятельности, поэтому мы научились получать его в промышленных масштабах для:
Как горючее для ракет (жидкий водород)-
Электроэнергетики для охлаждения электрических генераторов-
Сварки и резки металлов.
Масса водорода используется при производстве синтетического бензина (для улучшения качества топлива низкого качества), аммиака, хлороводорода, спиртов, и других материалов. Атомная энергетика активно использует его изотопы.
Соприкосновение жидкого водорода и кожных покровов грозит сильным и болезненным обморожением.
Космические агентства и частные компании уже разрабатывают планы по отправке людей на Марс в ближайшие несколько лет, что в конечном итоге приведет к его колонизации. И с увеличением числа открытых землеподобных планет вокруг близлежащих звезд дальние космические путешествия становятся все более актуальными.
Однако людям нелегко выжить в космосе в течение длительного периода времени. Одной из основных проблем космического полета на большие расстояния является транспортировка достаточного количества кислорода для дыхания космонавтов и достаточного количества топлива для работы сложной электроники. К сожалению, в космосе практически нет кислорода, поэтому запасать его нужно на Земле.
Но новое исследование, опубликованное в Nature Communications , показывает, что можно производить водород (для топлива) и кислород (для дыхания) из воды, используя только полупроводниковый материал, солнечный (или звездный) свет и невесомость, что делает далекие путешествия более реальными.
Использование неограниченного ресурса Солнца для питания нашей повседневной жизни - одна из самых глобальных задач на Земле. Поскольку мы медленно отходим от нефти к возобновляемым источникам энергии, исследователи заинтересованы в возможности использования водорода в качестве топлива. Лучшим способом сделать это было бы разделение воды (H2O) на ее составляющие: водород и кислород. Это возможно с использованием процесса, известного как электролиз, который состоит в пропускании тока через воду, содержащую некоторое количество растворимого электролита (например, соли - прим. перев.). В результате вода распадается на атомы кислорода и водорода, которые выделяются каждый на своем электроде.

Электролиз воды.
Хотя этот метод технически возможен и известен уже не одно столетие, он все еще не стал легкодоступным на Земле, поскольку нам нужно больше инфраструктуры, связанной с водородом - например, заправочных станций водорода.
Водород и кислород, полученные таким образом из воды, могут также использоваться в качестве топлива на космическом корабле. Запуск ракеты с водой на самом деле был бы намного безопаснее, чем с дополнительным ракетным топливом и кислородом на борту, так как при аварии их смесь может быть взрывоопасной. Теперь же в космосе специальная технология сможет разделить воду на водород и кислород, которые, в свою очередь, могут быть использованы для поддержания дыхания и работоспособности электроники (например, с помощью топливных элементов).
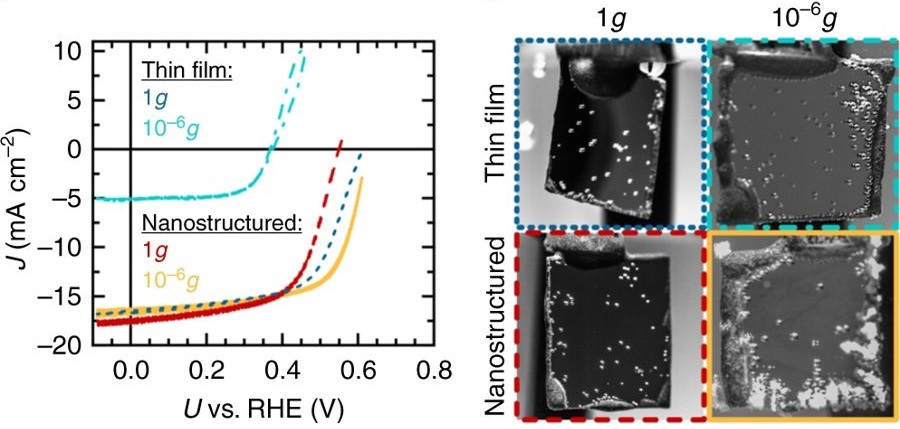
Процесс фотокатализа в земных условиях и при микрогравитации (в миллион раз меньше, чем на Земле). Как видно, во втором случае количество появляющихся пузырьков газа больше.
Процесс с использованием фотокатализаторов является наилучшим вариантом для космических путешествий, поскольку оборудование весит намного меньше, чем необходимое для электролиза. В теории, работать с ним в космосе также проще. Отчасти это объясняется тем, что интенсивность солнечного света вне атмосферы Земли существенно выше, так как в последней достаточно большая часть света поглощается или отражается по пути к поверхности.
В новом исследовании ученые сбросили полностью рабочую экспериментальную установку для фотокатализа с башни высотой в 120 метров, создав условия, называющиеся микрогравитацией. По мере того, как объекты падают на Землю в свободном падении, эффект гравитации уменьшается (но сама она никуда не исчезает, поэтому это и называют микрогравитацей, а не отсутствием гравитации - прим. перев.), поскольку нет сил, которые компенсируют притяжение Земли - таким образом, на время падения в установке создаются условия как на МКС.
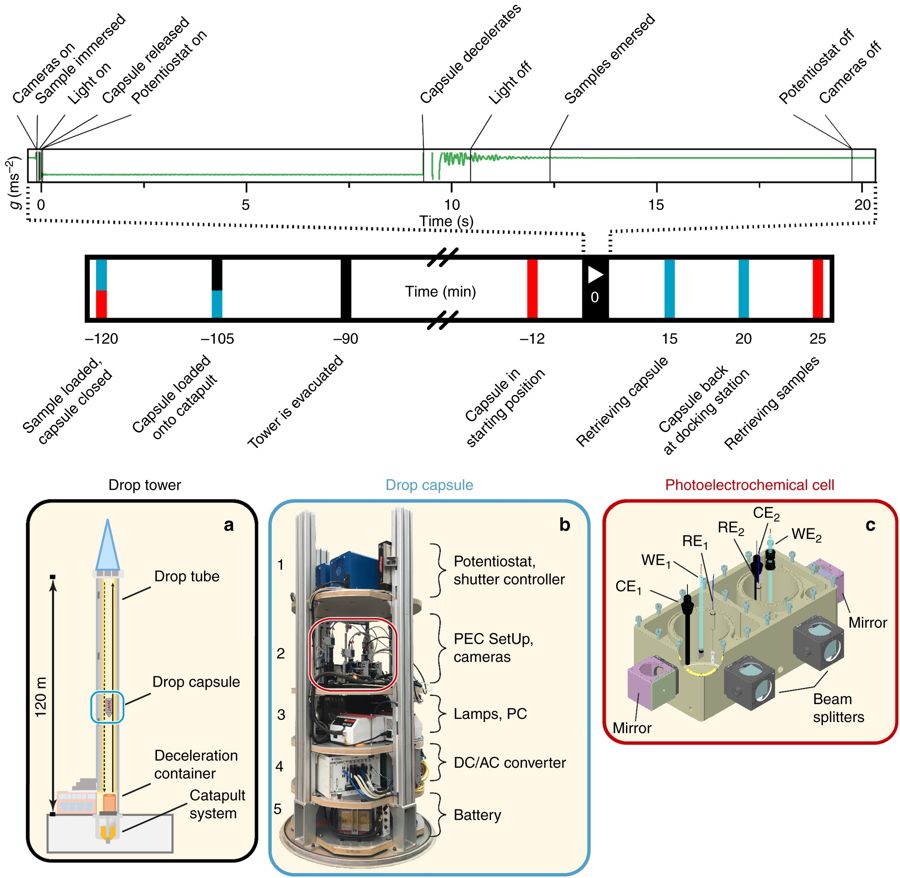
Экспериментальная установка и процесс эксперимента.
Исследователям удалось показать, что в таких условиях действительно возможно раcщепить воду. Однако, поскольку при этом процессе получается газ, то в воде образуются пузырьки. Важной задачей является избавление от пузырьков материала катализатора, поскольку они препятствуют процессу создания газа. На Земле гравитация заставляет пузырьки всплывать на поверхность (вода около поверхности плотнее пузырьков, что позволяет им плавать на поверхности), освобождая пространство у катализатора для образования следующих пузырьков.
При невесомости это невозможно, и пузырьки газа остаются на катализаторе или около него. Тем не менее, ученые скорректировали форму катализатора в наноразмерных масштабах, создав пирамидальные зоны, где пузырек может легко оторваться от вершины пирамиды и попасть в воду, не препятствуя процессу образования новых пузырей.
Но остается одна проблема. В отсутствие силы тяжести пузырьки останутся в жидкости, даже несмотря на то, что они вынуждены были покинуть катализатор. Гравитация позволяет газу легко выходить из жидкости, что имеет решающее значение для использования чистого водорода и кислорода. Без гравитации никакие пузырьки газа не плавают на поверхности и не отделяются от жидкости - вместо этого образуется аналог пены.
Это резко снижает эффективность процесса, блокируя катализаторы или электроды. Инженерные решения вокруг этой проблемы будут ключевыми для успешной реализации технологии в космосе - одно из возможных решений заключается в вращении установки: таким образом центробежные силы создадут искусственную гравитацию. Но, тем не менее, благодаря этому новому исследованию мы стали на шаг ближе к длительному космическому полету людей.
Спиральные галактики, как наш Млечный Путь, как правило, имеют довольно спокойный, но устойчивый темп звездообразования. Другие галактики, такие как NGC 6946, которая находится примерно в 22 млн. световых лет от Земли на границе созвездий Цефея и Лебедя, гораздо более активны в этом плане. Это поднимает вопрос о том, что является питательной средой для устойчивого формирования звезд в этой и аналогичных ей спиральных галактиках.
Предыдущие исследования ближайшего галактического пространства вокруг NGC 6946 с телескопа WSRT в Нидерландах выявили протянутое гало водорода. Однако, холодный поток мог быть сформирован водородом совсем из другого источника — газом из межгалактического пространства, который никогда не нагревался до высоких температур процессом рождения звезд.
Используя Green Bank Telescope (GBT), Пизано удалось обнаружить свечение, испускаемое нейтральным водородом, соединяющим NGC 6946 с его космическими соседями. Этот сигнал был просто ниже порога обнаружения других телескопов, но уникальные возможности GBT позволили ученому обнаружить это слабое излучение.
Астрономы уже давно предположили, что крупные галактики могут получать постоянный приток холодного водорода с помощью его откачки с других менее массивных компаньонов.
Дальнейшие исследования помогут подтвердить природу этого наблюдения и помогут пролить свет на возможную роль, которую холодные потоки играют в эволюции галактик.
I.Водород – химический элемент
а) Положение в ПСХЭ
б) Распространённость водорода вприроде
| Водород - химический элемент. | В земной коре (литосфера и гидросфера) – 1% по массе(10 местосреди всех элементов) |
| АТМОСФЕРА - 0,0001% по числу атомов | |
| Самый распространённый элемент во вселенной – 92% от числа всех атомов(основная составная часть звёзд и межзвёздного газа) |
элемент
В организмах животных и растений (то есть в составе белков,нуклеиновых кислот, жиров, углеводов и других)
В теле человека в среднем содержится около 7 килограммов водорода.
в) Валентность водорода в соединениях
II. Водород – простое вещество (Н 2)
Получение
А) Взаимодействие металлов с кислотами:
Zn + 2HCl= ZnCl2 + H2
Б) Взаимодействие активных металлов с водой:
2Na+ 2H2 O= 2NaOH+ H2
·Из природного газа
CH 4 + 2H 2 O=4H 2 +CO 2
Нахождениеводорода в природе.
Водород широкораспространен в природе, его содержание в земной коре (литосфера и гидросфера) составляетпо массе 1%, а по числу атомов 16%. Водород входит в состав самогораспространенного вещества на Земле - воды (11,19% Водорода по массе), в составсоединений, слагающих угли, нефть, природные газы, глины, а также организмыживотных и растений (то есть в состав белков, нуклеиновых кислот, жиров,углеводов и других). В свободном состоянии Водород встречается крайне редко, внебольших количествах он содержится в вулканических и других природных газах.Ничтожные количества свободного Водорода (0,0001% по числу атомов) присутствуютв атмосфере. В околоземном пространстве Водород в виде потока протонов образуетвнутренний (протонный) радиационный пояс Земли. В космосе Водородявляется самым распространенным элементом. В виде плазмы он составляет околополовины массы Солнца и большинства звезд, основную часть газов межзвезднойсреды и газовых туманностей. Водород присутствует в атмосфере ряда планет и вкометах в виде свободного Н 2 , метана СН 4 , аммиака NH 3 ,воды Н 2 О, радикалов. В виде потокапротонов Водород входит в состав корпускулярного излучения Солнца и космическихлучей.
Существуют три изотопа водорода:
а) легкий водород – протий,
б) тяжелый водород – дейтерий (D),
в) сверхтяжелый водород – тритий (Т).
Тритий неустойчивый(радиоактивный) изотоп, поэтому в природе он практически не встречается.Дейтерий устойчив, но его очень мало: 0,015% (от массы всего земного водорода).
Валентностьводорода в соединениях
В соединениях водородпроявляет валентностьI.
Физическиесвойства водорода
Простое веществоводород (Н 2) – это газ, легче воздуха, без цвета, без запаха, безвкуса, t кип = – 253 0 С, водород в воде нерастворим , горюч. Собирать водород можно путем вытеснениявоздуха из пробирки или воды. При этом пробирку нужно перевернуть вверх дном.
Получениеводорода
В лаборатории водородполучают в результате реакции
Zn + H 2 SO 4= ZnSO 4 + H 2.
Вместо цинка можноиспользовать железо, алюминий и некоторые другие металлы, а вместо сернойкислоты – некоторые другие разбавленные кислоты. Образующийся водород собираютв пробирку методом вытеснения воды (см. рис. 10.2 б) или просто вперевернутую колбу (рис. 10.2 а).
В промышленности в большихколичествах водород получают из природного газа (в основном это метан) привзаимодействии его с парами воды при 800 °С в присутствии никелевогокатализатора:
CH 4 + 2H 2 O = 4H 2 +CO 2(t, Ni)
или обрабатывают привысокой температуре парами воды уголь:
2H 2 O + С =2H 2 + CO 2 . (t)
Чистый водород получаютиз воды, разлагая ее электрическим током (подвергая электролизу):
2H 2 O = 2H 2 + O 2 (электролиз).
Бесцветный горючий газ без запаха. Плотность водорода при нормальных условиях равна 0,09 кг/м3- плотность по воздуху - 0,07 кг/м3- теплота сгорания-28670 ккал/кг- минимальная энергия зажигания - 0,017 мДж. С воздухом и кислородом образует взрывоопасную смесь. Смесь с хлором (1:1) на свету взрывается- с фтором водородсоединяется со взрывом в темноте- смесь с (2:1) - гремучий газ. Пределы взрываемости: с 4 - 75 об. %, с кислородом 4,1 - 96 об. %.
Водород и Вселенная
Рождающий воду
Опыт, едва не стоивший жизни
С кислородом воздуха водородобразует взрывчатую смесь –- гремучий газ. Поэтому при работе с водородом необходимо соблюдать особую осторожность. Чистый водород сгорает почти бесшумно, а в смеси с воздухом издает характерный громкий хлопок. Взрыв гремучего газа в пробирке не представляет опасности для экспериментатора, однако при использовании плоскодонной колбы или посуды из толстого стекла можно серьезно пострадать.
Водород имеет двойственную химическую природу, проявляя как окислительную, так и восстановительную способность. В большинстве реакций он выступает в качестве восстановителя, образуя соединения, в которых его степень окисления равна +1. Но в реакциях с активными металлами он выступает в качестве окислителя: его степень окисления в соединениях с металлами равна -1.
Таким образом, отдавая один электрон, водород проявляет сходство с металлами первой группы периодической системы, а присоединяя электрон, – с неметаллами седьмой группы. Поэтому водород в периодической системе обычно помещают либо в первой группе и в то же время в скобках в седьмой, либо в седьмой группе и в скобках в первой.
Использование и получение водорода
Используется водород в производстве , метанола, хлороводорода, для гидрирования растительных жиров (при выработке маргарина), также для восстановления металлов (молибдена, вольфрама, индия) из оксидов. Водород-кислородным пламенем (3000°С) сваривают и режут тугоплавкие металлы и сплавы. Жидкий водород служит ракетным топливом.
При гидрогенизации угля и нефти бедные водородом низкосортные виды топлива превращаются в высококачественные.
Водород используют для охлаждения мощных генераторов электрического тока, а его изотопы находят применение в атомной энергетике.
В промышленности водород получают электролизом водных растворов солей (например, NaCl, Na2CO4), а также при конверсии твердого и газообразного топлива – угля и природного газа. Процессы конверсии протекают при температуре порядка 1000°С в присутствии катализаторов. Получаемая при этом газовая смесь называется синтез-газом.
Почти в каждой домашней аптечке имеется пузырек 3-процентного раствора перекиси водородаН2О2. Его используют для дезинфекции ран, остановке кровотечений.
В зависимости от назначения технический водород выпускается в сжатом и несжатом виде двух марок:
И все повторяется вновь. Например, весь кислород, существующий в биосфере, делает свой оборот за 2000 лет, а углекислый газ за 300. Такой кругооборот принято называть биогеохимическим циклом.
Пищевая цепь, резервный и обменный фонд
Таким образом, в биосфере круговорот веществ, движущей силой которого является деятельность живых организмов, можно разделить на две составляющие. Одна – резервный фонд – это часть вещества, которая не связана с деятельностью живых организмов и до времени в обороте не участвует. И вторая – это оборотный фонд. Он представляет собой лишь небольшую часть вещества, которая активно используется живыми организмами.
Атомы каких основных химических элементов столь необходимы для жизни на Земле? Это: кислород, углерод, азот, фосфор и некоторые другие. Из соединений, основным в кругообороте, можно назвать воду.
Кислород

Круговорот кислорода в биосфере следует начать с процесса фотосинтеза, в результате которого миллиарды лет назад он и появился. Он выделяется растениями из молекул воды под воздействием солнечной энергии. Кислород образуется также в верхних слоях атмосферы в ходе химических реакций в парах воды, где химические соединения разлагаются под воздействие электромагнитного излучения. Но это незначительный источник кислорода. Основным является фотосинтез. Кислород содержится и в воде. Хотя его там, в 21 раз меньше, чем в атмосфере.
Образовавшийся кислород используется живыми организмами для дыхания. Он также является окислителем для различных минеральных солей.
И человек является потребителем кислорода. Но с началом научно-технической революции, это потребление многократно возросло, так как кислород сжигается или связывается при работе многочисленных промышленных производств, транспорта, для удовлетворения бытовых и иных нужд в ходе жизнедеятельности людей. Существовавший до этого так называемый обменный фонд кислорода в атмосфере в размере 5% общего его объема, то есть вырабатывалось в процессе фотосинтеза столько кислорода, сколько его потреблялось. То теперь этого объема становиться катастрофически мало. Происходит потребление кислорода, так сказать, из неприкосновенного запаса. Оттуда, куда его уже некому добавить.
Незначительно смягчает эту проблему, что некоторая часть органических отходов не перерабатывается и не попадает под воздействие гнилостных бактерий, а остается в осадочных породах, образуя торф, уголь и тому подобные ископаемые.
Если результатом фотосинтеза является кислород, то его сырьем – углерод.

Круговорот азота в биосфере связан с образованием таких важнейших органических соединений, как: белки, нуклеиновые кислоты, липопротеиды, АТФ, хлорофилл и другие. Азот, в молекулярной форме, содержится в атмосфере. Вместе с живыми организмами — это всего около 2% всего, имеющего на Земле азота. В таком виде он может употребляться только бактериями и сине-зелёными водорослями. Для остального растительного мира в молекулярной форме азот не может служить питанием, а может перерабатываться лишь в виде неорганических соединений. Некоторые виды таких соединений образуются во время гроз и с дождевыми осадками попадают в воду и почву.
Гнилостные бактерии расщепляют азотосодержащие органические соединения до аммиака. Часть его уходит в атмосферу, а другая иными видами бактерий окисляется до нитритов и нитратов. Те, в свою очередь, поступают в качестве питания для растений и нитрифицирующими бактериями восстанавливаются до оксидов и молекулярного азота. Которые вновь попадают в атмосферу.
Таким образом, видно, что основную роль в кругообороте азота, играют различные виды бактерий. И если уничтожить хотя бы 20 таких видов, то жизнь на планете прекратится.
И опять установленный кругооборот был разорван человеком. Он для целей увеличения урожайности сельскохозяйственных культур, стал активно применять азотосодержащие удобрения.
Содержание азота в различных веществах сопоставляют с содержанием там углерода. Оборотные циклы этих двух элементов крепко связаны.
Углерод

Круговорот углерода в биосфере неразрывно связан с кругооборотом кислорода и азота.
В биосфере схема круговорота углерода базируется на жизнедеятельности зеленых растений и их способности к превращению углекислого газа в кислород, то есть фотосинтезе.
Углерод взаимодействует с другими элементами различными способами и входит в состав практически всех классов органических соединений. Например, он входит в состав углекислого газа, метана. Он растворен в воде, где его содержание значительно больше чем в атмосфере.
Хотя по распространённости углерод не входит в десятку, но в живых организмах он составляет от 18 до 45% сухой массы.
Мировой океан служит регулятором содержания углекислого газа. Как только его доля в воздухе повышается, вода выравнивает положения, поглощая углекислый газ. Еще одним потребителем углерода в океане являются морские организмы, которые используют его для строительства раковин.

Благодаря тому, что процесс дыхания с выделение углерода и процесс фотосинтеза с его поглощением проходит через живые организмы очень быстро, в кругообороте участвует лишь незначительная доля всего углерода планеты. Если бы этот процесс был невзаимным, то растения только суши использовали весь углерод всего в течение 4-5 лет.
Фосфор

Круговорот фосфора в биосфере неразрывно связан с синтезом таких органических веществ, как: АТФ, ДНК, РНК и другие.
В почве и воде содержание фосфора очень мало. Основные его запасы в горных породах, образовавшихся в далеком прошлом. С выветриванием этих пород начинается кругооборот фосфора.
Растениями фосфор усваивается лишь в виде ионов ортофосфорной кислоты. В основном это продукт переработки могильщиками органических остатков. Но если почвы имеют повышенный щелочной или кислотный фактор, то фосфаты практически в них не растворяются.
Фосфор является прекрасным питательным веществом для различного вида бактерий. Особенно сине-зеленой водоросли, которая при увеличенном содержании фосфора бурно развивается.
Тем не менее большая часть фосфора уносится с речными и другими водами в океан. Там он активно поедается фитопланктоном, а с ним морским птицам и другим видам животных. Впоследствии фосфор попадает на океаническое дно и формирует осадочные породы. То есть возвращается в землю, лишь под слоем морской воды.
Как видно кругооборот фосфора специфичен. Его трудно и назвать кругооборотом, так как он не замкнут.

В биосфере круговорот серы необходим для образования аминокислот. Он создает трехмерную структуру белков. В нем участвуют бактерии и организмы, потребляющие кислород для синтеза энергии. Они окисляют серу до сульфатов, а одноклеточные доядерные живые организмы, восстанавливают сульфаты до сероводорода. Кроме них, целые группы серобактерий, окисляют сероводород до серы и далее до сульфатов. Растения могут потреблять из почвы лишь ион серы — SO 2- 4. Таким образом, одни микроорганизмы являются окислителями, а другие восстановителями.
Местами накопления серы и ее производных в биосфере является океан и атмосфера. В атмосферу сера поступает с выделением сероводорода из воды. Кроме того, сера попадает в атмосферу в виде диоксида при сжигании на производствах и в бытовых нуждах горючего ископаемого топлива. В первую очередь угля. Там она окисляется и, превращаясь в серную кислоту в дождевой воде, с ней же выпадает на землю. Кислотные дожди сами по себе наносят существенный вред всему растительному и животному миру, а кроме этого, с ливневыми и талыми водами, попадают в реки. Реки несут ионы сульфатов серы в океан.

В биосфере нет более распространенного вещества. Его запасы в основном в солено-горьком виде вод морей и океанов – это около 97%. Остальное пресные воды, ледники и подземные и грунтовые воды.
Круговорот воды в биосфере условно начинается с ее испарения с поверхности водоемов и листьев растений и составляет примерно 500 000 куб. км. Обратно она возвращается в виде осадков, которые попадают либо непосредственно обратно в водоемы, либо, пройдя через почву и подземные воды.
Роль воды в биосфере и истории ее эволюции такова, что вся жизнь с момента своего появления, была полностью зависима от воды. В биосфере вода многократно через живые организмы прошла циклы разложения и рождения.
Кругооборот воды имеет под собой в большей степени физический процесс. Однако, животный и, особенно, растительный мир принимает в этом немаловажное участие. Испарения воды с поверхностных участков листьев деревьев таков, что, например, гектар леса испаряет в сутки до 50 тонн воды.
Если испарение воды с поверхностей водоемов естественно для ее кругооборота, то для континентов с их лесными зонами, такой процесс – единственный и главный способ его сохранения. Здесь кругооборот идет как бы в замкнутом цикле. Осадки образуются из испарений с поверхностей почвы и растений.
В процессе фотосинтеза растения используют водород, содержащийся в молекуле воды, для создания нового органического соединения и выделения кислорода. И, наоборот, в процессе дыхания, живые организмы, происходит процесс окисления и вода образуется снова.
Круговорот веществ в природе - это взаимосвязанные биологические, химические, физиологические процессы движения и видоизменения соединений, которые имеют повторяющийся характер.
Биогенные элементы
Для благоприятного функционирования всей биосферы и непрерывности ее процессов, внутри нее должны постоянно осуществляться обмены биогенных веществ, все элементы которых важны для жизни как таковой. В организмы живых существ входят те же составляющие, что и в воздух, воду, почву и минералы. Отличие только в том, что молекулы неживой природы просты и однотипны, а живые организмы состоят из множества атомов разных типов.

- водород
- кислород
- сера
- фосфор
- углерод
- азот
- железо
Важно! Все процессы на планете взаимосвязаны, и основным условием существования жизни на планете является непрерывный оборот биогеохимических веществ.
Возникновение круговоротов
Активность живого вещества и энергетические потоки Солнца выступают движущими силами этого процесса. Они перераспределяют, концентрируют и перемещают огромное количество жизненно необходимых веществ между растениями, их корневыми системами и всеми существами на планете.
Важно! Энергия заключена в химических связях органических веществ, которая поглощена продуцентом, вследствие чего она циркулирует в круговороте.
Возникает циклический оборот энергии потому, что действует закон ее сохранения. Она не исчезает бесследно, а расходуется для жизни биосферы Земли, переходя из одного состояния в другое.

- Переходят в виде пищи от организма к организму;
- Выделяются в окружающий мир;
- Снова приобщаются автотрофами в процессы жизнедеятельности организмов.
Структура природного цикла
- Большой либо геологический
- Малый либо биологический
Геологический
- Испарение влаги;
- Ее передвижение с воздушными потоками в состоянии пара;
- Формирование облаков;
- Осадки;
- Подземный и поверхностный сток воды в Мировой океан.
- По поверхности земной коры . Сток наполняет материковые водоемы, чьи воды стекаются в океаны. Эта вода содержит в себе растворенные химические элементы, частички почвы и гумуса.
Важно! По причине неконтролируемой вырубки лесов и безответственной деятельности человека в отношении ресурсов Земли, количество вод поверхностного стока растет с каждым годом. Это стало причиной многих экологических отклонений.
- Оседает в верхних слоях земной коры . Вода впитывается и сохраняется на некоторое время в почвах для питания растений. Спустя время, переработанная в процессе фотосинтеза, она переходит в атмосферу в парообразном состоянии.
- Проникает в более глубокие слои коры и образует подземные воды. Попадая в глубины Земли и заполняя ее трещины, вода вымывает растворенные минеральные вещества и доставляет их в океан.

Важно! Большой цикл круговорота никогда не повторяется в точности, как предыдущий, и проходит по спирали, а не по кругу.
Малый
- Продуценты
- Консументы
- Запас энергии и полезных веществ
- Редуценты

- Все организмы вбирают в себя атомы биогенных веществ из гидросферы, литосферы и атмосферы;
- В телах организмов проходят химические реакции с участием этих веществ;
- После переработки микроэлементы выделяются в виде продуктов распада в окружающую среду;
- Окружающий мир и все живые организмы планеты, черпая из него питательные вещества и выделяя их обратно в виде продуктов жизнедеятельности, создают общую экосистему.
Важно! Организованная таким образом жизнь на Земле продолжается уже миллионы лет. Если внести даже незначительные изменения в структуру, массу и в исходный химический состав живого вещества, можно необратимо повлиять на весь характер биологического цикла.
- Восходящий поток образуется, благодаря взаимодействию окружающей среды с растениями. На этом этапе создается первичный продукт.
- Нисходящий поток генерируется всеми уровнями экосистемы, которые преобразуют синтезированную продукцию в неорганические вещества.

Основные отличия круговоротов
- Составляющими компонентами. В геологическом круговороте принимают участие химические вещества со всех уровней земной коры. Биологический - отличается взаимодействием только между биогенными элементами.
- Длительностью . Цикл Малого оборота длится от года до сотни лет. Период Большого - тянется до сотен тысяч лет.
- Движущей силой. Импульсом для геологического круговорота выступает вода, которая “путешествует” между сушей и водоемами. В Малом круговороте в этой роли выступают живые организмы, их продукты жизнедеятельности и питание.
Влияние человека
Человек, как существо биологическое, непосредственно втянут в круговорот веществ. Однако ему все труднее соблюдать баланс и кодекс невмешательства в основные природные процессы. Бесконтрольно потребляя ресурсы планеты, заполняя неперерабатываемыми отходами ее атмосферу и биосферу, человек неблагоприятно влияет на естественный круговорот. Таким образом он наносит вред себе в первую очередь. Так, излишки азотных удобрений, которыми люди щедро посыпают почвы, впитываются в глубокие слои почвы и смываются дождями с полей, попадая в воду. Так или иначе, нитраты попадают в организм человека через пищу и воду, вызывая рак и другие сбои в процессах жизнедеятельности. Необходимо помнить, что все на Земле взаимосвязано. Для гармоничной и продолжительной жизни нужно поддерживать баланс веществ в природе, учитывая особенности естественного круговорота. Для лучшего восприятия всей изложенной информации смотрите тематическое видео.Читайте также:

