Химия и охрана окружающей среды реферат
Обновлено: 05.07.2024
Гипермаркет знаний>>Химия>>Химия 11 класс>> Химия: Химия и проблемы охраны окружающей среды
В ниши дни проблема охраны окружающей среды чрезвычайно возросла в связи со значительным, а очень часто и катастрофическим воздействием хозяйственной деятельности человека на природу.
Производствен нал деятельность человека нанесла биосфере — живой оболочке Земли — серьезный урон, нарушив сложившееся за времн существования планеты экологическое равновесие. Загрязнение окружающей среды в нашем сознании связывается в первую очередь с отравлением воды, воздуха, земли, которое может непосредственно влиять на здоровье и самочувствие человека. Однако химическое загрязнение чревато и косвенными эффектами. Например, большие выбросы углекислого газа сказываются на климате, что, в свою очередь, отражается на производстве продуктов питания; изменение концентраций биогенных элементов (азота, серы, фосфора, кшшя к др.) приводит к гибели одних популяций и бурному размножению других.
Химическое загрязнение окружающей среды обусловлено следующими факторами:
1) повышением концентрации биогенных элементов из-за канализационных сбросов и стока с полей удобрении, вызывающих бурное развитие водорослей и нарушение баланса в существующих экосистемах;
2) отравлением воды, почвы и воздуха отходами химических производств;
3) воздействием на воду и почву продуктов сжигания топлива, снижающих качество воздуха и вызывающих кислотные дожди;
4) потенциальным заражением воздуха, воды и почвы радиоактивными отходами, образующимися при производстве ядерного оружия и атомной энергии;
5( выбросами углекислого газя и химических веществ, снижающих содержание озона, что может привести к изменению климата или образованию озоновых дыр.
Охрана атмосферы от химического загрязнения
Как вы уже знаете, атмосферный воздух представляет собой смесь газов, содержащую (по объему) 78,09% азота, 20,95% кислорода, 0,93% аргона Аг, 0,03% углекислого газа СО2.
В процессе развития жизни на Земле все живые организмы, в том числе п человек, приспособились именно к такому составу атмосферы и очень чутко реагируют на его изменения.
Особое значение имеет кислород как главный компонент биологическою окисления. Для поддержания обмена веществ требуется непрерывная доставка кислорода в ткани н клетки. Атмосферный азот служит источником веществ, необходимых для питания растений, а углекислый газ — для осуществления процесса фотосинтеза.
Атмосфера оказывает не только прямое влияние на живые организмы, но и косвенное, поскольку От нес зависит характер солнечной радиации, достигающей поверхности Земли, климат и другие факторы, регулирующие существование биосферы.
Атмосфера — регуляторный механизм биосферы
Атмосфера является одной из главных частей механизма, регулирующего круговорот воды, кислорода, азота, углерода. Значение атмосферы состоит в том, что она служит экраном, защищающим жизнь на Земле от губительных воздействий из космоса. Через атмосферу проникают солнечные лучи — источник жизни. Атмосфера прозрачна для электромагнитного излучения в диапазоне длин волн от 0,3 до 0,52 нм. в которых заключено 82% всей энергии солнечных лучей, я также для радиоволн с длиной от 1 мм до 30 м. Жесткое коротковолновое излучение - рентгеновские и у-лучи — поглощается всей толщей атмосферы и не доходит до поверхности Земли.
Особое значение имеет атмосферный озон 03, интенсивно поглощающий коротковолновые ультрафиолетовые лучи с длиной волны менее 0,29 нм. Таким образом, атмосфера защищает жизнь на Земле от коротковолновых лучей. Вместе с тем она пропускает инфракрасное излучение солнца, но благодаря содержащимся в ней озону, углекислому газу п водяному пару непрозрачна для инфракрасного излучения Земли. Если бы эти газы не содержались в атмосфере. Земля превратилась бы в безжизненный шар, средняя температура на поверхности которого была бы -23 ºС, в то время когда она фактически равна +14.8 ºС. Жизнь в той форме, в которой она существует на Земле, возможна лишь при наличии атмосферы со всеми ее физическими и химическими свойствами.
Естественное загрязнение атмосферы можно рассматривать как фактор, способствующий ее регуляторной функции. Поэтому сам термин «загрязнение* здесь является в какой-то мере условным. В атмосферу попадают газы, выделяющиеся в результате горения лесов, извержения вулканов, биохимических реакций. Особое значение имеет естественная атмосферная пыль. Она образуется при выветривании горных порол, эрозии почв, лесных и торфяных пожарах. В атмосфере она создает ядра конденсации, без которых было бы невозможно образование осадков: снега, дождя.
Искусственное (антропогенное) загрязнение может быть связано с попаданием в атмосферу:
1) твердых частиц (цементная и резиновая автомобильная пыль, пыль горно-металлургических предприятий и т. д.);
2) газообразных веществ (углекислый и угарный газы, оксиды азота и серы, метан и аммиак, углеводороды и другие летучие соединения — бензин, растворители и т. д.);
3) радиоактивных веществ, поступающих в воздух в результате взрывов атомных и ядерных бомб, аварий на атомных электростанциях, добычи урана и использования радиоактивных веществ в различных технологических процессах;
4) свинца и других тяжелых металлов.
Изменение свойств атмосферы в результате загрязнения
Искусственное загрязнение оказывает и прямое, и косвенное воздействие на живые организмы. Прямое токсическое действие на организмы оказывают, например, оксиды серы и азота. Оксид серы обладает сильным раздражающим действием на глаза, носоглотку, ткань легких. У растений он разрушает хлоропласты и другие клеточные органоиды. Интенсивность фотосинтеза при атом снижается в 1,5—2 раза. Особенно чувствительны к ЙОг хвойные растения. При концентрации всего одной части ЙОг на миллион частей воздуха всего в течение двух месяцев у пятилетних елей происходит пожелтение и опадение хвои.
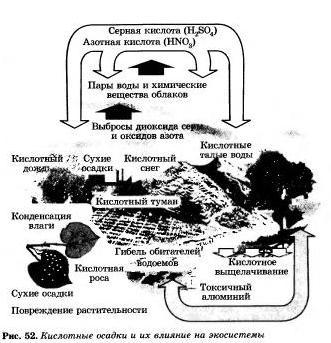
Оксиды азота (N0 и N02) — токсичные соединения, вызывающие раздражение дыхательных путей, а в высоких дозах - отек легких. Кроме этого, оксиды азота и серы образуют в атмосфере азотную и серную кислоты, которые в виде кислотных дождей выпадают вместе с осадками и вызывают гибель наземных растений и водных организмов. Они наносят большой вред архитектурным и скульптурным памятникам из мрамора, разрушают металлические крыши и конструкции — мосты и опоры.
Искусственное загрязнение оказывает косвенное воздействие на атмосферу, изменяя ее свойства. Так, в результате увеличивающегося сжигания топлива и уменьшения площадей, занятых земной растительностью, фотосинтетическяя генерация (восстановление кислорода из углекислого газа в результате фотосинтеза) в настоящее время уменьшилась на 30% по сравнению с предыеторичеекпм периодом. Ежегодная убыль кислорода составляет 31,62 млрд т. Если учесть, что в атмосфере содержится 1200 трлн т кислорода, то его количество в атмосфере уменьшается в год на 0,0025%. Казалось бы, очень немного, но, очевидно, в конце концов встанет вопрос о введении ограничений на потребление кислорода.
Озоновый экран разрушается оксидами азота, соединениями хлора и фтора, попадающими в атмосферу в результате распада фреонов. которые широко применяют в холодильной и парфюмерно-косметической промышленности.
Чтобы минимизировать загрязнения атмосферы, необходимо:
1) производить очистку выбросов в атмосферу от твердых и газообразных загрязняющих веществ с помощью электрофильтров, жидких и твердых поглотителей, циклонов и др.;
2) использовать экологически чистые виды энергии;
3) применять малоотходные и безотходные технологии;
4) добиваться уменьшения токсичности автомобильных выхлопных газов путем совершенствования конструкции двигателей и применения катализаторов, а также совершенствовать существующие и создавать новые электромобили и двигатели, работающие на водородном топливе.
Охрана водных ресурсов
Жизнь как физико-химический процесс протекает в водной среде. Животные, растения на 70—80% состоят из воды. Потеряв 50% своей массы в результате голодания, человек может остаться в живых, но потеря 15—20% массы в результате обезвоживания — смертельна.
Все реакции обмена веществ в организме человека, и в первую очередь реакции гидролиза, протекают или с участием воды, или в водной среде.
Но вода — не только условие жизни индивидуального организма. Без нее невозможно было бы существование биосферы, то есть жизни на Земле, поскольку круговорот веществ и энергии в биосфере возможен только с участием воды.
Круговорот воды действует беспрерывно. Он реализуется в трех основных географических объектах: океан — атмосфера — суша. С поверхности Мирового океана ежегодно испаряется 453000 км3 воды. Осадки, выпадающие на землю, составляют 525 000 км3. Превышение происходит за счет испарения воды с других водных поверхностей растениями.
Испаряющаяся вода, конденсируясь, образует облака и в виде осадков выпадает на землю. Они поглощаются почвой, и в результате подземного и поверхностного стока вода возвращается в моря и океаны.
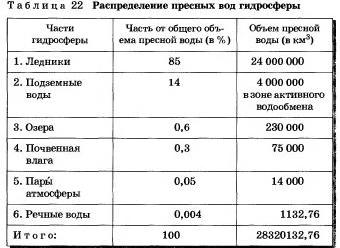
Теоретически можно считать водные ресурсы неисчерпаемыми, если принять, что при их рациональном использовании они непрерывно возобновляются в процессе круговорота. Вместе с тем потребление воды увеличивается, так как она служит одним из главных видов сырья для промышленности. Ее в огромных количествах используют в качестве теплоносителя и теряют в процессе охлаждения и подогрева.
В металлургии для выплавки 1 т чугуна и переплавки его в сталь требуется 300 м 3 воды, для получения 1 т меди — 500 м 3 , 1 т никеля — 4000 м3. Одним из главных потребителей воды является производство синтетических материалов. Для получения 1 т синтетнпеского каучука нужно 2100 м3 воды, лавсана — 4200 м3, капрона — 5600 м3. Для изготовления автомобиля нужно 246 м 3 воды, а для запуска межконтинентальной баллнстическоп ранеты — 189000 м3.
В горнодобывающей промышленности воду широко используют для добычи полезных ископаемых: при использовании гидромониторов, транспортировке, отделении минералов от руды методом флотации.
С потреблением огромного количества воды связано целлюлозно-бумажное производство. На производство 1 т бумаги требуется 250 м 3 воды. Еще больше расходуют воды в сельском хозяйстве: животноводстве и растениеиодстве.
При бережном отношении к воде можно уменьшить ее расход как в промышленном и сельскохозяйственном производстве, так и в коммунально-бытовом хозяйстве. Водоемкость в ней одного жителя крупного города составляет 35 л в сутки. Но за счет нерационального ее использования, потерь при транспортировке к потребителю, неисправности оборудования в квартирах (протекающие краны и сливные бачки) она увеличивается до 700 л. Запасы пресной воды в зонах интенсивной хозяйственной деятельности и проживання большинства людей становятся недостаточными, поэтому уже сейчас необходимо думать о ее сбережении.
Все химикаты, которые используют, хранят, проливают, закапывают в землю, могут попасть в грунтовые яды.
Загрязнение твердыми частицами происходит при попадании в водоемы песка, глины, шлаков, пустой породы и других твердых отходов добывающей, металлургической, химической и строительной промышленности.
Загрязнение минеральными веществами:
1) соединениями металлов (высокотоксичными — свинцом, ртутью, редкоземельными — кадмием, селеном, литием и др.), в результате чего при превышении предельно допустимой концентрации (ПДК) у людей поражаются органы слуха, зрения, нервная система, возможны случаи паралича и рождения детей с различными физическими и психическими аномалиями;
2) минеральными удобрениями, в результате попадания которых в водоемы наблюдается эвтрофикация, то есть неумеренное разрастание водной растительности (водоем со зловонной зеленой жижей вы, очевидно, видели не раз).
Загрязнение органическими веществами промышленного происхождения, входящими в состав стоков химической, нефтехимической, целлюлозно-бумажной и других видов промышленности. Среди таких веществ встречаются фенол, диоксин, CMC.
Загрязнение нефтью и ее производными. Одна тонна нефти, растекаясь по водной поверхности, способна занять площадь в 12 км2, а 1 л нефти может сделать непригодным к употреблению 1 млн л воды, то есть столько ее, сколько бы хватило для семьи из 4 человек в течение 20 лет. Нефтяная пленка представляет собой преграду для газообмена между водой и атмосферой. Она препятствует поглощению водой кислорода и углекислого газа, вызывая гибель планктона. Эта пленка представляет собой большую опасность для морских птиц и животных. Оперение птиц, вымазанное нефтью, теряет свои водонепроницаемые свойства, что приводит к их гибели.
Органические вещества биологического происхождения содержатся в бытовых и животноводческих стоках. Попадая в водоемы, эти стоки делают воду непригодной для питья, вызывают гибель рыбы, являются причиной эвтрофикации.
Пестициды. как и тяжелые металлы, двигаясь по трофической цепи: фитопланктон —► зоопланктон —► мелкие рыбы —► крупные рыбы, достигают в теле последних такой концентрации, которые могут быть смертельными для человека.
Кардинальным решением проблемы борьбы с загрязнением водной среды (гидросферы) был бы полный переход на безопасные технологии, при которых исключался бы сброс каких-либо стоков, а также разработка технологий с минимальным потреблением воды. Но разработка и внедрение малоотходных технологий — дорогостоящи и сложны, поэтому первоочередное значение приобретает процесс очистки сточных вод, включающий:
1) очистку и обеззараживание бытовых и животноводческих стоков:
2) орчистку стоков от последствий обслуживания автотранспорта и сельскохозяйственной техники:
3) очистку стоков, содержащих нефтепродукты.
Перспективны способы очистки воды от нефтепродуктов с помощью микроорганизмов и растений. Известны микроорганизмы, способные питаться углеводородами. Эксперименты, проведенпые с использованием грибков Candido UpoUtica, показали, что небольшие водоемы могут быть очищены от нефти за 5—в дней.
• лесонасаждение;
• агротехнические приемы, например создание долголетних культурных пастбищ, снегозадержание, внесение органических (но не минеральных) удобрений;
• почвозащитная система земледелия, заключающаяся в безотвальной вспашке и оставлении стерни на поверхности почвы;
• создание и внедрение почвозащитного земледелия, препятствующего технической эрозии, которая возникает как результат непосредственного разрушения слоя почиы техническими средствами, в основном колесами и гусеницами машин;
• недопущение загрязнения почвы остатками строительных деталей (панелей, блоков, кирпичей, золы, шлака), нефтью и нефтепродуктами, веществами, попадающими в иочьу из атмосферы (соединени I м 1 свинца, мышьяка, ртути, меди и т. д.);
• правильное применение удобрений и пестицидов. Около 20%, а иногда и все 50% удобрений не усваиваются растениями и остаются в почве тяжелым грузом для ее биоценоза. Пестициды могут попасть в почву и нарушить сложившиеся в ней трофические связи.
1. Назовите основные факторы, вызывающие химическое загрязнение окружи кчцеи среды.
2. Охарактеризуйте роль атмосферы для обеспечения жизнедеятельности биосферы — живой оболочки Земли.
3. Назовите основные источники химического загрязнения атмосферы и укажите пути борьбы с ними.
4. Что такое кислотные дожди? Какую роль играют они в природе и в жизни человека? Как с ними бороться?
5. Что такое парниковый эффект? Какую роль он играет в природе и в жизни человека?
6. Охарактеризуйте роль гидросферы (водной оболочки Земли) для жизнедеятельности биосферы и человека.
7. Назовите основные источники химическою загрязнения гидросферы и пути борьбы с ними.
8. Что такое эрозия почвы? Какие виды эрозни вы знаете и как с ней бороться?
опорный каркас урока 11 класса,химия в вопросах и ответах для всех классов, видео к урокам
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
Большие запасы железных руд находятся на Урале, где целые горы (например Магнитная, Качканар, Высокая и др.) образованы магнитным железняком. Большие залежи железных руд имеются вблизи Курска, на Кольском полуострове, в Западной и Восточной Сибири, на дальнем Востоке. Богатые залежи имеются на Украине.
Содержание
I. Нахождение железа в природе. Основные минералы и их свойства………3
II. Техногенные источники поступления железа в окружающую среду…….5
III. Химические свойства железа, его основные соединения…………………7
IV. Вредные соединения железа, источники их поступления в окружающую среду, свойства, поражающее действие, ПДК, способы очистки………………………………………………………………………. …10
V. Получение железа и его основных соединений, их практическое использование……………………………………………………………………13
Список используемой литературы……………………
Вложенные файлы: 1 файл
РЕФЕРАТ по химии печать.docx
ФЕДЕРАЛЬНОЕ АГЕНТСТВО МОРСКОГО И РЕЧНОГО ТРАНСПОРТА
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
Выполнил: студент гр. ГТ-14
I. Нахождение железа в природе. Основные минералы и их свойства………3
II. Техногенные источники поступления железа в окружающую среду…….5
III. Химические свойства железа, его основные соединения………………… 7
IV. Вредные соединения железа, источники их поступления в окружающую среду, свойства, поражающее действие, ПДК, способы очистки…………………………………………………………… …………. …10
V. Получение железа и его основных соединений, их практическое использование…………………………………………… ………………………13
Список используемой литературы……………………………………………18
I. Нахождение железа в природе. Основные минералы и их свойства
Железо – самый распространенный после алюминия металл на земном шаре; оно составляет около 5% земной коры. Встречается железо в виде различных соединений: оксидов, сульфидов, силикатов. В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
Железо входит в состав многих минералов, из которых слагаются месторождения железных руд.
Основные рудные минералы железа:
Гематит (железный блеск, красный железняк) – Fe2 O3 (до 70% Fe);
Магнетит (магнитный железняк) – Fe3 O4 (до 72,4% Fe);
Гидрогетит – FeOOH*nH2 O (лимонит) – (около 62% Fe);
Сидерит – Fe(CO3) (около 48,2% Fe);
Месторождения железных руд образуются в различных геологических условиях; с этим связано разнообразие состава руд и условий их залегания. Железные руды разделяются на следующие промышленные типы:
1. Бурые железняки – руды водной окиси железа (главный минерал – гидрогетит) , 30-55% железа.
2. Красные железняки, или гематитовые руды (главный минерал – гематит, иногда с магнетитом), 51-66% железа.
3. Магнитные железняки (главный минерал – магнетит), 50-65% железа.
4. Сидеритовые или карбонатные осадочные руды, 30-35% железа.
5. Силикатные осадочные железные руды, 25-40% железа.
Большие запасы железных руд находятся на Урале, где целые горы (например Магнитная, Качканар, Высокая и др.) образованы магнитным железняком. Большие залежи железных руд имеются вблизи Курска, на Кольском полуострове, в Западной и Восточной Сибири, на дальнем Востоке. Богатые залежи имеются на Украине.
Железо является также одним из наиболее распространенных элементов в природных водах, где среднее содержание его колеблется в интервале 0,01-26 мг/л.
Животные организмы и растения аккумулируют железо. Активно аккумулируют железо некоторые виды водорослей, бактерии.
В теле человека содержание железа колеблется от 4 до 7г (в тканях, крови, внутренних органах). Железо поступает в организм с пищей. Суточная потребность взрослого человека в железе составляет 11-30мг. В основных пищевых продуктах содержится следующее количество железа (в мкг/100г.):
Картофель, овощи, фрукты – от 600 до 900
II. Техногенные источники поступления железа в окружающую среду
В зонах металлургических комбинатов в твердых выбросах содержится от 22000 до 31000 мг/кг железа.
В прилегающие к комбинатам почвы поступает до 31-42 мг/кг железа. Вследствие этого железо накапливается в огородных культурах.
Много железа поступает в сточные воды и шламы от производств: металлургического, химического, машиностроительного, металлообрабатывающего, нефтехимического, химико-фармацевтического, лакокрасочного, текстильного.
Содержание железа в составе сырого осадка, выпадающего в первичных отстойниках крупного промышленного города, может достигать 1428 мг/кг.
Пыль, дым промышленных производств могут содержать большие количества железа в виде аэрозолей железа, его оксидов, руд.
Пыль железа или его оксидов образуется при заточке металлического инструмента, очистке деталей от ржавчины, прокате железных листов, электросварке и при других производственных процессах, в которых имеют место железо или его соединения.
Железо может накапливаться в почвах, водоемах, воздухе, живых организмах.
Основные минералы железа подвергаются в природе фотохимическому разрушению, комплексообразованию, микробиологическому выщелачиванию, в результате чего, железо из труднорастворимых минералов переходит в водные объекты.
Железосодержащие минералы окисляются бактериями типа Th. Ferrooxidans.
Окисление сульфидов можно описать в общем виде на примере пирита следующими микробиологическими и химическими процессами:
Как видно, при этом образуется еще один загрязняющий поверхностные воды компонент – серная кислота.
О масштабах ее микробиологического образования можно судить по такому примеру. Пирит – обычный примесный компонент угольных месторождений, и его выщелачивание приводит к закислению шахтных вод. По одной из оценок, в 1932г. в реку Огайо (США) с шахтными водами поступило около 3 млн. тонн H2 SO4 .
Микробиологическое выщелачивание железа осуществляется не только за счет окисления, но и при восстановлении окисленных руд. В нем принимают участие микроорганизмы, относящиеся к разным группам. В частности, восстановление Fe3+ до Fe2+ осуществляют представители родов Bacillusи Pseudomonas, а так же некоторые грибы.
Упомянутые здесь широко распространенные в природе процессы протекают так же в отвалах горнорудных предприятий, металлургических комбинатов, производящих большое количество отходов (шлаки, огарки и т.п.).
С дождевыми, паводковыми и грунтовыми водами высвобождающиеся из твердых матриц металлы переносятся в реки и водоемы. Железо находится в природных водах в разных состояниях и формах: в истинно растворенной форме входят в состав донных отложений и гетерогенных систем (взвеси и коллоиды).
Донные отложения рек и водоемов выступают в качестве накопителя железа. При определенных условиях железо может высвобождаться из них, в результате чего происходит вторичное загрязнение воды.
III. Химические свойства железа, его основные соединения
Железо – элемент VIII группы периодической системы. Атомный номер 26, атомный вес 55,85 (56). Конфигурация внешних электронов атома 3d6 4s2 .
По химическим свойствам железо как переходный элемент близок к соседним элементам той же группы периодической системы – никелю и кобальту.
В соединениях железо чаще 2-х и 3-х валентно, но известны также валентности 1, 4 и 6.
Для высших валентных состояний железа характерны кислотные свойства. Железо, особенно 3-х валентное, склонно к комплексообразованию. В химическом отношении железо – металл средней активности. В сухом воздухе при нагревании до 150-200о на поверхности компактного железа образуется тонкая защитная окисная пленка, предохраняющая его от дальнейшего окисления.
Во влажном воздухе железо быстро ржавеет, т.е. покрывается бурым налетом гидратированного оксида железа, который вследствие своей рыхлости не защищает железо от дальнейшего окисления.
В воде железо интенсивно корродирует. При обильном доступе кислорода при этом образуются гидратные формы оксида железа:
При недостатке кислорода или при его затрудненном доступе образуется смешанный оксид Fe3 O4(Fe2 O3 . FeO):
При взаимодействии железа с галогенами или галогеноводородами образуются галогениды железа.
Железо растворяется в соляной кислоте любой концентрации.
Аналогично происходит растворение в разбавленной серной кислоте:
В концентрированных растворах серной кислоты Fe(II) окисляется до Fe(III):
Однако в серной кислоте, концентрация которой близка к 100%, железо становится пассивным и взаимодействие практически не происходит.
В разбавленных и умеренно концентрированных растворах азотной кислоты железо растворяется:
При высоких концентрациях HNO3 растворение замедляется и железо становится пассивным.
Для железа характерны два ряда соединений: соединения Fe(II) и соединения Fe(III). Первые отвечают оксиду железа (II), или закиси железа FeO; вторые – оксиду железа (III), или окиси железа Fe2O3 .
Кроме того известны соли железной кислоты H2 FeO4 , в которой степень окисленности железа +6.
Основные соединения железа (II)
Железный купорос – FeSO4 . 7H2 O – светло-зеленые кристаллы, хорошо растворимые в воде.
Гидроксид железа (II) – Fe(OH)2 – белый осадок, который на воздухе вследствие окисления быстро принимает зеленоватую, а затем бурую окраску, переходя в Fe(OH)3 .
Оксид железа FeO, черный, легко окисляющийся порошок.
Карбонат железа FeCO3 . При действии воды, содержащей CO2 , карбонат железа, подобно карбонату кальция, частично переходит в более растворимую кислую соль Fe(HCO3 )2 . В виде этой соли железо содержится в природных железных водах.
Соли железа (II) легко могут быть переведены в соли железа (III) действием различных окислителей, например: HNO3 , KMnO4 , Cl2 и др.
Ввиду способности легко окисляться, соли железа (II) часто применяются как восстановители.
Основные соединения железа (III)
Хлорид железа FeCl3 – темно-коричневые с зеленым отливом кристаллы. Сильно гигроскопичное вещество.
Сульфат железа Fe2 (SO4 )3 – очень гигроскопичные, расплывающиеся на воздухе белые кристаллы. Образуют кристаллогидрат Fe(SO4 )3 . 9H2 O (желтые кристаллы). В водных растворах сульфат железа (III) сильно гидролизован.
Железо-аммонийные квасцы (NH4 )Fe(SO4 )2 . H2 O – хорошо растворимые в воде светло-фиолетовые кристаллы.
Гидроксид железа (III) Fe(OH)3 , более слабое основание, чем Fe(OH)2 .
Соли железа (III) сильно гидролизуются.
Характерной реакцией, отличающей соли железа (III) от солей железа (II), служит действие роданида калия KCNS (или роданида аммония) – появляется кроваво-красная окраска роданида железа (III) – Fe(CNS)3 .
Ионы железа (II) с роданидами не дают этой окраски.
Цианистые соединения железа
Гексациано (II) феррат калия K4 [Fe(CN)6 ]. 3H2 O – светло-желтые кристаллы. Эта соль называется желтой кровяной солью. Раствор ее не дает реакции, характерной для ионов Fe(II). Но с ионами Fe(III) желтая кровяная соль взаимодействует с образованием нерастворимой соли синего цвета – берлинской лазури:
Гексациано (III) феррат калия K3 [Fe(CN)6 ] – красная кровяная соль, темно красные кристаллы (безводные).
Красная кровяная соль – реактив на ионы Fe(II), с которыми она образует синий осадок, так называемой турнбулевой сини.
IV. Вредные соединения железа, источники их поступления в окружающую среду, свойства, поражающее действие, ПДК, способы очистки
В воздух рабочей зоны на металлургических, металлообрабатывающих предприятиях поступает пыль, аэрозоли из частиц железа и его соединений. При воздействии на кожу возможны аллергические дерматиты, при вдыхании такого воздуха происходит раздражение дыхательных путей, разрушение легких, плевры, нарушения функции печени, желудочные заболевания. Поэтому установлено ПДК (Предельно Допустимая Концентрация) для железосодержащих частиц в воздухе рабочей зоны в зависимости от типа частиц от 2 до 4мг/м3 .
При сгорании железного порошка, при операциях, связанных с работой электрической дуги, в окружающую атмосферу поступает дым оксида железа Fe2 O3 , который вызывает патологические изменения функции легких. ПДК для Fe2 O3 в воздухе (в пересчете на Fe) – 0,04мг/м3 .
Сульфаты и хлориды железа являются наиболее токсичными вредными примесями. ПДК для сульфата (в пересчете на Fe) в атмосферном воздухе – 0,007 мг/м3 , для хлорида – 0,004 мг/м3 .
У рабочих, обрабатывающих пириты, наблюдаются желудочные заболевания (гастриты, дуодениты).
Охрана окружающей среды в настоящее время – одна из насущных задач населения. Растет население Земли (оно достигло 6,5 млрд.). Каждому человеку требуется пища, одежда, крыша над головой. В то же время ресурсы планеты не умножаются, а иссекаются. Выбывают из оборота плодородные почвы, катастрофически быстро загрязняются воды и воздух. С каждым годом увеличиваются площади пустынь и уменьшаются площади лесов, дающих Земле кислород, стабилизирующих климат и циркуляцию вод. Повсюду дают себя знать химические загрязнения. Вырастают горы отбросов, в том числе очень опасных для здоровья людей, истощаются не возобновляемые ресурсы планеты, заметно ослаблена оздоровляющая способность Мирового океана.
Потенциальную опасность представляют промышленные токсичные отходы, накопившиеся неиспользованные и потерявшие свойства ядохимикаты, ухудшаются физико-химические свойства почв. Все это отрицательно влияет на здоровье человека и комфортность условий жизни.
Многие природные экосистемы (биогеоценозы лесов, рек и болот) утрачивают способность самоочищения, саморегулирования. Экономические проблемы многие предприятия стараются решить за счет эксплуатации природных ресурсов. Экологи, например, бьют тревогу о том, что в преддверии олимпиады заповедные уникальные территории Сочинского национального парка раскупаются для строительства объектов, не имеющих отношения к олимпиаде без проведения экологического мониторинга.
Немалая роль в этом деле принадлежит учителю химии.
Вопросы охраны окружающей среды
в курсе
неорганической химии
 |
Каждая тема курса химии дает возможность учителю совершенствовать экологическое образование и воспитание учащихся прежде всего на уроках
При повторении периодического закона Д. И. Менделеева особенно подчеркиваем, что периодический закон – один из важнейших объективных законов природы. В основе его лежит положение о материальности мира, его единстве, закономерностях и познаваемости всех тех процессов и явлений, которые в нем происходят.
Желательно познакомить учащихся с видами загрязнений окружающей среды и их классификацией.
 |
Обращаем внимание учащихся на важнейшие загрязнители биосферы.
Десять главных загрязнителей биосферы

Желудочный сок pH 1,7 (сильнокислая реакция)
Водопроводная вода pH 7,4 (слабощелочная)
Кровь человека pH 7,3 (слабощелочная)
Слюна pH 6,9 (слабокислая)
Слезы pH 7,0 (нейтральная)
Приводим pH соков некоторых плодов и овощей:
Картофель pH 5,92
Антоновка pH 2,50
Отмечаем, что почвы делятся на группы в зависимости от наличия ионов H + и OH - , что к отдельным группам почв приспособились отдельные определенные растения, животные, микромир. Поэтому изменение условий жизни хотя бы на одной территории влечет за собой нарушение целостности других территорий, так как в природе все взаимосвязано.
В мире химических элементов и их соединений содержаться как полезные, так и опасные для биосферы и здоровья человека вещества. На это стоит обратить внимание учащихся при изучении тем 4,5,6 групп таблицы Менделеева.
Оксиды углерода, азота, серы, сероводород и т.д. – основные загрязнители атмосферы. Их источники – ТЭС, металлургические заводы, автомобильный и авиационный транспорт.
Оксиды углерода (II) воздействует и на психическое состояние человека. Соединяясь с гемоглобином крови, он снижает обеспечение тканей организма кислородом. Не является ли это одним из факторов повышения агрессивности человека в густонаселенных районах?
Указываем, что СО относят к очень опасным загрязнителям. ПДК его в рабочей зоне 200 мг/м 3 .
Основной источник поступления в атмосферу этого газа – двигатели внутреннего сгорания, которые отличаются очень низким КПД.
По некоторым подсчетам в атмосферу ежегодно поступает 142379 млн. т. СО. Чтобы у учащихся не сложилось мнение, что СО только накапливается в окружающей среде, следует указать, что природа, самоочищаясь, использует оксид углерода (II). Он окисляется до СО2 , поглощается растениями, микроорганизмами, адсорбируется почвой и др.
Учащимся надо обязательно надо рассказать о первой помощи при отравлении бытовым угарным газом.
 |  |
 |
По прогнозам специалистов к 2100 году средняя температура на Земле увеличится на 6 градусов, что приведет к таянию ледников, повышению уровня мирового океана на 55 см. А это – затопление прибрежных и островных государств, их исчезновение.
 |
Изменение средних температур на поверхности Земли за последние 1000 лет.
Изучая химический элемент кремний необходимо ознакомить учащихся с экспериментальными исследованиями возникновения силикоза, вызываемого соединениями кремния. Оксид кремния SiO2 способен гидратироваться, образуя коллоидный раствор кремниевой кислоты, этот раствор является первопричиной процесса заболевания силикозом. Вдыхание кварцевой пыли вызывает первые симптомы силикоза: отдышка, боли в грудной клетке, кашель. Самым активным защитником от силикоза и других заболеваний органов дыхания является чистый воздух.
Силикатная промышленность (производство цемента; в Белгороде 2 цемзавода) дает в атмосферу большое количество мелкодисперсной фазы цемента, в результате несовершенства этого производства влага с цементом цементирует листья, прекращая газообмен. Цементное производство загрязняет окружающую среду (Hg) ртутью, т. к. она содержится в сырье, из которого получают цемент (известняки, глины, сланцы).
При изучении оксида азота ( IV ) подчеркиваем, что NO2 является наиболее опасным загрязнителем (ПДК – 0,085 мг/м 3 ). Источником его поступления в окружающую среду является производство азотной кислоты, взрывчатых веществ, фотопленки, удобрений, сжигание углей торфа, сланцев. Рассказываем учащимся, что ежегодно сжигается 7 млрд. т. условного топлива, от чего ежегодный избыток азота в биосфере достиг 9 млрд. т. Азот задерживается в водах, в почве, в биомассе. Выброшенные в атмосферу оксиды азота окисляются до азотной кислоты, которая попадает в почву, водоемы, закисляет их, наносит огромный вред организмам. Повышается содержание нитратов в грунтовых и колодезных водах и их концентрация в ряде мест достигает 500-700 и даже 1350 мг/л, что в десятки раз превышает ПДК. Люди, находящихся в зонах, загрязненных оксидами азота, страдают воспалениями глаз, трахеи, бронхов. При длительном вдыхании этих газов происходит оттек легких.
Необходимо отметить, что оксиды азота представляют опасность для озоновой оболочки Земли, роль которой заключается в задержании губительных для органического мира ультрафиолетовых лучей. В верхние слои атмосферы оксиды азота попадают с выхлопными газами реактивных самолетов, ракет, а также при ядерных взрывах.
Человек всегда радовался благотворным каплям дождя, но сейчас дожди представляют собой серьезную опасность: оксиды серы и азота поступают в воздух и вызывают образование кислотных дождей, которые наносят огромный вред здоровью людей и материальным средствам. Под их влиянием гибнут водоемы вместе с их обитателями, массивы лесов превращаются в мертвую зону.
 |
При изучении фосфора (Р) следует отметить, что фосфор играет важную роль в жизнедеятельности органического мира, особенно человека. Избыток его так же, как и недостаток, отрицательно сказывается на жизнедеятельности клеток, синтезе белков, мозговой деятельности. Избыток фосфора дает производство фосфорных удобрений, химических и медицинских препаратов, рыбный промысел, ядохимикаты и т. д. Следует отметить особую ядовитость метафосфорной кислоты и ее солей в связи, с чем они используются в сельском хозяйстве как пестициды.
При избытке азотных удобрений увеличивается содержание нитратов в овощных культурах, зеленом корме, что снижает их биологическую ценность, вкусовые качества. Клубни картофеля, выращенные в таких условиях, содержат мало крахмала, восприимчивы к заболеваниям, плохо сохраняются.
Количество металлов в результате хозяйственной деятельности человека через 50 лет в окружающей среде увеличится:
Zn и Pb – в 10 раз,
Mg и Cd – в 100 раз,
В результате рассеивания металлов вокруг металлургических заводов происходит недобор с полей пшеницы 20-30%, бобовых 40%, картофеля 47%, кормовой и сахарной свеклы до 35%.
Данные ВНИЦ мед. Информации
 |
В курсе неорганической химии практически отсутствует информация о роли металлов в природной среде, их негативном воздействии на человека. Тем не менее необходимо сформировать у учащихся представление о двойственной роли металлов, биологическом значении и токсическом действии, о последствии техногенного воздействия металлов и их соединений на биологические системы.
В подавляющем большинстве случаев, при переходе от легкого Ме к тяжелому, в пределах одной подгруппы, их токсичность возрастает, и убывает их содержание в биомассе.
Основные источники поступления Ме в окружающую среду – отходы металлургической промышленности, выбросы автотранспорта, сжигание топлива, химико-фармацевтическая промышленность, производство керамики, стекла, цемента, лакокрасочной промышленности, производство красителей, нефтеперерабатывающей промышленности.
Особую опасность представляют тяжелые Ме, такие как ртуть, свинец, кадмий. Они обладают мутагенными, канцерогенными свойствами, опасных для репродуктивной системы человека.
Самое опасное загрязнение – радиоактивное. Оно представляет угрозу не только ныне живущим поколениям, но и их потомкам из-за появления многочисленных мутаций.
26 апреля 1986 года произошла страшная катастрофа – авария на 4 блоке Чернобыльской АЭС. В атмосферу попало около 50 тонн ядерного топлива, что в 10 раз больше массы радиоактивных веществ от бомбы, сброшенной над Хиросимой.
Белгородская область также попала под влияние радиоактивного выброса, последствия которого сказываются на здоровье людей до сих пор.
Необходимо обратить внимание на двойственную роль микроэлементов. Микроэлементы – своеобразные катализаторы, участвуют в передаче наследственности, способствуют нормальному функционированию тех или иных органов. Но в зависимости от концентрации эти элементы могут наносить вред растениям, животным, человеку.
Угнетение синтеза витамина В-12
Невызревание и полегание злаков. Усыхание верхушек плодовых деревьев
Плохое плодоношение, растения дают невсхожие семена
Карликовый рост растений и животных
Уменьшение окислительных процессов
Отмирание точек роста стебля и корня
Энтерит у растений и животных
Вопросы охраны окружающей среды
в курсе органической химии.
 |
Знакомство с органическими веществами, загрязняющими природу и изучение их действия на живую и неживую природу повышает химическую грамотность учащихся в обращении с веществами.
К органическим веществам, загрязняющим природу, относятся различные газы, бензол и его ядохимикаты, нефть, продукты нефтепереработки, продукты коксования каменного угля, ряд спиртов, фенолы, многие кислоты и т.д.
Скопление метана ( CH 4 ) в шахтах, бункерах, местах гниения органических веществ ведет к понижению концентрации кислорода и это опасно. У человека наблюдается интоксикация организма, сонливость, головные боли, потеря сознания и ряд других нарушений функций организма.
Изучая вопросы нефтепереработки необходимо отметить, что в результате добычи, транспортировки и переработки нефти теряется большое количество нефтепродуктов, которые поступают в окружающую среду. Больше всего от этих загрязнений страдает мировой океан, куда поступает примерно 25-30 млн. т. в год. Массовая гибель планктона, продуцирующего 70% биогенного кислорода может привести к значительному нарушению его баланса в атмосфере. Нефть и нефтепродукты губительно влияют на икру рыб. Отмечены случаи массовой гибели птиц, моллюсков, морских млекопитающих. Многие токсиканты, присутствующие в нефти, являются канцерогенными веществами, они могут аккумулироваться растениями и другими организмами, действовать на органы пищеварения.
 |
Касаясь нефтепереработки , следует рассказать учащимся о получении моторного топлива, обратить внимание на то, что использование детонационно-устойчивых бензинов, лишенных тетраэтилсвинца, исключает загрязнение окружающей среды, экологически опасными соединениями свинца. При работе двигателя на высокооктановом бензине уменьшается объем СО в выхлопных газах, поскольку происходит полное сгорание топлива.
При изучении природных источников углеводородов необходимо познакомить учащихся с основными направлениями совершенствования технологического процесса: термическая подготовка шихты для коксования, увеличение единичной мощности коксовых печей; применение сухого тушения кокса с помощью инертных газов.
С ролью фенола как загрязнителя атмосферы знакомим учащихся после изучения его свойств. Попадая в растение, скапливаясь в мясе рыб, фенол с пищей попадает в организм человека. ПДК фенола в водоемах не должна превышать 0,001мг/л. Наибольший выброс фенола в окружающую среду дают производство пластмасс, коксохимическое и анилинокрасное производство. Чтобы предотвратить выброс фенола в окружающую среду, газы, содержащие фенол, подвергают каталитическому окислению.
Среди веществ-загрязнителей особо опасными являются ядохимикаты . Они используются не только на полях в сельском хозяйстве, они нашли широкое применение в быту в борьбе с переносчиками инфекционных заболеваний человека и животных, с членистоногими в бытовых условиях. При обработке ядохимикатами гибнут растения, животные, может погибнуть человек. Последствия действия ядохимикатов на генный аппарат еще недостаточно установлены, но исследования показывают, что их действие на организм наносит большой вред здоровью человека.
При изучении учащимися галогенопроизводных углеводородов необходимо указать на их роль в разрушении озонового слоя Земли. Это фреоны – хладагенты, аэрозоли, распылители и т.д. В атмосфере фреоны разлагаются с выделением оксидов хлора и губительно действуют на молекулы озона. Поэтому следует обратить внимание учащихся на понимание необходимости ограничения их использования.
 |
В нашей стране принимаются меры соблюдения необходимых технологических требований при производстве, при применении и транспортировке ядохимикатов. Ведется изучение механизма и скорости распада ядохимикатов в окружающей среде, а также продуктов их превращения, изучения токсичности ядохимикатов, чтобы обеспечить их безопасность для окружающей среды.
Экологизация в идеале означает создание промышленности, которая была бы изолирована от среды жизни. Настоящая техносфера не должна воздействовать на естественные процессы, текущие в не ее.
Отодвигание задач охраны живой природы на второй план противоречит созданию адекватных условий жизни человека на нашей планете.
Земля – наш общий дом. Это маленький шар во Вселенной, единственное место, где есть человек. Страны – бедные и богатые, маленькие и большие, люди – обитатели хижин и небоскребов, тундр и тропических лесов – все мы на одном корабле. У нас нет иной Земли, кроме нашей. Пусть живет в нас и в наших детях неугасимая любовь к природе, преклонения перед каждой травинкой, речушкой, родником.
Не допустим экологической катастрофы, которая обернется гибелью всего живого на Земле. Спасать нашу планету надо уже сегодня!
«Берегите эти земли, эти воды,
Даже малую былиночку любя
Берегите всех зверей внутри природы,
Рекомендуемая литература:
Миркин Б.М., Наумова Л.Г., Куршаков С.В., Юнусбаев Б.Х. Хрестоматия по экологии: Кн. Для учителя; Суравегина И.Т., Сенкевич В.М., Как учить экологии; Миркин Б.М., Наумова Л.Г. Экологическая азбука школьника; Польские химические олимпиады. Сборник задач. Хомченко П.П., Хомченко И.Г. Задачи по химии для поступающих в вузы; Гаврусейко Н.П. Задания для самостоятельной работы учащихся по органической химии; Гаврусейко Н.П. Задания для самостоятельной работы учащихся по химии (9-й кл.); Гаврусейко Н.П. Сборник самостоятельных и контрольных работ по химии; А.Н. Петин Экология 2005 г.
Главным источником загрязнения атмосферы являются предприятия черной и цветной металлургии, тепловые электростанции и автомобильный транспорт. Выбросы в атмосферу содержат оксиды углерода, азота и серы, углеводороды, соединения металлов и пыль.
При попадании в атмосферу углерод постоянно переходит из органических соединений в неорганические и наоборот. Это проявляется как в процессе фотосинтеза – образовании органических соединений из CO2 и воды в растениях под действием света, так и при дыхании человека и животных – кислород воздух при дыхании переходит в CO2, который возвращается в атмосферу.

Рис. 1 Кислотные осадки и их влияние на экосистему.
Составные части выхлопных газов автомобилей (CO, SO2, оксиды азота, тяжелые металлы) наносят огромный вред флоре и фауне планеты, а также могут быть причиной образования фотохимического смога, образование которого можно представить следующим образом:
2NO + O2 =2NO2 (окисление NO, выделяющегося с выхлопными газами)
NO2 + O2= NO + O3 (распад NO2 под действием УФ-излучения солнца)
Образующийся в результате озон может вступать в реакции с углеводородами, находящимися в атмосфере, тем самым приводя к образованию смога.
Сжигание топлива, мусора, а также работа металлургической промышленности – основные источниками загрязнения атмосферы тяжелыми металлами, такими, как Zn, Co, Ni, U, Sn, Ge, Pb, Be, V, Hg, Mo, As и др.
Рассмотрим негативное воздействие присутствия тяжелых металлов в атмосфере на организм человека и окружающую среду на примере свинца, поскольку этот металл обладает кумулятивными (накопительными) свойствами. Свинец оказывает воздействие на ферментные системы и обмен веществ, способен накапливаться не только в организме человека, но и в морских отложениях, и в пресной воде.
Свинец вызывает обширные патологические изменения в нервной системе, крови, сосудах, активно влияет на синтез белка, энергетический обмен клетки и её генетический аппарат, подавляет кровообразование; нарушает белковый и углеводный обмены, способен заменять кальций в костях. Соединения свинца могут вызвать мутации и репарации ДНК.
Загрязнение водных ресурсов
Количество растворенного в воде кислорода – один из важнейших показателей качества воды, поскольку он необходим для жизни обитателей водоемов. При избыточном присутствии в воде органических веществ количество растворенного кислорода уменьшается, в результате чего происходит гибель рыбы и других обитателей водоемов, в вода приобретает гнилостный запах (процесс разложения органических веществ вместо аэробных бактерий осуществляют анаэробные, в результате чего выделяется CH4, NH3, H2S и PH3).
Большой вред водным ресурсам наносят растворенные в воде минеральные удобрения, смываемые с поверхности почвы (нитраты, фосфаты и др.), вызывающие бурное развитие сорной травы и водорослей, что приводит к засорению водоемов и их гибели.
Промышленные сточные воды, содержащие огромное количество ядовитых для обитателей водоемов веществ, также оказывают негативное влияние на водные ресурсы планеты.
Загрязнение почв
Основная проблема, полученная человеком в результате загрязнения почв – её эрозия, т.е. разрушение плодородного слоя.
Применение минеральных азотных удобрений сильно загрязняет почву, поскольку нитраты накапливаются не только в почвах, но и в растениях, что приводит к ухудшению качества выращиваемой с/х продукции и отрицательному их действию на здоровье человека и животных. Нерациональное применение пестицидов также оказывает отрицательное воздействие на почву, среди которых наибольший вред наносят хлорорганические соединения (полихлорпинен, ДДТ).
Различные предприятия промышленности, а также транспортные магистрали в разной степени оказывают вредное воздействие на почву, путем ее загрязнения тяжелыми металлами (Pd, Cd, Cu, Zn, Hg, Bi), халькогенами (Se, Те и др.) и галогенами (F, Вг и др.).
Читайте также:

