Характеристика природных вод реферат
Обновлено: 06.07.2024
Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Водой покрыто 71% Земли, но лишь 2,5% (по массе) и 0,3% (по объему) -это пресная питьевая вода. При этом 0,2% этой воды - это вода полярных льдов. Поэтому рациональное использование и очистка природных вод является очень важной задачей.
Абсолютно чистой воды в природе не существует, потому что она есть лучший растворитель газов ( O2, N2, CO2, H2 S) и твердых веществ (минералов, пород, руд). Кроме того, в природных водах много органических веществ, являющихся продуктами жизнедеятельности водных организмов.
Таким образом, природные воды - это сложные многокомпонентные системы содержащие растворенные вещества в ионном или молекулярном виде, неорганические и органические в форме коллоидов, суспензий и эмульсий. Совокупность растительных и животных организмов, которые находятся в воде во взвешенном состоянии, составляют планктон. Организмы, обитающие на дне водоемов, составляют бентос.
Классификация природных вод
Большое разнообразие качественного и количественного состава природных вод не позволяет классифицировать их по какому-то одному признаку. Поэтому существует большое количество различных классификаций [10]. Наиболее распространенными являются классификации В. О. Алекіна, С.А. Щукарева, Л. А. Кульского, О. И. Перельмана, В. К. Хільчевського т.д. Рассмотрим некоторые из них.
I. По происхождению воды разделяют на:
• атмосферные (снег, дождь).
• подземные ( грунтовые, артезианские, родниковые, колодезные).
• поверхностные (океаны, моря, озера и т.п.).
II. По величине минерализации (г/дм3)
Согласно ГОСТ 27065-86 (СТ СЭВ 5184-85), под минерализацией воды понимают суммарную концентрацию анионов, катионов и растворимых в воде неорганических веществ в г/дм3 [11]. По минерализации воды делят на 4 вида.
По преимущественным содержанием того или иного аниона природные воды делят на 3 класса (классификация А.А. Алекина):
• гидрокарбонатные воды (в основном поверхностные воды - воды рек, озер) ;
• хлоридные воды (воды океанов, морей, соленых озер);
• сульфатные воды (некоторые колодезные воды).
Каждый класс природных вод с преимущественным содержанием катиона делят на 3 группы: кальциевая вода; магниевая вода; натриевая вода.
В соответствии с основными звеньями круговорота воды в природе различают воду атмосферную, поверхностную, грунтовую и морскую.
Атмосферная вода, выпадающая на земную поверхность, является наиболее чистой природной водой. Но и она содержит, кроме газов (кислорода, азота и углекислоты), поглощаемых ею из воздуха, органические и неорганические вещества, количество и состав которых зависят от характера атмосферы. В районе больших населенных пунктов и промышленных центров атмосферные осадки содержат сероводород, сернистую и серные кислоты, частицы пыли и сажи. Вблизи моря в дождевых водах обнаруживается некоторое количество растворенного хлористого натрия. Общее солесодержание атмосферной воды обычно не превышает 50 мг/л, а содержание в ней накипеобразующих солей ничтожно. Использование атмосферной воды для технических целей ограничивается трудностью сбора ее в значительных количествах.
Воды поверхностная, грунтовая и морская являются более минерализованными, чем атмосферная вода, и в большинстве случаев не могут непосредственно, без предварительной обработки, применяться для технических целей. Поверхностные воды рек, озер и искусственных водохранилищ всегда содержат то или иное количество растворенных веществ и нерастворимых механических примесей.
Растворенными веществами вода обогащается в результате контакта с различными горными породами при протекании по руслам рек и фильтрации через грунт. Просачиваясь через верхние слои почвы, представляющие собой мелкозернистые породы, вода освобождается от механических примесей, но одновременно обогащается солями, газами и органическими веществами, представляющими собой продукты разложения растительных и животных организмов.
Происходящие в почвах процессы окисления органических веществ вызывают расход кислорода и выделение углекислоты. Это имеет существенное значение для обогащения воды труднорастворимыми карбонатами (см. ниже).
Особенно интенсивно обогащают воду осадочные породы (известняки, доломиты, мергели, гипс, каменная соль и др.). Подпочвенными водами легче всего растворяются NaCl Na2SО4, MgSО4 и другие легкорастворимые соли. Обогащение природных вод труднорастворимыми карбонатами кальция СаСО3, магния MgCО3 и железа FeCО3 происходит не путем прямого растворения, а благодаря следующим химическим реакциям, которые протекают при наличии в воде свободной углекислоты:
В результате этих реакций образуются легкорастворимые в воде двууглекислые соединения - бикарбонаты кальция, магния и железа, диссоциирующие на катионы Са 2+ , Mg 2+ , Fe 2+ и анионы НСО3 - . Так как углекислые соли кальция и магния встречаются весьма часто в виде различных пород, например известняков, меловых отложений и доломитов, то бикарбонаты кальция и магния содержатся почти во всех природных водах в тех или иных количествах.
Коренные горные породы, представляющие собой сложные силикаты и алюмосиликаты (граниты, кварцевые породы и т. п.), почти нерастворимы в воде и лишь при продолжительном воздействии на них воды, содержащей органические кислоты, они, подвергаясь разрушению, образуют растворимые в воде силикаты.
Подземные воды, выходящие на поверхность из артезианских скважин, родников и ключей, называют грунтовыми. Грунтовые воды обычно бывают прозрачными, практически не содержащими механических и коллоидных примесей, от которых они освобождаются в процессе фильтрации через толщу грунта. Но при прохождении через грунт вода насыщается различными растворимыми веществами, вследствие чего солесодержание грунтовых вод, как правило, выше, чем поверхностных.
Из природных вод наиболее минерализованными являются воды океанов, открытых морей и соленых озер.
Кроме естественного кругооборота воды, существует также искусственный, созданный жизнедеятельностью человека. Вода из источников водоснабжения забирается насосами промышленных и коммунальных водопроводов, подается по трубам для того или иного употребления, заканчивающегося, как правило, ухудшением ее качества, после чего сточные воды спускаются в водоемы иногда после предварительной очистки, а нередко и без всякой очистки. В результате этого многие реки, являясь основными источниками водоснабжения, сильно загрязняются промышленными и бытовыми стоками. Загрязненная этими стоками вода вновь забирается водоприемниками нижележащих водопроводов и т. д. При дефиците воды такой кругооборот иногда замыкается внутри одного и того же предприятия.
С промышленными сточными водами фабрик, заводов, рудников и коммунальных предприятий в источники водоснабжения могут попадать свободные кислоты и щелочи, соединения меди, свинца, цинка, алюминия, а также некоторые органические соединения: фенолы, эфирные масла, нефтяные продукты и т. п. В сточных водах населенных пунктов присутствуют продукты разложения белков: амиды, амины, аммиак, сероводород и т. п. Такие стоки могут иногда радикально менять состав воды в водоемах в самых разнообразных отношениях, как это наблюдается, например, в случае химических, коксобензольных, нефтеперегонных и других заводов.
Степень загрязнения реки зависит от количества сточных вод, спускаемых в реку, живого сечения реки, скорости ее течения и величины самоочищающего действия реки. Последнее заключается в том, что взвешенные вещества постепенно осаждаются на дно, а органические вещества, окисляясь, переходят в газообразное состояние.
В оздоровлении реки большую роль играют также химико-биологические и чисто биологические процессы, основанные на жизнедеятельности животных и растительных микроорганизмов.
При использовании тепловыми электростанциями воды из загрязненных рек необходима сложная обработка ее, что требует дополнительных затрат, ухудшает эксплуатацию оборудования и снижает экономичность работы электростанции. Поэтому охрана водоемов и рек от загрязнений является важной народнохозяйственной задачей, разрешение которой требует проведения надлежащей предварительной очистки всех сточных вод перед спуском их в источники водоснабжения.
Жизнь на Земле является совокупностью многочисленных сложных процессов, основное место среди которых занимает круговорот тепла, влаги и веществ. Главную роль в этом играет вода - прародительница жизни на Земле.
Но случайно ли то, что наша жизнь неотделима от воды, и каковы основания этого?
В отличие от обычных людей, которые привыкли считать воду чем-то настолько обыйденным и привычным, что не стоит долгих размышлений, а тем более удивления, ученые считают эту жидкость самой загадочной и удивительной. Например, многие свойства воды аномальны, то есть существенно отличаются от соответствующих свойств соединений аналогичного строения. Как ни странно, но именно аномальные свойства воды дали этой жидкости возможность стать самоглавной на Земле.
В свободном состоянии на Земле содержится колоссальное количество воды - около полутора миллиардов кубических километров. Почти столько же воды находится в физически и химически связанном состоянии в составе кристаллических и осадочных пород.
Большая часть природных вод представляет собой растворы, содержание растворенных веществ в которых колеблется от 0,01 % (в пресных водах) до 3.5 % (в морской воде).
На долю пресной воды приходится только около 3 % всего запаса воды на планете (приблизительно 35 млн км3). Человек на свои нужды может непосредственно использовать только 0,006 % пресной воды - это та ее часть, которая содержится в руслах всех рек и в озерах. Остальная часть пресных вод труднодоступна - 70 % представляют собой ледниковые покровы полярных районов или горные ледники, 30 % - подземные водоносные слои.
Без преувеличения можно сказать, что наша планета пропитана водой. Именно, благодаря этому на Земле стало возможным развитие тех форм жизни, которые мы видим вокруг себя.
СПОСОБСТВОВАВШИЕ ПОЯВЛЕНИЮ ЖИЗНИ НА ЗЕМЛЕ
Сравнивая свойства воды со свойствами соединений-аналогов, приходим к выводу, что многие характеристики воды имеют аномальные значения. Как будет сказано ниже, именно эта аномальность свойств сыграет важнейшую для зарождения и существования жизни на Земле.
Температура темпер кипения
Рассмотрим тимпературы кипения соединений ряда Н2Эл, где Эл - элемент главной подгруппы VI группы.
t°с кип . +100 -60 -41 -2
Как видно, температура кипения воды резко отличается от температуры кипения соединений элементов-аналогов и имеет аномально высокое значение. Установлено, что подобная аномалия наблюдается для всех соединений типа Н2Эл, где Эл - сильно электроотрицательный неметалл (О, N и т. д.).
Если в ряду H2Te-H2Se-H2S температура кипения понижается равномерно, то от H2S к Н20 она скачкообразно возрастает. То же наблюдается для ряда HI -HBr-HCl-HF и H3Sb-H3As-H3P-H3N. Предположили, а впоследствии и доказали, что между молекулами Н20 существуют специфические связи, на разрыв которых и расходуется энергия нагревания. Эти же связи затрудняют отрыв молекул HF и H3N. Такой вид связи получил название водородной связи, смотрим его механизм.
Способность воды образовывать водородные связи имеет важное биохимическое значение.
Плотность
Для всех веществ характерно увеличение плотности при снижении температуры. Однако вода в этом случае ведет себя несколько необычно.
Минимальная температура, при которой вода может находиться, не замерзая, равна 0 "С. Было бы логично предположить, что наибольшая плотность воды также соответствует этой температуре. Однако экспериментально было доказано, что плотность жидкой воды максимальна при 4 °С.
Этот факт имеет колоссальное значение. Представим себе, что вода подчиняется закономерностям, характерным для всех других жидкостей. Тогда изменение ее плотности происходило бы, как у других жидкостей. В окружающем нас мире это привело бы к катастрофе: с приближением зимы и повсеместным похолоданием верхние слои жидкости в водоемах остывали бы и опускались на дно. Поднявшиеся на их место более теплые слои жидкости также охлаждались бы до 0 °С и опускались. Это продолжалось бы до тех пор, пока вся вода не охладилась до О °С. Далее вода, начиная с верхних слоев, начала бы замерзать. Будучи более плотным, лед опускался бы на дно, замерзание продолжалось бы до тех пор, пока вся вода природных водоемов не промерзла до дна. Понятно, что в таких условиях флора и фауна природных водоемов существовать не могла бы.
Другая аномалия плотности воды состоит в том, что плотность льда ниже, чем плотность воды, т. е. вода при замерзании не сжимается, как все другие жидкости, а наоборот - расширяется.
С точки зрения законов физики это абсурд, ведь более упорядоченное состояние молекул (лед) не может занимать больший объем, чем менее упорядоченное (жидкая вода) при условии,что количество молекул в обоих состояниях одинаково.
Как уже было сказано, в жидкой воде молекулы Н20 связаны между собой водородными связями. Образование кристаллов льда сопровождается образованием новых водородных связей, в результате чего молекулы воды образуют слои. Связь между слоями также осуществляется за счет водородных связей. Полученная структура (т. н. структура льда) относится к наименее плотным - пустоты, имеющиеся между молекулами в кристалле льда, превышают по величине молекулы воды. Поэтому плотность воды имеет большее значение, чем плотность льда.
Как правило, под поверхностным натяжением жидкости понимают силу, действующую на единицу длины контура поверхности раздела фаз и стремящуюся сократить эту поверхность до минимума. Величина поверхностного натяжения для воды имеет аномально высокое значение - 7,3 •10 -2 Н/м при 20 0 С (из всех жидкостей более высокое значение имеет только ртуть - 51 10 -2 Н/м).
Высокое значение поверхностного натяжения воды проявляется в том, что она стремится сократить свою поверхность до минимальной. Можно сказать, что под действием этой силы молекулы внешнего слоя воды сцепляются, образуя на поверхности некоторое подобие пленки. Она настолько прочна и упруга, что отдельные предметы имеют возможность держаться на поверхности воды, не погружаясь в нее, даже если их плотность больше плотности воды.
Наличие пленки дает возможность многим насекомым передвигаться на поверхности воды и даже садиться на нее, как на твердую поверхность.
Внутренняя сторона поверхности воды также активно используется живыми существами. Многим из нас доводилось видеть повисающих на ней личинок комаров или ползающих в поисках добычи маленьких улиток.
Высокое поверхностное натяжение обусловливает и такое необычайно важное в природе явление, как капиллярность (жидкость поднимается по очень тонким трубкам - капиллярам). Благодаря этому осуществляется питаний растений.
Для описания поведения воды в капиллярах выведены довольно сложные физические закономерности. Слои воды, расположенные вблизи твердой поверхности, структурно упорядочены. Толщина такого слоя может достигать десятков и сотен молекул. Сейчас ученые склоняются к тому, чтобы считать структурно упорядоченное состояние воды в капиллярах отдельным состоянием-капиллярным.
Капиллярная вода широко распространена в природе в виде так называемой поровой воды. Тонкой, но плотной пленкой она покрывает поверхности пор и трещин пород и минералов земной коры. Плотность этой пленки обусловлена и тем, что составляющие ее молекулы воды связаны с частицами, образующими твердое тело, межмолекулярными силами. Структурная упорядоченность поровой воды являеотся причиной того , что температура её кристализации ( замерзания) заметно ниже температуры свободной воды. Кроме того, свойства горных пород, с которыми соприкасается поровая вода, существенно зависят от того, в каком агрегатном состоянии она находится .[/sms]
С давних пор человек внимательно изучает свойства воды. В 1974 г. по решению ЮНЕСКО отмечалось 300-летие науки о воде — гидрологии. Гидросфера, являясь важнейшим элементом биосферы, играет решающую роль во многих процессах, протекающих в природе, и в обеспечении жизни человека. Вода широко используется человеком для его практической деятельности в промышленности, сельском и городском хозяйстве. Она применяется как сырье и хладагент, как источник энергии, для орошения полей, садов и огородов, для создания комфорта в городах и поселках, а водные магистрали— для транспортировки грузов и людей.
Вода всегда привлекала внимание не только тех, кто искал пути ее использования для практики, но и служила предметом вдохновения писателей, поэтов, художников.В связи с ростом народонаселения количество воды, приходящейся на одного жителя земли, постепенно уменьшается.
В настоящее время на человека в сутки приходится в среднем 33 м 3 воды из природных источников. В отдельных странах, этот показатель различается очень сильно: в Норвегии - 250, в Бразилии - 100, в США - 34 (без Аляски -20), в Румынии и Венгрии-11, в Китае и Индии - 9, в Польше, в Германии - 4,5, Египте - 3,5.
Недостаток пресной воды в городе Севастополе ощущался всегда, с момента его основания. Городские колодцы не могли обеспечить водой население и флот. С 1784 года в Севастополе началась прокладка водопровода. Еще острее стал вопрос о снабжении города пресной водой с расцветом парусной эпохи Черноморского флота.
Сегодня, в XXI веке, вопрос об обеспечении севастопольцев качественной водой для бытовых нужд стоит особенно остро.
Характеристика природных вод
Вода в природе, как это показано на рис. 1, находится в круговороте. Под действием солнечного тепла она испаряется с поверхности мирового океана, морей, рек и озер и затем осаждается на поверхность водных бассейнов и суши.
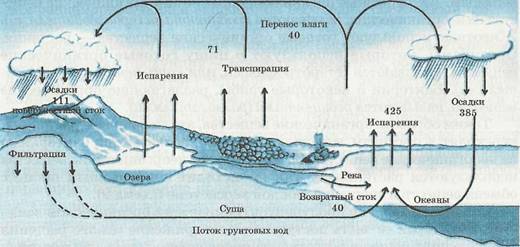
Рис. 1. Круговорот воды в природе
В настоящее время человек использует для своих нужд примерно 3000 куб. км стоков в год, в том числе для промышленный целей 600 куб. км. Объем гидросферы - 1389 млн. куб. км. Она занимает примерно 3/4 поверхности Земли - 449,53 млн. кв. км (суша - 165,34 млн. кв. км). Из общего количества воды 1350 млн. куб. км, или свыше 97,2% — океанская вода. Баланс других источников (в куб. км) воды приведен ниже:
| Полярные льды и ледники | 29х10 9 |
| Грунтовые воды | |
| до глубины в 750 м | 4,2х10 6 |
| на глубине 750-4000 м | 5,3х10 6 |
| вода в озерах | 120х10 3 |
| вода в реках | 12х10 3 |
| влага в почве | 24х10 3 |
| влага в атмосфере | 13х10 3 |
| Всего | 39х10 6 |
Значительное количество воды, порядка (10-11)х10 3 куб. кмявляется составной частью живых организмов, обитающих на земле. Организм человека примерно на 70% состоит из воды. Ежедневно человек поглощает 2 л воды.
Читайте также:

