Гниение белков в кишечнике биохимия реферат
Обновлено: 30.06.2024
Среди многочисленных разделов биологической химии и физиологии особое место занимают вопросы биохимии питания и пищеварении, так как часто именно с проблем питания начинаются проблемы здоровья.
Рациональное питание – это полноценное питание здоровых людей, которое является разнообразным и сбалансированным по всем параметрам. Рациональное питание – одна из главных составных частей здорового образа жизни. Первый принцип рационального питания заключается в том, что его энергетическая ценность должна соответствовать энергозатратам организма. Актуальность этого принципа обусловлена тем, что очень часто в рацион питания включаются избыточные количества энергоемких продуктов (хлеб, картофель, животные жиры, сахар и др.), что наряду со снижением двигательной активности приводит к возникновению избыточной массы тела и развитию ожирения, ускоряющих появление многих хронических заболеваний.
Второй принцип рационального питания – соответствие химического состава пищевых веществ физиологическим потребностям организма. Ежедневно в определенном количестве и соотношении в организм должно поступать около 70 ингредиентов, многие из которых не синтезируются в организме и поэтому являются жизненно необходимыми. Оптимальное снабжение организма этими пищевыми веществами возможно только при разнообразном питании. Максимальное разнообразие питания определяет третий принцип рационального питания. Наконец, соблюдение оптимального режима питания является следующим принципом рационального питания. Режим питания, также как и потребность в пищевых веществах и энергии, варьирует в зависимости от возраста, физической активности. Соблюдение основных принципов рационального питания делает его полноценным.
Современные научные исследования позволяют авторам этого пособия настойчиво рекомендовать студентам-медикам обратить самое пристальное внимание на вопросы биохимии и физиологии питания, так как в неблагоприятных экологических условиях возрастает значение защитных свойств пищи и специальных пищевых добавок.
Конечно, этому должно способствовать глубокое понимание сути процессов пищеварения, знание особенностей анатомии, физиологии, гистологии органов пищеварительного тракта, биохимии процессов переваривания и всасывания продуктов питания человека в разные возрастные периоды.
Представленное пособие состоит из введения, 3-х глав и раздела для закрепления и контроля усвоения темы.
Во введении авторы пособия обращают внимание студентов на необходимость изучения вопросов физиологии и биохимии пищеварения, подчеркивают значимость данного раздела для профессиональной деятельности врача.
Незаменимыми нутриентами служат витамины. В пособии приведены их классификация, причины развития алиментарных гипо-, авитаминозов, дана краткая характеристики ряда витаминов.
Заканчивается первая глава пособия описанием роли минеральных веществ и воды в организме человека.
Третья глава посвящена вопросам регуляции пищеварения, показаны основные регуляторы и их характеристика.
Рецензенты пособия: Коткова Т.В. –кандидат биологических наук, профессор РАЕ, доцент кафедры химии Оренбургского государственного аграрного университета;
Денисов Е.Н. –доктор медицинских наук, доцент, заведующий кафедрой биофизики и математики Оренбургского государственного медицинского университета.
Учебное издание способствует формированию у студентов следующей общекультурной компетенции (ОК): (способность и готовность анализировать социально-значимые проблемы и процессы, использовать на практике методы гуманитарных, естественнонаучных, медико-биологических и клинических наук в различных видах профессиональной и социальной деятельности (ОК-1)); и профессиональной компетенции способность и готовность к постановке диагноза на основании результатов биохимических исследований биологических жидкостей и с учетом законов течения патологии по органам, системам и организма в целом (ПК-15).
Биохимия процесса гниения белков. Метаболизм продуктов гниения белка в организме при избыточном потреблении пищевых белков и в патологических состояниях. Последствия гниения белка в кишечнике. Сбалансированный рацион, состоящий из овощей и фруктов.
| Рубрика | Биология и естествознание |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 25.05.2019 |
| Размер файла | 199,2 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Витебский государственный университет ордена дружбы народов
Гниение белков в кишечнике
Биохимия процесса гниения белков
Метаболизм продуктов гниения белка в организме
Последствия гниения белка в кишечнике человека
При избыточном потреблении пищевых белков и ряде патологических состояний (синдром мальдигестии (нарушения переваривания) белков и мальабсорбции (нарушения всасывания) аминокислот, кишечная непроходимость) в нижних отделах кишечника возможно развитие гнилостных и бродильных процессов. Под действием микрофлоры кишечника происходят превращения аминокислот, получившие название гниение белков в кишечнике. В результате гниения белков аминокислоты используются бактериями кишечника как энергетический материал и разрушаются с образованием ядовитых соединений - спиртов, альдегидов, аминов (путресцин, кадаверин, фенилэтиламин), аммиака, сероводорода, фенола, крезола, скатола, индола и др., которые, всасываясь в кровь, могут оказывать токсическое действие на организм. Эти соединения частично выводятся из организма с калом и кишечными газами, частично всасываются в кровь, переносятся ею в печень, где происходит их обезвреживание.
Биохимия процесса гниения белков
Ещё в начале ХХ века великий физиолог И. Мечников утверждал, что процессы гниения белковой пищи в кишечнике и вызываемая ими аутоинтоксикация - главное препятствие в достижении долголетия. В своих экспериментах он вводил подопытным животным гнилостные продукты из кишечника человека и получал у них различные патологические состояния организма.
Многочисленные гнилостные микроорганизмы кишечника для своего роста и размножения могут использовать целый ряд аминокислот: цистин, цистеин, метионин, орнитин, лизин, фенилаланин, тирозин и триптофан. Эти аминокислоты присутствуют в любых белках и поэтому процесс гниения в равной степени присущ как животной, так и растительной пище. Причём независимо от того, прошла она термообработку или нет.
Патогенная микрофлора кишечника располагает набором ферментных систем, отличных от соответствующих ферментов человека и катализирующих самые разнообразные превращения аминокислот и белков пищи.(i) Поэтому на высокобелковом рационе в кишечнике человека создаются оптимальные условия для образования ядовитых продуктов распада аминокислот: фенола, индола, крезола, скатола, сероводорода, метилмеркаптана, кадаверина, путресцина и т.д.
Суммарное токсическое действие этих веществ оказывает отрицательный эффект на весь организм человека. Даже в малых концентрациях продукты гниения белка могут вызывать головную боль, тошноту и общее ухудшение самочувствия. Ну а в высоких концентрациях многие из этих соединений обладают нейротоксичным действием, поражают центральную нервную систему, вызывают психические и неврологические расстройства, а также могут провоцировать депрессию.
Диаминокислоты - орнитин и лизин - подвергаются процессу декарбоксилирования с образованием токсичных аминов - путресцина и кадаверина.
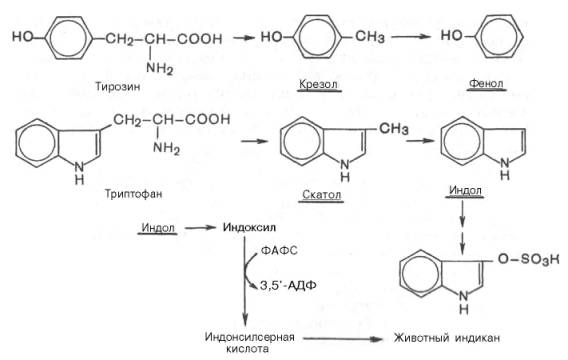
Из ароматических аминокислот: фенилаланин, тирозин и триптофан - при аналогичном бактериальном декарбоксилировании образуются соответствующие амины: фенилэтиламин, параоксифенилэтиламин и индолилэтиламин (триптамин).
Кроме того, микробные ферменты кишечника вызывают постепенноеразрушение боковых цепей циклических аминокислот, в частности тирозина и триптофана, с образованием ядовитых продуктов обмена - соответственно крезола и фенола, скатола и индола.
Рис. 1 - Образования ядовитых продуктов обмена ароматических аминокислот
После всасывания эти продукты через воротную вену попадают в печень, где подвергаются обезвреживанию путем химического связывания с серной или глюкуроновой кислотой с образованием нетоксичных, так называемых парных, кислот (например, фенолсерная кислота или ска-токсилсерная кислота). Последние выделяются с мочой. Механизм обезвреживания этих продуктов изучен детально.
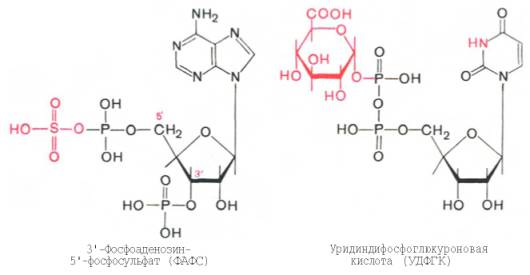
В печени содержатся специфические ферменты - арилсульфотрансфераза и УДФ-глюкоронилтран-сфераза, катализирующие соответственно перенос остатка серной кислоты из ее связанной формы - 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) и остатка глюкуроновой кислоты также из ее связанной формы - уридил-дифосфоглюкуроновой кислоты (УДФГК) на любой из указанных продуктов.
Рис. 2 - ФАФС и УДФГК
Индол (как и скатол) предварительно подвергается окислению в индоксил (соответственно скатоксил), который взаимодействует непосредственно в ферментативной реакции с ФАФС или с УДФГК. Так, индол связывается в виде эфиросерной кислоты. Калиевая соль этой кислоты получила название животного индикана, который выводится с мочой.
Рис. 3 - Образование гиппуровой кислоты
По количеству индикана в моче человека можно судить не только о скорости процесса гниения белков в кишечнике, но и о функциональном состоянии печени.
Метаболизм продуктов гниения белка в организме
Невсосавшиеся в кишечнике человека аминокислоты высокобелковой пищи используются патогенной микрофлорой толстой кишки в качестве энергетического субстрата. Ферменты этих гнилостных бактерий расщепляют аминокислоты и превращают их в амины, фенолы, индол, скатол, сероводород и другие ядовитые для организма соединения.
В теле человека эти чужеродные вещества (ксенобиотики) превращаются в менее токсичные, и даже нейтральные вещества. Процессы метаболизма ксенобиотиков осуществляются в любой клетке и обычно они приводят к превращению этих веществ в более водорастворимые и менее токсичные продукты обмена. Происходит это путем окисления токсинов специальными ферментами - оксидазами, а затем конъюгации (соединения) полученных метаболитов с теми или иными нейтральными веществами.
Первая фаза метаболизма - окисление
Этот процесс происходит на главных путях поступления ксенобиотиков в организм - пищевом (печень и желудочно-кишечный тракт) и дыхательном (легкие). Здесь необходимо отметить, что окисление, восстановление и гидролиз чужеродных соединений осуществляют в основном микросомальные и пероксимальные ферменты.
Это значит, что ходе этого процесса в организме человека образуется большое количество свободных радикалов, известных своими мутагенными и канцерогенными свойствами. Помимо этого, согласно современным исследованиям по гериатрии, повышенное образование свободных радикалов в организме значительно ускоряет старение его тканей.
В клетках печени в результате микросомального и пероксимального окисления эндотоксины приобретают функциональную группу, с которой затем смогут связаться особые нейтрализующие соединения.
Вторая фаза метаболизма - конъюгация
Основная функция этой фазы это присоединение к эндотоксину обезвреживающих элементов, например серной или глюкуроновой кислоты. Такое изменение свойств исходной молекулы токсина увеличивает её гидрофильность, то есть способствует появлению вокруг ксенобиотика сольватной оболочки из поляризованных молекул воды.
Функционирование второй фазы ограничивается тем, что в ней участвуют только те вещества, которые уже прошли первую фазу метаболизма ксенобиотиков. Но с другой стороны эта фаза имеет важное достоинство - ферменты ответственные за присоединение нейтрализующих молекул есть во всех клетках. Поэтому во второй фазе уже вся совокупность клеток организма борется с токсинами, что позволяет эффективно осуществлять или завершать детоксикацию.
Связывание, транспорт и выведение ксенобиотиков
Система обезвреживания образовавшихся в результате гниения белков пищи токсинов включает множество разнообразных ферментов, под действием которых практически любой ксенобиотик может быть нейтрализован.
Большинство ксенобиотиков в результате метаболизма становятся более гидрофильными, поступают в плазму крови, откуда они удаляются почками с мочой. Вещества более гидрофобные или с большой молекулярной массой (>300 кД) чаще выводятся с желчью в кишечник и затем удаляются с калом.
"Кооператив" печень - почки играет важнейшую роль в обезвреживании и выведении из организма большинства ксенобиотиков. Однако несмотря на доминирующую роль печени и почек в метаболизме ксенобиотиков, другие органы также принимают участие в этом процессе. В детоксикации организма, хоть и в меньшей степени принимают слизистые оболочки - желудочно-кишечного тракта, легких и верхних дыхательных путей. Благодаря диффузии ксенобиотики также могут выводиться с молоком кормящих матерей и секретом потовых, сальных, слюнных желез. Существует прямая корреляция между активностью гнилостных процессов в кишечнике и содержанием ксенобиотиков в крови и секрете желез(. )
Образование и обезвреживание крезола и фенола
Под действием ферментов бактерий из аминокислоты тирозина могут образовываться фенол и крезол путём разрушения боковых цепей аминокислот микробами.
Рис. 4. Катаболизм тирозина под действием бактерий. E - бактериальные ферменты.
Всосавшиеся продукты по воротной вене поступают в печень, где обезвреживание фенола и крезола может происходить путём конъюгации с сернокислотным остатком (ФАФС) или с глюкуроновой кислотой в составе УДФ-глюкуроната. Реакции конъюгации фенола и крезола с ФАФС катализирует фермент сульфотрансфераза.
Рис. 5. Конъюгация фенола и крезола с ФАФС. E - сульфотрансфераза.
Конъюгация глюкуроновых кислот с фенолом и крезолом происходит при участии фермента УДФ-глюкуронилтрансферазы. Итоговые продукты конъюгации хорошо растворимы в воде и выводятся с мочой через почки. Повышение количества конъюгатов глюкуроновой кислоты с фенолом и крезолом обнаруживают в моче при увеличении продуктов гниения белков в кишечнике.
Образование и обезвреживание индола и скатола
В кишечнике из аминокислоты триптофана микроорганизмы образуют индол и скатол. Бактерии разрушают боковую цепь триптофана, оставляя нетронутой кольцевую структуру. Индол образуется в результате отщепления бактериями боковой цепи, возможно, в виде серина или аланина.
гниение белок кишечник
Рис. 6. Катаболизм триптофана под действием бактерий. E - бактериальные ферменты.
Скатол и индол обезвреживаются в печени в два этапа. Сначала в результате микросомального окисления они приобретают гидроксильную группу. Так, индол переходит в индоксил, а затем вступает в реакцию конъюгации с ФАФС, образуя индоксилсерную кислоту, калиевая соль которой получила название животного индикана.
Рис. 7. Участие сульфотрансферазы в обезвреживании индола. E - сульфотрансфераза.
Последствия гниения белка в кишечнике человека
1) Закисление тканей и нарушение микроциркуляции. Вследствие того, что в организме человека все вышеперечисленные токсичные продукты гниения белка подвергаются обезвреживанию путем химического связывания с серной или глюкуроновой кислотой, в тканях тела происходит накопление кислых продуктов метаболизма. А, как известно, при сдвигах рН в кислую сторону, происходит дегидратация соединительной ткани и переход межклеточного вещества в состояние плохо проницаемого геля.
В итоге у человека возникает отек и ухудшение микроциркуляции тканей, что неизбежно приводит к нарушению их нормального метаболизма и ослаблению функциональной активности.
2) Воспалительный процесс в кишечнике и печени. Как известно, в зависимости от характера предпочитаемого пищевого субстрата кишечную микрофлору человека разделяют на две основные группы:
Сахаролитическая нормофлора (расщепляет сахара) относится в преимущественно к грамположительным микроорганизмам это бифидобактерии, лактобактерии, энтерококки, клостридии и т.д.
Протеолитическая микрофлора (расщепляет белки) относится в основном к грамотрицательным микроорганизмам это кишечная палочка, бактероиды, протей, фузобактерии и т.д.
Примечательным моментом в этом распределении кишечной микрофлоры является то, что все гнилостные микроорганизмы помимо того, что выделяют ядовитые для организма человека продукты распада аминокислот, ещё и содержат особый эндотоксин - липополисахарид. Это биологически активное вещество является компонентом наружной стенки ВСЕХ грамотрицательных бактерий.
В организме человека эндотоксин проникает через слизистую в ткани и кровь, где распознаётся иммунными клетками (в первую очередь макрофагами) и вызывает сильный иммунный ответ. Именно поэтому бактериальный эндотоксин гнилостной микрофлоры играет ключевую роль в развитии воспалительного процесса в толстом кишечнике, печени и эндотелии кровеносных сосудов.
3) Гипераммониемия (повышение уровня аммиака в организме). В результате гниения белков в кишечнике человека образуется и всасывается в кровь аммиак.
Аммиак - токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего на ЦНС. Этот ядовитый газ легко проникает через мембраны в клетки и изменяет течение некоторых биохимических реакций в митохондриях. Результатом воздействия аммиака на метаболизм тканей мозга является кислородное и энергетическое голодание нейронов, изменение нормального обмена аминокислот, а также подавление синтеза некоторых нейромедиаторов. Поэтому активное гниение белковой пищи в кишечнике может приводить к различным неврологическим и психическим нарушениям.
4) Агрегация эритроцитов. Избыток белка в рационе, приводит к ещё одному нежелательному последствию - агрегации (склеиванию) эритроцитов в монетные столбики или в более крупные комки.
Происходит это потому что при обезвреживания эндотоксинов активированные купферовские клетки и гепатоциты являются источником свободных радикалов, которые инициируют гибель этих клеток.
В этом процессе клетки печени выделяют особые соединения - белки острой фазы воспаления. Как известно именно эти вещества в плазме крови создают оптимальные условия для склеивания красных клеток крови. В свою очередь появление слипшихся монетных столбиков и других агрегатов из эритроцитов вызывает закупоривание мелкие сосудов и капилляров, что в конечном итоге нарушает нормальную микроциркуляцию крови.
Организм человека вынужден применять целый ряд защитных механизмов для обезвреживания токсичных веществ, образующихся в кишечнике из пищевых продуктов с высокой концентрацией белка. Это оказывает повышенную нагрузку на все клетки тела человека и неизбежно приводит к возникновению различных нарушений метаболизма, а также вызывает преждевременное старение организма.
Наполняя свой рацион овощами и фруктами, и ограничивая употребление высокобелковой пищи, люди естественным образом подавляют активность гнилостных микроорганизмов. Уменьшение потока ксенобиотиков и эндотоксинов на низкобелковом питании снижает нагрузку на печень, иммунную и выделительную системы. При этом в теле человека нормализуется обмен веществ, снижается риск возникновения многих заболеваний и продлевается срок жизни клеток всего организма.
При традиционном питании взрослый человек в среднем употребляет 100-120 гр. белка в сутки. На фрукторианстве при наличии в рационе высококалорийных фруктов или растительного масла достаточно употреблять в среднем около 3-4 кг растительной пищи в сутки, в которой общее количество белка находится в пределах 40-60 гр. Это в ДВА-ТРИ РАЗА меньше чем белковая нагрузка всеядного рациона(. ) Но это больше, чем установленный учёными физиологами белковый минимум для взрослого человека (70 кг), определённый на границе 37 гр. белка в сутки.
В наблюдениях проводившихся многие месяцы на людях, было установлено, что можно обеспечить азотистое равновесие посредством именно этого количества белка в рационе. Однако в экспериментах с животными на длительное время (более 5% от средней продолжительности жизни) при белковом минимуме были получены расстройства в ряде систем организма, падения удоев у коров, мышечная атрофия, заболевания кожи и бесплодие. Это означает, что в рационе здорового человека количество белка должно обязательно превышать значение белкового минимума. И это естественным образом получается при сбалансированном рационе состоящем из овощей и фруктов.
Подобные документы
Пищевые белки как основной источник аминокислот для человека. Группы аминокислот, которые встречаются в белках организма. Переваривание белков в желудке и кишечнике. Обезвреживание продуктов гниения путем соединения с серной и глюкуроновой кислотами.
презентация [2,5 M], добавлен 28.12.2013
Изучение кодирования аминокислотной последовательности белков и описание процесса синтеза белка в рибосомах. Генетический код и синтез рибонуклеиновой кислоты. Построение цепи матричной РНК и синтез протеина. Трансляция, сворачивание и транспорт белков.
реферат [3,5 M], добавлен 11.07.2015
История исследования белков. Белки: строение, классификация, обмен. Биосинтез белка. Функции белков в организме. Роль в жизнедеятельности организма. Высокомолекулярные органические соединения. Болезни, связанные с нарушением выработки ферментов.
реферат [29,2 K], добавлен 05.10.2006
Электрофоретическая подвижность белка, влияющие факторов и условия электрофореза. Сущность метода полного разделения сложной смеси белков. Извлечение белков из геля после электрофореза. Гели агарозы и их применения. Влияние вторичной структуры ДНК.
реферат [37,9 K], добавлен 11.12.2009
Результат расщепления и функции белков, жиров и углеводов. Состав белков и их содержание в пищевых продуктах. Механизмы регулирования белкового и жирового обмена. Роль углеводов в организме. Соотношение белков, жиров и углеводов в полноценном рационе.
Известно, что микроорганизмы кишечника для своего роста также нуждаются в доставке с пищей определенных аминокислот. Микрофлора кишечника располагает набором ферментных систем, отличных от соответствующих ферментов животных тканей и катализирующих самые разнообразные превращения пищевых аминокислот. В кишечнике создаются оптимальные условия для образования ядовитых продуктов распада аминокислот: фенола, индола, крезола, скатола, сероводорода, метилмер-каптана, а также нетоксичных для организма соединений: спиртов, аминов, жирных кислот, кетокислот, оксикислот и др.
Из ароматических аминокислот: фенилаланин, тирозин и триптофан – при аналогичном бактериальном декарбоксилировании образуются соответствующие амины: фенилэтиламин, параоксифенилэтиламин (или тира-мин) и индолилэтиламин (триптамин). Кроме того, микробные ферменты кишечника вызывают постепенное разрушение боковых цепей циклических аминокислот, в частности тирозина и триптофана, с образованием ядовитых продуктов обмена – соответственно крезола и фенола, скатола и индола.
После всасывания эти продукты через воротную вену попадают в печень, где подвергаются обезвреживанию путем химического связывания с серной или глюкуроновой кислотой с образованием нетоксичных, так называемых парных, кислот (например, фенолсерная кислота или ска-токсилсерная кислота). Последние выделяются с мочой.
Механизм обезвреживания этих продуктов изучен детально. В печени содержатся специфические ферменты – арилсульфотрансфераза и УДФ-глюкоронилтран-сфераза, катализирующие соответственно перенос остатка серной кислоты из ее связанной формы – 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) и остатка глюкуроновой кислоты также из ее связанной формы – уридил-дифосфоглюкуроновой кислоты (УДФГК) на любой из указанных продуктов.
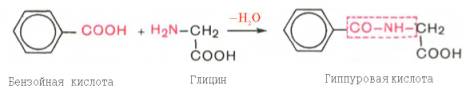
Индол (как и скатол) предварительно подвергается окислению в индоксил (соответственно скатоксил), который взаимодействует непосредственно в ферментативной реакции с ФАФС или с УДФГК. Так, индол связывается в виде эфиросерной кислоты. Калиевая соль этой кислоты получила название животного индикана, который выводится с мочой (см. главу 18). По количеству индикана в моче человека можно судить не только о скорости процесса гниения белков в кишечнике, но и о функциональном состоянии печени. О функции печени и ее роли в обезвреживании токсичных продуктов часто также судят по скорости образования и выделения гиппуровой кислоты с мочой после приема бензойной кислоты (см. главу 16).
Таким образом, организм человека и животных обладает рядом защитных механизмов синтеза, биологическая роль которых заключается в обезвреживании токсичных веществ, поступающих в организм извне или образующихся в кишечнике из пищевых продуктов в результате жизнедеятельности микроорганизмов.
Часть аминокислот не всасывается и подвергается процессам гниения с участием микрофлоры в толстом кишечнике. Продукты гниения аминокислот могут всасываться и попадают в печень, где подвергаются реакциям обезвреживания.
За счет деятельности микрофлоры толстого кишечника а/к подвергаются гниению с образованием ядовитых продуктов: при распаде серусодержащих а/к (цистина, цистеина и метионина) образуются H2S и метилмеркаптан (CH3SH). Диаминокислоты, в частности орнитин и лизин, подвергаются декарбоксилированию с образованием протеиногенных аминов (трупных ядов).

При разрушении фенилаланина, тирозина, триптофана, образуются соответствующие биогенные амины: фенилэтиламин, триптамин, серотонин. При разрушении этих же аминокислот могут образовываться крезол, фенол, скатол, индол, бензол.


Все эти вещества гидрофобны и обладают мембранотропным действием (поражают мембраны клеток печени, эритроцитов, легких). Продукты распада аминокислот поступают в печень, где подвергаются детоксикации. В печени эти продукты обезвреживаются путемконъюгации с серной или глюкуроновой кислотой с образованием нетоксичных парных кислот (фенолсерная, скатоксилсерная).

Происходит это так: в печени содержатся специфические ферменты - арилсульфотрансфераза и УДФ-глюкуронилтрансфераза, которые катализируют перенос остатка серной кислоты из ее связанной формы-ФАФС (фосфоаденозин-фосфосульфат) и остатка глюкуроновой кислоты из ее связанной формы-УДФГК (уридиндифосфоглюкуроновой кислоты) на любой из указанных выше продуктов. Продукты реакции нетоксичные так называемые парные кислоты (например, фенолсерная кислота, скатоксилсерная), выделяются с мочой.
Диагностическое значение индикана: он характеризует содержимое кишечника. Содержание индикана увеличивается при запорах, непроходимости кишечника, при перитонитах и парезах кишечника. В этих случаях индикан появляется в крови и выделяется с мочой в повышенных количествах. Увеличение его концентрации в крови наблюдается на ранних стадиях почечной недостаточности.
Эндогенный пул аминокислот в тканях - пути формирования и утилизации.
Белки организма постоянно находятся в обороте. Оборот белка - это время синтеза и распада белка. В отличие от распада липидов и углеводов, распад белка не находится под контролем гормонов, но зависит от энергетического статуса клетки: распад осуществляется под влиянием протеаз, которые чувствительны к концентрации ионов Ca 2+ . (концентрация Ca 2+ = 10 -7 моль в клетке, 10 -3 моль вне клетки). При нарушении энергообмена Ca-зависимая АТФ-аза не работает и Ca накапливается в клетке, что приводит к активации протеаз и усиленному распаду белка (протеолизу).
Изотопными методами было установлено, что общий метаболический пул а/к на 2/3 состоит из эндогенных а/к, и на 1/3 из экзогенных. Причем исключительно важное значение имеет именно эндогенный пул; который пополняется:
1) за счет гидролиза и протеолиза старых белков;
2) за счет частичного протеолиза прогормонов и протоферментов (система комплемента);
Читайте также:

