Генетическое редактирование человека реферат
Обновлено: 01.07.2024
Так что же такое редактирование генома?
Учёные сравнивают это с программами в компьютере, которые находят и заменяют ошибки в тексте. Только вместо исправления слов, редактор генома исправляет ДНК – биологический код, который является своеобразной "инструкцией" к живым организмам. С помощью редактирования генома исследователи могут деактивировать отдельные гены, корректировать вредоносные мутации и изменять активность специфичных генов у растений и животных – в том числе и у людей.
В чем смысл?
Энтузиазм вокруг темы редактирования генома объясняется возможностью лечить или предотвращать заболевания. Существуют тысячи генетических нарушений, которые передаются от поколения к поколению; многие из них – серьёзные и разрушительные. И они не редки: один ребёнок из двадцати пяти рождается с генетическим заболеванием. Среди самых распространённых – муковисцидоз (заболевание, которое характеризуется поражением желез внешней секреции – прим.), серповидноклеточная анемия (изменение строения белка гемоглобина, ведущее к тяжёлой форме анемии – прим.) и мышечная дистрофия.
Редактирование генома вселяет надежду на то, что эти болезни могут быть побеждены путём "переписывания" повреждённых генов в клетках пациента. Однако починка дефектных генов – это ещё не все возможности; уже есть опыт модифицирования иммунных клеток человека для борьбы с раком или для повышения их устойчивости к ВИЧ-инфекции. Также возможно исправление дефектных генов у человеческого эмбриона – таким образом можно предотвратить наследование серьёзных заболеваний. Но эта технология неоднозначна, так как генетические изменения могут распространиться на сперму или яйцеклетки пациента, то есть все внесённые генетические корректировки и любые побочные эффекты могут быть переданы следующим поколениям.
В каких ещё сферах применяется редактирование генома?
Агроиндустрия совершила большой скачок с помощью редактирования генома по целому ряду причин. Эта процедура быстрее, дешевле и более точная по сравнению с традиционной генетической модификацией, но помимо этого она позволяет производителям улучшать урожай без добавления генов других организмов – это как краеугольный камень всех споров вокруг ГМО в некоторых странах. С помощью редактора генома исследователи вырастили томаты без семян, пшеницу без глютена и грибы, которые не коричневеют со временем.
Некоторые отрасли медицины также воспользовались потенциалом новой технологии. Компании, работающие над производством антибиотиков нового поколения, разработали вирусы, которые сами по себе безопасны, но умеют находить и атаковать специфичные, вызывающие опасные инфекции штаммы бактерий. Также учёные используют редактор генома, чтобы обезопасить пересадку органов свиньи человеку. Помимо этого, редактирование генома повлияло на фундаментальные исследования, позволив учёным более точно понимать, как работают те или иные гены.
Так как это работает?
Напомните-ка, что такое гены?
Ген – это биологический шаблон, который организм использует для создания протеинов и ферментов, необходимых для построения и поддержания тканей и органов. Он представляет собой цепочку генетического кода, обозначаемого буквами G, C, T и A. У человека есть около 20 тысяч генов, сгруппированных в 23 пары хромосом, которые, в свою очередь, содержатся в ядре почти каждой клетки тела. Только около 1.5% нашего генетического кода, или генома, состоят из генов. Ещё 10% регулируют их, удостоверяясь, например, что гены включаются и выключаются в нужных клетках в нужное время. Остальная часть ДНК, судя по всему, бесполезна. "Бóльшая часть нашего генома не делает ничего, – говорит Джертон Лантер, генетик из Оксфордского Университета. – Это просто осколок эволюции".
Что за G, C, T и A?
Буквы генетического кода соответствуют молекулам гуанина (G), цитозина (С), тимина (Т) и аденина (А). В ДНК эти молекулы идут попарно: G и С, Т и А. Эти "основные пары" являются ступенями всем знакомой двойной спирали ДНК. Чтобы составить один ген, нужно много таких ступеней. Мутировавший ген, ответственный за муковисцидоз, содержит около 300.000 базовых пар, а за мышечную дистрофию – около 2,5 миллионов пар, это самый длинный ген в человеческом теле. Каждый из нас наследует от наших родителей около 60 новых мутаций, большинство – от отцов.
Но как добраться до нужных клеток?
Это весьма трудная задача. Большинство лекарств – это маленькие молекулы, которые могут путешествовать по телу с потоком крови, именно так они доставляются к органам и тканям. По сравнению с ними, молекулы, используемые в редакторе генома, огромны и доставить их к клеткам сложно. Но возможно. Один способ – добавить молекулы редактора генома в безвредные вирусы, которые инфицируют определённые типы клеток. Миллионы таких вирусов после этого вводятся в кровь или напрямую в поражённые ткани. Оказавшись в теле, вирусы вторгаются в необходимые клетки и высвобождают молекулы редактора генома, чтобы те делали свою работу. В 2017 году учёные из Техаса таким образом вылечили мышей от мышечной дистрофии Дюшена. Следующий шаг – клинические испытания на человеке.
Однако вирусы – не единственный способ доставить молекулы к клеткам. Исследователи использовали жировые наночастицы для переноса молекул Crispr-Cas9 к печени, а также короткие импульсы электричества, чтобы "открыть" поры эмбриона и через них ввести молекулы редактора генома.
Редактирование обязательно делать в самом организме?
Нет. Во время одного из самых первых испытаний редактора генома учёные забирали клетки из крови пациента, выполняли необходимые генетические корректировки и вводили исправленные клетки обратно. Такой метод выглядит многообещающим для лечения для людей, живущих с ВИЧ. Когда вирус попадает в организм, он инфицирует и убивает иммунные клетки. Но чтобы инфицировать иммунную клетку, ВИЧ сначала должен прицепиться к определённым белкам на её поверхности. Учёные выделили иммунные клетки из крови пациента и использовали редактор генома, чтобы вырезать ту ДНК, которая нужна клеткам для образования этих поверхностных белков. Без них ВИЧ не может получить доступ к клеткам.
Подобный способ может использоваться для борьбы с некоторыми типами рака: иммунные клетки выделяются из крови пациента и редактируются так, что они больше не могут синтезировать поверхностные белки, к которым цепляются раковые клетки. Отредактировав иммунные клетки и сделав из них "убийц рака", учёные размножают их и вводят обратно в организм пациента. Прелесть модифицирования клеток вне организма в том, что всё можно перепроверить до того, как вводить обратно, чтобы убедиться, что процесс редактирования проведён верно.
А что может пойти не так?
Приведёт ли это всё к "редактированию" будущих детей?
Любые изменения на эмбриональной стадии повлияют на все клетки человека и будут переданы его детям, поэтому очень важно избегать вредоносных ошибок и побочных эффектов. Проектирование человеческих эмбрионов также поднимает вопрос непростой перспективы "дизайна" детей, когда эмбрионы редактируются больше по социальным, чем по медицинским причинам; например, чтобы сделать человека выше или умнее. Однако такие черты могут контролироваться тысячами генов, большинство из которых ещё неизвестны. Поэтому на данный момент перспектива редактирования генома будущего потомства весьма отдалённая.
Когда редактирование будет доступно простым пациентам?
Открытие клиникам доступа к редактированию генома – практически на финишной прямой. базовое редактирование для исправления мутаций, которые вызывают серьёзные нарушения кровеносной системы: как, например, гемолитическая анемия у человеческих эмбрионов.
Перемещение генов
Спроектированное перемещение генов может доставить определённые гены целым популяциям организмов. Например, таким образом можно сделать москитов бесплодными и сократить количество заболеваний, которые они распространяют. Но эта технология очень противоречива, так как может иметь широкомасштабные непреднамеренные экологические последствия.
Редактирование эпигенома
Иногда нет цели полностью удалить или заменить ген – необходимо просто ослабить или усилить его активность. Сейчас учёные работают над способностью Crispr выполнять такие задачи, предоставляя его молекулам больше возможностей, чем раньше.

Обзор
Автор
Редакторы

Что такое CRISPR/Cas9 и с чем его едят
Хотя система CRISPR известна с 1980-х, активно о ней заговорили лишь несколько лет назад [1]. Повышенное внимание к технологии генной модификации связано с перспективами, которые она открывает. В частности, лечение генетических заболеваний. Это может изменить медицину. Освоение CRISPR/Cas9 в рамках человеческого тела подобно первым шагам в космосе.
Технология CRISPR (от англ. Clustered Regularly Interspaced Short Palindromic Repeats — короткие палиндромные повторы, регулярно расположенные группами) основана на направленном редактировании генома с помощью эндонуклеазы Cas9. Словно умные ножницы, фермент Cas9 совершает двунитевые разрезы в нужных участках гена, удаляя дефекты генетической информации (рис. 1). После того как разрыв внесен, включаются системы восстановления ДНК, и нужная неповрежденная последовательность встает на место удаленной дефектной [2].

Рисунок 1. Схема работы CRISPR/Cas9.

Рисунок 2. Общественное мнение относительно технологии CRISPR/Cas9.
Еще один шаг к совершенству
Отсутствие стопроцентной точности в работе эндонуклеазы Cas9 делает технологию небезопасной и ненадежной. Пока система не станет более точной, она не получит широкое распространение в практической медицине. Однако маленькие шаги в сторону реальности метода совершаются. Работа ученых из Массачусетского технологического института выводит технологию CRISPR на новый уровень посредством создания улучшенной версии фермента — eSpCas9.
eSpCas9 имеет повышенную специфичность, что снижает вероятность побочных эффектов при редактировании генома. Разрезы этого фермента более точные. Это позволило снизить риск вероятных ошибок примерно в 10 раз. Несомненно, такое открытие — настоящий прорыв для генного редактирования. Оно стало более специфичным и точным, а значит, стало ближе к практической медицине, чем когда-либо [3].
Первый блин комом
В апреле 2015 года мир должен был ахнуть от удивления: впервые ученым удалось не просто прочитать, а еще и отредактировать геном человека (рис. 3). Удивительно, но это событие не привлекло к себе много внимания. Такие авторитетные издания, как Nature и Science, не пожелали публиковать данные об исследовании ввиду его неэтичности. Связано это с тем, что впервые методику генного редактирования CRISPR/Cas9 проверили на человеческих эмбрионах [4].

Рисунок 3. Человеческие эмбрионы с отредактированным геномом.
Китайские ученые из университета Гуанчжоу использовали нежизнеспособные эмбрионы. Их получили посредством ЭКО. На этапе их образования произошел сбой, который привел к формированию трипронуклеарных эмбрионов, которые содержат не два пронуклеуса — материнский и отцовский, — а три. Такие зародыши обычно погибают еще до имплантации и нежизнеспособны: они содержат аномальный тройной набор хромосом (69 шт.), тогда как в норме кариотип составляют 46 [5]. Лишние 23 хромосомы не дают плоду развиваться нормально, что приводит к его гибели [6].
Перед учеными не стояла задача продлить время жизни трипронуклеарных эмбрионов. Их целью было осуществить генный нокаут бета-талассемии, которой страдали эмбрионы. Задумку не вполне удалось реализовать. Из 86-и лишь полсотни эмбрионов удалось протестировать. Генная модификация произошла в 28 зародышах, но почти во всех случаях — не такая, как надо, или в неправильном месте. Дефектный ген бета-талассемии был успешно удален из клеток лишь четырех эмбрионов.
Модификация людей одобрена законом
Официальное разрешение от вневедомственного органа Министерства здравоохранения Соединенного Королевства — HFEA (Human fertilisation and embryology authority) — на редактирование человеческих эмбрионов с помощью технологии CRISPR/Cas9 в 2016 году получила исследовательская группа из Института Фрэнсиса Крика в Великобритании под руководством биолога Кэти Ниакан. В качестве объекта исследования будут использоваться лишние эмбрионы, которые получают при ЭКО, — те, что оказались не нужны семьям ввиду свершившегося успешного подсаживания других зародышей. Раньше такой материал просто утилизировали за ненадобностью.
Это первое разрешение на подобную деятельность в Великобритании, и ученых не ждет полная свобода действий. Эмбрионы могут быть использованы лишь для определенных целей, которые будут оценены экспертной комиссией (рис. 4). Применять можно семидневные эмбрионы. Срок жизни объектов исследования после начала эксперимента — 14 дней. После этого они должны быть утилизированы. Подсаживание их к суррогатной матери исключено. Пролонгировать беременность генномодифицированными эмбрионами запрещено [7].

Рисунок 4. Человеческому эмбриону вводят отредактированную ДНК в лондонской лаборатории Института Фрэнсиса Крика.
Успех CRISPR/Cas9
Первые полосы научных журналов в августе 2017 года вновь украшала аббревиатура CRISPR/Cas9. На этот раз новостями об успешном эксперименте спешили поделиться ученые из Орегонского университета здоровья и науки (OHSU). Группа ученых во главе с уроженцем Казахстана Шухратом Миталиповым применили технологии редактирования генов CRISPR/Cas9, чтобы изменить ДНК больных человеческих эмбрионов [8].
Среди безумного моря наследственных патологий выбор объекта исследования пал на гипертрофическую кардиомиопатию. Это серьезное генетическое заболевание сердца с аутосомно-доминантным типом наследования. Это значит, что патология проявится при наличии хотя бы одной дефектной копии гена. При этом данный ген не сцеплен с половой хромосомой, поэтому встречается как у мужчин, так и у женщин.
Каждый год гипертрофическая кардиомиопатия уносит жизни 50% больных ей. Мутации в гене MYBPC3, отвечающем за сокращение кардиомиоцитов (клеток сердца), приводят к хаотичному расположению мышечных волокон и их утолщению. Возникает нарушение ритма, сердечная недостаточность и как следствие — смерть.
Особенно часто заболевание поражает молодых спортсменов [9]. Технология CRISPR/Cas9 позволила группе ученых отредактировать дефектный ген. В исследовании использовали 12 здоровых яйцеклеток и сперму, несущую мутантный ген MYBPC3. С помощью CRISPR/Cas9 из ДНК сперматозоидов удалось вырезать дефект, словно ножницами (рис. 5) [10].

Рисунок 5. Схема воздействия CRISPR/Cas9 на ген MYBPC3.
Что может предложить миру CRISPR/Cas9
Каждое крупное открытие в истории человечества встречало сопротивление. С этим столкнулись и Галилео Галилей, и Джордано Бруно, и Парацельс, и Игнац Земмельвейс, осмеянный за свое предложение мыть врачам руки перед осмотром больных. Мир с трудом принимает новые открытия. Сотни известных имен стали признанными лишь после смерти и были гонимы за свои убеждения при жизни.
Инквизиция и научное невежество остались далеко позади. Сегодня медицина развивается очень быстро — в сравнении с минувшими столетиями она движется семимильными шагами. Несомненно, CRISPR/Cas9 станет одним из важнейших биотехнологических открытий XXI века. Что же может предложить миру эта технология?
-
Лечение наследственных заболеваний. Реальным на данный момент представляется избавить мир от моногенных патологий — болезней, вызванных мутацией в одном гене. В техническом плане это осуществить проще, чем редактировать дефект нескольких генов (рис. 6) [11], [12].

Рисунок 6. Руками врача буквально лечится геном.

Рисунок 7. Развитие эмбриона из одного оплодотворенного яйца до бластоцисты.

Рисунок 8. Схема возможного использования органов свиней.

Рисунок 9. ГМ-пища.
Тем не менее случайные мутации, которые ненароком могут появиться при редактировании генома, потенциально могут быть еще опаснее, чем имеющиеся (рис. 11).

Рисунок 11. Схематичное изображение гена с опасной мутацией.
Этично ли редактировать людей?
CRISPR/Cas9 предстоит преодолеть не только технические трудности, которые требуют приближенного к ста процентам результата для внедрения в практическую медицину, но и этические (рис. 12). Насколько нравственно редактировать геном человека, данный ему при рождении? Можем ли мы вмешиваться в работу природы и модифицировать ее по своему усмотрению?

Рисунок 12. Обложка книги профессора Калифорнийского университета Пола Кнопфлера — GMO sapiens.
Что же принесет миру технология генного редактирования CRISPR/Cas9 — пользу или вред? Однозначного ответа на этот вопрос не даст никто. Хотя практической пользы от технологии пока получено не было, то будущее, которое рисует CRISPR/Cas9 в рамках биомедицины, рано или поздно наступит. И нам откроется возможность узреть и понять этот новый и смелый отредактированный мир (рис. 13).
Министерство здравоохранения Великобритании выдало первое разрешение на редактирование генома эмбрионов человека в исследовательских целях. О том, что это такое и зачем, рассказывает Константин Северинов, специалист в области молекулярной биологии (регуляция транскрипции генов бактерий), профессор Ратгерского университета (Нью-Джерси, США), заведующий лабораториями в Институте молекулярной генетики РАН и Институте биологии гена РАН.
– Что такое редактирование генома эмбрионов человека, зачем проводятся эти исследования, какова их цель?
– Редактирование генома человека – это новая технология, которая возникла вскоре после того, как были открыты защитные системы под названием CRISPR-Cas, с помощью которых бактерии борются с вирусами. Эти системы состоят из РНК и белковой части, при этом нуклеиновая кислота, малая РНК, направляет белок к строго соответствующему ей месту ДНК, а белок расщепляет обе цепочки ДНК в месте узнавания.
Оказалось, что эта система, созданная эволюцией для борьбы бактерий с вирусами, может использоваться как программируемая система внесения направленных раскусов [разрезания – ВМ] в молекулы ДНК в клетках любого организма.
Редактирование генома человека никакой особой технической сложности по сравнению с другими не представляет. CRISPR/Cas9 технология общая и позволяет редактировать клетки любых организмов – дрожжей, растений, животных и, конечно, человека.
Если почему-то две копии какого-то важного гена в оплодотворенной яйцеклетке – и от папы, и от мамы – окажутся дефектными, то это приговор: разовьется или тяжело больной человек, которого нельзя вылечить, или вообще развитие прекратится внутриутробно, произойдет выкидыш. Все клетки такого организма несут мутацию, не имеют здоровой копии гена.
С другой стороны, вредные мутации могут появляться в течение жизни в клетках отдельных тканей. Рак, например, – это в целом не наследственное заболевание, просто в ходе жизни мы накапливаем мутации, и некоторые из них приводят к различным поражениям в некоторых наших тканях, в частности к раку.
Тем не менее, болезни, имеющие генетическую подоплеку, в идеале можно с помощью технологии редактирования генома полностью вылечить – просто заменить испорченный текст гена на нормальный в определенных клетках.
– Дебаты по поводу этических норм работы с эмбрионом или эмбриональными клетками возникли еще в конце прошлого века в связи с развитием технологии эмбриональных стволовых клеток, а еще раньше – при введении в широкую практику ЭКО. На философском/религиозном уровне всё сводится к вопросу: когда у человека зарождается душа?
Сходная проблема с клонированием. Если клонировать кого-то, то это будет тот же человек или другой? Сейчас используют генетическое определение личности, а значит, клон будет абсолютно идентичен исходному с точки зрения, например, судебной? В общем, возникает масса интересных проблем.
Соответственно, опыты на человеческих эмбрионах запрещены. Например, в Соединенных Штатах во времена Джорджа Буша было запрещено федеральное финансирование, то есть выделение грантов на исследования по эмбриональным стволовым клеткам человека, сейчас запрет сняли, но имеется серьезное регулирование.
Но также нужно понимать, что в конечном счете ученые занимаются исследованиями и тратят деньги налогоплательщиков именно для того, чтобы излечивать болезни и обеспечивать всем долгую и счастливую жизнь. Совершенно очевидно, что у людей есть масса проблем, болезней, физических поражений, дефектов, связанных с эмбриональным развитием и из-за этого – масса покалеченных судеб. Но если на стадии эмбриона вмешаться и изменить какие-то гены, можно будет, наверное, все эти проблемы решить. Дело это очевидно благое, и так же, как с ЭКО, введение редактирования в практику – лишь вопрос времени.
– В чем отличие технологии редактирования генома отдельных (соматических) клеток, например, клеток сетчатки или стволовых клеток, от редактирования генома эмбриона как целого?
– В технологии никакой разницы нет. При наличии некоторого опыта в молекулярно-генетическом ремесле всё это можно сделать как с отдельными клетками, так и с эмбрионом. Просто из эмбриональной клетки может развиться целый организм, а из клетки соматической после генетической модификации формально целый организм развиться не может. Но, с другой стороны, можно из редактированных соматических клеток сделать индуцированные плюрипотентные стволовые клетки, а из них прийти к тому же самому, то есть организму с редактированным геномом.
– Есть ли опасность, что изменения коснутся также линии половых клеток и, следовательно, будут передаваться в поколениях?
Эмбрион развивается из единственной клетки – оплодотворенного яйца, из него развиваются несколько триллионов клеток, которые составляют вас или меня, включая половые клетки. Конечно, если на стадии эмбриона что-то изменить, то изменения будут везде.
– Технологии редактирования генома будут развиваться не только для эмбрионального редактирования. Например, сейчас людей, которые заболевают лимфомой, сначала облучают, а потом ищут донора, чтобы подсадить им костный мозг взамен уничтоженных пораженных кроветворных клеток. Иммуносовместимых доноров искать долго и сложно. А при технологии, когда берутся стволовые кроветворные клетки пациента, редактируются (то есть изменяется генетическая ошибка с помощью CRISPR/Cas9 технологии), а потом размножаются и вводятся человеку обратно, но уже не содержат мутацию, проблема донорства и совместимости полностью решается. То же самое справедливо для некоторых других форм рака, а также для гемофилии, талассемий…
А трансгенных животных с помощью этих CRISPR/Cas9 технологий уже делают без проблем. Технически, с точки зрения молекулярного биолога, что свинья, что человек – никакой разницы. Недавно, например, сделали свинью, из генома которой убрали все вирусы, которые там всегда есть и могут иногда активироваться. Так как свиней скоро, возможно, начнут использовать как фабрику органов для людей, потому что свиньи похожи на нас, то вирусы, которые есть у них в геноме надо убрать, чтобы предотвратить возможность их передачи людям. И этих хрюшек получили методом CRISPR/Cas9. Так что вопросы исследований на людях – чисто регуляторные, а не технические.
Все началось в 1987 г., когда в бактериальной ДНК были обнаружены странные нуклеотидные повторы, разделенные небольшими участками уникальных последовательностей. Спустя десять лет было показано, что эти повторенные последовательности, названные CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), являются системой адаптивного иммунитета бактерий – способом защиты против чужеродной ДНК, в частности, против бактериальных вирусов (бактериофагов).
Узнавание мишени происходит по знаменитому принципу комплементарности, по которому образуются пары нуклеотидов в двуспиральной структуре ДНК. Этот принцип работает во всех живых организмах на нашей планете, включая клетки человека. Поэтому главное в механизме CRISPR/Cas – его простота и универсальность.
Знаковое событие случилось в 2012 г., когда была опубликована совместная работа француженки Э. Шарпентье и американки Д. Дудна, где было показано, что бактериальная система CRISPR/Cas может быть использована для внесения разрывов в последовательность любой ДНК, что свидетельствовало об ее огромном потенциале для редактирования геномов (Jinek et al., 2012). Ведь, зная нуклеотидную последовательность, можно внести разрыв в точно выбранное место любой ДНК.
Ремонтируем ДНК направленно
В теории все это выглядит прекрасно, но вот в чем вопрос: в организме взрослого человека имеются десятки триллионов клеток, и в каждой из них содержится мутантный ген. Как эти подходы применить на практике? Как лечить реального пациента?
На самом деле в большинстве случаев нет нужды исправлять мутацию в каждой клетке организма. Например, серповидноклеточная анемия вызвана мутациями в гене, кодирующем субъединицу гемоглобина, что приводит к дисфункции только клеток крови – эритроцитов. А наследственные нейродегенеративные заболевания, например боковой амиотрофический склероз, связаны с гибелью нейронов определенных типов. Таким образом, мишенями для терапии многих генетических заболеваний могут быть клетки лишь определенных органов или тканей, где специфично синтезируются/не синтезируются продукты мутантных генов.
Относительно простой и эффективный способ получения стволовых клеток из клеток кожи в результате репрограммирования был изобретен в 2006 г. японскими исследователями К. Такахаси и С. Яманака (Takahashi & Yamanaka, 2006). Таким образом, появился метод вернуть практически любую клетку организма (крови, кожи, жировой ткани и т. д.) в состояние стволовой.
Возможность использования ИПСК для клеточной терапии наследственных заболеваний была впервые продемонстрирована на модели серповидноклеточной анемии (Hanna et al., 2007). В геном лабораторных мышей были встроены мутантные гены человека, приводящие к развитию этой болезни.
Из клеток кожи этих животных были получены индуцированные плюрипотентные стволовые клетки, в которых мутация была исправлена с помощью гомологичной рекомбинации. Путем направленной дифференцировки из этих клеток были получены стволовые предшественницы клеток крови, которые трансплантировали в организм животных. Последние не только прижились, но и превратились в здоровые эритроциты. Лечение оказалось успешным.
С тех пор cписок наследственных болезней, для которых успешно был опробован этот подход, пополнился десятками наименований и продолжает расти.
Активно развиваются и невирусные способы доставки, например, упаковка готовых молекулярных комплексов РНК-белок в липосомы (липидные пузырьки) или полимерные частицы. Это более безопасно, а также обеспечивает более строгий контроль над дозой.
Это все здорово, но…
Но, к примеру, в случае гемофилии B жизнеспособность клеток после исправления мутации не повышается. Тем не менее уже 3—7 % клеток печени, продуцирующих нормальный фактор свертывания крови, достаточно для устойчивого терапевтического эффекта (Ohmori et al., 2017).
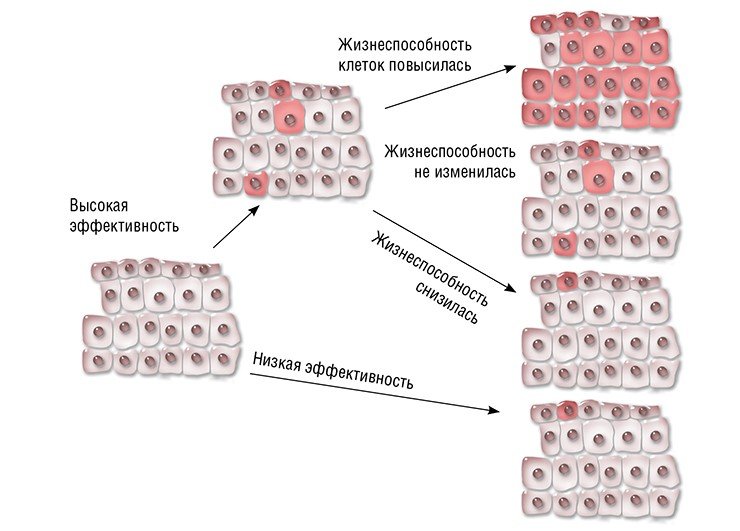
Что же касается исправления мутаций в онкогенах, то жизнеспособность и скорость пролиферации таких клеток будет снижаться относительно раковых, поэтому эффективность подобной терапии вызывает сомнения.
Тем не менее пример гемофилии B показывает, что если заболевание связано с отсутствием какого-то фермента или гормона, то небольшого числа клеток, его продуцирующих, может хватить, по крайней мере, для перевода болезни в более мягкую форму, а в некоторых случаях и для полного восстановления утраченных функций.
Система CRISPR/Cas9 открывает перед человечеством большие перспективы, но нужно понимать, что это не волшебная палочка для решения всех проблем, а инструмент, такой, как, например, молоток. И нужно учиться применять этот инструмент для каждой конкретной задачи.
Главный шаг, который уже был сделан в этой области, – это выход за пределы лабораторий. Уже существует ряд компаний, занимающихся внедрением технологии CRISPR/Cas в практику, и не только медицинскую. Этот подход, к примеру, используется сегодня для получения модифицированных микробов для нужд биотехнологии и модифицированных растений.
И здесь возникает очень серьезный этический вопрос: имеем ли мы право вмешиваться в ДНК человека? Или, наоборот, этично ли бездействовать, обрекая будущего ребенка на страдания?
Генетические изменения, внесенные в эмбрионы, сохранятся во всех клетках взрослого организма, и, соответственно, будут передаваться по наследству. Какой эффект окажет распространение таких модифицированных генов на человеческую популяцию в эволюционном аспекте, не говоря уже о риске возникновения новых евгенических движений?
Именно поэтому Д. Дудна, имеющая колоссальный авторитет в научном мире, призывает своих коллег не торопиться с применением этой технологии на эмбрионах человека, пока не будут разработаны международные этические и законодательные нормы для ее регулирования. В наши дни по всему миру проходят встречи, конференции, конгрессы и симпозиумы, на которых обсуждается будущее CRISPR/Cas. Возможно, от решений, которые будут приняты на них сейчас, зависят судьба человечества и то, как будет выглядеть наш мир в будущем.
В сентябре 2018 г. в новосибирском Академгородке также планируется провести международный конгресс по современным технологиям редактирования геномов, на котором будет обсуждаться технология CRISPR/Cas и, в частности, ее будущее в Российской Федерации.
Немудрый А. А., Валетдинова К. Р., Медведев С. П. и др. Системы редактирования геномов TALEN и CRISPR/Cas – инструменты открытий // Acta Naturae. 2014. Т. 6. № 3(22). С. 20—42.
Cox D. B., Platt R. J., Zhang F. Therapeutic genome editing: prospects and challenges // Nat Med. 2015. V. 21. N. 2. P. 121—131.
Jinek M., Chylinski K., Fonfara I. et al. A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity // Science. 2012. V. 337. N. 6096. P. 816—821.
Ma H., Marti-Gutierrez N., Park S. W. et al. Correction of a pathogenic gene mutation in human embryos // Nature. 2017. V. 548. N. 7668. P. 413—419.
Читайте также:

