Эндоскопические методы исследования в онкологии реферат
Обновлено: 05.07.2024
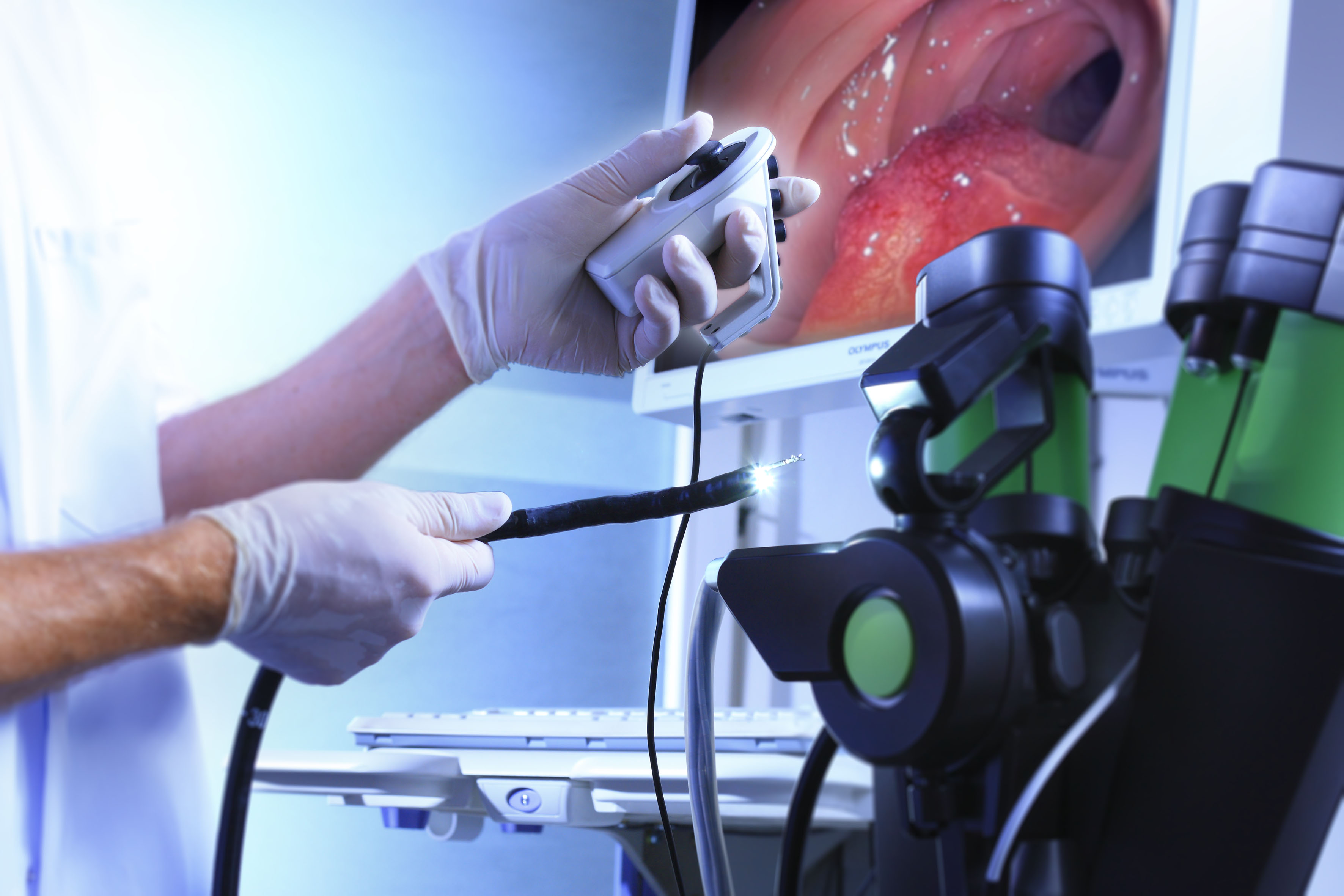
Эндоскопия - современный высокоинформативный метод инструментальной диагностики, который позволяет, не прибегая к помощи скальпеля, заглянуть внутрь полых органов.
Инструментом для данного исследования является эндоскоп - длинный гибкий зонд с оптической системой на конце, с помощью которой изображение исследуемого органа от объектива поступает к глазу врача-эндоскописта или выводится на экран монитора. Метод позволяет визульно оценить состояние органов, обнаружить очаги воспаления, кровотечения, эрозии, но самое главное – выявить и предотвратить развитие онкологических заболеваний. А специальные манипуляторы эндоскопа позволяют удалять инородные тела, проводить исследования (например, биопсию), удалять полипы, лечить эрозии.
Бронхоскопия - диагностическое исследование слизистых оболочек трахеи и бронхов. Это единственный метод, позволяющий непосредственно оценить внутреннюю поверхность бронхов, изучить их конфигурацию, рельеф слизистой оболочки и её сосудистый рисунок, а при необходимости произвести биопсию.
Эзофагогастродуоденоскопия - визуальное обследование верхних отделов желудочно-кишечного тракта (пищевод, желудок, двенадцатиперстная кишка). Такое исследование позволяет определить анатомические изменения в верхних отделах желудочно-кишечного тракта, детально изучить слизистую оболочку пищевода, желудка и двенадцатиперстной кишки, обнаружить воспалительную или опухолевую патологию, уточнить локализацию и степень распространенности процесса, а также произвести прицельную биопсию.
Колоноскопия - исследование внутренней поверхности толстой кишки. Этот метод диагностики позволяет выявить злокачественные и доброкачественные новообразования прямой и ободочной кишки, неспецифические воспалительные заболевания, врождённые аномалии развития толстой кишки, произвести прицельную биопсию из подозрительного участка. Обследование даёт достаточно информации о тонусе кишечника и способности к сокращению. Метод является основой скрининга колоректального рака.
Эндосонография сочетает возможности УЗИ и эндоскопии. Для исследования используют гибкий эндоскоп с видеокамерой и ультразвуковым датчиком. Его можно ввести в пищевод, желудок, двенадцатиперстную, прямую, толстую кишку, в дыхательные пути максимально близко к исследуемому образованию.
В отделении эндоскопии НМИЦ онкологии выполняются следующие виды эндоскопических исследований (в том числе под общей анестезией):
- Эзофагогастродуоденоскопия, колоноскопия
- Фиброларингоскопия, трахеобронхоскопия
- Эндосонография
Цены на некоторые основные виды исследований:
Эзофагогастродуоденоскопия высокого разрешения Трахеобронхоскопия Колоноскопия высокого разрешения Эндосонография
можно найти в прайс-листе, воспользовавшись быстрым поиском
Данный обзор посвящен изучению состояния скринингвых исследований при колоректальном раке (КРР) на современном этапе в мировом здравоохранении. КРР является одним из частых злокачественных новообразований (ЗНО) во всем мире после рака легких и молочной железы, две трети всех случаев колоректального рака возникает в более развитых регионах мира. Ведущей методикой ранней диагностики КРР в настоящее время является фиброколоноскопия. В статье указаны особенности проведения скрининговых программ по ранней диагностики КРР в различных странах мира. Представлены результаты скрининговых исследований различных крупных центров, подтверждающих влияние факторов риска, лежащих в основе патогенеза колоректального рака. По результатам различных метаанализов рассмотрены проблемы ранней диагностики, в частности проведения скрининговых программ и ее эффективности.

1. Бурцев Д.В. Структура злокачественных заболеваний толстой кишки и диагностические мероприятия по их выявлению на базе регионального консультативно-диагностического центра // Фундаментальные исследования. – 2012. – №4. – С.34-37.
2. Кашин С.В. Современные аспекты выполнения колоноскопии с целью скрининга полипов и колоректального рака // Доказательная гастроэнтерология. – 2012. – №2. – С.89-99.
3. Организация выявления и динамического наблюдения проктологических больных в системе диспансеризации населения: метод. рек. – М., 1989. – 26 с.
5. Солодкий В. Ранняя диагностика колоректального рака / В. Солодкий, В. Чхиквадзе, У. Станоевич и др. // Врач. – 2012. – №11. – С.20-23.
6. Шапкин Ю.Г., Чалык Ю.В., Рубцов В.С. Раннее выявление и эндоскопическое удаление колоректальных полипов в амбулаторных условиях // Фундаментальные исследования. – 2010. – №10. – С.131-137.
7. Atkin W.S. Once-only flexible sigmoidoscopy screening in prevention of colorectal cancer: a multicentrerandomised controlled trial / W.S. Atkin, R. Edwards, I. Kralj-Hans et al. // Lancet. – 2010; 375 (9726): 1624–1633.
8. Benson V.S. Colorectal cancer screening: a comparison of 35 initiatives in 17 countries / V.S. Benson, J. Patnick, A.K. Davies et al. // Int J. Cancer 2008; 122: 1357–1367.
9. Eddy D.M. Eddy D.M. Screening for colorectal cancer // Ann. Intern. Med. – 1990. – Vol.113. – P.373-384.
11. European Colorectal Cancer Screening Guidelines Working Group. European guidelines for quality assurance in colorectal cancer screening and diagnosis: overview and introduction to the full supplement publication // Endoscopy 2013; 45: 51–59.
12. Hardcastle J.D. Randomised controlled trial of faecal-occult-blood screening for colorectal cancer / J.D. Hardcastle, J.O. Chamberlain, M.H. Robinson et al. // Lancet 1996; 348: 1472–1477.
13. Heresbach D. Review in depth and meta-analysis of controlled trials on colorectal cancer screening by faecal occult blood test / D. Heresbach, S. Manfredi, P.N. D’Halluin et al. // Eur J GastroenterolHepatol 2006; 18: 427–433.
14. Hoff G., Dominitz J.A. Contrasting US and European approaches to colorectal cancer screening: which is best? // Gut 2010; 59: 407–414.
15. Hol L. Screening for colorectal cancer: randomized trial comparing guaiac-based and immunochemical faecal occult blood testing and flexible sigmoidoscopy / L. Hol, M.E. van Leerdam, M. van Ballegooijen et al. // Gut 2010; 59(1): 62–68.
16. Hol L. Screening for colorectal cancer: comparison of perceived test burden of guaiac-based faecal occult blood test, faecal immunochemical test and flexible sigmoidoscopy / L. Hol, V. de Jonge, M.E. van Leerdam et al. // Eur J Cancer2010; 46: 2059–2066.
17. Hol L. Uptake of faecal immunochemical test screening among nonparticipants in a flexiblesigmoidoscopy screening programme / L. Hol, E.J. Kuipers, M. van Ballegooijen et al. // Int J Cancer 2012; 130: 2096–2102.
18. Inadomi J.M. Adherence to colorectal cancer screening: a randomized clinical trial of competing strategies / J.M. Inadomi, S. Vijan, N.K. Janz et al. // Arch Intern Med 2012; 172: 575–582.
19. Jemal A. Global cancer statistics / A. Jemal, F. Bray, M.M. Center et al. // CA Cancer J Clin 2011; 61: 69–90.
20. Jorgensen O.D., Kronborg O., Fenger C. A randomised study of screening for colorectal cancer using faecal occult blood testing: results after 13 years and seven biennial screening rounds // Gut 2002; 50: 29–32.
21. Lansdorp-Vogelaar I. Effect of rising chemotherapy costs on the cost savings of colorectal cancer screening / I. Lansdorp-Vogelaar, M. van Ballegooijen, A.G. Zauberet al. //J Natl Cancer Inst2009; 101: 1412–1422.
22. Levin B. Screening and surveillance for the early detection of colorectal cancer and adenomatous polyps, 2008: a joint guideline from the American Cancer Society, the US Multi-Society Task Force on Colorectal Cancer, and the American College of Radiology / B. Levin, D.A. Lieberman, B. McFarland et al. // Gastroenterology 2008; 134(5): 1570–1595.
23. Loeve F. Endoscopic colorectal cancer screening: a cost-saving analysis / F. Loeve, M.L. Brown, R. Boer et al. // JNatl Cancer Inst2000; 92: 557–563.
24. Mandel J.S. Reducing mortality from colorectal cancer by screening for fecal occult blood, Minnesota Colon Cancer Control Study / J.S. Mandel, J.H. Bond, T.R. Church et al. // N Engl J Med 1993; 328: 1365–1371.
25. Mandel J.S. Colorectal cancer mortality: effectiveness of biennial screening for fecal occult blood / J.S. Mandel, T.R. Church, F. Ederer et al. // J Natl Cancer Inst 1999;91:434–437.
26. Mansouri D. Screening for colorectal cancer: What is the impact on the determinants of outcome? Critical Reviews / D. Mansouri, D.C. McMillan, E.M. Crighton et al. // Oncology/Hematology 2013; 85: 342–349.
27. Marbet U.A. Colonoscopy is the preferred colorectal cancer screening method in a population-based program / U.A. Marbet, P. Bauerfeind, J. Brunner et al. // Endoscopy 2008; 40: 650–655.
28. McFarland E.G. Revised colorectal screening guidelines: joint effort of the American Cancer Society, U.S. Multisociety Task Force on Colorectal Cancer, and American College of Radiology / E.G. McFarland, B. Levin, D.A. Lieberman et al. // Radiology 2008; 248 (3): 717–720.
29. Multicentre Australian Colorectal-neoplasia Screening (MACS) Group. A comparison of colorectal neoplasia screening tests: a multicentre community-based study of the impact of consumer choice. Med J Aust2006; 184: 546–50.
31. Regula J., Rupinski M., Kraszewska E. et al.// J. N.Engl. J. Med. – 2006. – Vol. 355. – P. 1863–1872.
32. Rex D.K. American College of Gastroenterology guidelines for colorectal cancer screening 2009 / D.K. Rex, D.A. Johnson, J.C. Anderson et al. //Am J Gastroenterol2009; 104: 739–750.
33. Sarfaty M., Feng S. Choice of screening modality in a colorectal cancer education and screening program for the uninsured // J Cancer Educ2006; 21: 43–49.
34. Screening for colorectal cancer: US Preventive Services Task Force recommendation statement. Ann Intern Med 2008; 149: 627–37.
35. Segnan N., Patnick J., von Karsa L. European guidelines for quality assurance in colorectal cancer screening and diagnosis. Luxembourg:Publications Office of the European Union; 2010, p. 1–386.
36. Segnan N. Randomized trial of different screening strategies for colorectal cancer: patient response and detection rates / N. Segnan, C. Senore, B. Andreoni et al. // J Natl Cancer Inst2005; 97: 347–357.
37. Senore C. Offeringpeople a choice for colorectal cancer screening / C. Senore, A. Ederle, L. Benazzato et al. // Gut 2012; published online March 22. DOI:10.1136/gutjnl-2011-301013.
38. Sieg A., Brenner H. Cost-saving analysis of screening colonoscopy in Germany // Gastroenterol2007; 45: 945–951.
39. Tappenden P. Option appraisal of population-based colorectal cancer screening programmes in England // P. Tappenden, J. Chilcott, S. Eggington et al. // Gut 2007; 56: 677–684.
40. Urjadov S.E. Diagnosticheskaja i lechebnajakolonoskopija [Diagnostic and therapeutic colonoscopy]. – Moscow: Panfilov Publ, 2010. – 176 p.
41. Van Cutsem E. Improving outcomes in colorectal cancer: Where do we go from here? / E. Van Cutsem, J.M. Borra`sb, A. Castells et al. // European Journal of Cancer 2013; 49, 2476–2485.
43. Winawer S.J. Prevention of colorectal cancer by colonoscopicpolypectomy, The National Polyp Study Workgroup / S.J. Winawer, A.G. Zauber, M.N. Ho et al. // N Engl J Med 1993; 329: 1977–1981.
44. Woolf S.H. The best screening test for colorectal cancer – a personal choice // N Engl J Med 2000; 343: 1641–1643.
45. Yabroff K.R. Are physicians’ recommendations for colorectal cancer screening guidelineconsistent? / K.R. Yabroff, C.N. Klabunde, G. Yuan et al. // J Gen Intern Med2011; 26: 177–184.
46. Zauber A.G. Evaluating test strategies for colorectal cancer screening: a decision analysis for the US Preventive Services Task Force / A.G. Zauber, I. Lansdorp-Vogelaar, A.B. Knudsen et al. // Ann Intern Med 2008; 149: 659–669.
В современной онкологии колоректальный рак (КРР) одна из самых широко распространенных во всем мире патология. Ежегодно заболевает около 1 млн человек, а количество смертей превышает 500 тыс. В следующие два десятилетия абсолютное число случаев КРР в мире, по прогнозам экспертов, увеличится в результате роста населения в целом и его старения как в развитых, так и развивающихся странах.
В настоящее время доказано, что скрининг КРР может снизить как заболеваемость, так и смертность путем ранней диагностики и удаления аденоматозных полипов и опухоли [12,13,19,20,24,25,43]. По данным исследований следует, что при скрининге пожизненный риск КРР для населения в целом снижается до 4,4 % [7].
Фиброколоноскопия (ФКС) в настоящее время является ведущей методикой эндоскопической диагностики злокачественных новообразований (ЗНО) толстой кишки. Современная ФКС, предполагает использование всех современных технологий, позволяющих выявлять патологические образования даже самых небольших размеров: хромоскопии, узкоспектральной эндоскопии и новейшей диагностической методики – аутофлюоресцентной эндоскопии [2]. В группах высокого риска (наследственная или семейная предрасположенность), как правило, в качестве скрининга на КРР осуществляется ФКС [41]. С помощью тотальной ФКС удается выявить до 55 % аденом и до 80 % карцином ободочной и прямой кишки, развившихся denovo, в начальных стадиях опухолевого процесса (по классификации Dukes’s А и В) [9].
Для улучшения выживаемости и снижения затрат на систему здравоохранения решающее значение имеет эффективный скрининг КРР с профилактической и диагностической целью[41]. Диагностика аденомы до развития рака не только улучшает показатели выживания, но и снижает заболеваемость раком. Важность и эффективность этой стратегии была признана Европейской Комиссией, призывающей к осуществлению скрининговых программ по всей Европе [11,35].
Американским онкологическим обществом установлены критерии проведения скрининга КРР и рекомендует ФКС каждые 10 лет или в начале анализ кала на скрытую кровь или/плюс гибкая ректороманоскопиякаждые 5 лет. Начинать скрининг в 50 лет или в более молодом возрасте при наличии семейных факторов риска [28,30].
В Великобритании выбор ФКС в качестве скринингового метода является стандартом для визуализации толстой кишки и выявления КРР [26]. В то же время общественное принятие эндоскопической оценки изменений в толстом кишечнике в настоящее время считается ограниченным, и ФКС не является широко распространенным методом первичного скрининга в Великобритании [22], т.к. при возможности выбора между ФКС и тестом FOBT предпочтение почти в 2 раза чаще отдается последнему [15].
Самый крупный скрининг, проведенный в Великобритании с использованием гибкой сигмоидоскопии [7], включал исследование 170000 человек в возрасте 55-64 лет. Сигмоидоскопию прошли 71 % участников, и в течение 11 лет у принявших участие в тесте отмечалось снижение частоты КРР на 23 % и снижение смертности от КРР на 33 %.
Скрининг КРР еще только развивается, и поэтому по всему миру наблюдается вариативность в предпочтительной стратегии скрининга [42]. В связи с этим во многих странах эксперты предлагают населению выбор между доступными методами скрининга [22,44], однако при этом рекомендуют стратегию, которая принята в США [22]. В то же время в США рекомендуются различные стратегии скрининга, что позволяет пациенту иметь выбор [22,32,34], а на практике врачи имеют возможность предложить только одну или максимум две стратегии [45]. В европейских странах предлагается только один метод для целевой выборки населения [8].
Изучению частоты выбора скрининга КРР посвящены достаточно много исследований [18,27,29,33,36]. Так, в Итальянском исследовании участники выбирали между FOBT и гибкой сигмоидоскопией; из 970 участников 54 % отдали предпочтение FOBT и 46 % выбрали гибкую сигмоидоскопию [36]. В Австралийском исследовании 1333 человек были включены в выбор между FOBT, гибкой сигмоидоскопией, ФКС и КТ-колонографией [29]. Из 226 человек, предварительно выбравших FOBT, 66% прошли тест FOBT и 27 % прошли ФКС, остальные выбрали другие стратегии и не прошли ни FOBT-тест, ни ФКС. Из 220 человек, которые предварительно не определились с видом скрининга, но согласившихся участвовать в скрининге, 58 % предпочли пройти FOBT и 36 % – ФКС. В Американском исследовании, выбирая между FOBT и ФКС, 55 % участников выбрали FOBT и 45 % выбрали ФКС [18]. Швейцарское исследование показало, что когда 2731 участников были включены в выбор между методами скрининга, ФКС прошли 75 %, гибкуюсигмоидоскопию – 4 %, сочетание гибкой сигмоидоскопии и FOBT – 10 % и только 11 % – FOBT [27].
По результатам исследований ни одна стратегия скрининга КРР рака не показала превосходства, включая первоочередность, риски и затраты [42]. Тем значительнее изменения, влияющие на выбор метода в предпочтении при скрининге КРР в США по сравнению с Европой [14]. В США ФКС часто рекомендуется в качестве основного метода скрининга, в то время как в Европе обычно выше охват населения для FOBT-скрининга [42]. В Австралии в рандомизированном исследовании сравнивали приемлемость скринингов FOBT, гибкой сигмоидоскопии, ФКС, КТ-колонографии [29].Самый высокий рейтинг был для КТ-коло-нографии, несколько ниже для гибкой сигмоидоскопии, а самый низкий – для ФКС. Еще одно рандомизированное исследование в Голландии [16] показало, что на следующее исследование скрининга были готовы прийти 94 % обследованных FOBT, 94 % – FIT и 84 % – после гибкой сигмоидоскопии.
Несмотря на то что все методы скрининга вносят существенный вклад в снижение смертности, ФКС является наиболее эффективной стратегией скрининга КРР для снижения заболеваемости и смертности [46]. В то же время в Американской системе здравоохранения гибкая сигмоидоскопия признана более экономически эффективной по сравнению с FOBT [21]. Экономическую эффективность сигмоидоскопии показали и три Европейских исследования [23,38,39].
В настоящее время растет интерес к двухступенчатой системе набора участников для скрининга КРР, согласно которому участники могут выбрать, какой метод обследования они пройдут первым [17,37]. Согласно руководящим принципам, США в качестве предпочтительного первого исследования все же рекомендуют ФКС[32].
Итальянское исследование сообщило о более частом выборе последующего метода скрининга ФКС среди мужчин, а среди женщин – последующего FIT-исследования [37]. Такие выводы соответствует результатам других исследований, показывающих более частый выбор FOBT-скрининга среди женщин и скрининга ФКС среди мужчин [15].
Частая локализация рака в области прямой и сигмовидной кишки среди всех ЗНО толстой кишки сигмоидоскопия как скрининговая методика позволяет выявить рак толстой кишки с высокой эффективностью [1,10,40]. Исследование кала на скрытую кровь, крови на онкомаркеры с учетом других факторов риска позволяет отобрать контингент больных для ФКС с обязательным исследованием слепой кишки вплоть до червеобразного отростка, печеночного изгиба и всех отделов ободочной кишки [31], где сложнее выявить злокачественные новообразования.
К сожалению, в настоящее время в отечественной системе здравоохранения, отсутствует стандарт ранней диагностики КРР [6]. Как правило, ФКС назначается пациентам с явными симптомами поражения толстой кишки (примесь крови в кале, тенезмы, пальпируемое образование в проекции ободочной кишки, прогрессирующий запор и др.). В то же время профилактические эндоскопические исследования толстой кишки проводятся достаточно редко. В большинстве случаев у врачей первого звена имеют место низкая онкологическая настороженность в отношении КРР, недостаточное знание с его клиническими формами и, следовательно, малая потребность в колоноскопии как о методе первичного обследования. В связи с этим рак толстой кишки в 70-93 % случаев выявляется лишь в III-IV стадии, а полипы прямой и ободочной кишок, как правило, оказываются случайной находкой при обследовании больных по поводу других заболеваний [3].
Своевременная диагностикаи лечение предраковых заболеваний толстой кишки, а также выявление КРР на ранних стадиях способны снизить не только заболеваемость, но и смертность [5]. Своевременное удаление полипов толстой кишки приводит к снижению заболеваемости КРР почти на 80 % [4]. Разработка единых протоколов скрининга и диагностической тактики при выявлении КРР будет способствовать оптимальному применению методов ранней первичной диагностики эпителиальных опухолей толстой кишки (ФКС, FOBT, FIT, виртуальная колоноскопия, определение молекулярно-генетического профиля энтероцитов в кале) и уточняющих методов клинической диагностики (эхография, компьютерная томография, магнитно-резонансная томография, позитронно-эмиссионная томография). Разработка и применение единых стандартов ранней диагностики повысит выявляемость ЗНО толстой кишки на ранних стадиях и позволит выбирать оптимальную тактику лечения КРР, что, в конечном итоге, будет способствовать снижению показателей смертности [5].
Рецензенты:

Эндоскопические исследования сегодня стали неотъемлемой частью клинической педиатрии. Они с успехом применяются в детской онкологии, давая лечащему врачу исчерпывающую информацию о картине заболевания. Современные достижения научно-технического прогресса позволили сконструировать различные типы детских эндоскопов и инструментария, которые отвечают требованиям, предъявляемым при исследованиях у детей, в том числе и у новорождённых. Это позволяет применять различные диагностические методики у детей с опухолями легких, средостения, печени, поджелудочной железы, надпочечников, почек, забрюшинных внеорганных опухолях, а также при опухолях малого таза.
Дети обследуются в эндоскопическом отделении при помощи новейших электронных цифровых видеоэндоскопических систем. Помимо обычного осмотра они позволяют проводить исследования с предварительной окраской слизистой оболочки, а также в специальных режимах, таких как режим высокой чёткости, осмотр в узкоспектральном диапазоне, исследование с различной степенью увеличения объекта по типу эндоскопической микроскопии. При проведении эндоскопических исследований идёт видеофотодокументация, результаты исследований фиксируются на цифровых носителях, что обеспечивает объективизацию данных и возможность последующего контроля и сравнительной оценки в процессе лечения.
Маленьким пациентам широко применяются различные методики эндоскопического ультразвукового исследования с помощью специальных ультразвуковых эндоскопов и ультразвуковых зондов для уточняющей диагностики подслизистых опухолей пищевода, желудка, 12-перстной кишки, опухолей поджелудочной железы, легких и средостения, определения точных границ и глубины распространения при злокачественных опухолях. Широко используются методики пункционной биопсии под ультразвуковым контролем через стенки пищевода, желудка, прямой кишки, трахеи и бронхов для морфологической верификации характера поражения. Лечебные эндоскопические вмешательства проводятся с помощью самых современных электрохирургических, лазерных и аргоноплазменных установок.
Перечень эндоскопических исследований, проводимых детям по назначению лечащего врача:
Дыхательная система
1. Диагностические методики
- Фиброскопия верхних дыхательных путей
- Ларингоскопия с биопсией по показаниям
- Трахеоскопия с биопсией по показаниям
- Бронхоскопия с биопсией по показаниям
- Эндобронхиальное ультразвуковое исследование с тонкоигольной пункционно-аспирационной биопсией
- Эндобронхиальное ультразвуковое исследование с использованием радиальных мини- зондов для диагностики периферического рака легкого
- Эндобронхиальное ультразвуковое исследование радиальным датчиком для определения глубины инвазии и распространенности опухолевого процесса.
- Эндоскопическая лазерная деструкция, аргоноплазменная коагуляция и петлевая электроэксцизия доброкачественных опухолей, предраковых процессов и раннего рака гортани.
- Петлевая электроэксцизия, лазерная деструкция, лазерная и аргшоноплазменная коагуляция доброкачественных опухолей трахеи и бронхов
- Паллиативная петлевая электроэксцизия, аргоноплазменная и диатермокоагуляция злокачественных новообразований трахеи и бронхов для восстановления просвета дыхательных путей
- Рассечение, лазерная деструкция, баллонная дилатация рубцовых стенозов трахеи и бронхов
- Установка стентов (эндопротезов) в трахее и бронхах для обеспечения проходимости дыхательных путей при стенозирующих опухолях и рубцовых стриктурах трахеи и бронхов
Органы желудочно-кишечного тракта
1. Диагностические методики
- Видеоэзофагогастродуоденоскопия
- Видеоректосигмоколоноскопия
- Эндосонография пищевода, желудка и 12-перстной кишки радиальными и конвексными эхоэндоскопами и ультразвуковыми зондами
- Эндоскопическое ультразвуковое исследование панкреатобилиарной области
- Пункционная биопсия неэпителиальных опухолей пищевода, 12-перстной кишки и толстой кишки под эндоскопическим ультразвуковым контролем(ЭУЗИ).
- Пункционная биопсия опухолей средостения через стенку пищевода под контролем ЭУЗИ
- Пункционная биопсия опухолей поджелудочной железы через стенку желудка под контролем ЭУЗИ
- Пункционная биопсия опухолей малого таза через стенку прямой кишки под контролем ЭУЗИ
- Рентгеноэндоскопическое исследование протоков поджелудочной железы и желчных протоков
2. Лечебные методики
- Эндоскопическое удаление полипов пищевода, желудка, толстой и прямой кишки
- Эндоскопическая внутрипросветная хирургия при раннем раке пищевода, желудка, толстой и прямой кишки (эндоскопическая резекция слизистой оболочки, эндоскопическая подслизистая диссекция)
- Эндоскопическая внутрипросветная хирургия при нейроэндокринных опухолях желудка, толстой и прямой кишки
- Установка стентов (эндопротезов) в пищеводе, желудке, 12-перстной кишке, толстой и прямой кишке при злокачественных опухолях для восстановления просвета органа
- Эндоскопические вмешательства при рубцовых сужениях анастомозов после операций на пищеводе, желудке, толстой и прямой кишке (баллонная дилатация, электрохирургическое рассечение, установка эндопротезов)
- Эндоскопическая установка билиарных стентов (эндопротезов)
- Эндоскопическое дренирование кист поджелудочной железы через стенку желудка
- Эндоскопическая установка гастростом.
Все диагностические и лечебные процедуры у детей при эндоскопических процедурах в НИИ детской онкологии и гематологии выполняются в сопровождении медикаментозного сна (седация, седоанальгезия).
Сон в седации не очень глубокий, поэтому функция дыхания у ребёнка не нарушается. После седации пациент или совсем ничего не помнит о произведенной процедуре или у него остаётся смутное воспоминание о прошедшем.
Проведение седации возможно как в условиях операционной, так и за её пределами. Несмотря на эту кажущуюся "простоту" седация требует от специалиста-анестезиолога очень внимательного и скрупулезного подхода - такого же, как и другие виды анестезии.

Эндоскопия – это инструмент борьбы с ранними формами рака

Ключевые преимущества трансплантации почки в НИИ урологии и интервенционной радиологии имени Н.А.Лопаткина
- Высокопрофессиональный состав хирургов экспертного класса
- Многолетний опыт трансплантации почек
- Комплексная диагностика
- Междисциплинарный
консилиум врачей
и оперативное лечение - Качественная
предоперационная
подготовка - Послеоперационное ведение пациентов
- Коррекция возникающих осложнений
- Лечение пациентов из любого региона России

МНИОИ имени П.А. Герцена является пионером в российском здравоохранении по развитию и внедрению в клиническую медицину передовых методов эндоскопической диагностики и лечения ранних форм рака желудочно-кишечного тракта и органов верхних дыхательных путей. Высоко квалифицированные врачи клиники специализируются на самых сложных клинических ситуациях, требующих профессиональных навыков и подготовки экспертного класса.

Масштаб заболевания
Рак желудка является одним из наиболее часто встречающихся злокачественных заболеваний России и, к сожалению, в большинстве случаев данная опухоль выявляется на поздних стадиях, когда пациенту уже достаточно сложно помочь. По статистическим данным в 2017 году в России было выявлено 37321 новых случаев заболеваний раком желудка. Между тем, в ряде стран с высокой заболеваемостью раком желудка, (Япония и Южная Корея), более половины случаев рака желудка выявляется на ранних стадиях опухолевого процесса. Эти страны практически справились с национальной бедой, так как характер заболевания во многом был связан с гастрономическими пристрастиями населения этого региона. В Японии борьбу против рака желудка объявили национальной программой, заставив при этом население пройти поголовный скрининг.
Новые методы диагностики
В МНИОИ имени П.А Герцена Минздрва России разработаны и активно применяются сверхсовременные методы уточняющей эндоскопической диагностики ранних форм рака органов желудочно-кишечного тракта. К ним относятся методы эндоскопии сверхвысокого увеличения – конфокальная лазерная эндомикроскопия и эндоцитоскопия, позволяющие в реальном времени в процессе эндоскопического исследования оценивать слизистую оболочку желудка на тканевом и клеточном уровне – с увеличением изображения до 1000 раз. Этот метод позволяет выявлять новообразования предельно малых размеров (менее 1 мм) и делать заключение о наличии или отсутствии опухоли без биопсии!


Новые методы лечения
При обнаружении рака желудка, пищевода и других локализаций на I стадии – ранней его формы, активно применяется метод малоинвазивного органосохраняющего и внутрипросветного эндоскопического лечения, которое позволяет помочь больному без открытой операции и химиотерапии. Такое лечение обеспечивает высокое качество жизни пациентов, низкие показатели рецидивов и смертности (менее 1%). За последние 5 лет благодаря использованию собственных методик, ранний рак желудка был выявлен более чем у 500 больных и большинству из них проведено органосохраняющее внутрипросветное эндоскопическое лечение: эндоскопическая резекция слизистой оболочки с диссекцией в подслизистом слое, позволяющие удалять эндоскопически даже опухоли больших по площади размеров.
Также в клиническую практику внедрены комбинированные методы эндоскопического лечения. Такой подход включает как эндоскопические резекционные методики, так и фотодинамическую терапию с различными фотосенсибилизаторами отечественного производства. Использование комбинированного эндоскопического лечения с фотодинамической терапией обеспечивает возможность излечения больных ранними и локализованными формами рака желудка, которым было отказано в проведении других методов лечения, вследствие наличия у них сопутствующей патологии сердечно-сосудистой системы.
Читайте также:

