Екологічна безпечність застосування і одержання фенолу реферат
Обновлено: 05.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Выберите документ из архива для просмотра:
Выбранный для просмотра документ фенолы2.doc
Муниципальное бюджетное общеобразовательное учреждение средняя общеобразовательная школа с. Хмелинец Задонского муниципального района Липецкой области
Фенолы: свойства, применение, вред
ученица 11 класса
Братищева Анна
Учитель химии
Воронина Г.Д.
Тема работы: свойства, применение и вред класса фенолов.
Актуальность: с развитием науки химия все прочно и прочно укрепляется в нашей жизни. Особое место в ней занимает такой класс веществ как фенолы. Их значение невозможно переоценить, потому как сфера их влияния очень широка. Поэтому необходимо знать, с какими веществами мы сталкиваемся каждый день, какова опасность отравления ими и как обезопасить себя от негативного влияния этих веществ.
Объект: класс фенолов
Предмет: характерные свойства и применение
Цель: доказать значимость фенолов в быту и промышленности
Задачи: 1) дать определение классу фенолов;
2) рассмотреть номенклатуру и изомерию;
3) изучить классификацию фенолов;
4) проанализировать строение молекулы;
5) выявить физические свойства;
6) выделить химические свойства;
7) описать основные методы синтеза фенола;
8) установить сферы применения данного класса веществ;
9) определить вред фенолов для здоровья человека и экологии;
10) описать симптомы отравления и оказание первой помощи.
Гипотеза: благодаря особенностям строения молекулы и химическим свойствам фенолы незаменимы в науке, производстве, медицине и повседневной жизни.
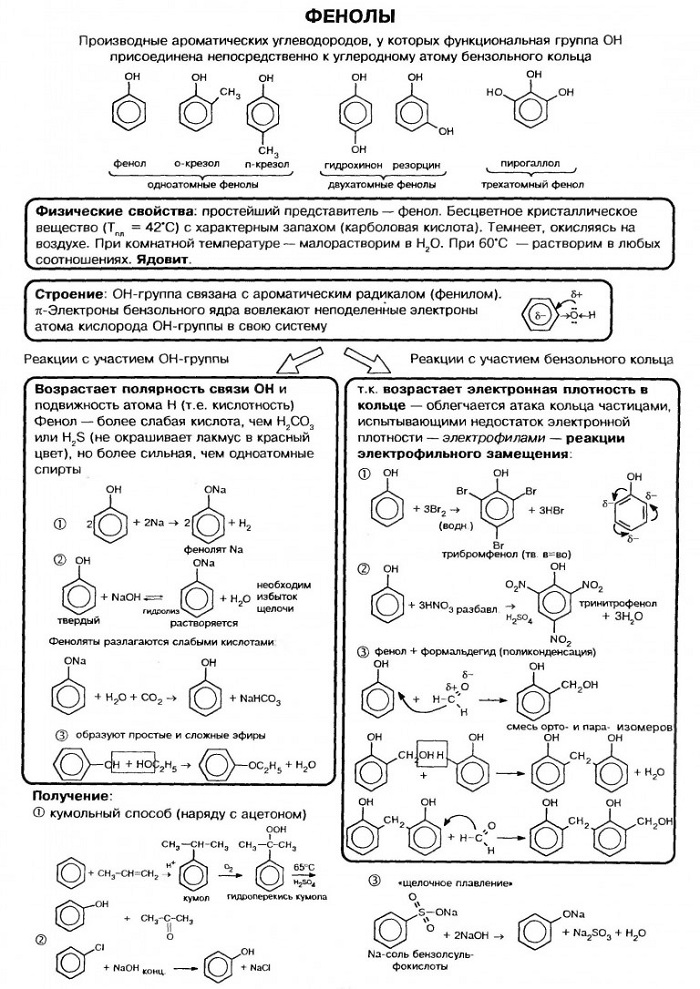
1. Класс фенолы.
Фенолы – это производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп, непосредственно соединенных с бензольным кольцом.
Первый представитель гомологического ряда фенолов - окси-бензол C6H5OH называют обычно просто бензолом или карболовой кислотой.
2. Изомерия и номенклатура фенолов
Возможны 2 типа изомерии:
изомерия положения заместителей в бензольном кольце

изомерия боковой цепи (строения алкильного радикала и числа радикалов)
Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей.
3. Классификация
Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле:


В соответствии с количеством конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы:

4. Строение молекулы

Фенильная группа C6H5 – и гидроксил –ОН взаимно влияют друг на друга.

Неподеленная электронная пара атома кислорода притягивается 6-ти электронным облаком бензольного кольца, из – за чего связь О–Н еще сильнее поляризуется. Фенол - более сильная кислота, чем вода и спирты.
В бензольном кольце нарушается симметричность электронного облака, электронная плотность повышается в положении 2, 4, 6. Это делает более реакционноспособными связи С-Н в положениях 2, 4, 6. и – связи бензольного кольца.
5. Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
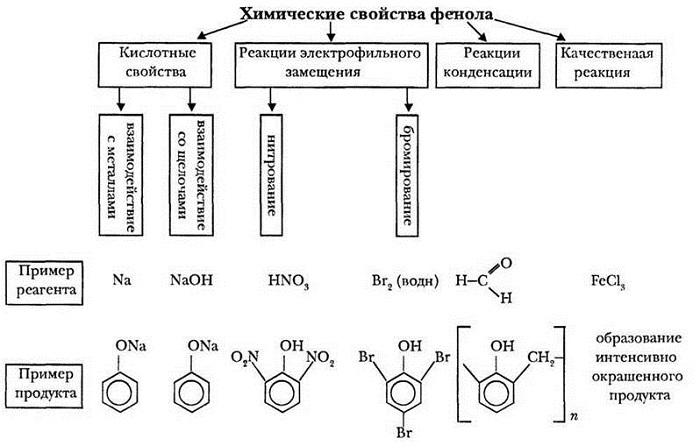
6. Химические свойства
I. Свойства гидроксильной группы
Кислотные свойства – выражены ярче, чем у предельных спиртов (окраску индикаторов не меняют):
· С активными металлами-
2C6H5-OH + 2Na → 2C6H5-ONa + H2
C6H5-OH + NaOH (водн. р-р) ↔ C6H5-ONa + H2O
! Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой –
C6H5-ONa + H2O + СO2 → C6H5-OH + NaHCO3
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2-, Br-)
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной
II. Свойства бензольного кольца
1). Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы (см. выше), но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Нитрование. Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов:

При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):

Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол):

Конденсация с альдегидами. Например:

2). Гидрирование фенола
C6H5-OH + 3H2 Ni, 170ºC → C6H11 – OH циклогексиловый спирт (циклогексанол)
III. Качественная реакция - обнаружение фенола
6C6H5-OH + FeCl3 → [Fe(C6H5-OH)3](C6H5O)3 + 3HCl
светло- фиолетовый раствор
7. Синтез фенола
1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
С6Н5―Сl + 2NaOH → C6H5―ONa + NaCl + Н2О.
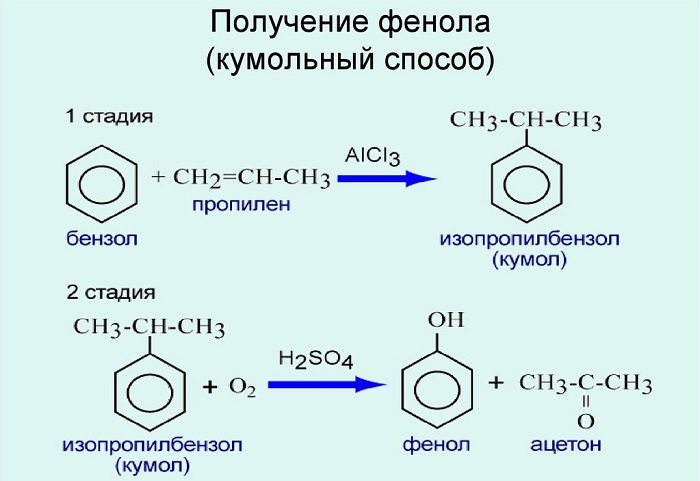
2. При каталитическом окислении изопропилбензола (кумола) кислородом воздуха образуются фенол и ацетон:

Это — основной промышленный способ получения фенола.
3. Получение из ароматических сульфокислот. Реакция проводится при сплавлении сульфокислот с щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:

8. Сферы применения
Разбавленные водные растворы фенола (карболка (5%)) применяют для дезинфекции помещений, белья. Являясь антисептиком, широко применялся в европейской и американской медицине в период 2 мировой войны, но из-за высокой токсичности в настоящее время использование сильно ограничено.
Раствор фенола используют в качестве дезинфицирующего средства (карболовая кислота). Двухатомные фенолы – пирокатехин, резорцин (рис. 3), а также гидрохинон (пара-дигидроксибензол) применяют как антисептики (антибактериальные обеззараживающие вещества), вводят в состав дубителей для кожи и меха, как стабилизаторы смазочных масел и резины, а также для обработки фотоматериалов и как реагенты в аналитической химии.
В виде отдельных соединений фенолы используются ограниченно, зато их различные производные применяют широко. Фенолы служат исходными соединениями для получения разнообразных полимерных продуктов – феноло-альдегидных смол (рис. 7), полиамидов, полиэпоксидов.
На основе фенолов получают многочисленные лекарственные препараты, например, аспирин, салол, фенолфталеин, кроме того, красители, парфюмерные продукты, пластификаторы для полимеров и средства защиты растений.
Широко используется в молекулярной биологии и генной инженерии для очистки ДНК. В смеси с хлороформом ранее использовался для выделения ДНК из клетки.
В настоящее время можно выделить несколько основных направлений использования фенола. Один из них – производство лекарственных средств.
Большинство этих лекарств — производные получаемой из фенола салициловой кислоты: o-HOC6H4COOH. Самое распространенное жаропонижающее — аспирин не что иное, как ацетилсалициловая кислота. Эфир салициловой кислоты и самого фенола тоже хорошо известен под названием салол.
При лечении туберкулеза применяют парааминосалициловую кислоту (сокращенно ПАСК) . Ну и, наконец, при конденсации фенола с фталевым ангидридом получается фенолфталеин, он же пурген.
9. Вред фенолов
Опасность фенола для здоровья человека заключается в том, что он оказывает негативное воздействие на нервную систему. Фенольные пары и пыль, а также раствор фенола, раздражают глаза, слизистые оболочки дыхательных путей, а также кожные покровы. Если фенол попадает в организм, то его всасывание происходит в считанные секунды даже в случае его прохождения через те участки кожи, которые не повреждены.
Буквально через несколько минут после попадания в организм, фенол оказывает паралитическое воздействие на головной мозг человека, а именно – на ткани головного мозга. Первые симптомы отравления фенолом – недолго длящееся возбуждение, после чего наступает паралич дыхательного центра организма. Следует отметить, что попадая в организм даже в минимальном количестве, фенол может вызвать кашель, сильную головную боль, тошноту и общую слабость. Что касается тяжелых случаев отравления этим веществом, то его характерными признаками являются потеря сознания, затруднение дыхания, омертвение роговицы глаза и также сокращением частоты пульса, судорогами и холодным потом.
Сегодня фенол является одним из наиболее опасных для здоровья человека веществ, и, к сожалению, достаточно широко распространенным. Для того, чтобы избежать негативного воздействия фенола на организм и отравления этим материалом, следует свести возможность контакта с ним к минимуму.
При приобретении строительных и отделочных материалов рекомендуется внимательно ознакомиться с их составом – как правило, вероятность наличия фенола особенно высока у материалов, изготовленных на основе полимеров. Рекомендуется выбирать только качественные строительные материалы, избегая подозрительно дешевой продукции. Практически всегда низкая цена свидетельствует о низком качестве продукции, и, как следствие, о том, что в ее составе содержатся вредные вещества. Кроме того, следует обращать внимание и на марку производителя: известные фабрики всегда имеют экологические сертификаты и изготавливают свою продукцию в соответствии с самыми современными требованиями к ее безопасности для здоровья человека. Таким образом, приобретая отделочные или строительные материалы от известных производителей, можно быть уверенным в том, что приобретается экологически чистый и безопасный материал, в составе которого нет вредных веществ, в том числе, и фенола.
10. Симптомы отравления фенолом и первая помощь
При остром отравлении, сопровождающем попадание фенола на кожу или вдыхание его паров, наблюдается сильное жжение в местах, подвергшихся его непосредственному воздействию. Проявляются ожоги слизистых тканей; возникает сильная боль в области рта, в глотке, животе; тошнота, рвота, понос; резкая бледность, слабость, отек легких; возможны острые аллергические проявления; артериальное давление понижено; развивается сердечно-легочная недостаточность, возможны судороги; моча бурая, быстро темнеет на воздухе.
Первая помощь – снять одежду (желательно сразу под душем), промыть пораженное место большим количеством воды. Прикрыть места ожогов фенолом чистой белой тканью. Если брызги фенола попали в глаза, необходимо обильно промывать их водой не менее 15 минут. Промыть желудок водой, внутрь дать активированный уголь. Спирт и вазелиновое масло противопоказаны. Во время стационарного лечения больному даются обволакивающие средства и анальгетики, подается О2 с обеспечением адекватной вентиляции легких, производится коррекция водноэлектролитного баланса.
Хроническое отравление фенолом приводит к анорексии – прогрессирующей потере веса; вызывает диарею, головокружение, трудности при глотании, обильное отделение слюны. При хроническом отравлении фенолами отмечено темное окрашивание мочи. Ученые, исследовавшие последствия фенольных отравлений указывают, что в результате длительного пребывания под воздействием фенола человек может чувствовать боли в мышцах, слабость. Печень у таких людей увеличена. Хроническое отравление фенолом вызывает поражения центральной нервной системы, нервные расстройства, сопровождаемые головными болями и потерей сознания, а также поражения почек, печени, органов дыхания и сердечно-сосудистой системы.
В нашей стране ПДК фенола в жилой зоне составляет 0,03 мг/м3 (СанПин 2.1.2.1002-00), а в воздухе рабочей зоны – 0,3 мг/ м3.
Запах фенола – сильный и сладковатый – начинает ощущаться, если концентрация фенола в воздухе превышает 0.04 ppm (0.000004%)
Помните, если вас настораживает неприятный запах недавно приобретенной вещи, если вам кажется, что ваше здоровье после покупки мебели или недавнего ремонта пошатнулось, будет лучше вызвать специалиста-эколога, который проведет все нужные исследования и даст необходимые рекомендации, чем пребывать в тревоге и сомнениях, опасаясь за свое здоровье и здоровье своих близких.
Среди строительных и отделочных материалов чаще всего фенол можно найти в составе дегтевой или битумной пропитки для строительных пергаминов, а также в составе рубероида – в нем он используется как вещество, препятствующее процессу гниения. Фенол имеет достаточно специфический запах, напоминающий запах гуаши, что позволяет безошибочно определить его наличие в том или ином материале. Увеличение потребности фенола объясняется как относительной дешевизной и доступностью этого сырья, так и уникальностью свойств многих продуктов переработки фенолов, особой ценностью их для ряда новых отраслей техники. Масштабы потребления фенола значительны и занимает 33 – е место среди всех выпускаемых химической промышленностью веществ и 17 – е место среди органических веществ.
Содержание работы
РАЗДЕЛ I. Свойства, применение и основные методы получения фенола
4
1.1
Химические свойства фенола
4
1.2
Физические свойства фенола
6
1.3
Вредные свойства фенола
7
1.4
Область применения и потребление фенола
8
1.5
Условия транспортировки и хранения фенола
10
1.6
Методы получения фенола
11
1.7
Масштабы производства фенола
12
РАЗДЕЛ II. Кумольный метод производства фенола
13
2.1
Блок – схема получения фенола кумольный способом
13
2.2
Стадии процесса кумольного метода
14
2.2.1
Алкилирование бензола пропиленом
15
2.2.2
Окисление изопропилбензола (кумола)
16
2.2.4
Кислотное разложение гидропероксида на фенол и ацетон
19
2.3
Технологическая схема получения фенола и ацетона кумольным методом
23
2.4
Выход продукта
25
2.5
Очистка фенола
26
2.6
Недостатки метода
26
РАЗДЕЛ III. Экология
27
3.1
Предельно допустимые концентрации при производстве фенола
27
3.2
Очистка сточных вод от фенола
28
3.2.1
Очистка сточных вод первого типа
29
3.2.2
Очистка сточных вод второго типа
30
3.3
Влияние фенола на организм человека
31
Список использованных источников
35
Файлы: 1 файл
Фенол.docx
РАЗДЕЛ I. Свойства, применение и основные методы получения фенола
Химические свойства фенола
Физические свойства фенола
Вредные свойства фенола
Область применения и потребление фенола
Условия транспортировки и хранения фенола
Методы получения фенола
Масштабы производства фенола
РАЗДЕЛ II. Кумольный метод производства фенола
Блок – схема получения фенола кумольный способом
Стадии процесса кумольного метода
Алкилирование бензола пропиленом
Окисление изопропилбензола (кумола)
Кислотное разложение гидропероксида на фенол и ацетон
Технологическая схема получения фенола и ацетона кумольным методом
РАЗДЕЛ III. Экология
Предельно допустимые концентрации при производстве фенола
Очистка сточных вод от фенола
Очистка сточных вод первого типа
Очистка сточных вод второго типа
Влияние фенола на организм человека
Список использованных источников
Фенол (C6H5OH) - химическое вещество органического происхождения, в котором гидроксильная группа замещает водородный атом и относится к группе ароматических углеводородов.
Фенол можно классифицировать по числу OH – группе:
- одноатомные фенолы (аренолы) : фенол (C6H5OH) и его гомологи;
- двухатомные фенолы (арендиолы): гидрохинон (C6H6O2), резорцин (C6H4(OH)2), пирокатехин;
- трехатомные фенолы (арентриолы): пирогаллол (C6H6O3), флороглюцин, гидроксигидрохинон и т. д.
Фенол широко используется практически во всех областях промышленного и народного хозяйства. Также фенол входит в состав многих дезинфицирующих средств, используемых в медицине. Среди строительных и отделочных материалов чаще всего фенол можно найти в составе дегтевой или битумной пропитки для строительных пергаминов, а также в составе рубероида – в нем он используется как вещество, препятствующее процессу гниения. Фенол имеет достаточно специфический запах, напоминающий запах гуаши, что позволяет безошибочно определить его наличие в том или ином материале. Увеличение потребности фенола объясняется как относительной дешевизной и доступностью этого сырья, так и уникальностью свойств многих продуктов переработки фенолов, особой ценностью их для ряда новых отраслей техники. Масштабы потребления фенола значительны и занимает 33 – е место среди всех выпускаемых химической промышленностью веществ и 17 – е место среди органических веществ.
РАЗДЕЛ I. Свойства, применение и основные методы получения фенола.
В данном разделе мы ознакомимся с физико – химическими свойствами фенола, куда и на что применяется фенол, основные условия транспортировки и хранения фенола, а так же максимально коротко опишем основные методы получения фенола в промышленных масштабах, после чего в дальнейшем разберем один из методов более подробно.
1.1 Химические свойства фенола.
В фенолах p-орбиталь атома кислорода образует с ароматическим кольцом единую p-систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О—Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов).
Кислотность фенола существенно выше чем у предельных спиртов: он реагирует как с щелочными металлами, позволяя образовать соль группы фенолят. Результат данной реакции получается фенолят натрия:
Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол; такая реакция доказывает, что фенол — более слабая кислота, чем угольная и сернистая:
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода.
Образование сложных эфиров. В отличие от спиртов, фенолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используются хлорангидриды кислот:
Реакции электрофильного замещения в феноле протекают значительно легче, чем в ароматических углеводородах. Поскольку ОН группа является ориентантом I рода, то в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара-положениях (при галогенировании, нитровании, поликонденсации и т.д.). Так, при действии бромной воды на фенол три атома водорода замещаются на бром, и образуется осадок 2,4,6-трибромфенола:
это - качественная реакция на фенол.
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации, и образуется фенолформальдегидная смола — высокомолекулярное соединение с разветвленной структурой типа:
Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
В заключение о химических свойствах фенола отметим, что для идентификации фенола очень часто используется его реакция с раствором FeCl3; при этом образуется комплексный ион фиолетового цвета:
это – качественная реакция на обнаружение фенола.
1.2 Физические свойства фенола.
Фенол образует бесцветные призматические кристаллы, розовеющие при хранении на воздухе. Практически обычно окрашены, т.к. легко окисляются кислородом воздуха, образуя соединения хиноидного строения. Очень гигроскопичны. Так же фенол является токсичным веществом, вызывает ожоги кожи, является антисептиком.
При температуре 65,3 о С фенол смешивается с водой в любых отношениях. Ниже этой температуры при растворении фенола в воде образуется два слоя: фенольная и водная фаза. Взаимную растворимость фенола и воды в интервале температур 0 – 65 о С приближенно можно вычислить из следующих уравнений:
где N – мольная доля растворенного вещества; t – температура ( o C).
При комнатной температуре, согласно приведенным уравнениям, в воде растворяется около 7% фенола, а в феноле около 27% воды. Хорошо растворим фенол в спирте, эфире, ацетоне, хлороформе и других органических растворителях.
В таблице 1. приведен ряд физико – химических характеристик фенола.
Таблица 1. Физико – химические свойства фенола.
Т. кип. При 760 мм. рт. ст.
Диэлектрическая проницаемость при 60 о
Константа кислотности в воде при 25 о С
Продолжение таблицы 1.
Константа кислотности в метаноле при 25 о С
Теплоты образования при 25 о С (в состоянии идеального газа)
Теплота испарения при 760 мм. рт. ст.
1.3 Вредные свойства фенола.
Практически сразу после получения фенола установили, что это химическое вещество обладает не только полезными свойствами, что позволяет его использовать в различных сферах науки и производства, но и является сильнодействующим ядом. Так, вдыхание паров фенола в течение продолжительного времени может привести к раздражению носоглотки, ожогам дыхательных путей и последующему отеку легких с летальным исходом. При соприкосновении раствора фенола с кожей образуется химические ожоги, которые впоследствии трансформируются в язвы. Если обработать раствором более 25% кожных покровов, то это может стать причиной смерти человека. Попадание фенола внутрь организма с питьевой водой, приводит к развитию язвенной болезни, атрофии мышц, нарушению координации движений, кровотечениям. Кроме этого, фенол является причиной возникновения раковых заболеваний, способствует развитию сердечной недостаточности и бесплодия.
Благодаря свойству окисления, пары этого химического вещества полностью растворяются в воздухе примерно через 20-25 часов. При попадании в почву фенол сохраняет свои ядовитые свойства на протяжении суток. Однако в воде его жизнеспособность может достигать 7-12 дней. Поэтому наиболее вероятный пусть попадания этого ядовитого вещества в человеческий организм и на кожные покровы – загрязненная вода.
В составе пластмасс фенол не теряет своих летучих свойств, поэтому использование фенопластов в пищевой промышленности, производстве предметов быта и детских игрушек на сегодняшний день категорически запрещено. Их применение также не рекомендовано для отделки жилых и служебных помещений, где человек проводит хотя бы несколько часов в сутки. Как правило, из организма фенол выводится с потом и мочой в течение 24 часов, однако за это время он успевает нанести здоровью человека непоправимый урон. Из-за вредных свойств во многих странах мира действует ограничение на использование данного вещества в медицинских целях.
1.4 Область применения и потребления фенола.
Первоначально фенол использовался для производства различного рода красителей, благодаря своему свойству изменять цвет в процессе окисления с бледно розового до бурого оттенка. Это химическое вещество вошло в состав многих видов синтетических красок. Кроме этого, свойство фенола уничтожать бактерии и микроорганизмы, было взять на вооружение в кожевенном производстве при дублении шкур животных. Позже фенол успешно использовался в медицине как одно из средств обеззараживания и дезинфекции хирургических инструментов и помещений, а в качестве 1.4%-го водного раствора – как болеутоляющее и антисептик для внутреннего и наружного применения. Кроме этого, фенол салициловой кислоты является основой аспирина, а ее производная – парааминосалициловая кислота – используется для лечения больных туберкулезом. Фенол также входит в состав сильнодействующего слабительного препарата – пургена.
Фенолы – органические соединения. Они в небольших количествах есть в природе. Основную массу фенола и производных на его основе получают синтетическим путём.
Что такое фенол
К фенолам относят производные ароматических углеводородов, в молекулах которых гидроксильные группы связаны с фенил радикалом. Они могут иметь одну или несколько гидроксогрупп.

Самым простым представителем этой группы соединений считают фенол. Он и дал название классу веществ. Это же соединение называют гидроксибензолом.
Общая и структурная формулы
Состав веществ можно выразить общей формулой С6Н6-n(ОН)n.
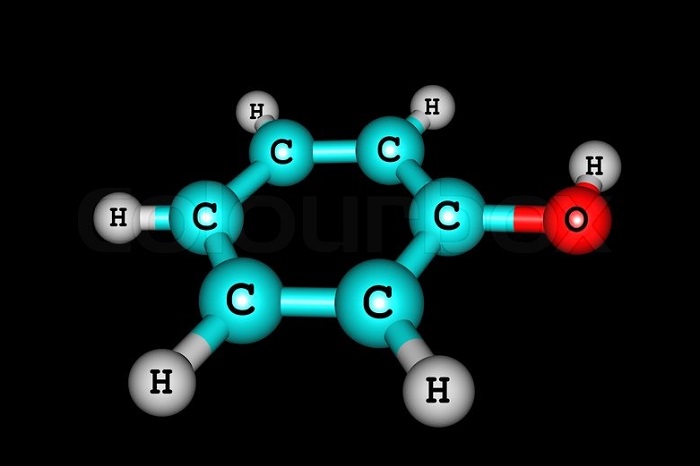
Простейший представитель класса имеет 1 гидроксогруппу. Его молекулярная формула С6Н5ОН. Структурная формула — ОН.
Если в молекуле фенола 1 атом водорода заместить на метильный радикал, получим метилфенол. Если к нему прибавить ещё одно бензольное ядро, получим нафтол.
Химические свойства фенола
Так как гидроксибензол содержит в своём составе 2 группы атомов, выделяют две группы химических свойств.
Свойства, идущие за счет фенил радикала:
Свойства, протекающие за счёт гидроксильной группы (кислотные свойства):
взаимодействие с активными металлами;
взаимодействие со щелочами.
Не следует понимать, что фенол, имея в своем составе черты строения бензола и спиртов, просто повторяет их свойства. На самом деле все сложнее. Чтобы понять особенность его химических взаимодействий, необходимо знать строение вещества. В молекуле фенола наблюдается взаимное влияние атомов.
На атоме кислорода гидроксильной группы есть 2 неподелённые электронные пары. Они взаимодействуют с π – электронной системой фенил радикала.
Результат взаимодействия следующий:
Нарушается равномерное распределение электронной плотности в фенил радикале. Она возрастает на атомах 2,4,6, то есть в орто– и параположениях. Именно в этих положениях водород будет легко замещаться на другие атомы.
Атом водорода гидроксогруппы, из-за влияния фенил радикала, приобретает положительный заряд и становится более подвижным.
Результатом влияния служат своеобразные свойства фенола. Он реагирует с активными металлами и щелочами. Спирты – только с металлами. В то же время и бензол, и гидроксибензол реагируют с бромной водой. Но у фенола, в отличие от бензола, идет замещение сразу по 3 атомам.
Физические свойства
С6Н5ОН – это белое кристаллическое вещество. В результате окисления кристаллы могут приобретать розовый цвет. Температура плавления 40,9 0 С. Молярная масса 94 г/моль.

Отличается характерным резким запахом. Вещество ядовито. Проникая в организм человека, вызывает тяжёлое отравление.
С чем реагирует фенол
Гидроксибензол вступает в реакцию с активными металлами. С натрием даёт фенолят натрия. Уравнение выглядит следующим образом:
2 С6Н5ОН + 2Na = 2С6Н5ОNa + H2
В реакциях со щелочами также образует феноляты. Реагируя с гидроксидом калия, образует фенолят калия:
С6Н5ОН + KOН = С6Н5ОK +H2O
Взаимодействуя со спиртами, образует эфиры. Например, в реакции с бутанолом, получают простой эфир:
С6Н5 ОН + НО–С4Н9 = С6Н5–О–С4Н9 +Н2О
Из свойств, протекающих за счёт фенил радикала, можно отметить реакцию нитрования. Взаимодействие с HNO3 даёт 2,4,6 тринитрофенол (пикриновую кислоту):
С6Н5ОН + 3HNO3 = C6H2(NO2)3OH +3H2O
Реагируя с формальдегидом, фенол образует фенолформальдегидную смолу. Это реакция поликонденсации – получение высокомолекулярного вещества из низкомолекулярных веществ с отщеплением побочного продукта. В данном случае – это вода.
Качественные реакции на фенол
К качественным реакциям относят взаимодействие с бромной водой. В результате получают осадок белого цвета:
С6Н5ОН + 3Br2 = C6H2Br3ОН + 3HBr
Ещё одной качественной реакцией является взаимодействие с хлоридом железа(III). Получается фиолетовое окрашивание. Качественные реакции позволяют разделить и определить органические вещества.
Реакция присоединения
К реакциям присоединения относят гидрирование ароматического ядра. Гидрирование – это реакции присоединения водорода. Превращение протекает легко, в присутствии катализатора. В результате разрушается π – электронная система, образуется циклогексанол и циклогексанон:
2С6Н5ОН + 5Н2 = С6Н11ОН + С6Н10О
Окисление
Фенол не устойчив к окислению. Продукты реакции могут быть разными. Это зависит от самого окислителя и от условий, в которых протекает реакция. При окислении перекисью водорода получается двухатомный фенол:
С6Н5ОН + Н2О2 = С6Н4(ОН)2
К реакции окисления относят и реакцию горения. Образуется углекислый газ и вода.
Получение фенола
Фенол в небольшом количестве содержится в каменноугольной смоле. Но потребности в веществе настолько велики, что этого источника недостаточно.
Разработаны разные способы получения:
По схеме С6Н6 ----- С6Н5Cl ----- С6Н5ОН. Минусом метода являются жёсткие условия замещения хлора на гидроксогруппу. Реакции приходится проводить при высокой температуре и давлении.
Используют для получения бензол и пропилен, в результате чего получают кумол. Затем кумол окисляют, в результате получают ценные продукты – фенол, ацетон.
Применение
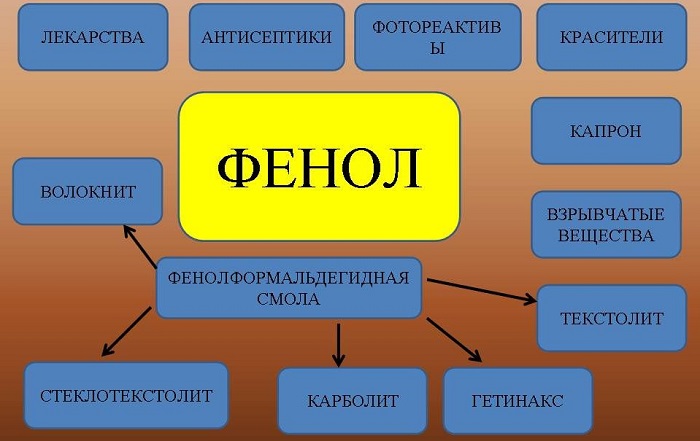
Вещество применяют для производства разнообразной продукции:
фенолформальдегидных смол и пластмасс;
раствор фенола в воде обладает антисептическими свойствами;
искусственных волокон и другой продукции.
Заключение
Фенол и фенольные соединения – очень важная группа веществ. Не следует забывать, что многие из них являются ядами. Все отходы промышленности, содержащие вещество, тщательно очищаются. Их подвергают каталитическому окислению, обработке озоном и другим способам очистки.

Фенол
Ключевые слова конспекта: Фенол и его строение. Фенолы. Физические и химические свойства фенола. Качественные реакции на фенол. Взаимное влияние атомов в молекуле фенола. Применение фенолов.
Фенол и его строение

В XIX в. хирургические операции проводились без соблюдения каких-либо мер дезинфекции и стерилизации. В больницах после проведения операционных вмешательств регистрировалась высокая смертность от различных инфекций. В 1867 г. английский хирург Джозеф Листер опубликовал статью, в которой утверждал, что воспаление ран после хирургических операций вызывается внесёнными извне микроорганизмами. Для борьбы с хирургическими инфекциями Листер предложил обрабатывать помещение, руки врача, операционное поле, медицинский инструмент и даже воздух операционной зоны карболовой кислотой — водным раствором органического соединения, называемого фенолом. Благодаря этому Листер вошёл в историю как основоположник антисептики.

Молекулярная формула фенола С6Н5ОН. В молекуле фенола гидроксильная группа связана с фенильным радикалом — одновалентным остатком ароматического углеводорода бензола:
Фенол — первый представитель гомологического ряда фенолов.
Физические и химические свойства фенола
Фенол представляет собой белые игольчатые кристаллы, приобретающие на воздухе розоватую окраску вследствие окисления. Это вещество малорастворимо в холодной воде, но хорошо растворяется в горячей.
Фенол ядовит. Он легко проникает через кожу, быстро впитывается слизистыми оболочками. Признаки отравления фенолом — сильная головная боль, тошнота, головокружение.
Впервые фенол был выделен из каменноугольной смолы. Этот способ получения долгое время оставался единственным. Ему на смену пришёл разработанный в Советском Союзе кумольный метод получения фенола. Этот метод основан на реакции окисления ароматического углеводорода (кумола) кислородом воздуха с получением двух важных продуктов — фенола и ацетона.
Молекула фенола, подобно молекулам спиртов, содержит гидроксильную функциональную группу. Однако в молекуле фенола с гидроксильной группой связан ароматический радикал, и эти два фрагмента молекулы оказывают друг на друга такое сильное влияние, что вещество приобретает специфические свойства, отличающие его как от спиртов, так и от аренов.

Влияние ароматического радикала —С6Н5 на гидроксильную группу выражается в значительном усилении её кислотных свойств. Это приводит к тому, что фенол, в отличие от спиртов, взаимодействует не только со щелочными металлами, но и со щелочами с образованием соли:

В свою очередь, гидроксильная группа влияет на протекание реакций по ароматическому кольцу. Например, замещение атома водорода атомом галогена уже не требует присутствия катализатора. Более того, при взаимодействии фенола с бромной водой атомами брома замещаются сразу три атома водорода цикла! И последнее. Гидроксильная группа направляет атомы брома, как полководец — войска, в строго определённые положения цикла: рядом с собой и напротив:
В продукте реакции фенола с бромом пронумерованы атомы углерода цикла. Теперь становится понятным название вещества: 2,4,6-трибромфенол. Три-бромфенол не растворяется в воде. При добавлении к раствору фенола бромной воды реакционная смесь мутнеет вследствие образования мелких кристалликов белого цвета. Эта реакция является качественной реакцией на фенол.
Ещё одна качественная реакция на фенол заключается в образовании окрашенного соединения фенола с катионом железа Fe 3+ . При добавлении нескольких капель раствора хлорида железа(III) к водному раствору фенола появляется характерное сиреневое окрашивание.

Применение фенола
В промышленности фенол получают в больших количествах. Почти 90 % всего объёма производства идёт на получение полимерных материалов, эпоксидных смол и синтетических волокон. На основе фенола получают синтетические моющие средства, лекарственные препараты, средства борьбы с сельскохозяйственными вредителями. Водный раствор фенола до сих пор находит применение в медицине, фенол добавляют в краски (некоторые сорта гуаши) в качестве связующего компонента и антисептика.

Читайте также:

