Реферат на тему фотохимические реакции
Обновлено: 02.07.2024
Фотохимическими называют реакции, протекающие под действием света. Поскольку любые химические реакции обусловлены процессами, происходящими с валентными электронами, то очевидно, что химическое действие света определяется его взаимодействием с электронами, находящимися на внешних: слоях электронных оболочек атомов. Поскольку количество поглощенной энергии пропорционально произведению потока излучения Фе на время, в течение которого тело подвергается освещению (т. е. доза излучения), то очевидно, что различные световые потоки производят одинаковое фотохимическое действие, если Ф1Dt1 = Ф2Dt2. Это положение представляет собой основной закон фотохимии и называется законом Бунзена и Роско.
Число j, показывающее, какая часть фотонов N из общего числа фотонов, поглощенных телом NП, вызвала фотохимические процессы, называют квантовым выходом реакции j = N/NП. Если каждый поглощенный фотон вызывает реакцию, то квантовый выход равен 100%. Однако обычно он не превышает нескольких процентов или долей процента. Например, квантовый выход реакции инактивации ферментов составляет примерно 0,1–0,01%.
Следует различать первичные и вторичные фотохимические реакции, так как многие из прореагировавших с фотонами молекул дают начало другим реакциям, происходящим с соседними молекулами. Эйнштейн показал, что каждой прореагировавшей молекуле соответствует только один поглощенный фотон, а следовательно, число прореагировавших молекул в первичной фотохимической реакции пропорционально числу поглощенных фотонов.
ТИПЫ ФОТОХИМИЧЕСКИХ РЕАКЦИЙ
Фотоприсоединение.К возбужденному атому или молекуле присоединяются нейтральные молекулы. Обозначим вступающие в реакцию молекулы А и В, а возбужденные молекулы соответственно А* и В*.
К этому типу реакций относятся:
а) фотодимеризация или фотополимеризация, протекающие по схеме A + A + hn ®A + A*® AA*;
б) фотооксидирование A + O2 + hn ®A* + O2 ® OAO;
в) фотогидратация A + H2O + hn ® A* + Н2О®НАОН и др.
Фотораспад.Он происходит с разрывом химических связей на радикалы, ионы или нейтральные молекулы
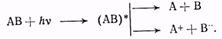
К числу широко известных реакций фотораспада относится реакция разложения бромистого серебра в фоточувствительных материалах. Под действием фотона из молекулы бромистого серебра удаляется электрон, и соединяющая молекулу ионная связь разрывается, в результате чего образуются мельчайшие частички металлического серебра, создающие так называемое скрытое изображение. Видимое изображение получается после обработки фотоматериала в проявителе, который вызывает усиленное выделение металлического серебра в местах скрытого изображения.
Фотосинтез. Это фотохимическая реакция синтеза органических веществ из углерода неорганических соединений и воды с образованием свободного молекулярного кислорода, протекающая в растениях и бактериях с участием хлорофиллов и некоторых других пигментов (каротиноиды, каротинолы и др.), которые играют роль катализаторов. В растениях углерод, поглощается в виде СО2. Фотоны разрывают прочную связь между кислородом и углеродом в молекуле СО2, и при этом образуются углеводороды, способные к дальнейшему окислению в организме животных. В простейшем случае, когда в растениях конечными продуктами фотосинтеза являются углеводороды, этот процесс, минуя промежуточные стадии, можно представить следующей реакцией: CO2 + H2O + hn ®СН2О + О2 + 469 кДж/моль.
Продукты этой реакции – кислород и углевод, из которого образуется глюкоза (СН2 = 1 êбСбН12О6). Реакция фотосинтеза обратна реакции, происходящей при дыхании, т.е. образованию СО2 и Н2О из органических соединений и кислорода.
Фотосинтез отличается от остальных фотохимических процессов тем, что он приводит к аккумулированию энергии света в виде свободной энергии химических связей в СН2О и в дальнейшем в глюкозе, так как свободная энергия СН2О больше свободной энергии СО2 и Н2О на 469 кДж/моль. Фотосинтез поэтому является единственным процессом, посредством которого органический мир пополняет свои запасы свободной энергии за счет энергии солнечного излучения, в то время как в процессах жизнедеятельности эта свободная энергия непрерывно растрачивается. Существенное отличие фотосинтеза от других биохимических реакций, происходящих в темноте (например, от синтеза белка в клетках животных), заключается в том, что только при фотосинтезе сложные вещества получаются непосредственно из таких простых веществ, как вода и СО2. Во всех других процессах в клетке синтез одних веществ связан с распадом других, поскольку необходимая для синтеза энергия черпается за счет энергии распада этих веществ.
Механизм фотосинтеза достаточно сложен и рассматривается в специальных курсах. Вкратце суть его сводится к тому. что пигменты в хлоропластах растений поглощают фотоны и их молекулы переходят в возбужденное состояние; при этом часть энергии излучается в актах люминесценции и часть переходит в теплоту. Вслед за этим происходит ряд процессов, в которых энергия возбужденных молекул пигментов расходуется на переносы электронов, окисление молекул воды с выделением свободного молекулярного кислорода и накоплением восстановленных пиридиннуклеотидов и АТФ. Эти богатые энергией соединения вступают в ряд темповых реакций, приводящих к связыванию и восстановлению СО2. Считается, что на образование одной молекулы О2, т. е. на протекание вышеприведенной суммарной реакции, расходуется 8 фотонов, т.е. квантовый выход реакции j = 1 ê8
Существуют реакции фотосинтеза, протекающие и без выделения О2, например у некоторых микроорганизмов: 2H2S + CO2 + hn –*CH2O + H2O + 2S. Эта реакция характерна для пурпурных и зеленых серобактерий.
Фотоизомеризация и некоторые другие реакции.Напомним,, что изомерами называют химические соединения, обладающие одинаковым составом, но различающиеся по расположению в них) атомов или групп атомов в пространстве. Изомеры могут быть разных видов. В частности, в геометрических изомерах группы атомов по-разному расположены относительно двойной связи С = С. Таковы, например, изомеры 1,2-дихлорэтилена.

Обе изомерные формы различаются некоторыми физическими и химическими свойствами. Например, температуры кипения цис- и транс-изомеров 1,2-дихлорэтилена равны соответственно 60,1 и 48,4°С. Обычно один из изомеров менее устойчив и переходит в другой изомер под действием определенных физических факторов: нагревания, освещения и др. Одна из важных фотобиологических реакций изомеризации происходит в сетчатке глаза.
Фотохимические реакции лежат в основе многих фотобиологических процессов, первичным актом в которых является поглощение фотона, за которым следует длинная цепочка превращений примерно в следующей последовательности: переход хромофорных молекулярных групп в возбужденное состояние ® эмиграция энергии возбужденного состояния от одной группы молекул к другой ® первичный фотофизический процесс и появление первичных фотопродуктов ® промежуточные процессы ® образование первичных стабильных химических продуктов ® биохимические процессы ® конечный фотобиологический эффект. Рассмотрение всех этих сложнейших процессов составляет предмет одного из разделов биофизики – фотобиологии.
Введение
1. Классификация фотохимических процессов
. Различие кинетики фотохимических и темновых реакций
. Процессы, протекающие при фотовозбуждении молекул
. Полные и локальные скорости фотохимических реакций
. Зависимость скорости фотохимических реакций от температуры
. Кинетикафлуоресценции, фосфоресценции и интеркомбинационной конверсии
. Хемилюминесценция
Заключение
Список литературы
фотохимический кинетика флуоресценция конверсия
Раздел физической химии, посвященный закономерностям реакций, протекающих под действием света, носит название фотохимии. Еще в начале XIX в. Гроттгус в России, а затем Дрейпер в США сформулировали закон, согласно которомуфотохимически активны только те лучи, которые поглощаются при реакции. Этот закон в настоящее время очевиден и не имеет исключений. Обратное утверждение, что лучи, которые поглощаются при реакции, являются фотохимически активными, не верно, так как не вce они вызывают фотохимическую реакцию.
Особенностью фотохимической активации является ее селективность. Поглощенные кванты света возбуждают и тем самым приводят вактивное состояние отдельную связь или группу атомов в данной молекуле. В этом большое преимущество активации молекул светом по сравнению с термической активацией.
Другой закон, которому подчиняются фотохимические реакции, был найден Бунзеном и Роско в 1855 г. в результате изучения реакции соединения хлора с водородом на свету. Этот закон формулируется так: химическое действие света прямопропорционально произведению интенсивности света I на время его воздействия t. Закон этот носит приближенный характер, потому что не вся поглощаемая световая энергия расходуется на химический процесс.
Основным законом, позволившим разобраться в механизме фотохимических реакций, является закон фотохимической эквивалентности А. Эйнштейна, согласно которому каждый поглощенный квант света вызывает превращение одноймолекулы.
Фотохимические реакции - химические превращения, протекающие под действием света в видимой и ультрафиолетовой области спектра.
Типы фотохимических реакций:
1. Фотодиссоциация (фотолиз) приводит к разложению исходного вещества, поглотившего световую энергию. Примерами реакции фоторазложения служат такие: разложение галогенидов серебра (основа серебряной фотографии), фотолиз паров ацетона CH3COCH3 → CO + другие продукты.
2. Фотосинтез приводит к образованию более сложных соединений. Примерами реакций фотосинтеза служат:
· фотосинтез озона в верхних слоях атмосферы, создающий защитный озоновый слой:
· фотосинтез органических соединений из углекислого газа, воды, минеральных веществ зелеными растениями. В частности, синтез глюкозы может быть описануравнением:
3. Фотохромизм - явление обратимого изменения пространственного или электронного строения молекул под действием света, сопровождающееся изменением окраски вещества. На основе фотохромных материалов изготовляются линзы с переменным светопропусканием, оконные стекла, фотохромные системы на основе некоторых органических и координационных соединений.
1. Классификацияфотохимических процессов
Для характеристики фотохимических реакций было введено понятие квантового выхода γ. Квантовым выходом называется отношение числа прореагировавших молекул к числу поглощенных квантов
где N' - число прореагировавших молекул; Q - количество поглощенной све товой энергии; hv- энергия одного светового кванта.
Для расчетов более удобно пользоваться не числом молекул, а числом молей.Тогда квантовый выход запишется в виде
где п - число прореагировавших молей вещества; NA- число Авогадро.
Количество энергии, необходимое для фотопревращения одного моля вещества при данной длине волны, равно 6,02∙1023hvи носит название Эйнштейн. Таким образом
где - волновое число.
Числовое значение одного Эйнштейна зависит от частоты.
После поглощения кванта света в молекуле могут происходить разнообразные процессы. В начале 20 в. Альбертом Эйнштейном и немецким физиком Иоганном Штарком был сформулирован второй закон фотохимии. В соответствии с этим законом, первичный фотохимический акт происходит под действием одного кванта света – фотона. Поэтому этот закон называют также законом квантовой эквивалентности.
Работа состоит из 1 файл
ФОТОХИМИЧЕСКИЕ РЕАКЦИИ.docx
ФОТОХИМИЧЕСКИЕ РЕАКЦИИ – химические превращения, протекающие под действием света в видимой и ультрафиолетовой области спектра.
После поглощения кванта света в молекуле могут происходить разнообразные процессы. В начале 20 в. Альбертом Эйнштейном и немецким физиком Иоганном Штарком был сформулирован второй закон фотохимии. В соответствии с этим законом, первичный фотохимический акт происходит под действием одного кванта света – фотона. Поэтому этот закон называют также законом квантовой эквивалентности. (После открытия лазеров было обнаружено, что у этого закона есть исключения: в случае очень мощного лазерного излучения возможно одновременное поглощение двух фотонов.)
Второй закон фотохимии служит основой для расчета квантового выхода фотохимической реакции, который равен числу прореагировавших (или вновь образовавшихся) молекул, деленному на число поглощенных квантов. Квантовый выход, определяемый экспериментально, позволяет судить о механизме фотохимической реакции.
Молекула, поглотившая в первичном процессе квант света, приобретает избыточную энергию, поэтому такую молекулу называют возбужденной. В отличие от теплового воздействия, когда возбуждаются колебательные движения молекулы и возрастает ее кинетическая энергия, при поглощении фотона энергия передается электронам. С электронно возбужденной молекулой могут происходить самые разнообразные процессы. Некоторые из них не связаны с химическими превращениями и называются фотофизическими процессами. Так, возбужденное состояние может за очень короткое время (порядка 10–9 с) вернуться в основное состояние, отдавая избыточную энергию в виде кванта света (как правило, с меньшей энергией). Этот процесс называется флуоресценцией. Если же в результате столкновения возбужденной молекулы с другими молекулами происходит передача избыточной энергии, то интенсивность флуоресценции снижается – частично или полностью. Такие процессы с потерей энергии называются тушением флуоресценции. Возбужденное состояние может также перейти в более долгоживущее (от 0,001 с до нескольких минут) триплетное состояние, энергия которого ниже. Испускание света из этого состояния называется фосфоресценцией.
Возбужденная светом молекула может также вступать в различные химические реакции. Свойства электронно возбужденного состояния могут сильно отличаться от свойств основного состояния молекулы. Так как у каждой молекулы существует лишь одно основное, но несколько возбужденных состояний, фотохимия данного соединения может быть существенно богаче его химии в основном состоянии. В результате появляется возможность осуществлять необычные химические превращения, не свойственные веществам в основном состоянии.
Если после поглощения фотона преобладают фотофизические процессы, число химически прореагировавших молекул, приходящихся на один поглощенный квант, то есть квантовый выход реакции, будет меньше единицы. Например, при облучении красным светом водного раствора ферриоксалата калия (комплекса трехвалентного железа с анионом щавелевой кислоты – оксалатом состава К3[Fe(C2O4)3]) квантовый выход фотохимической реакции 2Fe(C2O4)33– ® 2Fe2+ + 5C2O42– + 2CO2 равен всего 0,01, но возрастает с увеличением энергии кванта света. Еще меньшие квантовые выходы наблюдаются при фотохимическом разложении (фотолизе) твердых тел. Например, даже на ярком солнечном свету полимерные пленки разрушаются довольно медленно, в течение многих недель, месяцев и даже лет.
В большинстве фотохимических реакций получаемая молекулой энергия превышает типичные энергии активации темновых (термических) реакций и может даже превосходить энергию разрыва химических связей. Тем не менее многие фотохимические реакции отличаются высокой избирательностью, что связано с особенностями электронного строения возбужденного состояния.
Рассмотрим некоторые фотохимические реакции. В результате реакции фотодиссоциации происходит разрыв химических связей с образованием свободных радикалов (См. также СВОБОДНЫЕ РАДИКАЛЫ). Примером могут служить реакции Cl2 ® 2Cl; CH3I ® CH3 + I; CH3–N=N–CH3 ® 2CH3 + N2 и другие. Образующиеся атомы и радикалы обладают высокой реакционной способностью и вступают в быстрые темновые реакции, часто цепные. В результате квантовый выход суммарной реакции может стать значительно больше единицы. Так, при облучении смеси Cl2 + H2 квантовый выход HCl может достигать сотен тысяч. Фотохимическое радикально-цепное присоединение сероводорода к алкенам используется для синтеза меркаптанов – соединений с сильным запахом, которые добавляют к природному газу для обнаружения его утечки. Очень важны реакции фотодиссоциации молекул кислорода и озона, идущие в верхних слоях атмосферы. С помощью реакций фотодиссоциации можно осуществлять различные процессы радикальной полимеризации. Подобные процессы применяются в производстве интегральных схем; с помощью фоторезистов на кремниевой подложке обозначаются участки, на которых в последующем образуются элементы будущей микросхемы. В зубоврачебной технике фотополимеризация используется для отверждения современных пломбировочных материалов.
Реакция фотодиссоциации используется в промышленно важном процессе получения e-капролактама – исходного вещества для производства капрона. Облучению видимым светом подвергают нитрозилхлорид, который при этом распадается: NOCl + h238 ® NO + Cl. Далее атомы хлора реагируют с циклогексаном: цикло-С6Н12 + Cl ® цикло-С6Н11 + НСl, а циклогексильные радикалы реагируют с NO или NOCl: цикло-С6Н11 + NO (NOCl) ® цикло-С6Н11NO ® цикло-С6Н10=N–OH. Образовавшийся при изомеризации нитрозоциклогексана циклогексанонооксим далее превращается в e-капролактам.
Фотохимический разрыв С–С-связи в стероидном соединении 7-дегидрохолестерине используется для синтеза витамина D3, который добавляют в корма животных. В сходной фотохимической реакции из эргостерина получают витамин D2; эта реакция протекает под действием солнечного света и в коже человека.
Реакции фотодиссоциации с разрывом химических связей могут идти в разнообразных полимерных материалах под действием видимого или ультрафиолетового света. Образующиеся при этом радикалы могут приводить к разрыву связей С–С в углеродных цепочках полимера. Эти процессы приводят к так называемой фотодеструкции полимеров, которые ускоряются под действием агрессивных компонентов атмосферы – кислорода, озона, оксида азота(IV). В результате ухудшаются механические свойства полимера. Они особенно заметны на полиэтиленовой пленке парника, которая в течение многих месяцев подвергалась действию прямых солнечных лучей. Поэтому очень важны меры по фотостабилизации полимеров; ее можно осуществить введением ингибиторов радикальных реакций. С другой стороны, для упаковочных полимерных материалов, наоборот, желательно быстрое их разрушение после использования, чтобы избежать загрязнения этими полимерами окружающей среды. Такие полимеры намеренно делают светочувствительными; под действием солнечных лучей они рассыпаются в тонкий порошок.
Возбужденные светом молекулы могут также вступать в реакции переноса электрона – фотоокисление и фотовосстановление. Так, возбужденные карбонильные соединения в присутствии восстановителя могут превращаться в спирты, а возбужденные молекулы красителей, реагируя с кислородом, превращаются в бесцветные соединения. На фотовосстановлении солей железа(III) органическими реагентами (щавелевая или лимонная кислота) основаны методы светокопирования чертежей: образующиеся при фотовосстановлении Fe3+ ионы Fe2+, реагируя с красной кровяной солью, дают синий осадок См. также ЛАЗУРЬ БЕРЛИНСКАЯ.
Под действием света могут идти реакции фотоприсоединения. Так, при возбуждении молекул с двойной связью возможен ее разрыв с образованием бирадикала, например, Н2С=СН2 ® Н2С.–.СН2. Присоединение к нему второй молекулы этилена дает циклобутан. Такое циклоприсоединение с участием двух молекул алкенов происходит только под действием ультрафиолетового света; при нагревании эта реакция не идет, поскольку она запрещена так называемым правилом Вудворда – Хоффмана. В карбонильных соединениях с двойной связью С=О также возможен ее частичный разрыв с образованием реакционноспособного бирадикала. К нему может присоединиться молекула алкена с образованием четырехчленного циклического соединения – оксетана. Оксетановый цикл входит в состав некоторых антибиотиков; подобные соединения часто могут быть получены только фотохимически.
Под действием света идут также разнообразные реакции фотоизомеризации. Например, транс-стильбен (1,2-дифенилэтилен) под действием света превращается в цис-стильбен. Цис-транс-изомеризация ретиналя (вещества, родственного ретинолу – витамину А) под действием света приводит в результате ряда последующих процессов к возникновению зрительного сигнала в сетчатке глаза.
Фотохимическим хлорированием бензола получают инсектицид гексахлорциклогексан. Фтотохимическим хлорированием, сульфохлорированием (одновременная реакция с SO2 и Cl2) и сульфоокислением алканов получают растворители, моющие средства и средства для химической чистки. Большое практическое значение имеют фотохимические реакции в зеленых растениях (фотосинтез).
Обратимые превращения веществ под действием света в ряде случаев приводят к интересному явлению – фотохромизму. Оно заключается в приобретении или изменении окраски под действием света. Обратная реакция может идти как в темноте, так и под действием света с другой длиной волны. Скорости прямой и обратной реакции могут быть различными. Часто прямая фотохимическая реакция идет сравнительно быстро, а обратная темновая – медленно. Фотохромизм наблюдается как у неорганических, так и у органических соединений. Механизм явления может быть разным. В случае кристаллических соединений действие света может сводиться к перемещению электронов или атомов из одних узлов кристаллической решетки в другие. Так, светозащитное фотохромное стекло содержит около 0,5% хлорида или бромида серебра, сплавленного с боросиликатами щелочных металлов. Под действием света происходит перенос электронов от ионов галогена к ионам серебра; образовавшиеся атомы серебра делают стекло непрозрачным. Обратная реакция может идти под действием света с другой длиной волны или в темноте. Такое стекло используется для изготовления солнечных очков, окон зданий и автомобилей; оно само регулирует пропускаемый световой поток, делая его оптимальным.
Кроме галогенидов серебра, фотохромными свойствами (в присутствии различных добавок) обладают также некоторые соли щелочных металлов – титанаты, силикаты, фосфаты. Смесь кристаллического иодида ртути(I) зеленого цвета и желтого иодида серебра представляет пример фотохромной системы, в которой изменение цвета сопровождается окислительно-восстановительной реакцией и изменением кристаллической структуры; в результате образуются красный иодид ртути(II) и черный порошок серебра: Hg2I2 + 2AgI ® 2HgI2 + 2Ag.
Фотохромизм органических соединений связан, как правило, с изменением структуры молекулы. Фотохромная изомеризация характерна для многих ароматических нитросоединений. Например, в о-нитротолуоле при облучении происходит внутримолекулярный перенос протона, в результате которого светло-желтая жидкость переходит в ярко-синюю R2CH–NO2 R2С=N+(O–)–OH.
Знание о механизме фотохимических реакций очень важно для человека. Оно открыло ему дверь в мир блестящих открытий в различных областях науки и деятельности, помогло понять сущность многих процессов, протекающих в человеческом организме и мире природы.Область практического приложения фотохимии обширна. Разрабатываются способы химического синтеза на основе фотохимических реакций (фотохимический реактор, солнечная фотосинтетическая установка). Нашли применение, в частности для записи информации, фотохромные соединения. С применением фотохимических процессов получают рельефные изображения для микроэлектроники, печатные формы для полиграфии (фотолитография). Практическое значение имеет фотохимическое хлорирование (главным образом насыщенных углеводородов). Важнейшая область практического применения фотохимии – фотография. В организме человека проходят важнейшие фотохимические реакции, поэтому невозможно переоценить важность знания фотохимических реакций для медицины.
Цель реферата: обобщить и систематизировать знания о механизме фотохимических реакций как основы важнейших фотобиологических процессов.
Рассмотреть механизм фотохимической реакции, определить основные законы фотохимии.
Дать понятие цепной реакции и раскрыть ее механизм.
В отдельности рассмотреть фотобиологические процессы: загар, перекисное окисление липидов, зрительный процесс, фотосинтез.
Выяснить, какова область применения фотохимических реакций в стоматологии.
Глава1. Механизм фотохимической реакции
Фотохимия – это раздел физической химии, посвященный закономерностям реакций, протекающих под действием света.
Фотохимические процессы – это сложные химические реакции, протекающие под действием света.
Все фотохимические процессы подчиняются закону Гроттуса:
Химическое превращение вещества может быть вызвано только тем светом, который этим веществом поглощается.
Отраженные веществом лучи, а также прошедшие сквозь него, не вызывают никаких химических превращений.
Количественно фотохимический процесс выражается уравнением:
m=k∙W∙t
где m– масса прореагировавшего вещества;
W- мощность света;
k- коэффициент пропорциональности, который соответствует массе вещества, приходящейся на единицу поглощенной световой энергии.
Это уравнение справедливо только для первичных фотохимических реакций.
Рассмотрим механизм фотохимической реакции:
1 стадия –образование фотовозбужденных молекул

A+hν A*,
где А – молекула в исходном состоянии,
А* - молекула реагента, поглотившая квант света с энергией Е = hν.
Возбужденные молекулы распадаются или вступают в реакции с другими реагентами, образуя радикалы или ионы Х1 и Х2:

А* + В Х1 + Х2
Эта реакция называется первичной.
Активные частицы (ионы или радикалы) вступают во вторичные реакции в которых образуются конечные продукты:

Х1+В С

Х2+В D
Между количеством лучистой энергии, поглощенной частицами вещества и количеством, фотохимически прореагировавших частиц, существует соотношение, выражающее закон фотохимической эквивалентности Энштейна:
Число частиц, подвергшихся первичному фотохимическому превращению равно числу поглощенных ими квантов света.
Для суждения о том, применим ли к данной фотохимической реакции закон эквивалентности Энштейна, пользуются понятием о квантовом выходе реакции.
Квантовым выходом реакции γ называют отношение числа N частиц, претерпевших химическое превращение, к числу поглощенных квантов:
γ=N/(Q/hν)
Q – энергия поглощенного излучения.
Квантовый выход не для всех фотохимических реакций равен единице. Он может больше или меньше единицы. Больше – если вслед зареакций происходят вторичные реакции, в результате которых на один поглощенный фотон приходится несколько молекул продукта реакции.
Например, О2 + hν => О + О – первичная реакция
Один квант вызывает превращение трех молекул кислорода.
Меньше единицы–если имеются примеси, поглощающие фотоны, или в случае необратимости реакции.
Читайте также:

