Золото нахождение в природе кратко
Обновлено: 17.05.2024
Металлический радиус атома золота 0, 137 нм, радиус иона Au + — 0, 151 нм для координационного числа 6, иона Au 3+ — 0, 084 нм и 0, 099 нм для координационных чисел 4 и 6. Энергии ионизации Au 0 — Au + — Au 2+ — Au 3+ соответственно равны 9, 23, 20, 5 и 30, 47 эВ. Электроотрицательность по Полингу 2, 4.
Нахождение в природе
Содержание в земной коре 4, 3·10 –7 % по массе, в воде морей и океанов менее 5·10 –6 % мг/л. Относится к рассеянным элементам. Известно более 20 минералов, из которых главный — самородное золото (электрум, медистое, палладиевое, висмутовое золото). Самородки большого размера встречаются крайне редко и, как правило, имеют именные названия. Химические соединения золота в природе редки, в основном это теллуриды — калеверит AuTe2, креннерит (Au, Ag)Te2 и другие. Золото может присутствовать в виде примеси в различных сульфидных минералах: пирите, халькопирите, сфалерите и других.
Современные методы химического анализа позволяют обнаружить присутствие ничтожных количеств Au в организмах растений и животных, в винах и коньяках, в минеральных водах и в морской воде.
История открытия
Золото было известно человечеству с древнейших времен. Возможно, оно явилось первым металлом, с которым познакомился человек. Имеются данные о добыче золота и изготовлении изделий из него в Древнем Египте (4100-3900 годы до н. э.), Индии и Индокитае (2000-1500 годы до н. э.), где из него изготавливали деньги, дорогие украшения, произведения культа и искусства.
Получение
Источники золота при его промышленном получении — руды и пески золотых россыпных и коренных месторождений, содержание золота в которых составляет 5-15 г на тонну исходного материала, а также промежуточные продукты (0, 5-3 г/т) свинцово-цинкового, медного, уранового и некоторых других производств.
Процесс получения золота из россыпей основан на разнице плотностей золота и песка. С помощью мощных струй воды измельченную золотоносную породу переводят во взвешенное в воде состояние. Полученная пульпа стекает в драге по наклонной плоскости. При этом тяжелые частицы золота оседают, а песчинки уносятся водой.
Другим способом золото извлекают из руды, обрабатывая ее жидкой ртутью и получая жидкий сплав — амальгаму. Далее амальгаму нагревают, ртуть испаряется, а золото остается. Применяют и цианидный способ извлечения золота из руд. В этом случае золотоносную руду обрабатывают раствором цианида натрия NaCN. В присутствии кислорода воздуха золото переходит в раствор:
Физические и химические свойства
Золото — желтый металл с кубической гранецентрированной решеткой (a = 0, 40786 нм). Температура плавления 1064, 4 °C, температура кипения 2880 °C, плотность 19, 32 кг/дм 3 . Обладает исключительной пластичностью, теплопроводностью и электропроводимостью. Шарик золота диаметром в 1 мм можно расплющить в тончайший лист, просвечивающий голубовато-зеленым цветом, площадью 50 м 2 . Толщина самых тонких листочков золота 0, 1 мкм. Из золота можно вытянуть тончайшие нити.
Золото устойчиво на воздухе и в воде. С кислородом, азотом, водородом, фосфором, сурьмой и углеродом непосредственно не взаимодействует. Антимонид AuSb2 и фосфид золота Au2P3 получают косвенными путями.
В ряду стандартных потенциалов золото расположено правее водорода, поэтому с неокисляющими кислотами в реакции не вступает. Растворяется в горячей селеновой кислоте:
При аккуратном упаривании получаемого раствора можно получить желтые кристаллы золотохлористоводородной кислоты HAuCl4·3H2O.
С галогенами без нагревания в отсутствие влаги золото не реагирует. При нагревании порошка золота с галогенами или с дифторидом ксенона образуются галогениды золота:
Термическим разложением гексафторауратов (V), например, O2 + [AuF6] – получены фториды золота AuF5 и AuF7. Их также можно получить, окисляя золото или его трифторид с помощью KrF2 и XeF6.
Моногалогениды золота AuCl, AuBr и AuI образуются при нагревании в вакууме соответствующих высших галогенидов. При нагревании они или разлагаются:
При восстановлении золота из разбавленных растворов его солей, а также при электрическом распылении золота в воде образуется стойкий коллоидный раствор золота:
Окраска коллоидных растворов золота зависит от степени дисперсности частиц золота, а интенсивность от их концентрации. Частицы золота в растворе всегда отрицательно заряжены.
Применение
Золото и его сплавы используют для изготовления ювелирных изделий, монет, медалей, зубных протезов, деталей химической аппаратуры, электрических контактов и проводов, изделий микроэлектроники, для плакирования труб в химической промышленности, в производстве припоев, катализаторов, часов, для окрашивания стекол, изготовления перьев для авторучек, нанесения покрытий на металлические поверхности. Обычно золото используют в сплаве с серебром или палладием (белое золото; также называют сплав золота с платиной и другими металлами). Содержание золота в сплаве обозначают государственным клеймом. Золото 583 пробы является сплавом с 58, 3% золота по массе. См также Золото (в экономике).
Физиологическое действие
Некоторые соединения золота токсичны, накапливаются в почках, печени, селезенке и гипоталамусе, что может привести к органическим заболеваниям и дерматитам, стоматитам, тромбоцитопении.

В периодической системе химических элементов золото стоит под номером 79, но его значение для нашей цивилизации огромно. Этот минерал известен с самых древних времен. Алхимики Средневековья наделяли его мистическими свойствами, и долгие годы безуспешно пытались воссоздать в своих лабораториях. Инки обожествляли золото, считая его священным металлом бога Солнца. Из-за него рушились государства и восставали из пепла новые империи. Наш рассказ об удивительных свойствах золота и его биологической роли в организме человека.
История происхождения
Металл царей и фараонов
В России разработка собственных месторождений золота началась лишь в середине 18 века. Первые залежи драгоценного металла были обнаружены в Архангельской губернии, а масштабная добыча развернулась уже на Урале, после обнаружения золотоносных жил Ерофеем Марковым.
В составе живых организмов золото впервые обнаружил французский химик Клод Луи Бертольо. Мельчайшие частицы этого металла ученый синтезировал из золы растений.
Нахождение золота
в природе
Зато в водах Мирового океана скрыты поистине несметные запасы золота (примерно 5 килограмм на один кубический километр воды). В местах его наибольшей концентрации вода имеет характерный зеленоватый оттенок. Лидером по содержанию этого металла является Карибский бассейн (15-18 мг на тонну морской воды). Однако синтезировать его таким образом чрезвычайно сложно.
Интересный факт. В годы Второй мировой войны подобным промыслом пытались заниматься нацисты, но очень скоро поняли, что овчинка выделки не стоит: чтобы добыть 100 грамм золота, необходимо переработать около 100 тонн морской воды.
Именно вода и является основным проводником благородного металла, делая возможным его добычу. Переносимые грунтовыми водами, частицы этого вещества оседают в руслах рек и горной породе, образуя кварцевые золотоносные жилы.
Содержание золота на поверхности солнца во много раз превышает его запасы на нашей планете, поэтому метафорическое название данного элемента себя вполне оправдывает.
Область применения золота
• Золото – одно из основных средств инвестирования. Это оплот финансовой стабильности большинства стран.
• В стоматологии, для изготовления зубных протезов и коронок.
• Благодаря высокой степени электропроводимо сти используется в микроэлектронике , для изготовления контактов и гальванических покрытий.
• В ядерной сфере, в том числе, для изготовлений нейтронных бомб.
• Обладая хорошей устойчивостью к коррозии, служит для амальгамизации (покрытие защитной пленкой) металлических поверхностей.
Биологическая роль золота
У южноамериканских индейцев трапеза на золотой утвари считалась символом примирения. К тому же они были убеждены, что драгоценный металл способен нейтрализовать любой яд, который мог пустить в ход коварный недруг.
С развитием науки большинство подобных мифов было развеяно. Во многом это обусловлено тем, что металлическое золото очень плохо вступает в биохимические реакции. Содержание этого минерала в организме взрослого человека составляет приблизительно 10 мг. Почти половина его содержится в костной ткани. Кроме того, оно концентрируется в головном мозге, печени и почках.
Доказано, что в организме этот драгоценный металл выполняет следующие биологические функции:
• Обладает антибактериальны ми свойствами , усиливая действие серебра.
• Способствует укреплению иммунной системы.
• Благодаря высокой степени электропроводимо сти участвует в процессе передачи нервных импульсов.
• Обладает антисклеротическ им действием.
• Связывает гормоны в тканях.
Некоторые исследователи считают, что даже выпивая в сутки 2 литра чистой воды, за дефицит золота в организме можно не волноваться.
Применение золота в медицине
Возможно, многие не знают, что применение золота в медицине очень широкое. Препараты с его содержанием используют для лечения следующих заболеваний.
• Болезни суставов: остеохондроз, деформирующий, ревматоидный и псориатический артриты, синдром Фелти.
• Стоматологически е заболевания (пародонтоз).
• Сосудистые заболевания (гипертония).
• Аутоиммунные (системная красная волчанка).
• При депрессивных расстройствах.
• Для лечения злокачественных опухолей легких и ряда других онкологических заболеваний.
• Йодистое золото широко применяется для лечения атеросклероза, причем у таких препаратов практически отсутствуют побочные действия.
• В пластической хирургии и косметологии.
Отравление золотом.
Последствия передозировки
Нужно сказать , что отравление золотом – явление достаточно редкое. Получить опасную для здоровья дозу можно на ювелирном производстве, вдыхая мельчайшие частицы этого металла. Также подобное отравление возможно при передозировке золотосодержащим и препаратами.
Токсичная доза золота точно не определена, однако следует помнить, что оно относится к тяжелым металлам, а потому потенциально опасно. Особенно осторожно к приему препаратов с его содержанием следует относиться людям, страдающим от следующих заболеваний.
• Заболевания сердечно-сосудис той и кровеносных систем.
• Заболевания печени и почек.
Основными симптомами отравления золотом являются:
• тошнота, рвота, диарея;
• вялость, упадок сил;
• нарушение функций центральной нервной системы;
• поражения печени и почек.
При серьезной степени интоксикации наблюдается:
• появление характерных темных пятен на коже;
• серьезная потеря веса и истощение организма;
• развитие хронического конъюнктивита;
• угнетение центральной нервной системы;
• боли в мышцах, суставах и костях;
• поражение костного мозга;
• панцитопения (заболевание крови, характеризующеес я снижением уровня всех элементов).
При этом потенциально опасным для организма считается только коллоидное золото. В металлическом состоянии этот элемент практически безвреден, за исключением редких случаев аллергической реакции.
Дефицит золота
в организме
Продукты,
содержащие золото
Список продуктов, содержащих золото , весьма скуден. По сути, главным его пищевым источником является кукуруза. Если включать в свой рацион кукурузную кашу хотя бы единожды в месяц, ваш организм не испытает дефицита данного элемента.
Старая индейская легенда гласит, что когда мудрые боги решили разделить земные богатства между всеми народами, первыми к раздаче даров явились индейцы и выбрали самое ценное – отливающий золотом кукурузный початок. Неспроста маис настолько высоко ценился и почитался коренными жителями Америки.
Наноскопические частицы золота содержатся в корневой системе ячменя и льна. Кроме того, накапливать его способны красные и бурые водоросли, произрастающие на золотоносном шельфе. Благодаря этому геологам удается обнаруживать месторождения драгоценного металла в речных артериях и морских водах.
Большинство растений неспособны усваивать золото, поскольку в растворенном состоянии – это сильнейший яд, вызывающий омертвение клеток. Однако некоторые представители наземной флоры устойчивы к токсичному воздействию данного металла и могут накапливать его в незначительных количествах. К ним относятся следующие виды.
• Береза (листья и почки).
• Люцерна посевная (побеги и листья), полынь горькая, зайцегуб опьяняющий, хвощ полевой, желтушник седеющий.

Золото — минерал, являющийся природным твёрдым раствором серебра (следы, до 43%) в золоте; обычны примеси (следы, до 0,9%) меди, железа, свинца, реже – висмута, ртути, платины, марганца и др. Известны разновидности с повышенным содержанием меди – до 20% (медистое золото, купроаурит), висмута – до 4% (висмутистое золото, висмутаурит), платиноидов (платинистое и иридистое золото; порпецит – Au, Pd, родит – Au, Rh), природные амальгамы (Au, Hg).
СТРУКТУРА
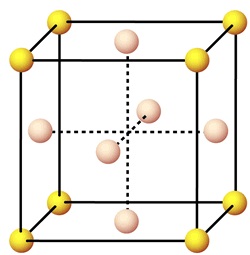
Кристаллическая структура золота
Кристаллизуется в кубической сингонии, в виде октаэдров, ромбододекаэдров, кубов и более сложных по форме кристаллов; нередко они искажены, сильно вытянуты, образуя “проволочки”, “волоски”, или уплощены параллельно грани октаэдра. Для самородного золота особенно низкопробного, характерно многообразие форм роста, оно обычно в виде скелетных кристаллов, дендритов, нитевидных и скрученно-нитевидных кристаллов. Широко распространены прожилковидные и неправильные комковидные, “крючковатые” выделения; на их поверхности нередко сохраняются отпечатки кристаллов других минералов, агрегаты которых включали скопления самородного золота. Травление выявляет кристаллически-зернистое строение золотых частиц.
СВОЙСТВА

Золотые слитки и самородки
Золото — очень тяжёлый металл: плотность чистого золота равна 19,32 г/см³ (шар из чистого золота диаметром 46,237 мм имеет массу 1 кг). Диамагнетик, то есть, магнитное поле в золоте ослабевает. Среди металлов по плотности занимает седьмое место после осмия, иридия, рения, платины, нептуния и плутония. Сопоставимую с золотом плотность имеет вольфрам (19,25). Высокая плотность золота облегчает его добычу, отчего даже простые технологические процессы — например, промывка на шлюзах, — могут обеспечить высокую степень извлечения золота из промываемой породы.
Золото — очень мягкий металл: твёрдость по шкале Мооса ~2,5, по Бринеллю 220—250 МПа (сравнима с твёрдостью ногтя).
Золото также высокопластично: оно может быть проковано в листки толщиной до ~0,1 мкм (100 нм) (сусальное золото); при такой толщине золото полупрозрачно и в отражённом свете имеет жёлтый цвет, в проходящем — окрашено в дополнительный к жёлтому синевато-зеленоватый. Золото может быть вытянуто в проволоку с линейной плотностью до 2 мг/м.
Температура плавления золота 1064,18 °C (1337,33 К), кипит при 2856 °C (3129 К). Плотность жидкого золота меньше, чем твёрдого, и составляет 17 г/см 3 при температуре плавления. Жидкое золото довольно летучее, и активно испаряется задолго до температуры кипения.
ЗАПАСЫ И ДОБЫЧА

Содержание золота в земной коре очень низкое — 4,3·10 -10 % по массе (0,5-5 мг/т), но месторождения и участки, резко обогащённые металлом, весьма многочисленны. Золото содержится и в воде. Один литр и морской, и речной воды содержит менее 5·10 −9 граммов Au, что примерно соответствует 5 килограммам золота в 1 кубическом километре воды.
Золоторудные месторождения возникают преимущественно в районах развития гранитоидов, небольшое их количество ассоциирует с основными и ультраосновными породами.
Для получения золота используются его основные физические и химические свойства: присутствие в природе в самородном состоянии, способность реагировать лишь с немногими веществами (ртуть, цианиды). С развитием современных технологий более популярными становятся химические способы.
В 1947 году американские физики Ингрем, Гесс и Гайдн проводили эксперимент по измерению эффективного сечения поглощения нейтронов ядрами ртути. В качестве побочного эффекта эксперимента было получено около 35 мкг золота. Таким образом, была осуществлена многовековая мечта алхимиков — трансмутация ртути в золото. Однако экономического значения такое производство золота не имеет, так как обходится во много раз дороже добычи золота из самых бедных руд.
ПРОИСХОЖДЕНИЕ

Изделия из золота
Самородное золото – главная форма нахождения золота в природе. Оно концентрируется в гидротермальных месторождениях образуя золотые руды, неравномерно распределяясь в трещиноватом жильном кварце и в сульфидах – пирите, арсенопирите, пирротине и др. В существенно сульфидных рудах самородное золото тонкодисперсное. При окислении руд на земной поверхности мелкое самородное золото частично растворяется и переотлагается; в ряде случаев оно обогащает верхние части рудных тел. Процессы их разрушения приводят к освобождению частиц самородного золота и их накоплению в россыпях; перемещаясь водными потоками вместе с другим кластическим материалом, частицы окатываются, округляются, деформируются, частично перекристаллизовываются; в результате электрохимической коррозии на них образуется тонкая оболочка высокопробного золота, что приводит к общему повышению пробы самородного золота в россыпях.
ПРИМЕНЕНИЕ

По своей химической стойкости и механической прочности золото уступает большинству платиноидов, но незаменимо как материал для электрических контактов. Поэтому в микроэлектронике золотые проводники и гальванические покрытия золотом контактных поверхностей, разъёмов, печатных плат используются очень широко.
Золото используется в качестве мишени в ядерных исследованиях, в качестве покрытия зеркал, работающих в дальнем инфракрасном диапазоне, в качестве специальной оболочки в нейтронной бомбе. Тонкий слой золота (20 нм) на внутренней поверхности оконных и витражных стекол существенно уменьшает нежелательные тепловые потери зимой, а летом предохраняет внутренние помещения зданий и транспортных средств от нагревания инфракрасными лучами.
Золотые припои очень хорошо смачивают различные металлические поверхности и применяются при пайке металлов. Тонкие прокладки, изготовленные из мягких сплавов золота, используются в технике сверхвысокого вакуума.
Традиционным и самым крупным потребителем золота является ювелирная промышленность. Ювелирные изделия изготавливают не из чистого золота, а из его сплавов с другими металлами, значительно превосходящими золото по механической прочности и стойкости. В настоящее время для этого служат сплавы Au-Ag-Cu, которые могут содержать добавки цинка, никеля, кобальта, палладия. Стойкость к коррозии таких сплавов определяются, в основном, содержанием в них золота, а цветовые оттенки и механические свойства — соотношением серебра и меди.
Значительные количества золота потребляет стоматология: коронки и зубные протезы изготовляют из сплавов золота с серебром, медью, никелем, платиной, цинком. Такие сплавы сочетают коррозионную стойкость с высокими механическими свойствами.
Соединения золота входят в состав некоторых медицинских препаратов, используемых для лечения ряда заболеваний (туберкулёза, ревматоидных артритов и т. д.). Радиоактивный изотоп 198 Au (период полураспада 2,967 сут.) используется при лечении злокачественных опухолей в радиотерапии.

Распространенность металла
Золото как химический элемент встречается повсеместно. Мнение о том, что драгметалл можно найти только на территории месторождений неверно. Золото в распыленном состоянии находится в растениях и животных, а также в организме человека. Определить наличие металла в этих случаях можно только особыми аналитическими методами. Золото в природе содержится в водах Мирового океана, его концентрация на тонну воды составляет от 4 до 10 мг. Такой показатель является хорошим, вот только эффективные способы извлечения металла из вод Мирового океана на сегодняшний день отсутствуют.

Среднее содержание желтого металла в коре нашей планеты не превышает одну миллионную долю процента, поэтому порог концентрации золота в основной породе, позволяющий считать некую территорию месторождением, также очень низок. Иногда даже соотношение в четверть грамма драгоценного металла на тонну породы может быть признано выгодным для начала добычи золота в этом месте.
Виды месторождений
Мировая золотодобывающая промышленность использует в качестве сырьевой базы непосредственно золотые месторождения и комплексные месторождения, содержащие драгоценный металл. Как появляется золото? Существует два типа месторождений металла в природе: коренные и россыпные.

Коренные месторождения являются первичными, так как их появление связано с магматическими процессами. Сама по себе магма Земли характеризуется высокой концентрацией драгоценного металла. В процессе вулканической активности она вырывалась на поверхность планеты, а затем начинала остывать. Но, так как в ее составе имеется множество элементов, остывание происходило неравномерно. Сначала кристаллизовались самые тугоплавкие вещества, затем более легкоплавкие компоненты простреливали в окружающую породу, образуя жилы. Последними остывали растворы золотосодержащих солей.
Причины нахождения золота в природе в виде сплавов с другими элементами также объясняется магматическими процессами. Состав магмы в разных местах мог отличаться, соотношение компонентов состава, как и условия формирования жил не относятся к постоянным величинам. По этой причине, разные месторождения отличаются друг от друга составом основной породы и золотого сплава, формой и местом залегания золотоносных жил, условиями добычи драгметалла. Чаще всего среди примесей золота встречаются медь, серебро и металлы платиновой группы.

Россыпные месторождения называются вторичными, так как образовались в результате воздействия внешних факторов на залежи драгметалла в коренных месторождениях. Золото в природе высвобождается из горной породы в результате ее разрушения из-за температурных перепадов, ветра, осадков и жизнедеятельности микроорганизмов. Перемещению драгметалла способствует вода, которая размывает породу, размельчая ее на мелкие куски и унося за собой частицы золота. Желтый металл благодаря своей плотности оседает в определенных местах, остальные компоненты породы уносятся водным потоком дальше.
По количеству запасов драгметалла коренные месторождения подразделяются на уникальные (более 1000 т), весьма крупные (100-1000 т), крупные (100-400 т), средние (25-100 т) и мелки (менее 25 т). Как выглядит золото в природе? Внешний вид драгметалла при его добыче зависит от фазового состояния элемента. Встречается свободное золото, в сростках с другими минералами (чаще всего с кварцем), а также тонковкрапленное в сульфидах или минералах породы.

Россыпные месторождения желтого металла делятся на аналогичные группы: уникальные (более 50 т), весьма крупные (5-50 т), крупные (1-5 т), средние (500 кг – 1 т), мелкие (менее 500 кг). На сегодняшний день запасы золотых россыпей достаточно истощены, тем не менее в России добыча драгметалла на таких месторождениях составляет около половины все добычи металла.
Самородки металла
Золото в природе встречается в виде самородков. На фото самых известных находок видно, что самородками принято называть большие природные куски драгметалла. Большинство таких невероятных находок было сделано в процессе поиска желтого металла, хотя были и случайные открытия. На сегодняшний день специалисты признают самородком кусок золота, вес которого превышает 5-12 г, а поперечное сечение более половины сантиметра.

Самые известные самородки металла весят несколько десятков килограммов. Наибольшим самородков за всю историю человечества является кусок золота, найденный в 11 веке в южных областях Афганистана. По описанию, дошедшему до наших дней, он должен был весить примерно 2,5 тонны.

Свойства золота в природе
Для драгоценного металла характерны высокие показатели теплопроводности и низкое значение электрического сопротивления. Одним из важных свойств металла можно считать его плотность: вес частиц золота является основой образования россыпных месторождений и большинства технологических процессов его добычи .
Россыпные месторождения золота в природе существуют благодаря тому, что тяжелые частицы металла оседали по пути своего следования в потоках воды, а легкая порода разрушалась и вымывалась. Высокая плотность драгметалла используется в процессе промывки на шлюзах, так как именно это физическое свойство обеспечивает высокие показатели излечения металла из промываемой породы.

Высокая отражательная способность элемента позволяет использовать тончайшие листы металла в производстве офисных стекол, стекол для самолетов и водных судов, шлемов для космонавтов. Изготовление тонких листов золота возможно благодаря его отличной ковкости и легкой полировке.
Желтый металл способен реагировать с фтором, но только при температуре в 300-400 градусов по Цельсию: при более низких параметрах реакция не осуществляется, а при более высоких – образующиеся фториды начинают разлагаться. Еще одной известной реакцией золота является его растворение во ртути с образованием амальгамы.
Читайте также:

