Углеводороды химические свойства кратко
Обновлено: 07.07.2024
Углеводороды – это органические соединения, которые состоят из углерода и водорода (иногда замещается на группы). Существует огромное количество углеводородов и для них существует множество классификаций.
По составу углеродного скелета делятся на:
- ациклические (алифатические) – определяются по числу атомов, с которыми связан углерод;
- циклические – имеют замкнутую цепь:
- карбоциклические – в цикле присутствуют только атомы углерода,
- гетероциклические – присутствуют не только атому углерода.
По наличию кратных связей и открытости цепи:
Предельные углеводороды
Химические свойства алканов
Алканы (парафины) – это соединения, для которых характерна sp 3 -гибридизация и наличие только σ-связи. Используются как источник энергии в промышленности и помощник в получении белка в микробиологии.
I. Реакции замещения
Эти реакции сопровождаются гомолитическим разрывом, который начинается в неорганических молекулах.
Реакции замещения являются основным типом реакций, которые характерны для молекул алканов. В связи с высокой энергией ионизации в молекуле алканов очень насыщенные связи, из –за чего химическое взаимодействие затруднено. Общим для реакций замещения являются жесткость условий и наличие сильных окислителей.
В ходе взаимодействия с хлором или бромом получается взрывчатое вещество, имеющее практическое значение. Взаимодействие с фтором провоцирует взрыв, не имеющее промышленного отклика. А реакция с йодом протекает очень медленно, поэтому редко проводится.
Идет под воздействием света.
Замещение водорода проходит у наименее гидрированного атома углерода.
1888 год – Коновалов открыл реакцию взаимодействия алканов с азотной кислотой (13-14 %) под воздействием температуры в 140°С. Она используется для производства ракетного топлива и взрывчатых веществ.
Эту реакцию используют при мыловарении и в производстве синтетических моющих средств.
II. Реакции с разрывом углерод-углеродной связи
При нормальных условиях алканы не реагируют с сильными окислителями, такими как серная кислота, перманганат или дихромат калия.
Алканы горят бесцветным или голубоватым пламенем. У метана, этана, пропана, бутана и пентана копоть не наблюдается, а у соединений с длинными углеродными цепями она есть.
Идет в присутствии катализатора.
Это химический процесс, протекающий при действии высоких температур. В результате углеродная цепь рвется, и образуются молекулы алкана и алкена.
Крекинг бывает: термическим; каталитическим.
Для каталитической реакции используются катализаторы и меньшие температуры.
III. Реакции с разрывом углерод-водородной связи
Алканы – это вещества, с помощью которых можно получить соединения с кратными связями.
Отщепление водорода осуществляется в присутствии катализаторов и при высоких температурах.
При дегидрировании алканов с длинными углеродными цепями образуются алкены.
Нагревание линейных алканов с катализатором провоцирует образование веществ с разветвленным углеродным скелетом.
Из алканов получают топливо, которое широко используют в микробиологии, биотехнологиях, органическом синтезе.
Химические и физические свойства циклоалканов
Циклоалканы (нафтены) – это насыщенные циклические углеводороды. Циклоалканы по физическим свойствам схожи с линейными алканами. Циклопропан и циклобутан – это газы, а начиная с циклопентана – жидкости с температурой кипения и плотностью выше, чем у соответствующих парафинов. Не растворяются в воде, но растворимы в эфирах.
I. Реакции присоединения
Реакционная способность зависит от размера цикла. Низшие циклоалканы напоминают алкены, а высшие – алканы.
Действие галогена различно в зависимости от условий.
-
Малые циклы под действием света



Реакция протекает в водном растворе.

В случае несимметричных молекулах соблюдается правило Марковникова.

Реакция проходит при высоких температурах и под действием таких катализаторов как никель, платина.

II. Дегидрирование
Высокие температуры (500°С) по-разному действуют на малые и большие циклы.


III. Горение
Устойчивость к окислителям повышается по гомологическому ряду.
Циклоалканы содержатся в нефтяных продуктах, и вырабатывается некоторыми видами растений. В природе они способны подвергаться микробиологическому окислению.
Непредельные углеводороды
Химические и физические свойства алкенов
Алкены (этиленовые углеводороды) – органические соединения, содержащие одну двойную связь. Температура плавления и кипения увеличивается по гомологическому ряду. При нормальных условиях с этена по бутен – газы, с пентена по гептадецен – жидкости, а далее твердые вещества. Они не растворяются в воде, но растворимы в эфирах.
π- связь менее прочная, чем σ-связь. Это связано с тем, что у негибридных облаков глубина перекрывания меньше. Для алкенов наиболее характерны реакции присоединения. Кроме того, алкены – это доноры электронов и их рассматривают как основания Льюиса.
I. Реакции присоединения
Электроны π-связи находятся вне плоскости, поэтому они более доступны для атакующей электрофильной частицы.
Реакция протекает под воздействием температуры и катализатора никеля.
Реакционная способность уменьшается в ряду HJ-HBr-HCl-HF. В этих реакциях действует правило Марковникова. Он утверждал, что при взаимодействии галогеноводородов или воды с несимметричными алкенами, водород присоединяется к более гидрированному атому углерода, а галоген – к менее.
Правило имеет несколько исключений.
-
Перекисный эффект Карыша.
Реакция подразумевает присоединение бромоводорода в присутствии перекиси водорода.
Спирты образуются при присоединении алкенов с водой в присутствии серной кислоты, высоких температурах и при оксиде алюминия.
II. Реакции полимеризации
Полимер – это соединение, состоящее из множества мономеров. Полимеризация не приводит к изменению качественного и количественного состава мономеров. Получение полиэтилена из этена имеет цепной или ступенчатый характер.
III. Реакции замещения (галогенирование)
Реакции замещения водорода могут проходить и у непредельных алкенов, но в их sp 3 -части. Проходят при жестких условиях – температура свыше 500°С.
IV. Окисление
Идет легко и образует разные продукты в зависимости от условий.
Алкены горят желтым светящимся пламенем.
Осуществляется в нейтральной среде при окислении с помощью перманганата калия. В результате образуются диолы, причем гидроксильные группы присоединяются к атомам углерода кратной связи.
Проходит в кислой среде. При окислении с помощью кипящего раствора перманганата калия происходит полное разрушение кратной связи, и атомы углероды способны создать карбоновую кислоту или углекислый газ.
В симметричной молекуле алкена образуется две молекулы одной и той же кислоты.
Если в соединении при кратной связи содержится два углеродных заместителя, то при окислении происходит образование кетона.
Жесткое окисление проходит и в щелочной среде.
Те же реакции проходят в присутствии дихромата калия.
Алкены – это исходный продукт в производстве полимеров и других органических веществ.
Химические и физические свойства диенов
Алкадиены – это органические соединения, имеющие две двойные связи. Существует несколько видов диенов:
- с кумулированными связями – примыкают к одному углеродному атому - СН2=С=СН2;
- с изолированными связями – разделены одном атомом углерода – СН2=СН-СН2-СН-СН2;
- с конъюгированными связями – разделены одной одинарной связью – СН2=СН-СН-СН2.
В нормальных условиях пропадиен и бутадиен-1,3 являются газами, а изопрен – летучей жидкостью. Алкадиены с изолированными связями – жидкости. Высшие диены находятся в твердом состоянии.
I. Реакции присоединения
У кумулированых и изолированных сначала взаимодействует с реагентом одна связь, а затем другая. А у сопряженных кратные связи образуют единую систему в центре молекулы, при этом параллельно идет процесс присоединения.
CH2=CH-CH=CH2 + Br2 → Br-CH2-CH=CH-CH2-Br С помощью этой реакции обесцвечивание бромная вода.
Реакция идет при нагревании в 60°С.
II. Полимеризация
В процессе этих реакций образуются эластомеры (синтетические каучуки). Проводится в присутствии натрия.
Алкадиены могут обесцвечивать раствор перманганата калия.
Из диенов получают каучуки, из которых производят резину различных марок.
Химические и физические свойства алкинов
Алкины – это органические соединения, имеющие одну тройную связь. По гомологическому ряду температура плавления и кипения увеличивается. В нормальных условиях этин, пропин, бутин – газы, с пентина по гексадецентин – это жидкости, а далее, по увеличению молекулярной массы, - твердые вещества. Температуры кипения у алкинов выше, чем у соответствующих алкенов. Плохо растворяются в воде, хорошо – в органических растворителях.
I. Реакции присоединения
В процессе реакции присоединение происходит сначала по одной π-связи, а затем по другой. Идут по механизмам электрофильного и нуклеофильного присоединения.
Электрофильное присоединение
Идет под действием катализатора никеля.
CH≡CH + Cl2 → Cl-CH=CH-Cl
Cl-CH=CH-Cl + Cl2 → Cl-CH(Cl)-CH(Cl)-Cl
Вышеперечисленные реакции могут подразумевать как присоединение одной молекулы, так и нескольких. В гидратации возможно присоединение только одной молекулы воды. Реакция Кучерова проходит при температуре в 70°С и катализатора в виде сульфата ртути.
Нуклеофильное присоединение
-
Присоединение синильной кислоты
Проходит в присутствии меди в аммиачном растворе.
II. Полимеризация
Протекает в присутствии солей меди и повышенных температурах.
Протекает в присутствии активированного углерода и температурах свыше 500°С. 3
III. Реакции замещения
Замещение происходи у водорода, стоящего при углероде с кратной связью.
-
Взаимодействие с амидом натрия
Получающиеся соединения взрывоопасны. Чтобы их нейтрализовать, необходимо залить их соляной кислотой.
IV. Окисление
Этин горит с большим выделением тепла.
В нейтральной и слабощелочной средах образуются соли щавелевой кислоты , а окисление гомологов провоцирует разрыв тройной связи с образование солей карбоновых кислот.
3 CH≡CH + 8 KMnO4 → 3 KOOC-COOK + 8MnO2 + 2 KOH + 2 H2O
В кислой среде окислитель расщепляет кратную связь с образованием карбоновых кислот.
Только ацетилен используется в промышленности, и именно он является важным химическим сырьем.
Ароматические углеводороды
Химические и физические свойства бензола
Наличие ароматического кольца влияет на характер химических реакций. Единая 6π-система электронов устойчива, поэтому ароматическим углеводородам характерны реакции электрофильного замещения.
Бензол – это бесцветная жидкость, имеющая резкий запах. Горит сильно коптящим пламенем. Образует с воздухом взрывчатые смеси.
I. Реакции замещения

Все эти реакции протекают по механизму бимолекулярного нуклеофильного замещения.
II. Реакции присоединения
Протекают только в жестких условиях. Присоединяться способны только богатые энергией реагенты.
Идет под воздействием температуры и катализаторов в виде платины.


При нормальных условиях азотная кислота, хромовая кислота и др. не могут окислить бензол. Он окисляется только в жестких условиях под действием кислорода, катализатора оксида ванадия и при температуре в 450°С.

Химические и физические свойства гомологов бензола
У гомологов бензола такие же физические свойства, что и у самого бензола. Во многом и химические свойства схожи.
I. Электрофильное замещение Радикалы гомологов бензола повышают электронную плотность на кольце в орто- и параположениях.
Катализатор – хлорид алюминия.




II. Реакции по боковой цепи
Осуществляется в присутствии света. Принцип замещения схож с реакцией алканов.
В отличие от бензола его гомологи способны вступать в реакции окисления.
Окисление дизамещенных гомологов происходит по такому же принципу.
Реакция проходит под действием оксида цинка.
Химические и физические свойства стирола
Стирол – это бесцветная жидкость, имеющая резкий запах. Плохо растворяется в воде, но хорошо в органических растворителях.
I. Реакции присоединения
Стирол обесцвечивает бромную воду. Реакция идет не по бензольному кольцу, а по виниловой группе.
II. Полимеризация
В ходе реакции образуется полистирол – твердая стекловидная масса.
При производстве полимеров активно используется стирол. На его основе создаются полистирол, пенопласт, пластики.

В лекциях по каждому классу веществ мы подробно рассматривали химические свойства и качественные реакции. Здесь мы рассмотрим именно те химические свойства углеводородов, на которые стоит обратить внимание, т.к. они часто встречаются в вопросах ЕГЭ.
алканы — малоактивные вещества
характерные реакции:замещения:
при дегидрогалогенировании вторичных и третичных галогенидов водород отщепляется преимущественно от наименее гидрогенизированного атома углерода
СH3-CH Cl -C H 2-СH3 → СH3-CH = CH—СH3+ HCl
Взаимодействие с щелочами:
(среда реакции оказывает влияние на продукты)
Характерные химические свойства — реакции присоединения:
при присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода.
Окисление алкенов:
Окисление циклоалканов:
цикл разрывается и по концам образуется группа -COOH:
Для бензола и его гомологов характерные химические свойства — реакции замещения:
У гомологов бензола направление реакции замещения зависит от катализатора:
Окисление аренов:
бензол не окисляется .
любые гомологи бензола окисляются до бензойной кислоты:
Кстати, ответы на наши вопросы:
А14 1 вариант: в отличие от пропена пропин взаимодействует с аммиачным раствором оксида серебра
Углеводороды представляют собой распространённые и наиболее востребованные виды веществ, к которым относят природный газ, нефть и метан. Эти органические соединения имеют в составе атомы химических элементов — водорода и углерода. Предельные углеводороды, или алканы, причисляются к подклассу ациклических. Их особенностью является то, что они сформированы после пресыщения всех валентностей атомами гидрогена.
- Общая классификация
- Наглядные примеры
- Ключевые параметры
- Структурные особенности
- Изомерия и номенклатура
- Химические свойства
- Естественные источники
- Ароматические соединения
- Сфера применения
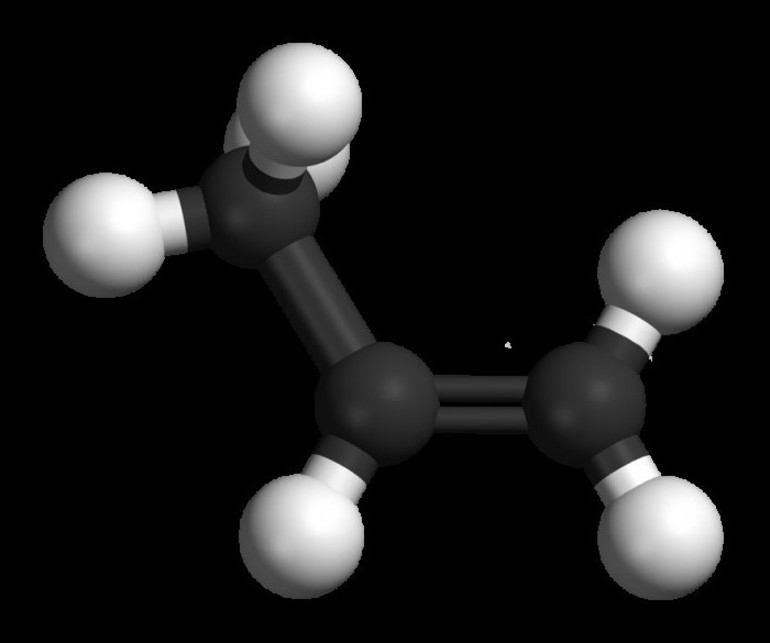
Общая классификация
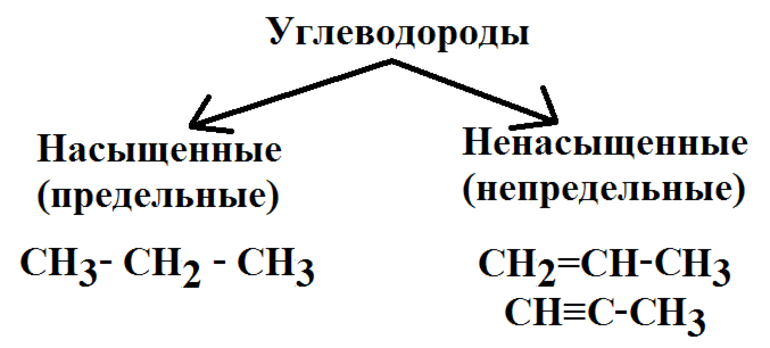
Общая формула предельных углеводородов — CnH2n+2. Если водород образует всего 1 связь, то у углерода их целых 4. Но это не свидетельствует о том, что между ними имеет место соотношение 1 к 4. Существуют не только одинарные, но и двойные, тройные связи между атомами углерода. По такому показателю выделяют классы углеводородов:
- Предельные. Их ещё называют алканами.
- Непредельные, или ненасыщенные алкены и алкины, соответственно, 2 и 3 связи.
Другая классификация относится к характеристикам молекул. В соответствии с ней выделяют углеводороды:
В первом случае вещества имеют линейную структуру, тогда как во втором они сформированы в виде замкнутой цепи. Карбоциклические подразделяются на ароматические и алициклические. Какие виды изомерии наблюдаются у предельных углеводородов:
- углеродного скелета;
- расположения кратной связи;
- так называемая геометрическая;
- межклассовая.
В отношении углеводородов имеет место и процесс полимеризации. Это ситуация, когда одинаковые молекулы соединяются. В итоге формируется материал, который совершенно не похож на базовый. Классический пример — полиэтилен. Для его получения используется стандартный этилен. Такое возможно, если приходится говорить о ненасыщенных углеводородах.
Отдельную категорию составляют структуры, относящиеся к непредельным. Новые атомы, непохожие на атомы водорода, притягивают новые атомы, пользуясь для этого свободными радикалами. В итоге формируются различные виды органических веществ. К ним можно отнести:
Наглядные примеры
Углеводороды объединяют обширный список веществ. Их рассматривают в школе на уроках химии за 9 класс. Для нахождения формулы этих соединений составляются специальные уравнения. Несмотря на довольно большую классификацию, следует обозначить основные классы и соединения, относящиеся к ним. Вот их названия:
- Предельные. К ним относят гексан, бутан, пропан, метан. В таблице предельных углеводородов представлено очень много веществ, и их список гораздо больше. В большинстве случаев приходится говорить о наиболее распространенных газах. , или как их еще называют, олефины объединяют бутен, пропилен, этилен.
- Алкины включают гексен, пентин, ацетилен.
- Алкадиены и алкадиины. Им соответствуют вещества с двойной и тройной связью, соответственно.
- Циклоалканы представляет собой разновидность углеводородов, у которых цепь имеет замкнутый вид.
Ко второму классу причисляют циклопентен и циклопропен. Существуют циклоалкины, которые не встречаются в естественных условиях. Учёные с давних пор пытаются создавать их искусственным путем. Достигнуть цели удалось только в начале прошлого века. В составе молекул циклоалканов присутствует от 8 атомов углерода. Если их будет меньше, соединение будет отличаться нестабильностью. Объясняется это значительным напряжением.
Ароматические углеводороды включают довольно простые соединения наподобие бензола. Также в эту категорию включены индол и нафталин.
Ключевые параметры
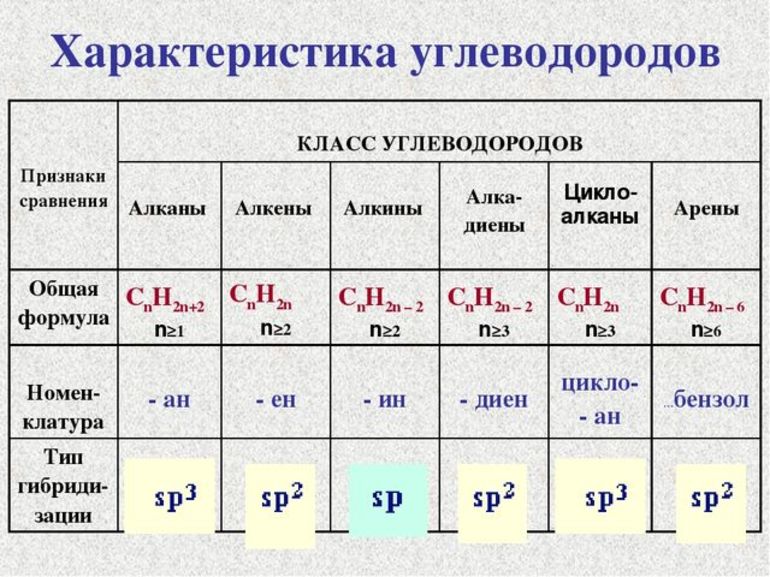
Углеводороды способны объединять большое количество различных соединений. Но если говорить об основных характеристиках, приходится отметить, что общего у них почти нет. Единственное, в чём они сходятся, это состав. Строение всегда отличное. Примечательным является их переход от газообразной формы к твёрдой. Они также могут переходить к нему из жидкого состояния. Происходит это сообразно увеличению числа атомов углерода в начале ряда. Другое сходство, которое можно обнаружить, это способность к горению. Одновременно с этим выделяется большое количество тепла, когда образуются вода и углекислый газ.
Структурные особенности
Алканы являются гомологами метана, то есть его производными. Молекулярная формула этого вещества записывается, как CH4. В случае если отнять от него атом водорода, удастся получить радикал (углеводородный остаток) CH3. В большинстве случаев в молекуле присутствует 4-валентный углерод. Соответственно, объединение двух радикалов приводит к формированию дополнительного представителя ряда гомологов этана C2H6. После отщепления атома гидрогена образуется радикал — этил. При объединении его с CH3 удается получить еще один гомолог — пропан.
Рассматривая структуру пропана, можно установить, что его основу составляет 2 разновидности атомов углерода. Это первичные и вторичные соединения. Любой первичный атом имеет связь с 1 атомом углерода. Если атом гидрогена отщепить от первичного атома пропана, будет сформирован первичный пропил. Объединение метила со вторичным пропилом способствует образованию различных вариантов других гомологов. Это может быть изобутан, имеющий широкую ветвь углеродной цепи либо стандартный бутан, у которого карбоновая цепь является прямой.
Метан представляет собой наиболее типичный вариант алканов. Так называемая сигма-связь характерна для этих соединений. Допустим, у метана присутствует 4 ковалентные связи. Отвечает за это 3 p- и 1 s-орбиталь. Атом углерода образует такие связи благодаря s-орбитали.
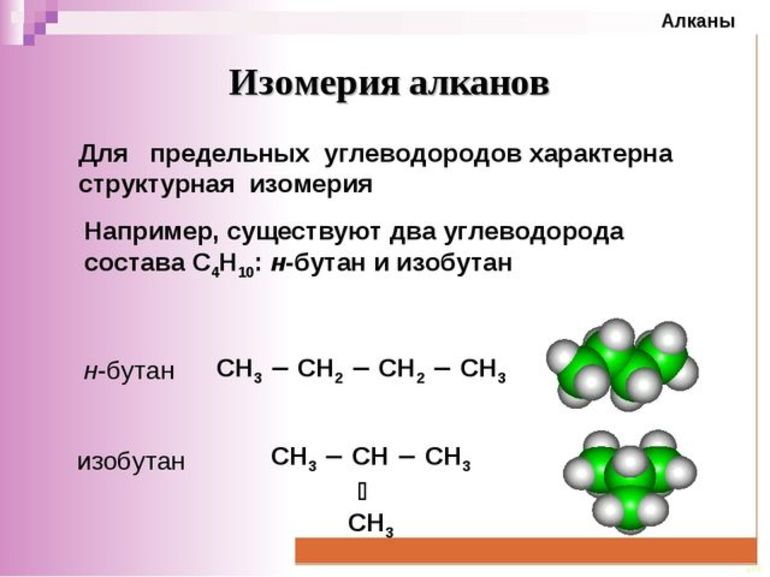
Изомерия и номенклатура
Чтобы определить формулы гомологов, в том числе бутана с его формулой C4H10, необходимо изучить явление изомерии. Что касается бутана, то за стабильность его формулы отвечают два различных соединения, тогда как в отношении формулы C5H12 их 3. Число изомеров постепенно увеличивается по мере повышения числа атомов углерода в молекулах алкана. 5 структурных формул, соответственно, присутствует в формуле C6H14. Если первые четыре соединения являются газами, то с 5 по 12 представлены жидкости. Вещества с 16 и далее имеют твердую структуру.
Химические свойства

Предельные углеводороды причисляются к группе инертных веществ. Это можно объяснить сигма-связью атома водорода и углерода в алканах. Вот почему они не способны притягивать к себе атомы водорода. Вещества могут вступать в реакции расщепления, дегидрирования, нитрирования. Также они принимают участие в процессе радикального галогенирования. В последнем случае молекулы галогенов с лёгкостью могут замещать таковые у гидрогена в составе алкана. Процесс нитрования приводит к тому, что водород во вторичных и третичных соединениях замещается нитрогруппой.
Несколько сложнее этот процесс проходит в случае с первичными и вторичными атомами.
Предельные углеводороды используются в производстве органических веществ различных видов. Непредельные получаются после отсоединения атома водорода от них.
Естественные источники
Помимо синтетических соединений, встречаются и природные источники углеводородов. Они присутствуют в почве в виде залежей. Большую часть нефти и газа составляют именно углеводороды. При обработке нефти это хорошо прослеживается. Во время такого процесса отмечается выделение большого количества веществ, относящихся к углеводородам. В составе газа и вовсе присутствует до 97% метана. Это вещество формируется при разложении органических отходов. Соответственно, чтобы получить его, не приходится прикладывать значительных усилий.
Получить углеводороды можно и в условиях лаборатории. Есть соединения, которые невозможно увидеть в природе. Их добывают синтетическим путем, проводя специальные химические реакции.
Ароматические соединения
Это отдельный гомологический ряд, который имеет формулу СпН2п-6. Такие углеводороды способны вступать практически в любые реакции присоединения: галогенирование, гибридизация и т. д. Многочисленные эксперименты, проведённые в их отношении, показали небольшую химическую активность бензола — классического представителя этой категории. Он демонстрирует увеличение стойкости к окислению. Присоединение становится возможным для него при доступе к ультрафиолетовым лучам. Пребывание в ср2-гибридном состоянии является характерной особенностью бензола. Углеродные атомы находятся в единой плоскости.
Выделяют чётные и нечётные представителей этого класса. Их нумерация идёт по часовой стрелке, когда выделяют наиболее старших и наиболее младших заместителей. Четные варианты — 2 и 6 обозначают как ортоположения, 3 и 5, то есть нечетное, это метаварианты.
В большинстве случаев это жидкости, обладающие неприятным запахом и запрещённые к использованию без специализированной защиты. Они недостаточно хорошо растворяются в воде, но хорошо реагируют на органические растворители. Мало реагируют они и на кислоты. В смесях с добавлением соли одноосновных кислот органического происхождения вещества распадаются на ионы.
Бензол и другие ароматические углеводороды получают в промышленных условиях. Примером является каменноугольная смола. Ее и другие вещества аналогичного класса получают:
- через отщепление атома водорода от циклопарафинов;
- посредством ароматизации алканов.
Сфера применения
Углеводороды очень важны для полноценного ведения деятельности человека. Применение предельных углеводородов разнообразно. Наиболее ценными ресурсами считаются газ и нефть. Они применяются в качестве энергоносителей и топлива. Но это далеко не полный список всех способов применения веществ этого класса. Углеводороды окружают человека практически всюду. Посредством полимеризации удаётся формировать новые вещества, служащие основой для различных типов тканей, пластмасс. Также необходимо выделить в особую категорию бензин, прочие продукты нефтепереработки, а также лакокрасочные изделия, асфальт, керосин.
Современное общество не может обойтись как без предельных, так и непредельных углеводородов. Несмотря на то что запасы нефти уменьшаются с каждым годом, отказаться от их применения по-прежнему невозможно. Правда, ученые активно занимаются поисками альтернативных источников углеводородов. С другой стороны, той же универсальности применения и эффективности не смог показать ни один из них.
Углеводороды представляют собой распространённые и наиболее востребованные виды веществ, к которым относят природный газ, нефть и метан. Эти органические соединения имеют в составе атомы химических элементов — водорода и углерода. Предельные углеводороды, или алканы, причисляются к подклассу ациклических. Их особенностью является то, что они сформированы после пресыщения всех валентностей атомами гидрогена.
- Общая классификация
- Наглядные примеры
- Ключевые параметры
- Структурные особенности
- Изомерия и номенклатура
- Химические свойства
- Естественные источники
- Ароматические соединения
- Сфера применения

Общая классификация

Общая формула предельных углеводородов — CnH2n+2. Если водород образует всего 1 связь, то у углерода их целых 4. Но это не свидетельствует о том, что между ними имеет место соотношение 1 к 4. Существуют не только одинарные, но и двойные, тройные связи между атомами углерода. По такому показателю выделяют классы углеводородов:
- Предельные. Их ещё называют алканами.
- Непредельные, или ненасыщенные алкены и алкины, соответственно, 2 и 3 связи.
Другая классификация относится к характеристикам молекул. В соответствии с ней выделяют углеводороды:
В первом случае вещества имеют линейную структуру, тогда как во втором они сформированы в виде замкнутой цепи. Карбоциклические подразделяются на ароматические и алициклические. Какие виды изомерии наблюдаются у предельных углеводородов:
- углеродного скелета;
- расположения кратной связи;
- так называемая геометрическая;
- межклассовая.

В отношении углеводородов имеет место и процесс полимеризации. Это ситуация, когда одинаковые молекулы соединяются. В итоге формируется материал, который совершенно не похож на базовый. Классический пример — полиэтилен. Для его получения используется стандартный этилен. Такое возможно, если приходится говорить о ненасыщенных углеводородах.
Отдельную категорию составляют структуры, относящиеся к непредельным. Новые атомы, непохожие на атомы водорода, притягивают новые атомы, пользуясь для этого свободными радикалами. В итоге формируются различные виды органических веществ. К ним можно отнести:
Наглядные примеры
Углеводороды объединяют обширный список веществ. Их рассматривают в школе на уроках химии за 9 класс. Для нахождения формулы этих соединений составляются специальные уравнения. Несмотря на довольно большую классификацию, следует обозначить основные классы и соединения, относящиеся к ним. Вот их названия:

- Предельные. К ним относят гексан, бутан, пропан, метан. В таблице предельных углеводородов представлено очень много веществ, и их список гораздо больше. В большинстве случаев приходится говорить о наиболее распространенных газах. , или как их еще называют, олефины объединяют бутен, пропилен, этилен.
- Алкины включают гексен, пентин, ацетилен.
- Алкадиены и алкадиины. Им соответствуют вещества с двойной и тройной связью, соответственно.
- Циклоалканы представляет собой разновидность углеводородов, у которых цепь имеет замкнутый вид.
Ко второму классу причисляют циклопентен и циклопропен. Существуют циклоалкины, которые не встречаются в естественных условиях. Учёные с давних пор пытаются создавать их искусственным путем. Достигнуть цели удалось только в начале прошлого века. В составе молекул циклоалканов присутствует от 8 атомов углерода. Если их будет меньше, соединение будет отличаться нестабильностью. Объясняется это значительным напряжением.
Ароматические углеводороды включают довольно простые соединения наподобие бензола. Также в эту категорию включены индол и нафталин.
Ключевые параметры

Углеводороды способны объединять большое количество различных соединений. Но если говорить об основных характеристиках, приходится отметить, что общего у них почти нет. Единственное, в чём они сходятся, это состав. Строение всегда отличное. Примечательным является их переход от газообразной формы к твёрдой. Они также могут переходить к нему из жидкого состояния. Происходит это сообразно увеличению числа атомов углерода в начале ряда. Другое сходство, которое можно обнаружить, это способность к горению. Одновременно с этим выделяется большое количество тепла, когда образуются вода и углекислый газ.
Структурные особенности
Алканы являются гомологами метана, то есть его производными. Молекулярная формула этого вещества записывается, как CH4. В случае если отнять от него атом водорода, удастся получить радикал (углеводородный остаток) CH3. В большинстве случаев в молекуле присутствует 4-валентный углерод. Соответственно, объединение двух радикалов приводит к формированию дополнительного представителя ряда гомологов этана C2H6. После отщепления атома гидрогена образуется радикал — этил. При объединении его с CH3 удается получить еще один гомолог — пропан.
Рассматривая структуру пропана, можно установить, что его основу составляет 2 разновидности атомов углерода. Это первичные и вторичные соединения. Любой первичный атом имеет связь с 1 атомом углерода. Если атом гидрогена отщепить от первичного атома пропана, будет сформирован первичный пропил. Объединение метила со вторичным пропилом способствует образованию различных вариантов других гомологов. Это может быть изобутан, имеющий широкую ветвь углеродной цепи либо стандартный бутан, у которого карбоновая цепь является прямой.
Метан представляет собой наиболее типичный вариант алканов. Так называемая сигма-связь характерна для этих соединений. Допустим, у метана присутствует 4 ковалентные связи. Отвечает за это 3 p- и 1 s-орбиталь. Атом углерода образует такие связи благодаря s-орбитали.
Изомерия и номенклатура
Чтобы определить формулы гомологов, в том числе бутана с его формулой C4H10, необходимо изучить явление изомерии. Что касается бутана, то за стабильность его формулы отвечают два различных соединения, тогда как в отношении формулы C5H12 их 3. Число изомеров постепенно увеличивается по мере повышения числа атомов углерода в молекулах алкана. 5 структурных формул, соответственно, присутствует в формуле C6H14. Если первые четыре соединения являются газами, то с 5 по 12 представлены жидкости. Вещества с 16 и далее имеют твердую структуру.
Химические свойства

Предельные углеводороды причисляются к группе инертных веществ. Это можно объяснить сигма-связью атома водорода и углерода в алканах. Вот почему они не способны притягивать к себе атомы водорода. Вещества могут вступать в реакции расщепления, дегидрирования, нитрирования. Также они принимают участие в процессе радикального галогенирования. В последнем случае молекулы галогенов с лёгкостью могут замещать таковые у гидрогена в составе алкана. Процесс нитрования приводит к тому, что водород во вторичных и третичных соединениях замещается нитрогруппой.
Несколько сложнее этот процесс проходит в случае с первичными и вторичными атомами.
Предельные углеводороды используются в производстве органических веществ различных видов. Непредельные получаются после отсоединения атома водорода от них.
Естественные источники
Помимо синтетических соединений, встречаются и природные источники углеводородов. Они присутствуют в почве в виде залежей. Большую часть нефти и газа составляют именно углеводороды. При обработке нефти это хорошо прослеживается. Во время такого процесса отмечается выделение большого количества веществ, относящихся к углеводородам. В составе газа и вовсе присутствует до 97% метана. Это вещество формируется при разложении органических отходов. Соответственно, чтобы получить его, не приходится прикладывать значительных усилий.
Получить углеводороды можно и в условиях лаборатории. Есть соединения, которые невозможно увидеть в природе. Их добывают синтетическим путем, проводя специальные химические реакции.
Ароматические соединения
Это отдельный гомологический ряд, который имеет формулу СпН2п-6. Такие углеводороды способны вступать практически в любые реакции присоединения: галогенирование, гибридизация и т. д. Многочисленные эксперименты, проведённые в их отношении, показали небольшую химическую активность бензола — классического представителя этой категории. Он демонстрирует увеличение стойкости к окислению. Присоединение становится возможным для него при доступе к ультрафиолетовым лучам. Пребывание в ср2-гибридном состоянии является характерной особенностью бензола. Углеродные атомы находятся в единой плоскости.

Выделяют чётные и нечётные представителей этого класса. Их нумерация идёт по часовой стрелке, когда выделяют наиболее старших и наиболее младших заместителей. Четные варианты — 2 и 6 обозначают как ортоположения, 3 и 5, то есть нечетное, это метаварианты.
В большинстве случаев это жидкости, обладающие неприятным запахом и запрещённые к использованию без специализированной защиты. Они недостаточно хорошо растворяются в воде, но хорошо реагируют на органические растворители. Мало реагируют они и на кислоты. В смесях с добавлением соли одноосновных кислот органического происхождения вещества распадаются на ионы.
Бензол и другие ароматические углеводороды получают в промышленных условиях. Примером является каменноугольная смола. Ее и другие вещества аналогичного класса получают:
- через отщепление атома водорода от циклопарафинов;
- посредством ароматизации алканов.
Сфера применения
Углеводороды очень важны для полноценного ведения деятельности человека. Применение предельных углеводородов разнообразно. Наиболее ценными ресурсами считаются газ и нефть. Они применяются в качестве энергоносителей и топлива. Но это далеко не полный список всех способов применения веществ этого класса. Углеводороды окружают человека практически всюду. Посредством полимеризации удаётся формировать новые вещества, служащие основой для различных типов тканей, пластмасс. Также необходимо выделить в особую категорию бензин, прочие продукты нефтепереработки, а также лакокрасочные изделия, асфальт, керосин.
Современное общество не может обойтись как без предельных, так и непредельных углеводородов. Несмотря на то что запасы нефти уменьшаются с каждым годом, отказаться от их применения по-прежнему невозможно. Правда, ученые активно занимаются поисками альтернативных источников углеводородов. С другой стороны, той же универсальности применения и эффективности не смог показать ни один из них.
Читайте также:

