Учение о строении вещества кратко
Обновлено: 02.07.2024
1. Все вещества состоят из атомов.
2. Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида (элемента).
3. При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
4. При физических явлениях молекулы сохраняются, при химических - разрушаются; при химических реакциях атомы в отличие от молекул сохраняются.
5. Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
О том, что все тела состоят из отдельных частиц, когда-то задумался Демокрит, философ из Древней Греции. По его представлению, эти частицы между собой сцепляются, как пазлы и образуют материальные тела. Эти предположения ученые смогли подтвердить только в восемнадцатом веке. В настоящее время этот раздел физики хорошо изучен. Первоначальные сведения о строении вещества школьники получают в 7 классе.

Строение физических тел
На сегодняшний день есть научно доказанная теория о строении материи. Кратко основные положения по этому поводу таковы:
- Все физические тела состоят из вещества. Например, ножницы состоят из металла, стакан из стекла и т. д. Различаются они еще и своим состоянием, т. е. некоторые могут быть представлены в твердом, жидком и газообразном виде, например, вода. Лед — твердый вид воды, собственно вода — это жидкий вид и пар — газообразный. Все они имеют разные свойства.
- Все состоит из частиц. Между частицами есть расстояния, поэтому они могут сдвигаться относительно друг друга, при этом объем веществ увеличивается или уменьшается. Частицы, из которых состоят вещества очень малы, а значит твердые и жидкие тела выглядят сплошными.
Молекулы

Мельчайшую частицу вещества называют молекулой. Наименьшая частица воды или кислорода — молекулы воды или кислорода.
Ученые доказали, что молекулы одного и того же вещества одинаковы, т. е. лед, вода и водяной пар имеют одинаковый молекулярный состав.
Григорий Остер по этому поводу придумал вот такую загадку:
С разных концов медного провода длиной в тысячу километров парочка физиков отколупнула по одной молекуле меди. Чем отличаются эти молекулы?
И правильный ответ на этот вопрос — они ничем не отличаются. Они совершенно одинаковы, а еще они не статичны:
- Все молекулы постоянно находятся в движении. Скорость движения зависит от температуры вещества. Чем выше температура, тем быстрей их движение. В твердых материях амплитуда движения молекул гораздо меньше, чем у веществ в жидком и газообразном состоянии.
- Молекулы совершают колебательные движения, и твердый предмет сохраняет свою форму почти неизменной. А еще известно, что когда вещество нагревается, расстояния между его частицами увеличиваются, а при охлаждении уменьшаются. Соответственно, при изменении температуры некоторые предметы либо увеличивают свой объем, либо уменьшают. В качестве примера можно привести подъем столбика в медицинском ртутном термометре при увеличении температуры тела.
Атомы

Отчего же физики, зная о существовании атома, называют мельчайшей частицей молекулу? А все потому что в целом виде она может быть самостоятельной и с присущими лично ей химическими свойствами, а если ее разделить, эти свойства теряются.
Зачем все это знать

Зная о строении вещества, можно объяснить различные физические явления. Например, почему вода в чайнике выкипает и ее количество уменьшается? А потому что молекулы воды при нагреве испаряются, т. е. переходят в газообразное состояние. Именно поэтому их количество в чайнике постепенно уменьшается и, соответственно, уменьшается и объем воды. Почему снашивается и уменьшается подошва на ботинке? Потому что при трении о поверхность (асфальт, пол, песок и т. д. ) часть молекул остается там, а их количество в подошве становится меньше.
Первоначальные сведения о строении вещества в 7 классе изучаются подробно, что позволяет объяснять различные физические явления. Человечеству в целом это помогает создавать новые материалы с заданными нужными свойствами.
Атомно-молекулярное учение развил и впервые применил в химии великий русский ученый Ломоносов. Сущность учения Ломоносова можно свести к следующим положениям :
Частицы — молекулы и атомы — находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ из различных атомов.
Основные положения атомно-молекулярного учения можно сформулировать так:
Существуют вещества с молекулярным и немолекулярным строением.
Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей — в газах.
Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
Атомы одного вида отличаются от атомов другого вида массой и свойствами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решето находятся молекулы. Связи между молекулами, расположенными в узлах кристаллической решетки, слабые и при нагревании разрываются. Поэтому вещества с молекулярным строением, как правило, имеют низкие температуры плавления.
У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления.
Объяснение физических и химических явлений с точки зрения атомно-молекулярного учения. Физические и химические явления получают объяснение с позиций атомно-молекулярного учения. Так, например, процесс диффузии объясняется способность молекул (атомов, частиц) одного вещества проникать между молекулами (атомами, частицами) другого вещества. Это происходит потому, что молекулы (атомы, частицы) находятся в непрерывном движении и между ними имеются промежутки. Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения:
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.

Траектория броуновской частицы
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение. Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Робертом Броуном в 1827 г. Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую (рис. 3.1.1). Теория броуновского движения была создана А.Эйнштейном в 1905 г. Экспериментально теория Эйнштейна была подтверждена в опытах французского физика Жана Перрена, проведенных в 1908–1911 гг.
Главный вывод теории А. Эйнштейна состоит в том, что квадрат смещения 2 > броуновской частицы от начального положения, усредненный по многим броуновским частицам, пропорционален времени наблюдения t.
Это соотношение выражает так называемый диффузионный закон. Как следует из теории коэффициент пропорциональности D монотонно возрастает с увеличением температуры.
Постоянное хаотичное движение молекул вещества проявляется также в другом легко наблюдаемом явлении – диффузии. Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга. Наиболее быстро процесс протекает в газе, если он неоднороден по составу. Диффузия приводит к образованию однородной смеси независимо от плотности компонентов. Так, если в двух частях сосуда, разделенных перегородкой, находятся кислород O2 и водород H2, то после удаления перегородки начинается процесс взаимопроникновения газов друг в друга, приводящий к образованию взрывоопасной смеси – гремучего газа. Этот процесс идет и в том случае, когда легкий газ (водород) находится в верхней половине сосуда, а более тяжелый (вислород) – в нижней.
Значительно медленнее протекают подобные процессы в жидкостях. Взаимопроникновение двух разнородных жидкостей друг в друга, растворение твердых веществ в жидкостях (например, сахара в воде) и образование однородных растворов – примеры диффузионных процессов в жидкостях.
В реальных условиях диффузия в жидкостях и газах маскируется более быстрыми процессами перемешивания, например, из-за возникновения конвекционных потоков.
Наиболее медленно процесс диффузии протекает в твердых телах. Однако, опыты показывают, что при контакте хорошо очищенных поверхностей двух металлов через длительное время в каждом из них обнаруживается атомы другого металла.
Диффузия и броуновское движение – родственные явления. Взаимопроникновение соприкасающихся веществ друг в друга и беспорядочное движение мельчайших частиц, взвешенных в жидкости или газе, происходят вследствие хаотичного теплового движения молекул.
Силы, действующие между двумя молекулами, зависят от расстояния между ними. Молекулы представляют собой сложные пространственные структуры, содержащие как положительные, так и отрицательные заряды. Если расстояние между молекулами достаточно велико, то преобладают силы межмолекулярного притяжения. На малых расстояниях преобладают силы отталкивания. Зависимости результирующей силы F и потенциальной энергии Eр взаимодействия между молекулами от расстояния между их центрами качественно изображены на рис. 3.1.2. При некотором расстоянии r = r0 сила взаимодействия обращается в нуль. Это расстояние условно можно принять за диаметр молекулы. Потенциальная энергия взаимодействия при r = r0 минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии r0, нужно сообщить им дополнительную энергию E0. Величина E0 называется глубиной потенциальной ямы или энергией связи.
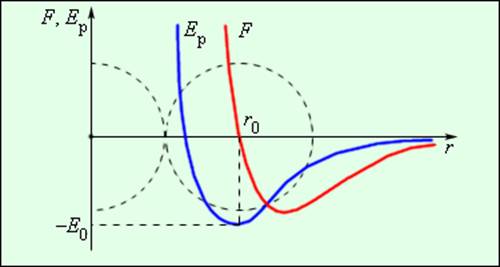
Сила взаимодействия F и потенциальная энергия взаимодействия Eр двух молекул. F > 0 – сила отталкивания, F –10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше.
Беспорядочное хаотическое движение молекул называется тепловым движением. Кинетическая энергия теплового движения растет с возрастанием температуры. При низких температурах средняя кинетическая энергия молекулы может оказаться меньше глубины потенциальной ямы E0. В этом случае молекулы конденсируются в жидкое или твердое вещество; при этом среднее расстояние между молекулами будет приблизительно равно r0. При повышении температуры средняя кинетическая энергия молекулы становится больше E0, молекулы разлетаются, и образуется газообразное вещество.
В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений равновесия). Эти центры могут быть расположены в пространстве нерегулярным образом (аморфные тела) или образовывать упорядоченные объемные структуры (кристаллические тела).
В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему. Этим объясняется текучесть жидкостей. Близко расположенные молекулы жидкости также могут образовывать упорядоченные структуры, содержащие несколько молекул. Это явление называется ближним порядком в отличие от дальнего порядка, характерного для кристаллических тел.
В газах расстояния между молекулами обычно значительно больше их размеров. Силы взаимодействия между молекулами на таких больших расстояниях малы, и каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда. Среднее расстояние между молекулами воздуха при нормальных условиях порядка 10 –8 м, т. е. в десятки раз превышает размер молекул. Слабое взаимодействие между молекулами объясняет способность газов расширяться и заполнять весь объем сосуда. В пределе, когда взаимодействие стремится к нулю, мы приходим к представлению об идеальном газе.
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12 C. Молекула углерода состоит из одного атома.
Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NА:
Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории.
Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NА:

Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро:
Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса.
За единицу массы атомов и молекул принимается 1/12 массы атома изотопа углерода 12 C (с массовым числом 12). Она называется атомной единицей массы (а. е. м.):
1 а. е. м. = 1,66·10 –27 кг.
Эта величина почти совпадает с массой протона или нейтрона. Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12 C называется относительной массой.
Читайте также:

