Теория атома водорода по бору кратко
Обновлено: 05.07.2024
Первый шаг на пути разрешения противоречий между теорией и результатами эксперимента в физике атома был сделан в 1913 г. Н. Бором. Свои представления о механизме излучения и поглощения света атомом он сформулировал в виде следующих постулатов.
Первый постулат Бора: атом может находиться только в некоторых состояниях, в которых не происходит излучения, хотя при этом электроны в атоме движутся с ускорением. Такие состояния называются стационарными состояниями атома.
Второй постулат Бора: излучение света атомом происходит при переходе атома из одного стационарного состояния с большей энергией в другое стационарное состояние с меньшей энергией. При этом энергия кванта света определяется уравнением:
где Еn - энергия начального состояния; Еk - энергия конечного состояния.
При поглощении кванта света или любой другой энергии атом переходит из одного стационарного состояния с меньшей энергией в другое стационарное состояние с большей энергией.
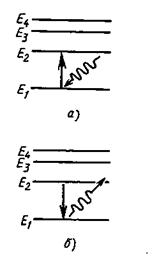
Для наглядного представления возможных энергетических состояний атомов и переходов атомов из одного состояния в другое используются энергетические диаграммы, на которых каждое стационарное состояние атома отмечается горизонтальной линией, называемой энергетическим уровнем (рис. 18.2).
Все стационарные состояния, кроме одного, являются стационарными лишь условно. Бесконечно долго каждый атом может находиться лишь в стационарном состоянии с минимальной энергией Е1 . Это состояние атома называется основным состоянием. Все остальные стационарные состояния атома с энергиями Е2, Е3 , . Еп называются возбужденными состояниями.
Ниже всех остальных на диаграмме располагается энергетический уровень основного состояния атома, энергетические уровни возбужденных состояний располагаются над основным уровнем на расстояниях, пропорциональных разности энергий возбужденного и основного состояний.
Переходы атома из одного состояния в другое изображаются вертикальными линиями между соответствующими уровнями на диаграмме энергий, направление перехода обозначается стрелкой (рис. 18.2).
В результате соударения с другим атомом, с любой заряженной частицей или при поглощении фотона атом может перейти из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией (рис. 18.2а). Из любого возбужденного состояния атом самопроизвольно переходит в основное состояние или в другое возбужденное состояние с меньшей энергией. Этот переход сопровождается излучением фотонов (рис. 18.2б). Время жизни атомов в возбужденных состояниях обычно не превышает 10 -7 -10 -9 с.
Основное изменение, внесенное в физику атома постулатами Бора, заключалось в отказе от представлений о непрерывности изменения всех физических величин и в принятии идеи квантования значений физических величин, которыми описывается внутреннее состояние атома. Квантование энергии атома объясняет линейчатый спектр излучения атомов.
Линейчатые спектры были открыты еще в начале XIX в., однако закономерности линейчатых спектров и их происхождение долго не удавалось установить. Первые успехи были достигнуты при изучении спектра водорода. Экспериментально было обнаружено, что спектральные линии группируются в отдельные серии. Анализ измеренных значений длин волн позволил получить эмпирическую формулу, по которой можно было рассчитать значения этих длин волн:
где R = 1,097×10 7 м -1 - постоянная Ридберга; k и n – целые числа; k=1, n =2, 3, 4. - серия Лаймана (ультрафиолетовая область спектра); k=2, n=3, 4, 5. - серия Бальмера (видимая и близкая ультрафиолетовая область); k=3, n=4, 5, 6. - серия Пашена (инфракрасная область спектра). Эта формула получила название – обобщенная формула Бальмера.
Боровская теория атома водорода была разработана с использованием законов классической механики Ньютона и постулатов Бора. Для электрона, движущегося по стационарной орбите с номером n, Бор записал второй закон Ньютона:
и правило квантования стационарных орбит:
где m – масса электрона; vn – скорость электрона на орбите радиуса rn; - постоянная Планка с чертой (= 1,054×10 -34 Дж×с); е – элементарный электрический заряд.

Из уравнений (18.3) и (18.4) были получены следующие формулы:
где ro = 0,529×10 -10 м - боровский радиус атома водорода, n- номер орбиты; rn – радиус стационарной орбиты с номером n;
где En - энергия стационарного состояния атома водорода; eo - электрическая постоянная, h- постоянная Планка, Ei=13,6 эВ - энергия ионизации атома водорода.
Второй постулат Бора позволяет определить энергию кванта света, излучаемого атомом, и длину волны излучения:
Последняя формула находится в прекрасном согласии с экспериментальной формулой (18.2).
Боровская теория атома водорода позволяет объяснить происхождение линейчатых спектров испускания, связывая их появление с наличием дискретного ряда энергетических состояний атомов и переходами между ними.
Согласно представлениям Бора, движение электронов вокруг ядра в стационарных состояниях определяется законами обычной механики, для описания же процессов перехода атома из одного стационарного состояния в другое эти законы не применимы, и следует воспользоваться квантовыми представлениями.
На рис. 18.3 представлена схема энергетических уровней атома водорода. Значения энергии каждого уровня рассчитывались по формуле (18.6). Стрелками показаны переходы атома из одного стационарного состояния в другое, которые сопровождаются излучением квантов света. Серия Лаймана возникает при переходе атомов с вышележащих уровней энергии на первый (основной, n=1), серия Бальмера – при переходе на второй уровень энергии (n=2), серия Пашена – при переходе на третий уровень энергии (n=3).
 |
Первый шаг на пути разрешения противоречий между теорией и результатами эксперимента в физике атома был сделан в 1913 г. Н. Бором. Свои представления о механизме излучения и поглощения света атомом он сформулировал в виде следующих постулатов.
Первый постулат Бора: атом может находиться только в некоторых состояниях, в которых не происходит излучения, хотя при этом электроны в атоме движутся с ускорением. Такие состояния называются стационарными состояниями атома.
Второй постулат Бора: излучение света атомом происходит при переходе атома из одного стационарного состояния с большей энергией в другое стационарное состояние с меньшей энергией. При этом энергия кванта света определяется уравнением:
где Еn - энергия начального состояния; Еk - энергия конечного состояния.
При поглощении кванта света или любой другой энергии атом переходит из одного стационарного состояния с меньшей энергией в другое стационарное состояние с большей энергией.
Для наглядного представления возможных энергетических состояний атомов и переходов атомов из одного состояния в другое используются энергетические диаграммы, на которых каждое стационарное состояние атома отмечается горизонтальной линией, называемой энергетическим уровнем (рис. 18.2).
Все стационарные состояния, кроме одного, являются стационарными лишь условно. Бесконечно долго каждый атом может находиться лишь в стационарном состоянии с минимальной энергией Е1 . Это состояние атома называется основным состоянием. Все остальные стационарные состояния атома с энергиями Е2, Е3 , . Еп называются возбужденными состояниями.
Ниже всех остальных на диаграмме располагается энергетический уровень основного состояния атома, энергетические уровни возбужденных состояний располагаются над основным уровнем на расстояниях, пропорциональных разности энергий возбужденного и основного состояний.
Переходы атома из одного состояния в другое изображаются вертикальными линиями между соответствующими уровнями на диаграмме энергий, направление перехода обозначается стрелкой (рис. 18.2).
В результате соударения с другим атомом, с любой заряженной частицей или при поглощении фотона атом может перейти из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией (рис. 18.2а). Из любого возбужденного состояния атом самопроизвольно переходит в основное состояние или в другое возбужденное состояние с меньшей энергией. Этот переход сопровождается излучением фотонов (рис. 18.2б). Время жизни атомов в возбужденных состояниях обычно не превышает 10 -7 -10 -9 с.
Основное изменение, внесенное в физику атома постулатами Бора, заключалось в отказе от представлений о непрерывности изменения всех физических величин и в принятии идеи квантования значений физических величин, которыми описывается внутреннее состояние атома. Квантование энергии атома объясняет линейчатый спектр излучения атомов.
Линейчатые спектры были открыты еще в начале XIX в., однако закономерности линейчатых спектров и их происхождение долго не удавалось установить. Первые успехи были достигнуты при изучении спектра водорода. Экспериментально было обнаружено, что спектральные линии группируются в отдельные серии. Анализ измеренных значений длин волн позволил получить эмпирическую формулу, по которой можно было рассчитать значения этих длин волн:
где R = 1,097×10 7 м -1 - постоянная Ридберга; k и n – целые числа; k=1, n =2, 3, 4. - серия Лаймана (ультрафиолетовая область спектра); k=2, n=3, 4, 5. - серия Бальмера (видимая и близкая ультрафиолетовая область); k=3, n=4, 5, 6. - серия Пашена (инфракрасная область спектра). Эта формула получила название – обобщенная формула Бальмера.
Боровская теория атома водорода была разработана с использованием законов классической механики Ньютона и постулатов Бора. Для электрона, движущегося по стационарной орбите с номером n, Бор записал второй закон Ньютона:
и правило квантования стационарных орбит:
где m – масса электрона; vn – скорость электрона на орбите радиуса rn; - постоянная Планка с чертой (= 1,054×10 -34 Дж×с); е – элементарный электрический заряд.
Из уравнений (18.3) и (18.4) были получены следующие формулы:
где ro = 0,529×10 -10 м - боровский радиус атома водорода, n- номер орбиты; rn – радиус стационарной орбиты с номером n;
где En - энергия стационарного состояния атома водорода; eo - электрическая постоянная, h- постоянная Планка, Ei=13,6 эВ - энергия ионизации атома водорода.
Второй постулат Бора позволяет определить энергию кванта света, излучаемого атомом, и длину волны излучения:
Последняя формула находится в прекрасном согласии с экспериментальной формулой (18.2).
Боровская теория атома водорода позволяет объяснить происхождение линейчатых спектров испускания, связывая их появление с наличием дискретного ряда энергетических состояний атомов и переходами между ними.
Согласно представлениям Бора, движение электронов вокруг ядра в стационарных состояниях определяется законами обычной механики, для описания же процессов перехода атома из одного стационарного состояния в другое эти законы не применимы, и следует воспользоваться квантовыми представлениями.
На рис. 18.3 представлена схема энергетических уровней атома водорода. Значения энергии каждого уровня рассчитывались по формуле (18.6). Стрелками показаны переходы атома из одного стационарного состояния в другое, которые сопровождаются излучением квантов света. Серия Лаймана возникает при переходе атомов с вышележащих уровней энергии на первый (основной, n=1), серия Бальмера – при переходе на второй уровень энергии (n=2), серия Пашена – при переходе на третий уровень энергии (n=3).

По мере накопления знаний о материи и веществе происходило появление и уточнение теорий, объясняющих особенности строения атомов. Поговорим кратко о теории строения атома Бора.
Проблемы планетарной модели атома
В начале XXв Э. Резерфорд установил, что распределение заряда внутри атома крайне неравномерно. В центре атома находится компактное ядро, содержащее весь положительный заряд, а вокруг него на достаточно большом расстоянии (по сравнению с ядром) обращаются электроны. Была построена планетарная модель атома.
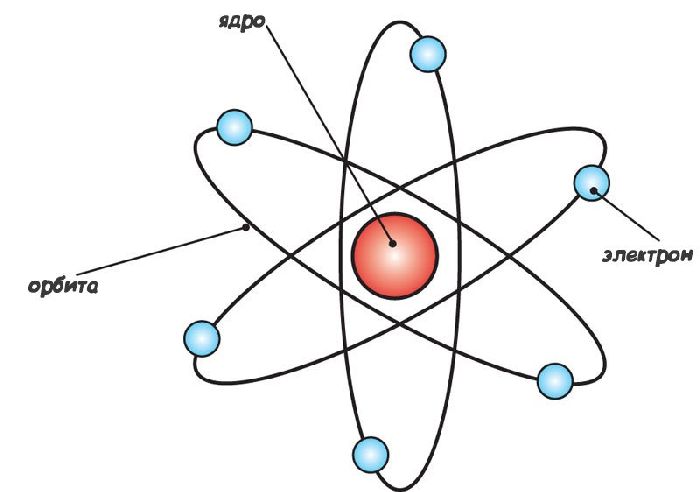
Рис. 1. Планетарная модель атома.
Эта модель хорошо объяснила результаты опытов по зондированию атомов α-частицами, однако, она противоречила достаточно хорошо обоснованной и подтвержденной к тому времени теории электродинамики Максвелла.
Согласно теории Максвелла, любой заряд, движущийся с ускорением, излучает электромагнитные волны и теряет энергию. Электрон, двигаясь по круговой орбите вокруг ядра, движется с постоянным центростремительным ускорением, и поэтому должен излучать, терять энергию, и в конце концов, упасть на ядро. Расчеты показывали, что это должно происходить в очень короткий промежуток времени, порядка десятков наносекунд. В реальности же атомы стабильны.
Вторым затруднением планетарной модели были сложности объяснения линейчатых спектров – противоречия здесь не было, но и обосновать наличие спектральных линий эта модель не могла.
Постулаты Бора
Для объяснения наблюдаемых явлений в 1913 г Н. Бор предложил свою теорию, базирующуюся на двух постулатах:
- Существуют особые стационарные состояния атома, находясь в которых электроны не излучают энергию, хотя двигаются с ускорением. В каждом стационарном состоянии электрон обладает некоторой энергией $E_n$, разной для разных состояний.
- Электроны излучают или поглощают энергию, переходя из одного стационарного состояния в другое, количество излучаемой или поглощаемой энергии равно разности энергий стационарных состояний.
Постулаты Н.Бора были допущениями, которые никак не обосновывались, исходя из классических теорий того времени. Однако, они явились первой ласточкой новой теории – квантовой механики.
Модель атома Н. Бора
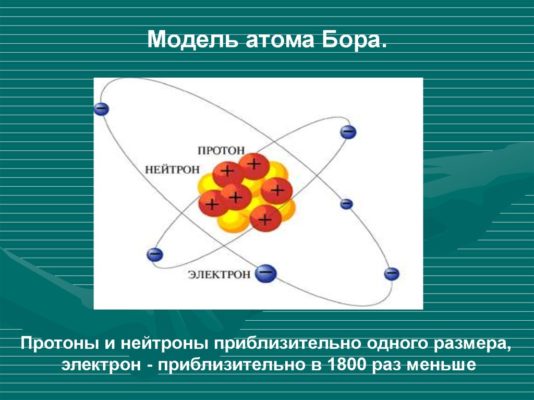
Рис. 2. Модель атома Бора.
На основе своих постулатов и законов механики И.Ньютона Н.Бор смог определить радиусы орбит электрона в атоме водорода, а также энергию, соответствующую стационарному уровню $n$:
- $n$ – номер энергетического уровня (1,2,3…);
- $E_n$ – энергия электрона на уровне $n$;
- $R_y$ – постоянная Ридберга, численно равная 13.6 эВ.
Теория Бора объяснила как стабильность атомов, так и линейчатый характер спектров. Например, серия самых ярких линий спектра водорода, открытая в 1885 г И. Бальмером (названная его именем), соответствует переходам на второй энергетический уровень с третьего, четвертого и более высоких уровней.
Атом водорода способен излучать и более мощную серию, соответствующую переходам на первый энергетический уровень с более высоких, однако, эта серия лежит в ультрафиолетовой области, и была открыта только в 1906 г. Т. Лайманом. Есть и другие серии линий, соответствующих переходам на третий и более высокие уровни.
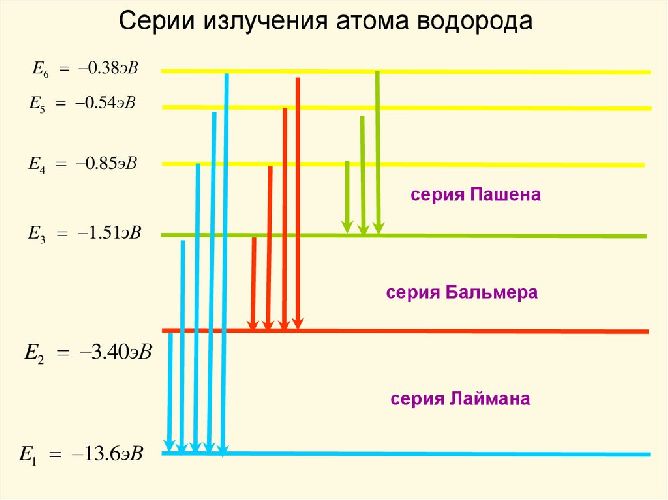
Рис. 3. Серия Бальмера серия Лаймана серия Пашена.
Что мы узнали?
Н. Бор разработал теорию строения атомов на основе своих двух допущений-постулатов. Эта теория смогла объяснить противоречие с электродинамикой Максвелла и линейчатый спектр излучения вещества.
Автор — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев.
Темы кодификатора ЕГЭ: постулаты Бора.
Планетарная модель атома, успешно истолковав результаты опытов по рассеянию -частиц, в свою очередь столкнулась с очень серьёзными трудностями.
Как мы знаем, любой заряд, движущийся с ускорением, излучает электромагнитные волны. Это - неоспоримый факт классической электродинамики Максвелла, подтверждаемый многочисленными наблюдениями.
Нам также хорошо известно, что электромагнитные волны несут энергию. Стало быть, ускоренно движущийся заряд, излучая, теряет энергию, которая этим излучением уносится.
А теперь давайте возьмём произвольный электрон в планетарной модели. Он двигается вокруг ядра по замкнутой орбите, так что направление его скорости постоянно меняется. Следовательно, электрон всё время имеет некоторое ускорение (например, при равномерном движении по окружности это будет центростремительное ускорение), и поэтому должен непрерывно излучать электромагнитные волны. Расходуя свою энергию на излучение, электрон будет постепенно приближаться к ядру; в конце концов, исчерпав запас своей энергии полностью, электрон упадёт на ядро.
Если исходить из того, что механика Ньютона и электродинамика Максвелла работают внутри атома, и провести соответствующие вычисления, то получается весьма озадачивающий результат: расход энергии электрона на излучение (с последующим падением электрона на ядро) потребует совсем малого времени - порядка секунды. За это время атом должен полностью "коллапсировать" и прекратить своё существование.
Таким образом, классическая физика предрекает неустойчивость атомов, устроенных согласно планетарной модели. Этот вывод находится в глубоком противоречии с опытом: ведь на самом деле ничего такого не наблюдается. Предметы нашего мира вполне устойчивы и не коллапсируют на глазах! Атом может сколь угодно долго пребывать в невозбуждённом состоянии, не излучая при этом электромагнитные волны.
Постулаты Бора.
Оставалось признать, что внутри атомов перестают действовать известные законы классической физики. Микромир подчиняется совсем другим законам.
Первый прорыв в познании законов микромира принадлежит великому датскому физику Нильсу Бору. Он предложил три постулата, резко расходящиеся с механикой и электродинамикой, но тем не менее позволяющих правильно описать простейший из атомов - атом водорода.
Классическая физика хорошо описывает непрерывные процессы - движение материальной точки, изменение состояния идеального газа, распространение электромагнитных волн. . . Энергия объекта, подчиняющегося механике или электродинамике, в принципе может принимать любые значения. Однако линейчатые спектры указывают на дискретность процессов, происходящих внутри атомов. Эта дискретность должна фигурировать в законах новой теории.
Первый постулат Бора. Всякий атом (и вообще, всякая атомная система) может находиться не во всех состояниях с любым, наперёд заданным значением энергии. Возможен лишь дискретный набор избранных состояний, называемых стационарными, в которых энергия атома принимает значения Находясь в стационарном состоянии, атом не излучает электромагнитные волны.
Как видим, первый постулат Бора вопиющим образом противоречит классической физике: налагается запрет на любые значения энергии, кроме избранного прерывистого набора, и признаётся, что электроны, вроде бы движущиеся ускоренно, на самом деле не излучают.
Выглядит фантастически, не правда ли? Однако в том же 1913 году, когда Бор предложил свои постулаты, существование стационарных состояний было подтверждено экспериментально - в специально поставленном опыте немецких физиков Франка и Герца. Таким образом, стационарные состояния - это не выдумка, а объективная реальность.
Значения разрешённого набора называются уровнями энергии атома. Что происходит при переходе с одного уровня энергии на другой?
Второй постулат Бора. Если атом переходит из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией , то разность этих энергий может высвободиться в виде излучения. В таком случае излучается фотон с энергией
Эта же формула работает и при поглощении света: в результате столкновения с фотоном атом переходит из состояния в состояние с большей энергией , а фотон при этом исчезает.
Для примера на рис. 1 показано излучение фотона при переходе атома с энергетического уровня на уровень . Переход заключается в том, что электрон "соскакивает" с одной орбиты на другую, расположенную ближе к ядру.

Рис. 1. Излучение фотона атомом
Формула (1) даёт качественное представление о том, почему атомные спектры испускания и поглощения являются линейчатыми.
В самом деле, атом может излучать волны лишь тех частот, которые соответствуют разностям значений энергии разрешённого дискретного набора ; соответственно, набор этих частот также получается дискретным. Вот почему спектр излучения атомов состоит из отдельно расположенных резких ярких линий.
Вместе с тем, атом может поглотить не любой фотон, а только тот, энергия которого в точности равна разности каких-то двух разрешённых значений энергии и . Переходя в состояние с более высокой энергией , атомы поглощают ровно те самые фотоны, которые способны излучить при обратном переходе в исходное состояние . Попросту говоря, атомы забирают из непрерывного спектра те линии, которые сами же и излучают; вот почему тёмные линии спектра поглощения холодного атомарного газа находятся как раз в тех местах, где расположены яркие линии спектра испускания этого же газа в нагретом состоянии.
Качественного объяснения характера атомных спектров, однако, недостаточно. Хотелось бы иметь теорию, позволяющую вычислить частоты наблюдаемых спектров. Бору удалось это сделать в самом простом случае - для атома водорода.
Атом водорода.
Атом водорода состоит из ядра с зарядом , которое называется протоном, и одного электрона с зарядом (через обозначена абсолютная величина заряда электрона). При построении своей теории атома водорода Бор сделал три дополнительных предположения.
1. Прежде всего, мы ограничиваемся рассмотрением только круговых орбит электрона. Таким образом, электрон движется вокруг протона по окружности радиуса с постоянной по модулю скоростью (рис. 2 ).

Рис. 2. Модель атома водорода
2. Величина , равная произведению импульса электрона на радиус орбиты , называется моментом импульса электрона. В каких единицах измеряется момент импульса?
Это в точности размерность постоянной Планка! Именно здесь Бор увидел появление дискретности, необходимой для квантового описания атома водорода.
Правило квантования (третий постулат Бора). Момент импульса электрона может принимать лишь дискретный набор значений, кратных "перечёркнутой" постоянной Планка:
3. Выше мы говорили, что классическая физика перестаёт работать внутри атома. Так оно в действительности и есть, но вопреки этому мы предполагаем, что электрон притягивается к протону с силой, вычисляемой по закону Кулона, а движение электрона подчиняется второму закону Ньютона:
Эти три предположения позволяют довольно просто получить формулы для уровней энергии атома водорода. Переписываем соотношение (3) в виде:
Из правила квантования (2) выражаем :
и подставляем это в (4) :
Отсюда получаем формулу для допустимых радиусов орбит электрона:
Теперь перейдём к нахождению энергии электрона. Потенциальная энергия кулоновского взаимодействия электрона с ядром равна:
(Она отрицательна, так как отсчитывается от бесконечно удалённой точки, в которой достигает максимального значения.)
Полная энергия электрона равна сумме его кинетической и потенциальной энергий:
Вместо подставим правую часть выражения (4) :
Полная энергия, как видим, отрицательна. Если на радиус орбиты никаких ограничений не накладывается, как это имеет место в классической физике, то энергия может принимать любые по модулю значения. Но согласно (5) существует лишь дискретный набор возможных значений радиуса; подставляя их в (6) , получаем соответствующий набор допустимых значений энергии атома водорода:
Основное состояние атома водорода - это состояние с наименьшей энергией . В основном состоянии атом может находиться неограниченно долго. Вычисление даёт:
Мы видим, что если атом находится в основном состоянии, то для выбивания электрона нужно сообщить атому энергию, равную как минимум 13,6 эВ. Эта величина носит название энергии ионизации атома водорода.
По формуле (5) легко вычислить радиус орбиты основного состояния:
То есть, диаметр атома оказывается равным как раз см - величине, известной из опыта. Таким образом, теория Бора впервые смогла объяснить размер атома!
Кроме того, в рамках теории Бора удаётся получить формулы для вычисления частот (или длин волн) спектра атома водорода. Так, согласно второму постулату Бора и формуле (7) имеем:
На практике чаще имеют дело с длинами волн. Учитывая, что , формулу (8) можно переписать так:
Константа м называется постоянной Ридберга. Теория Бора даёт значение этой постоянной, очень хорошо согласующееся с экспериментом.
Длины волн спектра атома водорода образуют серии, характеризующиеся фиксированным значением в формуле (9) . Все длины волн данной серии излучаются при переходах на уровень с вышележащих энергетических уровней .
Переходы в основное состояние:
образуют серию Лаймана. Длины волн этой серии описываются формулой (9) при :
Линии серии Лаймана лежат в ультрафиолетовом диапазоне.
Переходы на второй уровень:
образуют серию Бальмера. Длины волн этой серии подчиняются формуле (9) при :
Первые четыре линии серии Бальмера лежат в видимом диапазоне (рис. 3 ), остальные - в ультрафиолетовом.

Рис. 3. Видимый спектр атома водорода (серия Бальмера)
Переходы на третий уровень:
образуют серию Пашена.Длины волн этой серии описываются формулой (9) при :
Все линии серии Пашена лежат в инфракрасном диапазоне.
Имеются ещё три "именованных" серии: это серия Брэккета (переходы на уровень), серия Пфунда (переходы на уровень ) и серия Хэмпфри (переходы на уровень ). Все линии этих серий лежат в далёкой инфракрасной области.
Достоинства и недостатки теории Бора.
О достоинствах модели атома водорода, предложенной Бором, мы так или иначе уже сказали. Резюмируем их.
-Теория Бора продемонстрировала, что для описания атомных объектов принципиально недостаточно представлений классической физики. В микромире работают другие, совершенно новые законы.
Для микромира характерно квантование - дискретность изменения величин, описывающих состояние объекта. В качестве меры квантования, как показала теория Бора, может выступать постоянная Планка , которая является универсальной константой и играет фундаментальную роль во всей физике микромира (а не только в явлениях излучения и поглощения света).
-Теория Бора впервые и совершенно точно указала на факт наличия стационарных энергетических состояний атома, образующих дискретный набор. Этот факт оказался общим свойством объектов микромира.
-В рамках модели Бора удалось получить формулы для вычисления частот спектра атома водорода и объяснить размер атома. Классическая физика была не в состоянии решить эти проблемы.
Однако теория Бора, разумеется, не могла претендовать на роль общей теории, описывающей микромир. Модель Бора обладала рядом существенных недостатков.
-Теория Бора непоследовательна. С одной стороны, она отвергает описание атома на основе классической физики, так как постулирует наличие стационарных состояний и правила квантования, непонятных с точки зрения механики и электродинамики. С другой стороны, классические законы - второй закон Ньютона и закон Кулона - используются для записи уравнения движения электрона по круговой орбите.
-Теория Бора не смогла дать адекватное описание самого простого после водорода атома гелия. Подавно не могло быть и речи о распространении теории Бора на более сложные атомы.
-Даже в самом атоме водорода теория Бора смогла описать не всё. Например, дав выражения для частот спектральных линий, модель Бора не объясняла различие в их интенсивностях. Кроме того, неясен оставался механизм образования молекулы водорода из двух атомов.
Несмотря на свои недостатки, теория Бора стала важнейшим этапом развития физики микромира. Полуклассическая-полуквантовая модель Бора послужила промежуточным звеном между классической физикой и последовательной квантовой механикой , построенной десятилетием позже - в 1920-х годах.
Теория Бора это попытка объяснить модель атома пользуясь идеями Планка , о дискретности электромагнитного излучения.
В соответствии с ними Н. Бор предположил, что процессы, происходящие при этом внутри атома, также подчиняются квантовым закономерностям.

Что такое теория Бора
Модель атома, предложенная Резерфордом, не могла удовлетворительно объяснить механизм излучения атомом электромагнитных волн, так как по мере излучения энергия электрона, а вместе с ней и скорость его движения вокруг ядра должны убывать и в конце концов электрон должен упасть на ядро.
В 1913 г. Н. Бор предложил новую теорию излучения света атомами, в основу которой были положены идеи М. Планка. Теория Н. Бора основывается на двух постулатах.
- Внутренняя энергия атома дискретна, т. е. может принимать только определенные дозволенные значения или уровни, кратные некоторым характерным для данного атома количествам или квантам энергии. Состояния, соответствующие этим уровням энергии, являются стационарными (равновесными): находясь в таком состоянии, атом не излучает электромагнитных волн несмотря на происходящее в нем движение электронов.
- Испускание (или поглощение) атомом электромагнитного излучения происходит при переходе из одного стационарного состояния в другое. При этом испускается (или поглощается) фотон монохроматического излучения с энергией Eф, равной разности энергетических уровней Е2 и Е1 соответствующих этим состояниям:
Частота излучения v соответствует энергии фотона:
v = Eф/h = (E2 —E1)/h
где h — постоянная Планка.
Для согласования выдвинутых им положений с Резерфордовской моделью атома Н. Бор предложил считать, что стационарным состояниям или дозволенным энергетическим уровням атома соответствует движение электронов по орбитам определенного радиуса. Эти орбиты должны удовлетворять условию, чтобы момент количества движения lэ электрона был кратен постоянной Планка, деленной на 2π, т. е. где п — есть целое число, называемое квантовым числом атома, которое соответствует порядковому номеру орбиты. Число п может принимать значения: п — 1,2,3 …
Из этого условия можно определить радиусы дозволенных орбит электрона. В общем виде:
r = (h 2 /(4π 2 me 2 ))(n 2 /Z)
где т — масса, е — заряд электрона, п — квантовое число или порядковый номер орбиты, Z — порядковый номер элемента.
Таким образом, радиусы дозволенных орбит прямо пропорциональны квадрату квантового числа и обратно пропорциональны порядковому номеру элемента. Например, для атома водорода (Z = 1) радиус наименьшей (п =1) орбиты r = 0,53•10 -8 см. Эта величина и характеризует порядок размеров атома.
Энергия электрона в атоме состоит из кинетической энергии движения по орбите (скорость порядка 10 8 см/сек) и потенциальной энергии в поле ядра. Обе величины зависят от радиуса орбиты. Следовательно, определенным радиусам орбит соответствуют определенные энергетические уровни.
Изменение энергии электрона

Как изменяется энергия электрона и энергетический уровень атома при изменении радиуса орбиты.
- При увеличении радиуса орбиты скорость движения электрона уменьшается, соответственно уменьшается и его кинетическая энергия.
- Для того чтобы удалить электрон от ядра, надо совершить работу против сил притяжения, следовательно, потенциальная энергия электрона с увеличением радиуса орбиты увеличивается.
При этом потенциальная энергия возрастает на большую величину, чем уменьшается кинетическая, поэтому общая энергия электрона по мере увеличения радиуса орбиты увеличивается. Соответственно возрастают и энергетические уровни атома (рис. 2):
Разность энергии между двумя соседними стационарными уровнями по мере увеличения радиуса орбит, наоборот, уменьшается:
Стационарный уровень с наименьшей энергией называется основным, он характерен для атома в обычном состоянии (т. е. атома, не подвергающегося никаким внешним воздействиям). Остальные стационарные уровни называются возбужденными.
Возбуждение атома
Это может быть соударение частиц в процессе теплового движения или при электрическом разряде в газах, поглощение фотона электромагнитного излучения и т. п. Возбужденное состояние может возникнуть также при рекомбинации ионов в газе, под действием частиц радиоактивного излучения и т. д.
Возбужденное состояние атома неустойчиво (метастабильно). Как правило, примерно через 10 -8 сек электрон возвращается на основную орбиту, при чем излучает фотон, уносящий дополнительную энергию, полученную электроном при возбуждении атома (рис. , а).
При этом атом возвращается в основное состояние. Электрон может возвращаться на основную орбиту не сразу, а ступеньками через промежуточные уровни, В этом случае будет излучаться несколько фотонов с частотой, соответствующей разности энергетических уровней ступеней перехода (рис. , б).
При люминесценции возбуждение атомов происходит в результате поглощения энергии фотонов падающего на вещество излучения.
Если энергия фотона достаточно велика (ультрафиолетовое и еще более коротковолновое рентгеновское излучение), то при этом происходит возбуждение атома с последующим излучением (рис. , в).
Для того чтобы перевести внешний электрон на одну из возбужденных орбит, требуется в зависимости от природы атома энергия порядка нескольких электрон-вольт.
При возвращении электрона на основную орбиту будут излучаться фотоны с такой же энергией, что соответствует частоте видимого или близкого к нему ультрафиолетового излучения.
При пере ходах электрона с одной возбужденной орбиты на другую излучаются фотоны с еще меньшей энергией, относящиеся к инфракрасному излучению.
Таким образом, оптическое излучение связано преимущественно с переходом внешних электронов.
Спектр излучения атомов водорода

Пример спектра излучения атомов водорода в теории атома водорода по бору В зависимости от энергии, сообщенной атому при возбуждении, электрон может перейти на различные возбужденные орбиты.
При возвращении его на основную орбиту будут излучаться фотоны различной энергии, т. е. с различной частотой или длиной волны.
Каждой длине волны излучения соответствует линия в спектре, поэтому в спектре излучения атома водорода должно быть значительное число линий, расположение которых отражает энергетические уровни атома.
В спектре же газа, когда свет излучается громадным количеством атомов, будут присутствовать все возможные линии.
Еще до создания теории Н. Бора было установлено, что в спектре водорода имеются группы (серии) линий, расположение которых подчинено определенным закономерностям.
Например, четыре линии в видимой части спектра вместе с линиями в близкой ультрафиолетовой части составляют серию Бальмера. Частоты всех линий этой серии можно выразить общей формулой:
v = R ((1/2 2 ) — (1/n 2 ))
где R — постоянная, равная 3,29•10 15 сек -1 , а п — переменное число, которое может принимать значение 3, 4, 5 и т. д.
Имеются и другие серии, например серия Лаймана в ультрафиолетовой части спектра, серии Пашена, Брекета и другие — в инфракрасной, частоты которых также могут быть выражены соответствующими формулами.
Расчеты частоты колебаний атомов водорода
Н. Бор произвел расчеты, в которых связал частоту колебаний, соответствующую длинам волн линий этих серий, с возможными в атоме водорода переходами между энергетическими уровнями.
На рис. 3 приведена диаграмма, в которой сопоставлены график распределения энергетических уровней (в), схема возможных переходов электрона (а), а также расположение линий в спектре (б).
При переходе электрона с любой возбужденной орбиты на основную разность энергетических уровней наибольшая, фотоны имеют наиболее короткую длину волны и излучение лежит в ультрафиолетовой области (серия Лаймана).
При аналогичном переходе электрона на первую возбужденную орбиту разность энергетических уровней меньше, спектральные линии относятся к видимой части спектра (серия Бальмера).
При переходе электрона на вторую возбужденную орбиту энергия фотонов еще меньше и излучение лежит в инфракрасной области (серия Пашена и др.).
Таким образом, теория Бора получила полное подтверждение в установленных экспериментально спектральных закономерностях.
Статья на тему Теория Бора
Похожие страницы:
Теория Бора В основу своей теории Н. Бор положил несколько постулатов: 1. Электроны могут двигаться вокруг ядра только по строго.
Содержание статьи1 Линейчатые спектры элементов Теория Бора1.1 Теория Бора строения атома1.2 Постулаты бора спектр элемента Линейчатые спектры элементов Теория Бора Ядерная модель.
Атом Резерфорда Бора Развитие исследований радиоактивного излучения, с одной стороны, и квантовой теории, с другой, привели к созданию квантовой модели.
Теория атомного ядра Как только выяснилось существование нейтронов, было предложено совершенно новое представление о строении ядра, впервые высказанное и обоснованное советским.
Состояние электронов в атомах Понятие о волновой механике. Теория Бора оказала огромные услуги физике и химии, подойдя, с одной стороны.
История атома Бора Бор, как и Томсон до него, ищет такое расположение электронов в атоме, которое объяснило бы его физические.
Квантовые постулаты Бора. Модель атома водорода по Бору
Выход из крайне затруднительного положения в теории атома был найден в 1913 г. датским физиком Нильсом Бором на пути дальнейшего развития квантовых представлений о процессах в природе.

Постулаты Бора
Последовательной теории атома Бор, однако, не разработал.
Он в виде постулатов сформулировал основные положения новой теории.
Причем и законы классической физики не отвергались им безоговорочно.
Новые постулаты, скорее, налагали лишь некоторые ограничения на рассматриваемые классической физикой движения.
Успех теории Бора был тем не менее поразительным, и всем ученым стало ясно, что Бор нашел правильный путь развития теории.
Этот путь привел впоследствии к созданию стройной теории движения микрочастиц — квантовой механики.
Первый постулат Бора
Cуществуют особые, станционарные состояния атома, находясь в которых атом не излучает энергию, при этом электроны в атоме движутся с укорением.
Каждому стационарному состоянию соответствует определенная энергия Еn.
Bторой постулат Бора
Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией Еn. Энергия излученного фотона равна разности энергий стационарных состояний:
Отсюда частоту излучения можно выразить так:

Согласно теории Бора энергия электрона в атоме водорода, находящегося на n-м энергетическом уровне, равна:

При поглощении света атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией.
Второй постулат, также как и первый, противоречит электродинамике Максвелла, так как согласно этому постулату частота излучения света свидетельствует не об особенностях движения электрона, а лишь об изменении энергии атома.
Свои постулаты Бор применил для построения теории простейшей атомной системы — атома водорода.
Основная задача состояла в нахождении частот электромагнитных волн, излучаемых водородом.
Эти частоты можно найти на основе второго постулата и правила определения стационарных значений энергии атома.
Это правило (правило квантования) Бору опять-таки пришлось постулировать.
Модель атома водорода по Бору
Используя законы механики Ньютона и правило квантования, на основе которого определяются возможные стационарные состояния атома, Бор смог вычислить радиусы орбит электрона и энергии стационарных состояний атома.
Минимальный радиус орбиты определяет размеры атома.
На рисунке значения энергий стационарных состояний (в электрон- вольтах 1 ) отложены на вертикальной оси.
В атомной физике энергию принято выражать в электронвольтах (сокращенно эВ).
1 эВ равен энергии, приобретаемой электроном при прохождении им разности потенциалов 1 В: 1 эВ = 1,6 • 10 -19 Дж.

Теория Бора приводит к количественному согласию с экспериментом для значений этих частот.
Все частоты излучений атома водорода составляют в своей совокупности ряд серий, каждая из которых образуется при переходах атома в одно из энергетических состояний со всех верхних энергетических состояний (состояний с большей энергией).
Переходы в первое возбужденное состояние (на второй энергетический уровень) с верхних уровней образуют серию Бальмера.
На рисунке эти переходы изображены стрелками.
Данная серия названа по имени швейцарского учителя И. Бальмера, который еще в 1885 г. на основе экспериментальных данных получил простую формулу для определения частот видимой части спектра водорода.
Поглощение света
Поглощение света — процесс, обратный излучению.
Атом, поглощая свет, переходит из низших энергетических состояний в высшие.
При этом он поглощает излучение той же самой частоты, которую излучает, переходя из высших энергетических состояний в низшие.
На основе двух постулатов и правила квантования Бор определил радиус атома водорода и энергии стационарных состояний атома.
Это позволило вычислить частоты излучаемых и поглощаемых атомом электромагнитных волн.
Трудности теории Бора. Квантовая механика
Наибольший успех теория Бора имела в применении к атому водорода, для которого оказалось возможным построить количественную теорию спектра.
Однако разработать количественную теорию для следующего за водородом атома гелия на основе боровских представлений не удалось.
Относительно атома гелия и более сложных атомов теория Бора позволяла делать лишь качественные (хотя и очень важные) заключения.
Это и неудивительно.
Ведь теория Бора является половинчатой, внутренне противоречивой.
С одной стороны, при разработке теории атома водорода использовались привычные законы механики Ньютона и давно известный закон Кулона, а с другой — вводились квантовые постулаты, никак не связанные с механикой Ньютона и электродинамикой Максвелла.
Введение в физику квантовых представлений требовало радикальной переработки как механики, так и электродинамики.
Эта переработка была осуществлена в начале второй четверти XX в., когда были созданы новые физические теории: квантовая механика и квантовая электродинамика.
Постулаты Бора оказались совершенно правильными.
Но они рассматривались уже не как постулаты, а как следствия основных принципов этих теорий.
Правило же квантования Бора, как выяснилось, применимо далеко не всегда.
Представление об определенных орбитах, по которым движется электрон в атоме Бора, оказалось весьма условным.
На самом деле движение электрона в атоме имеет очень мало общего с движением планет по орбитам.
Если бы атом водорода в наинизшем его энергетическом состоянии можно было сфотографировать с большой выдержкой, то мы увидели бы облако с переменной плотностью.
Большую часть времени электрон находится на определенном расстоянии от ядра.
Это расстояние можно принять за грубое подобие радиуса орбиты.
Фотография атома совсем не походила бы на привычный рисунок Солнечной системы, а скорее напоминала бы расплывчатое пятно, полученное при фотографировании бабочки, порхающей около фонаря.
В настоящее время с помощью квантовой механики можно ответить практически на любой вопрос, относящийся к строению и свойствам электронных оболочек атомов.
Атомная физика. Физика, учебник для 11 класса - Класс!ная физика
Читайте также:

