Спирты и фенолы кратко
Обновлено: 04.07.2024
Спирты – органические вещества, содержащие одну или более гидроксильных групп (−OH), напрямую связанных с атомом углерода в состоянии sp 3 -гибридизации).
Фенолы – соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца.
Номенклатура и классификация
При использовании номенклатуры ИЮПАК названия спиртов характеризуются суффиксом -ол. В зависимости от числа гидроксильных групп спирты бывают одно-, двух-, трехатомные. В зависимости от того, при каком атоме углерода находится гидроксильная группа, спирты классифицируют на первичные, вторичные и третичные.
Строение и физические свойства
Строение спиртов отчасти схоже со строением воды. Как и в воде, между молекулами спирта образуются водородные связи, поэтому спирты имеют более высокие температуры плавления и кипения, чем можно было бы ожидать. Влияние гидроксильной группы на свойства вещества особенно велико в соединениях с короткой углеводородной цепочкой. Например, метанол и этанол неограниченно смешиваются с водой, имеют довольно высокие плотности и температуры кипения для своей молекулярной массы, а высшие спирты являются гидрофобными и мало отличаются по свойствам от аналогичных углеводородов без гидроксильной группы [9].
При рассмотрении фенолов необходимо выделить влияние гидроксильной группы –OH на ароматическое кольцо, которое повышает в бензольном кольце электронную плотность (особенно в орто- и пара-положениях) благодаря одной из неподелённых пар электронов кислорода, учавствующей в сопряжении с π-системой бензольного кольца. Смещение неподелённой электронной пары атома О в сторону бензольного кольца приводит к усилению полярности связи O–H. В итоге молекулы фенола распадаются в водных растворах с элиминированием протона, а значит фенол проявляет себя как слабая кислота. Это является основным отличием фенолов от спиртов, являющихся неэлектролитами. Основная часть одноатомных фенолов при нормальных условиях – бесцветные кристаллические вещества с низкой температурой плавления и специфическим запахом. Фенолы плохо растворяются в воде, но с легкостью – в органических растворителях. Они токсичны, а при хранении на воздухе постепенно окисляются и темнеют.
Химические свойства
Кислотно-основные реакции спиртов. Спирты способны проявлять как кислотные, так и основные свойства. Как кислоты, спирты с щелочными и щелочноземельными металлами, а также сильными основаниями (например, амидами или гидридами) реагируют с образованием алкоголятов:
Спирты также проявляют основные свойства – образуют соли с сильными кислотами (соли алкоксония) и дают донорно-акцепторные комплексы с кислотами Льюиса:
По связи О–Н → фенолы в большинстве реакциий активнее спиртов, так как эта связь полярнее из-за смещения электронной плотности от кислорода к бензольному кольцу (участие неподеленной электронной пары атома кислорода в системе π-сопряжения). Фенол с растворами щелочей дает соли – феноляты (например, фенолят калия – C6H5OК):
Превращение спиртов в галогеналканы. Одной из наиболее важных реакций с участием связи C–O является превращение спиртов в галогеноалканы. Гидроксильная группа в спиртах может быть замещена на атом галогена:

Превращение спиртов в эфиры неорганических кислот. При действии концентрированной азотной кислоты могут быть получены органические нитраты:
Превращение спиртов в простые эфиры. Медленно нагревая спирты в присутствии серной кислоты обеспечивается межмолекулярная дегидратация спиртов с образованием простых эфиров:
| 2ROH |  | ROR + H2O. |
Превращение спиртов в сложные эфиры. Сложные эфиры получаются из спиртов в реакциях с органическими кислотами при нагревании с участием кислотного катализатора (чаще всего, концентрированной серной кислоты). Этот процесс имеет название кислотно-каталитической реакции этерификации:

Реакции окисления спиртов. Первичные спирты в зависимости от выбора агента окисляются до альдегидов или карбоновых кислот:
| CH2═CH–CH2OH |  | CH2═CH–CHO. |
Вторичные – до соответствующих кетонов и кислот:
| R–CHOH–R ´ |  | R–CO–R ´ . |
Третичные спирты устойчивы к окислению, однако под действием сильных окислителей могут быть расщеплены с разрывом углеродной цепи в различные карбонильные соединения.
Реакции восстановления спиртов. Неактивированные гидроксильные группы довольно устойчивы к гидрогенолизу и могут быть восстановлены в довольно жёстких условиях. Реакции гидрирования протекают при высоких температурах и давлении, в качестве катализаторов используются: никель, смешанные оксиды хрома-меди и т. д.
| RCH2OH + H2 |  | RCH3 + H2O. |
Методы получения
Реакции окисления. Для получения первичных спиртов применяют окисление металлорганических соединений:
При окислении алкенов происходит образование двухатомных спиртов:

Реакции восстановления. При мягком восстановлении карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров также образуются спирты:
R–COOR ´ + 4[H] → R–CH2OH + R ´ OH.
Реакции присоединения – активно используется в промышленности при синтезе метанола:

CO + 2H2 CH3OH.
Реакции замещения (гидролиза):
Биохимические методы производства. Известный с давних времён способ получения этанола – спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Схематично реакцию можно выразить уравнением [10]:
Кумольный способ получения фенола: (1949 г., Р. Ю. Удрис, П. Г. Сергеев, Б. Д. Кружалов). Получают сразу два продукта – куол и ацетон из кумола. Технология считается практически безотходной (выход полезных продуктов более 99 %) и экономичной. Сейчас кумольный способ используют как основной в мировом производстве фенола:

Применение
Одноатомные насыщенные спирты C3–C9, из которых главным компонентом является изоамиловый спирт, представляют основной компонент сивушного масла – побочного продукта спиртового брожения. Амиловый спирт используется для получения сложных эфиров, для целей парфюмерии и в производстве бездымного пороха. Пирокатехин и гидрохинон (парадигидроксибензол, бензол-1,4-диол) используют в фотографии как проявитель, в производстве красителей, лекарственных веществ. Фенол активно используется для производства фенолформальдегидных смол, поликарбона и эпоксидных смол, нейлона и капрона. Фенол и его производные также обуславливают консервирующие свойства коптильного дыма. Бутанол – компонент в топливных элементах и сырье для производства водорода. В 2007 г. в Великобритании начались продажи биобутанола в качестве добавки к бензину. Метанол используется для выпуска формальдегида, который используется для производства фенолформальдегидных смол и формалина, уксусной кислоты. Метанол используется для заправки гоночных мотоциклов и автомобилей. Этанол широко применяется как растворитель и антисептик: в пищевой промышленности; в качестве автомобильного топлива. Смесь этанола с бензином обозначается буквой Е. Цифрой и буквой Е обозначается процентное содержание этанола. Е85 – означает смесь из 85 % этанола и 15 % бензина. Биоэтанол как топливо нейтрален в качестве источника парниковых газов. Он обладает нулевым балансом диоксида углерода, поскольку при его производстве путём брожения и последующим сгоранием выделяется столько же CO2, сколько до этого было взято из атмосферы использованными для его производства растениями. Глицерин фармацевтическая и парфюмерная промышленность, смягчитель кожи и тканей, производство взрывчатых веществ.

Спирты, фенолы и их производные широко представлены в животном и растительном мире. Формулы спиртов и фенолов очень похожи, однако фенолы выделяются в отдельный от спиртов класс.
Общие сведения: спирты, фенолы
Спирты и фенолы являются органическими соединениями, которые содержат гидроксильную группу OH. Эти соединения можно рассматривать, как производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу. В спиртах гидроксильная группа замещает водород в открытой или замкнутой углеродной цепи, а также в боковых радикалах в ароматических углеводородах.
В фенолах гидроксильная группа непосредственно связана с ароматическим ядром.
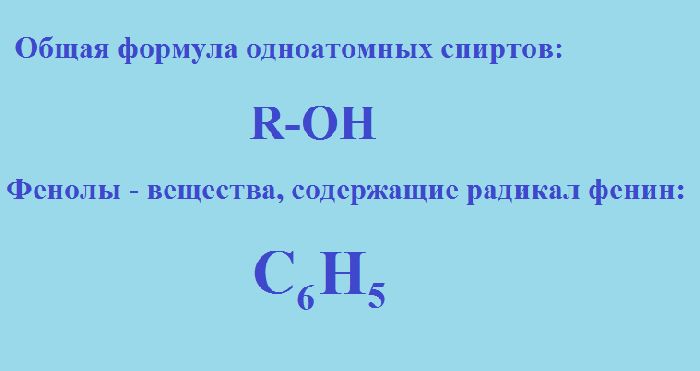
Рис. 1. Общая формула спирты и фенолы.
Классификация спиртов
Классификация спиртов производится по типу радикала, связанного с гидроксильной группой, и по числу гидроксильных групп в молекуле. Используется тривиальная, радикально-функциональная и международная систематическая номенклатура.
По типу радикала спирты делятся на:
- предельные спирты – один или более атомов водорода в предельном углеводороде замещены на гидроксильные группы
- непредельные спирты – один или более атомов водорода в непредельном углеводороде замещены на гидроксильные группы
Не все непредельные спирты устойчивы. Если гидроксильная группа находится у углеродного атома, связанного кратной связью, то такие спирты в свободном виде не существуют. Они переходят в более устойчивое соединение с карбонильной группой.
- алициклические спирты – одна или несколько гидроксильных групп замещают атомы водорода в циклоалкане
- ароматические спирты – гидроксильная группа замещает атом водорода в боковом радикале ароматического углеводорода
По числу гидроксильных групп спирты классифицируют на:
- одноатомные спирты, например, CH3-CH2-CH3-OH пропиловый спирт, пропанол-1
- двухатомные спирты (гликоли), например, HO-CH2-CH2-OH этиленгликоль, этандиол-1,2
- трехатомные спирты (глицерины) – C3H8O3
Классификация фенолов
При классификации фенолов рассмотрим только фенолы, содержащие одно бензольное ядро. Они также классифицируются по атомности:
- одноатомные фенолы. C6H5OH – фенол, карболовая кислота, гидроксибензол. Это первый член гомологического ряда фенолов. Фенол получают из каменноугольной смолы, он сильный антисептик, применяется для дезинфекции и обеззараживания.
- двухатомные фенолы. Первый член гомологического ряда – C6H4(OH)2 – дигидроксибензол, он имеет три изомера: пирокатехин, ризорцин, гидрохинон. Эти соединения применяются для получения лекарств, красителей, пластмасс, а также в фотографии.
Что мы узнали?
В зависимости от типа углеводородного радикала, а также в некоторых случаях особенностей прикрепления группы -ОН к этому углеводородному радикалу соединения с гидроксильной функциональной группой разделяют на спирты и фенолы.
Спиртами называют соединения, в которых гидроксильная группа соединена с углеводородным радикалом, но не присоединена непосредственно к ароматическому ядру, если таковой имеется в структуре радикала.
Если в структуре углеводородного радикала содержится ароматическое ядро и гидроксильная группа, при том соединена непосредственно с ароматическим ядром, такие соединения называют фенолами.
Почему же фенолы выделяют в отдельный от спиртов класс? Ведь, например, формулы

очень похожи и создают впечатление веществ одного класса органических соединений.
Однако непосредственное соединение гидроксильной группы с ароматическим ядром существенно влияет на свойства соединения, поскольку сопряженная система π-связей ароматического ядра сопряжена также и с одной из неподеленных электронных пар атома кислорода. Из-за этого в фенолах связь О-Н более полярна по сравнению со спиртами, что существенно повышает подвижность атома водорода в гидроксильной группе. Другими словами, у фенолов значительно ярче, чем у спиртов выражены кислотные свойства.
Химические свойства спиртов
Одноатомные спирты
Реакции замещения
Замещение атома водорода в гидроксильной группе
1) Спирты реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от защитной пленки Al2O3), при этом образуются алкоголяты металлов и выделяется водород:
Образование алкоголятов возможно только при использовании спиртов, не содержащих растворенной в них воды, так как в присутствии воды алкоголяты легко гидролизуются:
2) Реакция этерификации
Реакцией этерификации называют взаимодействие спиртов с органическими и кислородсодержащими неорганическими кислотами, приводящее к образованию сложных эфиров.
Такого типа реакции являются обратимыми, поэтому для смещения равновесия в сторону образования сложного эфира, реакцию желательно проводить при нагревании, а также в присутствии концентрированной серной кислоты как водоотнимающего агента:
Замещение гидроксильной группы
1) При действии на спирты галогеноводородных кислот происходит замещение гидроксильной группы на атом галогена. В результате такой реакции образуются галогеналканы и вода:
2) При пропускании смеси паров спирта с аммиаком через нагретые оксиды некоторых металлов (чаще всего Al2O3) могут быть получены первичные, вторичные или третичные амины:
Тип амина (первичный, вторичный, третичный) будет в некоторой степени зависеть от соотношения исходного спирта и аммиака.
Реакции элиминирования (отщепления)
Дегидратация
Дегидратация, фактически подразумевающая отщепление молекул воды, в случае спиртов различается на межмолекулярную дегидратацию и внутримолекулярную дегидратацию.
При межмолекулярной дегидратации спиртов одна молекула воды образуется в результате отщепления атома водорода от одной молекулы спирта и гидроксильной группы — от другой молекулы.
В результате этой реакции образуются соединения, относящиеся к классу простых эфиров (R-O-R):
Внутримолекулярная дегидратация спиртов протекает таким образом, что одна молекула воды отщепляется от одной молекулы спирта. Данный тип дегидратации требует несколько более жестких условий проведения, заключающихся в необходимости использования заметно более сильного нагревания по сравнению с межмолекулярной дегидратацией. При этом из одной молекулы спирта образуется одна молекула алкена и одна молекула воды:
Поскольку молекула метанола содержит только один атом углерода, для него невозможна внутримолекулярная дегидратация. При дегидратации метанола возможно образование только простого эфира (CH3-O-CH3).
Нужно четко усвоить тот факт, что в случае дегидратации несимметричных спиртов внутримолекулярное отщепление воды будет протекать в соответствии с правилом Зайцева, т.е. водород будет отщепляться от наименее гидрированного атома углерода:
Дегидрирование спиртов
а) Дегидрирование первичных спиртов при нагревании в присутствии металлической меди приводит к образованию альдегидов:
б) В случае вторичных спиртов аналогичные условия приведут у образованию кетонов:
в) Третичные спирты в аналогичную реакцию не вступают, т.е. дегидрированию не подвергаются.
Реакции окисления
Горение
Спирты легко вступают в реакцию горения. При этом образуется большое количество тепла:
Неполное окисление
Неполное окисление первичных спиртов может приводить к образованию альдегидов и карбоновых кислот.
В случае неполного окисления вторичных спиртов возможно образование только кетонов.
Неполное окисление спиртов возможно при действии на них различных окислителей, например, таких, как кислород воздуха в присутствии катализаторов (металлическая медь), перманганат калия, дихромат калия и т.д.
При этом из первичных спиртов могут быть получены альдегиды. Как можно заметить, окисление спиртов до альдегидов, по сути, приводит к тем же органическим продуктам, что и дегидрирование:
Следует отметить, что при использовании таких окислителей, как перманганат калия и дихромат калия в кислой среде возможно более глубокое окисление спиртов, а именно до карбоновых кислот. В частности, это проявляется при использовании избытка окислителя при нагревании. Вторичные спирты могут в этих условиях окислиться только до кетонов.
ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫ
Замещение атомов водорода гидроксильных групп
Многоатомные спирты так же, как и одноатомные реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от пленки Al2O3); при этом может заместиться разное число атомов водорода гидроксильных групп в молекуле спирта:
2. Поскольку в молекулах многоатомных спиртов содержится несколько гидроксильных групп, они оказывают влияние друг на друга за счет отрицательного индуктивного эффекта. В частности, это приводит к ослаблению связи О-Н и повышению кислотных свойств гидроксильных групп.
Большая кислотность многоатомных спиртов проявляется в том, что многоатомные спирты, в отличие от одноатомных, реагируют с некоторым гидроксидами тяжелых металлов. Например, нужно запомнить тот факт, что свежеосажденный гидроксид меди реагирует с многоатомными спиртами с образованием ярко-синего раствора комплексного соединения.
Так, взаимодействие глицерина со свежеосажденными гидроксидом меди приводит к образованию ярко-синего раствора глицерата меди:
Данная реакция является качественной на многоатомные спирты. Для сдачи ЕГЭ достаточно знать признаки этой реакции, а само уравнение взаимодействия уметь записывать необязательно.
3. Так же, как и одноатомные спирты, многоатомные могут вступать в реакцию этерификации, т.е. реагируют с органическими и кислородсодержащими неорганическими кислотами с образованием сложных эфиров. Данная реакция катализируется сильными неорганическими кислотами и является обратимой. В связи с этим при осуществлении реакции этерификации образующийся сложный эфир отгоняют из реакционной смеси, чтобы сместить равновесие вправо по принципу Ле Шателье:
Если в реакцию с глицерином вступают карбоновые кислоты с большим числом атомов углерода в углеводородном радикале, получающиеся в результате такой реакции, сложные эфиры называют жирами.
В случае этерификации спиртов азотной кислотой используют так называемую нитрующую смесь, представляющую собой смесь концентрированных азотной и серной кислот. Реакцию проводят при постоянном охлаждении:
Сложный эфир глицерина и азотной кислоты, называемый тринитроглицерином, является взрывчатым веществом. Кроме того, 1%-ный раствор данного вещества в спирте обладает мощным сосудорасширяющим действием, что используется при медицинских показаниях для предотвращения приступа инсульта или инфаркта.
Замещение гидроксильных групп
Реакции данного типа протекают по механизму нуклеофильного замещения. К взаимодействиям такого рода относится реакция гликолей с галогеноводородами.
Так, например, реакция этиленгликоля с бромоводородом протекает с последовательным замещением гидроксильных групп на атомы галогена:
Химические свойства фенолов
Как уже было сказано в самом начале данной главы, химические свойства фенолов заметно отличаются от химических свойств спиртов. Связано это с тем, что одна из неподеленных электронных пар атома кислорода в гидроксильной группе сопряжена с π-системой сопряженных связей ароматического кольца.
Реакции с участием гидроксильной группы
Кислотные свойства
Фенолы являются более сильными кислотами, чем спирты, и в водном растворе в очень небольшой степени диссоциированы:
Большая кислотность фенолов по сравнению со спиртами в плане химических свойств выражается в том, что фенолы, в отличие от спиртов, способны реагировать со щелочами:
Однако, кислотные свойства фенола выражены слабее, чем даже у одной из самых слабых неорганических кислот – угольной. Так, в частности, углекислый газ, при пропускании его через водный раствор фенолятов щелочных металлов, вытесняет из последних свободный фенол как еще более слабую, чем угольная, кислоту:
Очевидно, что любой другой более сильной кислотой фенол также будет вытесняться из фенолятов:
3) Фенолы являются более сильными кислотами, чем спирты, а спирты при этом реагируют с щелочными и щелочноземельными металлами. В связи с этим очевидно, что и фенолы будут реагировать с указанными металлами. Единственное, что в отличие от спиртов, реакция фенолов с активными металлами требует нагревания, так как и фенолы, и металлы являются твердыми веществами:
Реакции замещения в ароматическом ядре
Гидроксильная группа является заместителем первого рода, и это значит, что она облегчает протекание реакций замещения в орто- и пара-положениях по отношению к себе. Реакции с фенолом протекают в намного более мягких условиях по сравнению с бензолом.
Галогенирование
Реакция с бромом не требует каких-либо особых условий. При смешении бромной воды с раствором фенола мгновенно образуется белый осадок 2,4,6-трибромфенола:
Нитрование
При действии на фенол смеси концентрированных азотной и серной кислот (нитрующей смеси) образуется 2,4,6-тринитрофенол – кристаллическое взрывчатое вещество желтого цвета:
Реакции присоединения
Поскольку фенолы являются ненасыщенными соединениями, возможно их гидрирование в присутствии катализаторов до соответствующих спиртов:

Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные группы (—OH).
По характеру радикала спирты классифицируют на насыщенные и ненасыщенные, по числу гидроксильных групп — на одноатомные, двухатомные, трехатомные и многоатомные.
В зависимости от того, к какому атому углерода присоединена гидроксильная группа, спирты делят на первичные, вторичные и третичные.
Для спиртов характерна изомерия углеродного скелета, изомерия положения гидроксильной группы, а также межклассовая изомерия с простыми эфирами.
Способы получения спиртов. Существует много способов получения предельных одноатомных спиртов.
1. Гидролиз моногалогенпроизводных алканов:

Эта реакция может протекать по различным механизмам в зависимости от строения исходного галоидного алкила и условий реакции.
2. Гидратация алкенов. Эта реакция идет в присутствии катализаторов, например серной или фосфорной кислоты, оксида алюминия. Направление реакции определяется правилом Марковникова:

3. Восстановление альдегидов и кетонов. В присутствии катализаторов альдегиды при восстановлении водородом переходят в первичные спирты, а кетоны — во вторичные:

В жидком состоянии молекулы спиртов ассоциированы за счет образования водородных связей:

Метиловый спирт получают из синтез-газа, а этиловый — при спиртовом брожении глюкозы:

Химические свойства спиртов определяются наличием реакционноспособной гидроксильной группы и строением связанного с ней углеводородного радикала. Ниже приведены некоторые характерные для спиртов реакции:

Ряд реакционной способности спиртов в реакциях со щелочными металлами: первичные > вторичные > третичные.
Образовавшиеся алкоголяты под действием воды разлагаются на спирт и соответствующую щелочь:

Образование простых эфиров:

Образование галоидных алкилов:

Внутримолекулярная дегидратация спиртов. Реакция идет в присутствии катализатора — серной кислоты (температура 170 °С) или в присутствии Al2O3 при температуре 400 °С. Отщепление атома водорода подчиняется правилу Зайцева: атом водорода отщепляется от наименее гидрогенизированного атома углерода. Примеры:

Реакции окисления. Спирты окисляются под действием сильных окислителей. Направление реакции зависит от природы окислителя и температуры реакции. Оксид меди при нагревании окисляет спирты до альдегидов. Бихромат калия или перманганат калия в кислой среде на холоде окисляет первичные спирты до альдегидов, а при нагревании — до карбоновых кислот:

Вторичные спирты окисляются до кетонов, третичные спирты при обычных условиях не окисляются:

Метиловый спирт окисляется до углекислого газа:

Алкандиолами, или гликолями, называют двухатомные спирты, которые отвечают общей формуле CnH2n(OH)2 и содержат в своем составе две гидроксильные группы, расположенные при различных углеродных атомах. Для двухатомных спиртов возможна изомерия углеродного скелета и изомерия положения гидроксильных групп. Родоначальником двухатомных спиртов является этиленгликоль HOCH2—CH2OH.
Диолы получают водным или щелочным гидролизом дигалоидалканов или контролируемым окислением алкенов перманганатом калия в водном растворе.

Этиленгликоль получают гидратацией окиси этилена. Его химические свойства:

Качественная реакция для многоатомных спиртов — взаимодействие со свежеосажденным гидроксидом меди (II) с образованием комплексного соединения — гликолята меди, которое имеет характерную голубую окраску:

Трехатомные спирты, или триолы, отвечают формуле CnH2n–1(OH)3 и содержат в своем составе три гидроксильные группы, связанные с алифатическим углеводородным радикалом. Для трехатомных спиртов возможна изомерия углеродной цепи и изомерия положения гидроксильных групп. Их родоначальником является глицерин HOCH2—CH(OH)—CH2OH. Получают глицерин омылением растительных или животных жиров в присутствии щелочных или кислотных катализаторов. Его химические свойства:


Фенолами называют соединения, у которых гидроксильная группа связана непосредственно с бензольным кольцом. По числу гидроксильных групп в кольце различают одно-, двух- и трехатомные фенолы. Для фенолов характерны изомерия относительного положения радикалов в кольце, структурная изомерия заместителей и межклассовая изомерия с ароматическими спиртами. Методы получения фенола и его гомологов. Фенол и его метильные гомологи — о-, м- и п-крезолы в значительном количестве встречаются в каменноугольной смоле. Фенол и ацетон получают в промышленности по методу Сергеева — Кружалова: бензол в присутствии безводного треххлористого алюминия реагирует с пропиленом с образованием изопропилбензола. При окислении этого соединения кислородом при температуре 110—130 °С образуется неустойчивое соединение — гидроперекись изопропилбензола. Под действием серной кислоты оно распадается на фенол и ацетон:

Химические свойства фенолов:


Реакции замещения (в зависимости от соотношения межд у реагентами образуются следующие продукты):
Спирты - кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда - метанол - CH3OH. Общая формула их гомологического ряда - CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH - гликоли), трехатомными (3 группы OH - глицерины) и т.д.

Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).

Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса "ол" к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.

Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.

Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) - алкены, а в реакциях с водным раствором щелочи образуются спирты.

Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.

В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.

Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.

В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы - образуется двухатомный спирт (гликоль).

Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии - кислотные.
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.

Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.

В результате реакций спиртов с кислотами образуются различные эфиры.

Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t 140°С) механизм дегидратации становится внутримолекулярный - образуются алкены.
- Диметиловый эфир - CH3-O-CH3
- Метилэтиловый эфир - CH3-O-C2H5
- Диэтиловый эфир - C2H5-O-C2H5

Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
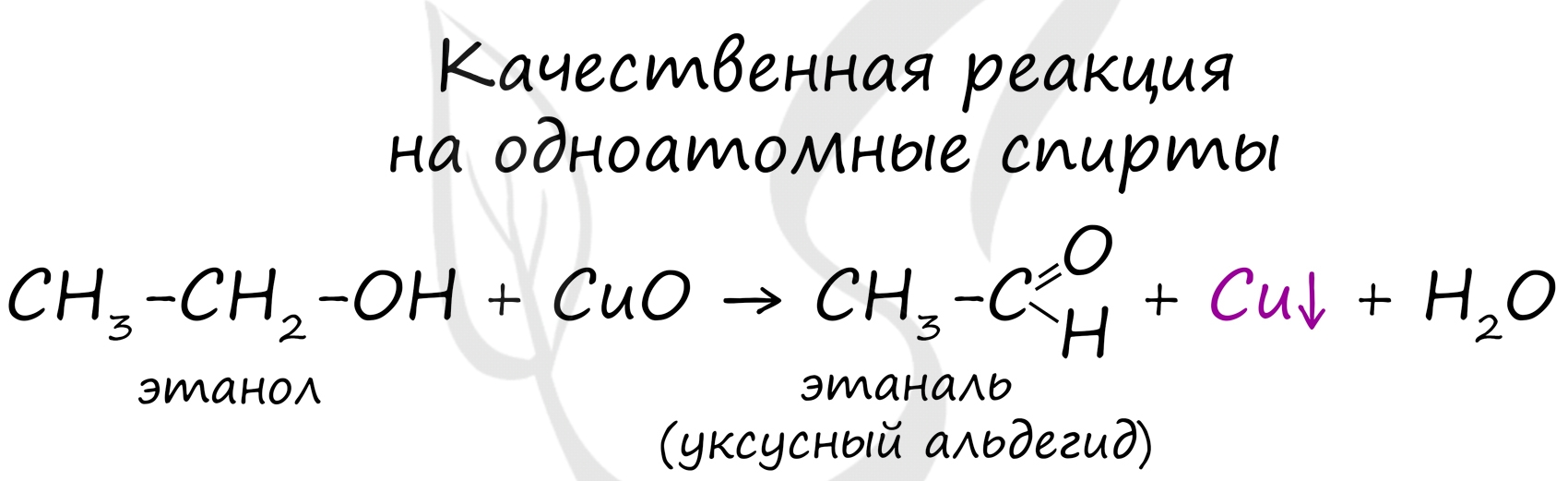
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.

Первичные спирты окисляются до альдегидов, а вторичные - до кетонов. Альдегиды могут быть окислены далее - до карбоновых кислот, в отличие от кетонов, которые являются "тупиковой ветвью развития" и могут только снова стать вторичными спиртами.

Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.

Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

