Приготовление толстой капли крови на малярийный плазмодий алгоритм кратко
Обновлено: 04.07.2024
Малярия (лихорадка, болотная лихорадка) - острая или хроническая эндемическая трансмиссивная болезнь, характеризующаяся приступами лихорадки, увеличением печени и селезенки, гемолитической анемией, рецидивирующим течением. Заболевание у людей вызывают 4 вида малярийных плазмодиев: 1. Plasmodium vivax - возбудитель трехдневной формы малярии; 2. Plasmodium ovale - вызывает трехдневный овале-малярии; 3. Plasmodium malariae - возбудитель четырехдневной формы малярии; 4. Plasmodium falciparum - вызывает тропическую малярию. Заболевание через укусы передают самки комаров рода Anopheles. Кроме того, определенное эпидемиологическое значение имеет трансфузионная малярия, которая возникает после переливания крови от донора паразитоносителей или при манипуляции инструментами, загрязненными зараженной кровью. В процессе своей жизнедеятельности плазмодии проходят сложный цикл развития со сменой хозяина. Он состоит из двух фаз: половой (спорогонии), которая проходит в теле самки комара, и бесполой (шизогонии), что происходит в организме человека. Сначала плазмодии проникают в клетки печени (тканевая шизогония), позже - в эритроциты (эритроцитарная шизогония). Успешная лабораторная диагностика малярии возможна именно в период эритроцитарной шизогонии.
Микроскопическое исследование толстой капли и мазков крови
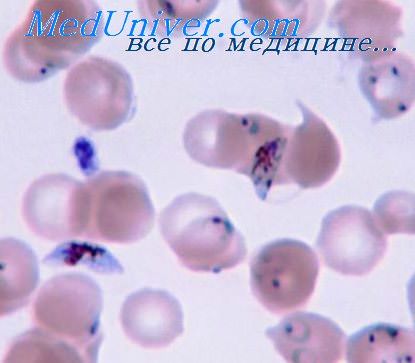
Микроскопическое исследование толстой капли и мазков крови является наиболее распространенным и важным методом диагностики заболевания. Кровь от больных надо брать до начала лечения и несколько раз повторять во время лечения. Плазмодиев в крови больше на высоте лихорадки, особенно после 2-3-го приступа, хотя их можно обнаружить и в период апирексии. Для исследования крови от каждого больного после прокола мякоти пальца готовят 4-8 препаратов (мазки и толстые капли), которые окрашивают по методу Романовского-Гимза. Ядра паразитов окрашиваются в красный, а цитоплазма - в сине-голубой цвет. При наличии возбудителей в эритроцитах обнаруживают различные стадии их развития: 1) кольцевидные трофозоиты возникают после их проникновения в эритроциты; узкий ободок цитоплазмы окружает вакуоль, которая выжимает ядро к периферии и паразит по форме напоминает кольцо (кольцо) 2) амебовидную трофозоиты (взрослые формы) 3) зрелые трофозоиты (шизонты), которые делятся на 6-24 еротроцитарних мерозоитов. При разрушении эритроцитов они попадают в плазму крови. Часть мерозоитов в эритроцитах превращается в незрелые мужские и женские половые клетки - микро-и макрогаметоциты. Для определения вида малярийных плазмодиев необходимо уметь дифференцировать их морфологические особенности. Сначала просматривают толстые капли. Если у них плазмодиев не проявляют, тонкие мазки крови вообще не исследуют. И только при наличии паразитов в толстой капле, особенности их строения изучают в мазках.
Современная диагностика малярии. Выявление малярийных плазмодиев
В распознавании малярии важное значение имеют данные эпидемиологического анамнеза (уровень эндемии и сезон передачи возбудителей в данной местности, возникновение болезни на протяжении 3 лет после пребывания в эндемическом очаге или на протяжении 3 мес после гемотрансфузии или внутривенных инфузий и др.) и выявление характерных клинико-лабораторных признаков (высокая и часто приступообразная лихорадка, сплено- и гепатомегалия, анемия и панцитопения).
Решающее значение в диагностике болезни имеет обнаружение плазмодиев в препаратах крови — толстой капле и мазке. Исследование крови на малярию проводят при первом подозрении на эту болезнь, независимо от температуры тела в момент забора крови.
Для паразитологического исследования используют капиллярную кровь, взятую из пальца, или венозную кровь. Микроскопию препаратов крови, окрашенных по Романовскому-Giemsa, проводят с использованием иммерсионной системы (окуляр 7х, объектив 90х). В каждом препарате изучают не менее 100 полей зрения (0,25 мкл крови), даже в тех случаях когда паразиты выявляются при исследовании меньшей площади препарата, что способствует более четкому изучению эритроцитарных стадий паразитов и выявлению случаев mixt-инвазии.
Ввиду большого объема крови, изучаемого в толстой капли крови, ее исследование позволяет быстрее обнаружить малярийные паразиты и определить интенсивность паразитемии. Изучение мазка крови помогает более точно определить видовую принадлежность паразитов и стадии их эритроцитарного развития. При определении вида возбудителя используют морфологические признаки плазмодиев и пораженных эритроцитов.
Важное клиническое значение имеет не только видовая характеристика возбудителя, но и определение стадий их развития и численности паразитов. Это особенно актуально для диагностики P. falciparum-малярии, при которой наличие в крови зрелых трофозоитов и шизонтов, а также большая интенсивность паразитемии являются прогностически неблагоприятными. Интенсивность паразитемии в толстой капли крови определяют по числу паразитов в поле зрения: 1-100 плазмодиев в 10 полях зрения соответствуют 5-50 паразитам в 1 мкл крови (+); 10-100 плазмодиев в 10 полях зрения— 50-500 паразитов в 1 мкл крови (++); 1-10 плазмодиев в 1 поле зрения — 500-5000 паразитов в 1 мкл крови (+++); 10-100 плазмодиев в 1 поле зрения — 5000-50 000 паразитов в 1 мкл крови (++++), более 100 паразитов в 1 поле зрения — более 50 000 паразитов в 1 мкл крови (+++++); а также по соотношению числа паразитов и лейкоцитов в препарате с последующим перерасчетом на число лейкоцитов в 1 мкл крови. Интенсивность паразитемии может быть вычислена и по количеству паразитов, приходящихся на 100 эритроцитов (в 10 полях зреня) При паразитемии P. falciparum более 100 000 плазмодиев в 1 мкл или поражении более 5% эритроцитов прогноз может быть неблагоприятным у 7-20% больных, а при паразитемии более 500 000 плазмодиев в 1 мкл крови или поражении 10% эритроцитов и более летальные исходы развиваются в 65% случаев. При Р. vivax-малярии редко поражается более 2% эритроцитов.
Определенное диагностическое значение имеют выявляемые в гемограмме признаки анемии (анизопойкилоцитоз, ретикулоцитоз и др.), лейкопения и относительный лимфомоноцитоз.
Серодиагностика малярии включает использование НРИФ, РИФ, ИФА, РИГА и др. и имеет наибольшее значение в неэндемических районах. Обнаружение в НРИФ антител к P. falciparum в титре 1:80 и более свидетельствует о свежей инвазии.
Дифференциальный диагноз малярии проводят с гриппом и другими острыми респираторными вирусными инфекциями, острыми кишечными инфекциями, лептоспирозом, желтой лихорадкой, злокачественными формами вирусных гепатитов, тифо-паратифозными заболеваниями, бруцеллезом, сепсисом, геморрагическими лихорадками инфекциями мочевыделительной и гепатобилиарной систем, заболеваниями системы крови.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Основной метод лабораторной диагностики малярии – обнаружение эритроцитарных паразитов в толстой капле или мазке крови. В практической работе исследуют преимущественно толстые капли, так как за один и тот же промежуток времени в толстой капле можно просмотреть в 30- 50 раз больший объем крови, чем в мазке, а следовательно, и количество плазмодиев в ней больше. К мазку обращаются лишь в тех случаях, когда видовую принадлежность найденных паразитов по толстой капле установить не удается. Для выявления возбудителей малярии кровь берут при первом же подозрении на эту инфекцию независимо от температуры тела (лучше всего во время лихорадки или сразу после озноба), поскольку паразиты циркулируют в крови и в интервале между приступами.
Предметные стекла, на которых готовят препараты, должны быть хорошо вымыты и обезжирены. Кровь берется с соблюдением правил асептики. Кожу пальца протирают спиртом и прокалывают стерильной иглой-копьем или толстой инъекционной иглой. Если кровь из мякоти пальца вытекает плохо, то больного просят сделать несколько энергичных движении рукой, кистью и слегка массируют палец. Первую выступившую каплю крови вытирают сухой ватой, затем палец поворачивают проколом вниз и ко второй капле прикасаются предметным стеклом.
Тонкие мазки крови приготавливают по методике, общепринятой для гематологических исследований. Мазок не должен доходить ни до конца, ни до краев предметного стекла. Поэтому капля крови должна быть диаметром не более 2–3 мм. Предметное шлифованное стекло, которым делается мазок, должно быть уже стекла, на которое наносят мазок. Для этого углы шлифованного стекла обламывают пинцетом. В целях приготовления мазка шлифованное стекло славят перед каплей крови под углом 45° и продвигают вперед до соприкосновения с ней. Когда кровь равномерно распределится между обоими стеклами, быстрым дви-жением делают мазок.
Для приготовления толстой капли крови на предметное стекло наносят каплю крови диаметром около 5 мм. Эту каплю размазывают иглой или углом предметного стекла в диск диаметром 10–15 мм. Толщина капли должна быть такой, чтобы сквозь нее можно было читать газетный шрифт Мазки не должны быть толстыми, поскольку после высыхания они растрескиваются и отстают от стекла. Обычно на стекло наносят 2–3 капли на некотором расстоянии одна от другой. Взятые капли должны быть отмечены. На обратной стороне стекла восковым карандашом указывается фамилия больного или соответствующий регистрационный номер.
Очень удобно наносить толстую каплю на влажный толстый мазок крови. В этом случае капля самостоятельно растекается в правильный диск. Простым карандашом на мазке делается маркировка препарата Такой препарат удобен еще и тем, что в мазке довольно хорошо сохраняется часть пораженных эритроцитов, а это важно для уточнения вида паразита. Преимущество данного метода в том, что капля, нанесенная на мазок, удерживается более прочно, чем нанесенная непосредственно на стекло.
Приготовленные толстые капли высушивают при комнатной температуре не менее 2–3 ч без какого-либо дополнительного подогревания во избежание фиксации крови. После высыхания капли на нее наливают краску Романовского- Гимза. разведенную как обычно (2 капли краски на 1 мл дистиллированной воды). Продолжительность окраски в среднем составляет 30- 45 мин. Окрашенную каплю осторожно ополаскивают водопроводной водой (сильная струя может смыть каплю) и просушивают в вертикальном положении. Фильтровальной бумагой ее высушивать нельзя. При окраске капли в водных растворах красок происходит выщелачивание гемоглобина из эритроцитов, вследствие чего в окрашенной капле эритроциты уже не видны. Из форменных элементов сохраняются лейкоциты и тромбоциты.
Мазки фиксируют, помещая их на 3 мин в метиловый или на 10 мин в 96% этиловый спирт. Зафиксированные препараты высушивают на воздухе, защищая от пыли и мух. Потом препараты помещают в специальный контейнер и окрашивают азур-эозиновым красителем по Романовскому – Гимза на протяжении 20- 30 мин.
По истечении этого срока контейнер подставляют под слабую струю воды и промывают. После того как из контейнера польется неокрашенная вода, остатки ее сливают и промывают еще раз. Не рекомендуется сначала сливать краску, а затем промывать мазок водой, поскольку пленка, образовавшаяся на поверхности красителя, может попасть на препараты и оказаться причиной Диагностической ошибки. Капля на мазке окрашивается так же, как толстая капля.
Промытые препараты высушивают и исследуют под микроскопом. В зараженных эритроцитах видны плазмодии малярии с голубой цитоплазмой и ярко-красным ядром. Нахождение плазмодиев малярии в крови больного является неоспоримым доказательством болезни.
1. Установить доверительные отношения с пациентом, объяснить цель и ход исследования, получить согласие на проведение манипуляции.
2. Пациента усадить.
Техника выполнения:
1. Выполнить гигиеническую обработку рук, надеть перчатки.
2. Обработать место прокола стерильным ватным шариком, смоченным в спирте.
3. Проколоть иглой – копьём кожу
четвертого пальца или мочки уха.
4. Стереть первую каплю крови сухим ватным шариком.
5. К следующей капле крови прикасаются стеклом в 2 местах на небольшом расстоянии друг от друга, не касаясь пальца.
6. Затем, углом другого стекла или стеклянной палочкой обе капли соединяют и размазывают до диаметра 10-15 мм.
Последующий уход: не требуется.
Возможные осложнения: нет.
1. Забор крови желательно проводить в период повышения температуры в начале заболевания и на фоне нормальной температуры в конце заболевания для контроля эффективности лечения.
2. Обычно для каждого пациента готовят 2-3 толстые капли одновременно и 1 мазок крови.
2.Если при взятии крови, кровь идёт
плохо, руку опустить вниз.
Выдавливать кровь из пальца
нельзя, т.к. может выступать лимфа,
а это повлияет на результаты
- объяснить пациенту значение исследования.
- предупредить пациента, что будет небольшой укол. Попросить потерпеть, не напрягать кисть.
Забор рвотных масс на посев
Практический аспект
Этико-деонтологический аспект
Цель: диагностическая.
Показания: пищевые токсикоинфекции, холера.
Противопоказания: нет.
Подготовить:
1.Широкогорлые стерильные флаконы (банки).
2. металлическую ложку или пипетку
3. Плотную бумагу или целлофан.
4. Клеёнчатый фартук.
Подготовка пациента: не требуется.
Техника выполнения:
1. Выполнить гигиеническую обработку рук, надеть перчатки.
2. Рвотные массы собрать в стерильные банки или широкогорлые флаконы в количестве 50-100 (мл)
2. Отверстие банки или флакона
Последующий уход: если у пациента продолжается рвота, оказать помощь, после прекращения рвоты пациенту дать прополоскать рот, умыть, переодеть.
Возможные осложнения: распространение инфекции.
Примечания: аналогичным способом можно собрать промывные воды желудка, но промывание следует производить кипяченой водой без применения антисептических
средств, обладающих губительным действием на микробы.
- рассказать пациенту о значении исследования.
- пациента успокоить, следить за его состоянием.
- забор производится специальной металлической ложкой или пипеткой с резиновым грушевидным баллончиком на конце.
Забор крови на серологическое исследование
Практический аспект
Этико-деонтологический аспект
Цель: диагностическая
Показания: подозрение на брюшной тиф, вирусные гепатиты, ВИЧ-инфекцию и другие инфекционные заболевания.
Противопоказания: нет.
Подготовить:
1.Центрифужные пробирки в штативе.
2.Инъекционную иглу с широким просветом.
3.Стерильные марлевые шарики, салфетки, бинт.
6. Стерильный лоток
7. Флакон с 70% спиртом
8. Венозный жгут
9. Клеёнчатую подушку, обёрнутую пелёнкой.
10.Ёмкость с дезинфицирующим раствором.
11.Лоток для использованного материала.
Подготовка пациента:
1.Установить доверительные отношения с пациентом.
2.Объяснить пациенту цель и ход процедуры, получить согласие.
3.Помочь пациенту занять удобное положение (сидя или лёжа).
4.Под локоть пациента подложить клеёнчатую подушку, обёрнутую стерильной салфеткой или пелёнкой.
Техника выполнения:
1.Обработать руки на гигиеническом уровне, надеть стерильные перчатки.
2.Подготовить стерильный лоток со стерильной иглой для венепункции и стерильной салфеткой, штатив с центрифужными пробирками.
3.Осмотреть и пропальпировать вену.
4.Исследовать пульс на лучевой артерии.
5.Наложить жгут на плечо пациента, обёрнутое стерильной пелёнкой.
6.Повторно исследовать пульс.
7.Попросить пациента работать кулаком.
8.Дважды обработать кожу внутренней поверхности локтевого сгиба спиртом в направлении от периферии к центру (сначала большую поверхность, затем только место венепункции).
9.Ниже места предстоящей венепункции положить стерильную марлевую салфетку.
10.В правую руку взять иглу для венепункции, попросить пациента зажать кулак.
11.Большим пальцем левой руки зафиксировать вену, правой рукой выполнить венепункцию, левой рукой подставить под канюлю иглы пробирку и набрать необходимое количество крови.
12. Поставить пробирку в штатив.
13. Попросить пациента разжать кулак, снять жгут и приложив к месту венепункции стерильный марлевый шарик, смоченный спиртом, извлечь иглу.
14.Попросить пациента согнуть руку в локтевом суставе или наложить давящую повязку.
Последующий уход:
1.Весь использованный инструментарий подвергнуть дезинфекции.
3.Вымыть и высушить руки.
4.Оформить направление в лабораторию. Доставить пробирку с кровью в лабораторию.
Возможные осложнения: гематома, инфицирование.
1.В дальнейшем, кровь
центрифугируется, из неё готовится
сыворотка и проводится реакция агглютинации с готовыми диагностикумами различных заболеваний.
2. Недостаток метода в том, что антитела появляются на 5-7 день болезни, преимущества - точный и используется для контроля за эффективностью лечения.
3.При заборе крови на ВИЧ – инфекцию используется шприц- контейнер.
– выявление специфических антител к возбудителю заболевания или антигенов микроорганизма .
Читайте также:

