Гены не кодирующие белки кратко
Обновлено: 02.07.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Аллели – (от греч. allelon друг друга, взаимно) различные формы одного и того же гена, расположенные в одинаковых участках (локусах) гомологичных (парных) хромосом, контролирующие один и тот же белок. Все гены соматических клеток, за исключением генов, расположенных в половых хромосомах, представлены двумя аллелями, один из которых унаследован от отца, а другой – от матери. Различия между аллелями обусловлены мутациями.
Аутосомно-доминантный тип наследования – мутантный аллель (вариант) доминирует над нормальным аллелем (вариантом), т.е. проявляется как в гомозиготном, так и в гетерозиготном состоянии; патологическая наследственность прослеживается в родословной "по вертикали"; по крайней мере, один из родителей имеет проявление данной мутации. При этом мутантный ген расположен в аутосоме (неполовой хромосоме) и наследование не сцеплено с полом.
Аутосомно-рецессивный тип наследования – нормальный аллель (вариант) подавляет проявление мутантного аллеля (варианта), т.е. мутация может проявиться, только находясь в гомозиготном состоянии. При этом мутантный ген расположен в аутосоме (неполовой хромосоме) и наследование не сцеплено с полом.
Ген – элементарная единица наследственности, наименьший неделимый элемент наследственного материала, который может быть передан от родителей потомству как целое и который определяет признаки, свойства или физиологическую функцию организма. На молекулярном уровне - это участок молекулы ДНК, кодирующий первичную структуру белков и РНК.
Генетический вариант полиморфизма – в широком смысле аналогичен понятию аллеля; здесь, в узком смысле – одна из двух разновидностей гена, различающихся по одному генетическому полиморфизму. Генетические варианты полиморфизма обычно отличаются аминокислотной последовательностью белкового продукта гена или уровнем экспрессии гена.
Генотип – (здесь, в узком смысле) сочетание генетических вариантов (аллелей), расположенных на гомологичных хромосомах.
Гетерозиготный – содержащий разные аллели (генетические варианты) в соответствующих локусах гомологичных хромосом.
Гомозиготный – содержащий одинаковые аллели (генетические варианты) в соответствующих локусах гомологичных хромосом.
Гомологичные хромосомы – парные хромосомы из диплоидного набора, одинаковые по форме, размерам и набору генов.
Делеция – утрата в результате мутации сегмента ДНК размером от одного нуклеотида до субхромосомного фрагмента, включающего несколько генов. В случае генных полиморфизмов рассматриваются делеции, ограниченные одним геном.
Диплоидный набор – набор хромосом в соматических клетках организма, который содержит два гомологичных набора хромосом, из которых один передается от одного родителя, а второй - от другого.
Доминантный аллель – аллель, проявляющийся в фенотипе гетерозиготных особей.
Инсерция – вставка сегмента ДНК размерами от одного нуклеотида до субхромосомного фрагмента, включающего несколько генов. В случае генных полиморфизмов рассматриваются инсерции, ограниченные одним геном.
Интрон – область гена, разделяющая экзоны и не несущая информации об аминокислотной последовательности белкового продукта.
Миссенс-мутация - мутация, приводящая к подстановке несоответствующей аминокислоты в полипептидную цепь.
Мультифакториальные заболевания – заболевания, вызываемые взаимодействием множества наследственных и внешних факторов, например, ишемическая болезнь сердца, инфаркт миокарда (ИМ), инсульт, некоторые формы рака, психические заболевания и др.
Мутантный вариант полиморфизма – вариант полиморфизма, возникший вследствие мутации из своего предшественника – нормального варианта.
Мутация – изменение нуклеотидной последовательности ДНК. Чаще всего мутации представляют собой однонуклеотидные замены – миссенс-мутации. Влияние мутации на функцию гена может варьировать от ее полного нарушения до незначительного влияния или отсутствия влияния.
Нормальный вариант полиморфизма – наиболее распространенный в популяции вариант полиморфизма, который является предшественником других вариантов, возникающих вследствие мутаций.
Нуклеотид – структурная единица нуклеиновых кислот. В состав ДНК входят 4 нуклеотида: аденин – А, тимин – Т, гуанин – G, цитозин – С.
Пенетрантность – количественный показатель фенотипической изменчивости проявления гена. Измеряется (обычно в %) отношением числа особей, у которых данный ген проявился в фенотипе, к общему числу особей, в генотипе которых этот ген присутствует в необходимом для его проявления состоянии (гомозиготном – в случае рецессивных генов или гетерозиготном – в случае доминантных генов). Проявление гена у 100% особей с соответствующим генотипом называется полной пенетрантностью, в остальных случаях – неполной пенетрантностью. Неполная пенетрантность свойственна проявлению генов, связанных с мультифакториальными заболеваниями: болезнь развивается только у части лиц, в генотипе которых присутствует аномальный ген; у остальных же наследственное предрасположение к болезни остаётся нереализованным.
Полиморфизм гена – многообразие нуклеотидных последовательностей гена, в том числе его аллельных форм.
Прогностический – понятие, характеризующее заключение о предстоящем развитии и исходе, основанное на специальном исследовании.
Промотор – участок молекулы ДНК, к которому присоединяются молекулы РНК-полимеразы, что сопровождается инициацией транскрипции соответствующих генов; как правило, промотор расположен на операторном конце оперона; каждый ген (или оперон) имеет свой промотор, контролирующий его транскрипцию.
Рецессивный аллель – аллель, не проявляющийся в фенотипе гетерозиготных особей.
Фенотип – особенности строения и жизнедеятельности организма, обусловленные взаимодействием его генотипа с условиями среды.
Хромосома – составной элемент клеточного ядра, являющийся носителем генов. В основе хромосомы лежит линейная молекула ДНК
Экзон – фрагмент гена, кодирующий аминокислотную последовательность белкового продукта данного гена.
Экспрессия гена – перенос генетической информации от ДНК через РНК к полипептидам и белкам в определенных типах клеток организма.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Геном человека. Один ген - один белок - справедливо ли?
Появившись на свет, мы очень быстро узнаем, что все люди разные. Для большинства из нас эта разница заключена в чем-то простом, например цвете волос или глаз. Для других эта разница приобретает большую выраженность, принимая форму врожденных дефектов или синдромов. Накапливаясь, они приводят к росту заболеваемости и смертности. В канадском исследовании было показано, что около 12% людей имеют проблемы со здоровьем, вызванные или связанные с генетическими заболеваниями, проявившимися в период от рождения до раннего зрелого возраста. Генетика изучает признаки и наследственные различия индивидуумов.
Как показал еще Грегор Мендель, мы способны уяснить принципы наследования и без знаний о ДНК и ее организации в геноме. Однако традиционное понимание медицины и медицинской генетики сейчас стоит на пороге революционного пересмотра. В этой технологической революции геномной медицины мы тем не менее все еще нуждаемся в понимании фундаментальных принципов генетики и наследственности.
Геномика — наука о наборе генов живых организмов, их функциях и взаимодействии между собой и с окружающей их средой, изучающая, кроме того, как генетическое разнообразие соотносится с риском развития тех или иных заболеваний и с эффективностью того или иного метода лечения (фармакогеномика). Усилия по выделению и картированию генов привели к созданию функциональной геномики, которая пытается выяснить функции того или иного гена, генную регуляцию и генное взаимодействие.
Знания и технологии, полученные с помощью геномики, оказывают и будут оказывать столь же существенное влияние на репродуктивную медицину, как и на другие ее разделы. Акушеры и гинекологи должны будут не только обладать знаниями в области генетики и принципов наследования, но и иметь представление о геномике и ее технологиях, а также о том, каким образом они могут повлиять на риск, диагностику и лечение патологических состояний. Врачи будут способны не только использовать традиционную парадигму диагностики и лечения заболеваний, но и распознавать и лечить геномные заболевания еще до их манифестации.
Они должны быть готовыми столкнуться с этическими, юридическими и социальными аспектами такого революционного подхода. И хотя эра геномной медицины принесет новые инструменты индивидуализации риска заболеваний, эффективной профилактики и лечения, фундаментальными компонентами медицины все же останутся базовое обследование и сбор семейного анамнеза.
Более 10% генома составляют повторяющиеся последовательности ДНК, которые могут отвечать за структуру самих хромосом. Описано множество длинных и коротких разбросанных повторяющихся элементов, в том числе так называемое Alu-семейство. Alu-последовательности обнаружены в богатых генами регионах и, вероятно, играют роль в генетической рекомбинации.
Геном человека содержит более 3 млрд пар оснований, последовательность которых идентична на 99,9% у всех людей. Удивительно, но все разнообразие человечества построено всего лишь на 0,1% геномной последовательности. Однонуклеотидный полиморфизм — наиболее распространенный вариант ДНК в геноме, встречается с частотой около 1 на 10 млн. Однонуклеотидный полиморфизм — замещения одного основания, происходящие в среднем в 1 из 1250 нуклеотидов. Замена основания не приводит к изменению фенотипа; это явление обнаруживают приблизительно в 1% популяции.
Из-за своей повсеместной распространенности в человеческом геноме однонуклеотидный полиморфизм имеет большую ценность в определении изменений последовательностей, связанных с повышенным риском тех или иных заболеваний, с помощью традиционного анализа групп сцепления и популяционных исследований ассоциаций. Несмотря на то что однонуклеотидный полиморфизм, по-видимому, не влияет на кодирование белка, он может способствовать развитию некоторых заболеваний за счет присутствия в регуляторных регионах или интронах. Однонуклеотидный полиморфизм также может определять чувствительность заболевания к терапии, например в случае с полиморфизмом рецептора к ангиотензину II типа 1 и его ассоциации с застойной сердечной недостаточностью.

Обзор
Найти ответ на этот вопрос оказалось куда сложнее, чем кто-либо предполагал
Автор
Редактор

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Как же мало известно о генах! Первый раз я остро ощутила это, находясь на практике в лаборатории медицинской генетики Харбинского медицинского университета. Исследовательская группа, где я проходила стажировку, занималась изучением онкогена Sei-1, который индуцирует образование двухминутных хромосом (DM), что способствует развитию онкогенеза. Однако механизм образования онкогена Sei-1 остается неизвестным до сих пор. А ведь различные мутации генов являются причиной возникновения и других опасных заболеваний человека, помимо рака. Итак, в данной статье мы изложим некоторые соображения о том, почему мы все еще многое не знаем о генах, а также сформулируем наше мнение о том, сколько генов у человека.
Выявление полного списка генов необходимо для выяснения молекулярных механизмов возникновения и развития рака, шизофрении [3], деменции, а также многих других заболеваний человека. Секвенирование ДНК, выделенной из тканей больных, позволяет выявлять такие мутации, как нуклеотидные замены, делеции и вставки, ответственные за возникновение этих заболеваний.
Немного о РНК

Рисунок 2. Виды РНК
рисунок автора статьи
Регуляторные нкРНК очень широко представлены в организме, классифицируются в зависимости от размера и выполняют ряд важных функций (табл. 1).
Проблема терминологии
Ген любой участок хромосомной ДНК, который транскрибируется в функциональную молекулу РНК или сначала транскрибируется в РНК, а затем транслируется в функциональный белок.
Это определение включает как гены некодирующих РНК, так и белок-кодирующие гены, и позволяет определять все варианты альтернативного сплайсинга в одном локусе как варианты одного и того же гена. Это позволяет исключить псевдогены – нефункциональные остатки структурных генов, утратившие способность кодировать белок.
Результаты двух первых исследований свидетельствовали о наличии у человека 31 000 [2] и 26 588 белок-кодирующих генов [17], а в 2004 появилась полная последовательность генома человека [4], и авторы подсчитали, что полный каталог насчитывает 24 000 белок-кодирующих генов. Каталог человеческих генов Ensembl включает 22 287 белок-кодирующих генов и 34 214 транскриптов [18].
Секвенирование нового поколения (NGS)
Появление высокопроизводительных методов параллельного секвенирования (в ходе такого секвенирования миллионы фрагментов ДНК из одного образца секвенируются одновременно) или секвенирования нового (следующего) поколения (next-generation sequencing, NGS) [1] позволило значительно ускорить поиск функциональных участков генома [4]. Биотехнологические компании разработали и коммерциализировали различные платформы для NG-секвенирования, позволяющие секвенировать от 1 млн до десятков млрд коротких последовательностей (ридов, reads) длиной 50–600 нуклеотидов каждая. К наиболее популярным платформам относятся такие, как Illumina и IonTorrent, использующие амплификацию ДНК с помощью ПЦР [19], а также платформы одномолекулярного секвенирования, такие как Helicos Biosciences HeliScope, Pacific Biosciences SMRT (single molecule real-time sequencing), и нанопорового секвенирования Oxford Nanopore, осуществляющие секвенирование в реальном времени и позволяющие прочитывать значительно более длинные риды — до 10–60 тыс. нуклеотидов. Кроме того, изобретение секвенирования РНК (RNA-seq) в 2008 году, которое создавалось для количественного определения экспрессии генов, также способствовало обнаружению транскрибируемых последовательностей, как кодирующих, так и некодирующих РНК [20].
Благодаря NGS, базы данных днкРНК и других генов РНК (таких как микро-РНК) резко выросли за десятилетие, и текущие каталоги генов человека теперь содержат больше генов, кодирующих РНК, чем белки (табл. 2).
| Типы генов | Gencode | Ensembl | RefSeq | CHESS |
|---|---|---|---|---|
| Белок-кодирующие гены | 19 901 | 20 376 | 20 345 | 21 306 |
| Гены длинных некодирующих РНК | 15 779 | 14 720 | 17 712 | 18 484 |
| Антисмысловые РНК | 5501 | — | 28 | 2694 |
| Другие некодирующие РНК | 2213 | 2222 | 13 899 | 4347 |
| Псевдогены | 14 723 | 1740 | 15 952 | — |
| Общее число транскриптов | 203 835 | 203 903 | 154 484 | 323 827 |

Рисунок 3. Последовательность ДНК, получаемая после секвенирования человеческого генома
В ходе секвенирования РНК обнаружилось, что альтернативный сплайсинг, альтернативное инициирование транскрипции и альтернативное прерывание транскрипции проиcходят гораздо чаще, чем полагали, затрагивая до 95% человеческих генов. Следовательно, даже если известно местоположение всех генов, сначала нужно выявить все изоформы этих генов, а также определить, выполняют ли эти изоформы какие-либо функции или они просто представляют собой ошибки сплайсинга.
Базы данных генов человека
Задача по составлению каталога всех генов по-прежнему не решена. Проблема заключается в том, что за последние 15 лет только две исследовательские группы составили список доминантных генов: RefSeq, которая поддерживается Национальным центром биотехнологической информации (NCBI) при Национальных институтах здоровья (NIH), и Ensembl/Gencode, которая поддерживается Европейской молекулярно-биологической лабораторией (EMBL). Однако, несмотря на большой прогресс, сейчас в каталогах различается количество белок-колирующих генов, генов длинных некодирующих РНК, псевдогенов, а также варьирует количество антисмысловых РНК и других некодирующих РНК (табл. 2). Каталоги еще дорабатываются: например, в прошлом году сотни генов, кодирующих белок, были добавлены или удалены из списка Gencode. Эти разногласия объясняют проблему создания полного каталога человеческих генов.
В 2017 году была создана новая база данных генов человека — CHESS. Примечательно, что она включает все белок-кодирующие гены как Gencode, так и RefSeq, так что пользователям CHESS не нужно решать, какую базу данных они предпочитают. Бóльшее количество генов может вызывать больше ошибок, но создатели считают, что бóльший набор окажется полезным при исследовании болезней человека, которые еще не отнесены к генетическим. Набор генов CHESS в настоящее время в версии 2.0 еще не окончательный, и, безусловно, создатели работают над его усовершенствованием.

Именно последний вариант мы и рассмотрим в этой статье, посвящённой некодирующим РНК и их роли в заболеваниях человека.
Некодирующие РНК (нкРНК, в англоязычной литературе — non-coding RNA, ncRNA) — это молекулы рибонуклеиновых кислот, которые не подвергаются трансляции, то есть по их последовательности не синтезируются белки. В геноме человека число генов некодирующих РНК превышает число белок-кодирующих генов (~23 000 и ~20 000, соответственно, согласно базе данных GENCODE, январь 2017) [1]. Если же учесть тот факт, что транскрипции подвергается не вся ДНК, а примерно 50–80% генома, то преобладание некодирующих последовательностей становится гораздо более впечатляющим: лишь 2% из образующихся РНК транслируется в белки, а оставшиеся 98% приходятся на нкРНК [2–4]. Основные виды некодирующих РНК, число их генов и год открытия перечислены в Таблице 1, а схематичное строение и основные функции некоторых нкРНК представлены на Рисунке 1.
Таблица 1 ❘ Виды некодирующих РНК.

Рисунок 1 ❘ Основные виды некодирующих РНК [7].
Помимо перечисленных в Таблице 1 и на Рисунке 1, к регуляторным нкРНК относятся и многие другие типы РНК (рис.2). Например, среди малых нкРНК присутствуют РНК, взаимодействующие с белками PIWI (пиРНК, piwi-interacting RNA, piwiRNA), киРНК с натуральным антисмысловым транскриптом (natural antisense short interfering RNA, natsiRNA) и другие. Однако эти виды некодирующих РНК не обнаружены в клетках человека, и/или их патогенетическое и диагностическое (а также терапевтическое) значение ещё не показано, поэтому здесь мы их не рассматриваем.

Рисунок 2 ❘ Некодирующие РНК [8].
Но какую же роль играют эти РНК, если они не кодируют белки?
Регуляторные некодирующие РНК можно разделить на малые (20–400 нуклеотидов) и длинные (от 200–400 до десятков тысяч нуклеотидов) [2–4,9]. Все они участвуют в модификации других РНК и играют важную роль в регуляции экспрессии генов на разных уровнях.
Процесс экспрессии некодирующих РНК также управляется на транскрипционном или посттранскрипционном уровне (после стадии транскрипции), при этом регуляторами могут выступать другие нкРНК (рис. 3), благодаря их способности взаимодействовать с ДНК, РНК и белками [3].
Рисунок 3 ❘ Взаимная регуляция ДНК, различных видов РНК и белков [7].
Малые регуляторные нкРНК вовлечены во многие физиологические и патологические процессы: пролиферацию, дифференцировку и апоптоз клеток, секрецию инсулина, биосинтез холестерина и др. [11]. Обнаружено, что все малые РНК функционируют на основе механизма РНК-интерференции (Рис. 4). Кстати, за открытие этого механизма американские исследователи Эндрю Файер (Andrew Fire) и Крейг Мелло (Craig Mello) в 2006 году получили Нобелевскую премию по физиологии и медицине.
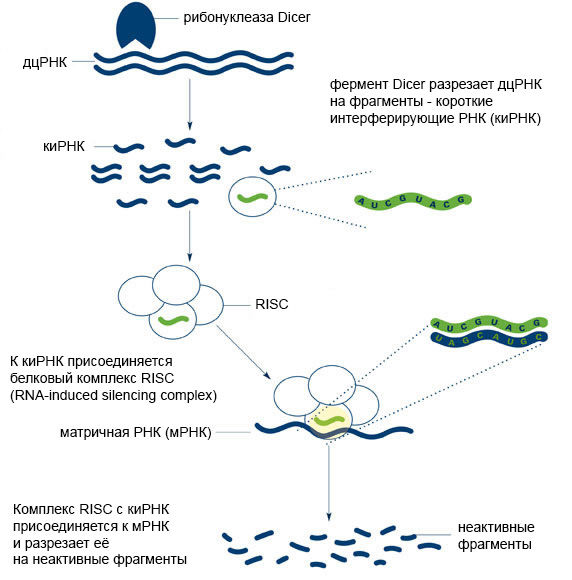
Рисунок 4 ❘ Принцип РНК-интерференции [12]
Суть РНК-интерференции заключается в подавлении экспрессии гена на посттранскрипционном уровне (после синтеза мРНК), при активном участии малых молекул РНК – киРНК или микроРНК.
Далее, в ходе РНК-интерференции, одна из цепей киРНК (в её роли может выступать и одноцепочечная микроРНК) вступает во взаимодействие с комплексом белков под названием RISC (RNA-induced silencing complex). Вторая цепь киРНК при этом деградирует [13,14]. Одноцепочечные микроРНК также способны участвовать в процессе РНК-интерференции. Однако комплексу RISC сложнее взаимодействовать с микроРНК, поэтому последние оказываются гораздо менее эффективными регуляторами посттранскрипционной экспрессии [15].
Центральным элементом комплекса RISC является эндонуклеаза Ago2 – фермент, расщепляющий нуклеиновые кислоты. В том случае, если цепочка киРНК, связавшаяся с комплексом RISC, окажется полностью комплементарна какой-либо мРНК – эндонуклеаза разрежет эту мРНК по месту комплементарного связывания. Нарезанные фрагменты функционально неактивны и к тому же быстро разрушаются ферментами клетки [14].
Можно заметить, что, хотя и киРНК и микроРНК участвуют в процессе интерференции, действуют они с некоторыми отличиями. Рассмотрим их подробнее.
Короткие интерферирующие РНК:
- Не имеют собственных генов; представляют собой фрагменты более длинных дцРНК.
- Абсолютно комплементарны мРНК-мишени.
- Запускают разрушение мРНК-мишени; НЕ подавляют её трансляцию.
- Функции — защита клетки от чужеродного генетического материала (вирусов, трансгенов), регуляция некоторых генов.
МикроРНК:
- Считываются с собственных генов.
- Большинство микроРНК комплементарны мРНК-мишени не полностью, а лишь в seed region.
- Подавляют трансляцию мРНК-мишени ИЛИ активируют её разрушение.
- Функции — регуляция генов-мишеней.
Считается, что микроРНК способны управлять экспрессией до 30% всех белок-кодирующих генов [2,4,11]. Тем самым эти малые нкРНК регулируют многие процессы жизнедеятельности клеток: пролиферацию, дифференцировку, апоптоз и др.
И малым и длинным некодирующим РНК свойственна тканеспецифичная экспрессия, когда каждый отдельный тип нкРНК преобладает в какой-либо одной ткани организма [4]. Так, miR-1 чаще других микроРНК встречается в мышечной ткани, в том числе и в сердце, а miR-122 с большей вероятностью обнаружится в гепатоцитах [11]. Нарушения экспрессии нкРНК сопровождают многие заболевания, в том числе онкологические и наследственные, хотя в большинстве случаев неясно, является ли изменение экспрессии причиной или следствием болезни [2].
К изменению уровня экспрессии — то есть снижению или усилению синтеза микроРНК- могут приводить внешние факторы, например, ионизирующая радиация или воздействие перекиси водорода [11]. Под их воздействием или спонтанно могут происходить мутации генов микроРНК, химические модификации ДНК и гистонов, активация генов транскрипционными факторами [4]. Всё вышеперечисленное способно нарушать экспрессию микроРНК, вызвать увеличение или снижение количества молекул микроРНК в клетке, ослабление или усиление экспрессии мРНК-мишеней, а также может привести к появлению новых мишеней у микроРНК. Такие клеточные процессы могут отразиться и на здоровье человека – от появления незначительных особенностей фенотипа до развития тяжёлых болезней [2].
Делеция гена miR-17 вызывает дефекты роста и развития скелета. Мутация, затрагивающая seed region miR-96 вызывает наследственную прогрессирующую потерю слуха, а аналогичное повреждение гена miR-184 приводит к развитию наследственного кератоконуса, которому предшествует полярная катаракта [16]. Нарушение экспрессии некодирующих РНК (микроРНК и длинных нкРНК) обнаружено при злокачественных опухолях, поражениях сердечно-сосудистой системы, нейродегенеративных процессах [17,18]. К примеру, при миодистрофиях Дюшенна и Беккера изменяется уровень сразу нескольких микроРНК — miR‑146b, miR‑155, miR‑214 и miR‑221/222. Показана ассоциация miR‑155 и гипертонии, miR‑17, miR‑20а и легочной гипертензии, а также изменение экспрессии таких длинных нкРНК, как aHIF, ANRIL, KSNQ10T1, MIAT и MALAT1 при инфаркте миокарда [4,16,18].

Рисунок 5 ❘ Молекулярные механизмы действия нкРНК при злокачественных опухолях (адаптировано из [20]).
Следует отметить, что некоторые нкРНК обладают двойственной ролью – то есть могут выступать и как онкосупрессоры и как онкогены, в зависимости от конкретного типа опухоли, то есть от клеточного и тканевого окружения. Например, микроРНК let-7 проявляет свойства онкогена при опухолях шейки матки, снижая экспрессию регулятора апоптоза Fas, но выступает как супрессор при немелкоклеточном раке лёгкого, подавляя экспрессию медиаторов клеточного цикла RAS и циклинов [4,16,18].
Некоторые примеры из множества некодирующих РНК, обладающих онкогенными, онкосупрессорными и двойственными свойствами показаны в Таблице 2.
Кроме того, микроРНК обладают способностью изменять чувствительность опухолей к химиотерапевтическим препаратам. Эта тема также активно изучается многими исследователями. Значительнее всего на чувствительность злокачественных клеток различных типов к химиотерапии влияют такие микроРНК, как miR-21, miR-26a/b, miR-125a/b, miR-203 и miR-218. Механизм их действия заключается преимущественно в регуляции экспрессии белков, вовлечённых в процесс апоптоза — BCL2, Survivin и PTEN [22]. Свою роль играет и воздействие других микроРНК на другие клеточные пути (Рис. 6).
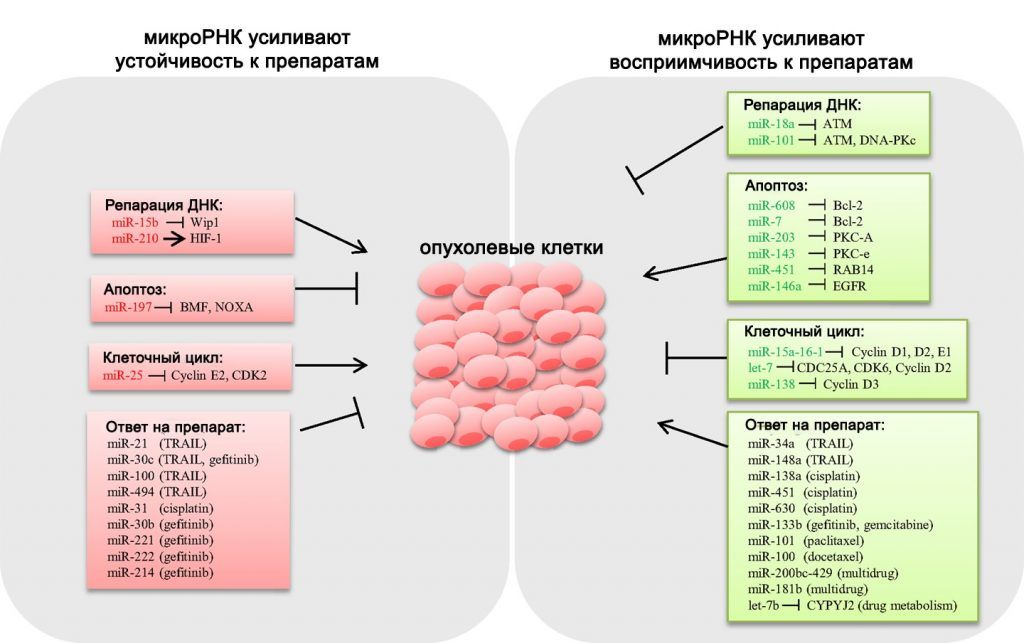
Рисунок 6 ❘ Влияние микроРНК на химиочувствительность опухолевых клеток (адаптировано из [23]).
Благодаря тому, что экспрессия регуляторных некодирующих РНК тканеспецифична, а их уровень изменяется во время патологических процессов, возможно использовать нкРНК в качестве диагностического и прогностического маркера. Точность диагностики по микроРНК значительно выше по сравнению с диагностикой по мРНК-маркерам. Более того, в ряде случаев профиль экспрессии некодирующих РНК позволяет предсказать исход болезни [2]. К примеру, уровень длинной нкРНК LIPCAR изменяется при инфаркте миокарда, а определённые его значения указывают на высокий риск смерти пациента от сердечной недостаточности [24]. Для опухолей разной локализации и клеточного происхождения характерны специфичные профили экспрессии генов микроРНК. Например, набор из пяти миРНК (miR-25, miR-34c, miR-191, let-7e, miR-34a) позволяет различить основные гистологические типы немелкоклеточного рака легкого и может быть использован как маркер неблагоприятного прогноза [19]. Длинные нкРНК можно применять и для прогноза возможного развития опухолей: установлена ассоциация между генетическим вариантом длинной нкРНК Н19 и риском развития рака мочевого пузыря [3,16].
Самым многообещающим видом биомаркеров для диагностики заболеваний представляются внеклеточные (циркулирующие) микроРНК и длинные нкРНК, составляющие 42,3% и 3,4% всех внеклеточных РНК соответственно. При наличии патологического процесса в организме уровень маркерной нкРНК в крови может повышаться более чем в десятки раз по сравнению с нормальным. Диагностически значимые микроРНК выявляются не только в цельной крови, но и в плазме и сыворотке крови, слюне, моче, пищеварительных соках и других жидкостях, выделяемых организмом человека [25].
В биологических жидкостях регуляторные РНК могут присутствовать в крови в одной из трёх форм:
- микроРНК и длинные нкРНК из повреждённых тканей;
- микроРНК и длинные нкРНК, заключённые в мембранные пузырьки — экзосомы или апоптозные тельца;
- микроРНК в комплексе с мРНК-связывающим белком (липопротеины высокой плотности, нуклеофосмин 1, белки семейства Argonaute и т. д.) [15,25,26].
Диагностика заболеваний по внеклеточным РНК обладает следующими преимуществами:
- Циркулирующие нкРНК очень стабильны, в том числе в экстремальных условиях, включая высокие температуры, высокий или низкий рН и циклы заморозки – разморозки.
- РНК легко обнаружить в образцах тканей и жидкостей таким методом, как количественная ПЦР с обратной транскрипцией (qRT-PCR).
- Уровень нкРНК, циркулирующих в жидкостях человеческого тела, изменяется соответственно уровню аналогичных нкРНК в тканях.
- Получение клинических образцов, которые содержат циркулирующие нкРНК – малоинвазивный и простой процесс [11, 26].
Наиболее эффективным методом для определения уровня циркулирующих микроРНК в биологических жидкостях является количественная ПЦР с обратной транскрипцией. Она обладает высокой чувствительностью и позволяет оценивать динамику изучаемого показателя. Единственным её недостатком является ограничение по числу одновременно анализируемых образцов. Другие методы, такие как микрочиповые технологии или различные виды секвенирования обладают большей пропускной способностью, однако микрочиповой метод не позволяет проводить точную количественную оценку измеряемого показателя, а секвенирование, как правило, экономически неэффективно [18].
Метод qRT-PCR позволяет успешно диагностировать некоторые виды рака, выявляя в различных биологических жидкостях нкРНК, попадающие туда из распавшихся тканей злокачественных опухолей или секретируемые переродившимися клетками в виде экзосом – пузырьков, окружённых мембраной [15]. Экзосомы доставляют регуляторные белки и РНК от одних клеток к другим, тем самым индуцируя апоптоз или же стимулируя рост раковых клеток [6]. Примеры нкРНК, способных выступать в роли диагностических маркеров при злокачественных опухолях, приведены в Таблице 3.

Таблица 3 ❘ Циркулирующие нкРНК как биомаркеры различных видов рака.
Вовлечённость некодирующих РНК в развитие заболеваний позволяет разрабатывать не только методы диагностики, но и новые способы терапии. Если установлено, что при развитии заболевания в клетке возникает нехватка какой-либо микроРНК, то необходимо повысить её уровень (Рис.7). Однако, непосредственное введение микроРНК или сходных по механизму действия коротких интерферирующих РНК небезопасно. В клеточных культурах и in vivo показано, что киРНК обладают дозозависимой токсичностью и вызывают повреждение печени у мышей. Поэтому, для повышения уровня микроРНК, необходимо применять обходные пути.

Рисунок 7 ❘ Возможности терапии с помощью нкРНК [27].
В том случае, когда транскрипция гена микроРНК подавлена из-за его избыточного метилирования, экспрессию можно восстановить с помощью деметилирующих препаратов. Можно применить и искусственные молекулы, способные действовать как малые нкРНК. В 2009 году были созданы имитаторы микроРНК – малые дцРНК, которые ингибируют трансляцию специфических генов-мишеней [11].
Имитируют действие микроРНК и одноцепочечные олигонуклеотиды, комплементарные мРНК-мишеням. Из-за комплементарности и антипараллельности смысловой мРНК, такие препараты называют антисмысловыми олигонуклеотидами (АСО). Соединяясь с мРНК, АСО образуют двуцепочечные РНК. В итоге мРНК либо утрачивает способность к трансляции, либо расщепляется в результате РНК-интерференции. Примером такого препарата, уже применяющегося для лечения, является мипомерсен (mipomersen). Он используется в качестве вспомогательной терапии при гомозиготной семейной гиперхолестеринемии. Механизм действия мипомерсена – снижение уровня мРНК аполипопротеина В, что снижает и уровень атерогенного холестерина в плазме [28].
Следует отметить, что одноцепочечные олигонуклеотиды заряжены отрицательно и обладают гидрофильностью, поэтому сами не могут преодолеть гидрофобную клеточную мембрану, к тому же они быстро подвергаются расщеплению ферментами. Поэтому для облегчения доставки изменяют химическую структуру олигонуклеотидов или внедряют их во вспомогательные молекулярные комплексы — вирусные частицы или липосомы. Однако применение вирусных методов in vivo ограничено высокой иммуногенностью вирусных белков и вероятностью их внедрения в нежелательные места генома [11].
Наиболее безопасным и эффективным методом является химическая модификация антисмысловых олигонуклеотидов. Подробнее о видах такой модификации, препарате мипомерсен, а также о фармакологических свойствах антисмысловых препаратов можно прочитать в статье "Фармакология антисмысловых препаратов"
Несколькими исследовательскими группами созданы АСО, которые могут связываться не с мРНК, а с длинными нкРНК или микроРНК [2]. В 2009 г. на основе модифицированных олигонуклеотидов разработан таргетный препарат миравирсен, ингибирующий miR-122, необходимую для репликации вируса гепатита С. Препарат успешно прошёл все клинические испытания и уже применяется в клинике [28].
Множество других антисмысловых препаратов для лечения широкого спектра заболеваний находятся на различных фазах клинических испытаний и все они являются весьма многообещающими. Не исключено, что дальнейшее выяснение функциональной роли некодирующих РНК в норме и при патологии позволит выявить новые диагностические маркеры и разработать принципиально новые терапевтические препараты, открывая новые перспективные возможности для медицины будущего.
Читайте также:

