Практическое значение предельных углеводородов и их галогенозамещенных кратко
Обновлено: 05.07.2024
Углеводороды – группа веществ, к которой относятся нефть и метан, природный газ. Их разнообразие велико. Речь, конечно, про углеводороды. Это одновременно одни из самых распространенных и самых востребованных человечеством веществ. Что же они собой представляют? Стоит вспомнить, о чем в 9 классе рассказывала химия.
Углеводороды
Этот класс веществ объединяет самые разные соединения, большинство из которых давно и успешно используются для своих целей человеком. Это объясняется тем, что углерод очень легко образует химические связи, особенно с водородом, поэтому и наблюдается такое разнообразие. Без этого была бы невозможна жизнь в том виде, в котором мы ее знаем. Углеводороды – это вещества, состоящие из двух элементов: углерода и водорода. Их молекулы могут быть не только линейными, но и разветвленными, а также образовывать замкнутые циклы.
Классификация углеводородов
Углерод образует четыре связи, а водород – одну. Но это не значит, что их соотношение всегда равно 1 к 4. Дело в том, что между атомами углерода могут быть не только одинарные, но и двойные, а также тройные связи. По этому критерию различают классы углеводородов. В первом случае эти вещества называются предельными (или алканами), а во втором – ненасыщенными или непредельными (алкенами и алкинами для двух и трех связей соответственно).
Еще одна классификация предусматривает рассмотрение молекулы. В этом случае различают алифатические углеводороды, структура которых линейна, и карбоциклические, в виде замкнутой цепи. Последние в свою очередь делятся на алициклические и ароматические.
Помимо этого, углеводороды часто подвергаются полимеризации – процессу присоединения одинаковых молекул одна к другой. В результате получается совершенно новый материал, не похожий на базовый. Примером может служить полиэтилен, получающийся из просто этилена. Это возможно только когда речь идет о ненасыщенных углеводородах.
Структуры, которые также относятся к классу непредельных, могут с помощью своих свободных радикалов присоединять и новые атомы, отличные от водорода. В этом случае получаются другие органические вещества: спирты, амины, кетоны, эфиры, белки и т. д. Но это уже совершенно отдельные темы в химии.
Примеры углеводородных соединений
Углеводороды – это огромное разнообразие веществ даже с учетом классификации. Но все же стоит кратко перечислить наименования соединений, входящих в этот многочисленный класс.
- Предельные углеводороды – это метан, этан, пропан, бутан, пентан, гексан, гептан и т. д. Первое и третье названия наверняка знакомы даже тем, кто не особенно дружит с химией. Так называются довольно распространенные виды газов.
- В класс алкенов (олефинов) входят этен (этилен), пропен (пропилен), бутен, пентен, гексен и т. д.
- К алкинам относятся этин (ацетилен), пропин, бутин, пентин, гексин и т. д.
- Кстати, двойные и тройные связи могут быть не одиночными. В таком случае такие структуры относятся к алкадиенам и алкадиинам. Но слишком уж углубляться не стоит.
- Что касается углеводородов, структура которых замкнута, для них есть свои названия: циклоалканы, циклоалкены и циклоалкины.
- Названия первых: циклопропан, циклобутан, циклопентан, циклогексан и т. д.
- Во второй класс входят циклопропен, циклобутен, циклопентен, циклогексен и т. д.
- Наконец циклоалкины, не встречающиеся в природе. Синтезировать их пытались очень давно и долго, и это удалось лишь в начале XX века. Молекулы циклоалкинов состоят не менее чем из 8 атомов углерода. При меньшем количестве соединение просто нестабильно из-за слишком большого напряжения.
- Есть еще арены (ароматические углеводороды), самым простым и распространенным представителем которых является бензол. Также к этому классу относятся нафталин, фуран, тиофен, индол и т. д.
Свойства углеводородов
Как уже было упомянуто выше, углеводороды – это огромное количество самых разных веществ. Поэтому говорить об их общих свойствах несколько странно, ведь таковых просто нет.
Одинаковой чертой у всех углеводородов может считаться разве что состав. А также тот факт, что в начале каждого ряда, по мере увеличения количества атомов углерода, происходит переход от газообразной и жидкой формы к твердой.
Есть и еще одна схожесть: все углеводороды обладают хорошей горючестью. При этом выделяется много тепла, образуются углекислый газ и вода.
Природные источники углеводородов

Как и другие полезные ископаемые, некоторые углеводороды располагаются в виде залежей и запасов в земной коре. В частности, они составляют большую часть газа и нефти. Это хорошо видно при переработке последней: в процессе выделяется огромное количество веществ, большая часть из которых относится именно к углеводородам. Газ и вовсе на 80-97% обычно состоит из метана. Кроме того, метан образуется при разложении органических отходов и останков, так что его получение не представляет серьезной проблемы.
Другие источники углеводородов – лаборатории. Те вещества, которые не встречаются в природе, могут быть синтезированы из других соединений с помощью химических реакций.
Использование углеводородов
Углеводороды играют огромную роль в современной жизни человечества. Нефть и газ стали очень ценными ресурсами, ведь они служат в качестве топлива и энергоносителей. Но это не единственные способы применения соединений из данного класса. Углеводороды – это буквально все, что окружает людей в быту. С помощью полимеризации удалось получить новые материалы, из которых изготавливаются разные виды пластмасс, тканей и т. д. Керосин, растворители, лакокрасочные изделия, парафины, асфальт, гудрон, битум, и это не считая основных продуктов нефтепереработки – бензина и дизельного топлива.
Значение этих веществ огромно. Как непредельные, так и предельные углеводороды – это сотни и тысячи вещей, к которым каждый человек привык и не может без них обходиться в самых простых ситуациях. Отказаться от их использования крайне сложно даже с учетом того, что запасы нефти и газа иссякнут, как предрекают аналитики. Уже сейчас человечество ведет активный поиск альтернативных источников энергии, но ни один из вариантов пока не показал такой же эффективности и универсальности, как углеводороды.
Роль углеводородов в организме человека
По характеру воздействия на организм человека различают две группы углеводородов: раздражающие и канцерогенные.
Раздражающие углеводороды оказывают наркотическое воздействие на центральную нервную систему и влияют на слизистые оболочки. К ним относятся альдегиды, все непредельные и предельные соединения углерода с водородом, не относящиеся к ароматическим соединениям.
Наибольшую опасность для человека представляют углеводородные соединения канцерогенной группы: 1,2-бензантрацен, 3,4-бензпирен (С20Н12), 1,2-бензпирен (C2oHi2), 3,4-бензфлуорантен (С2оН14). Особо опасен 3,4-бензпирен, являющийся своего рода индикатором присутствия в смеси других канцерогенов.
Углеводороды - очень большой класс соединений, относящихся к органическим. Они включают в себя несколько основных групп веществ, среди которых практически каждое находит широкое применение в промышленности, быту, природе. Особенное значение имеют галогенопроизводные углеводороды, о которых и пойдет речь в статье. Они имеют не только высокое промышленное значение, но и являются важным сырьем при множестве химических синтезов, получении лекарственных средств и прочих важных соединений. Уделим особое внимание строению их молекул, свойствам и другим особенностям.

Галогенопроизводные углеводороды: общая характеристика
С точки зрения химической науки, к данному классу соединений относятся все те углеводороды, в которых один или несколько атомов водорода замещены на тот или иной галоген. Это очень обширная категория веществ, так как они имеют важное промышленное значение. В течение довольно короткого времени люди научились синтезировать практически все галогенопроизводные углеводородов, применение которых необходимо в медицине, химической отрасли, пищевой промышленности и быту.
Основной метод получения данных соединений - это синтетический путь в лаборатории и промышленности, так как в природе практически ни один из них не встречается. Вследствие наличия атома галогена они обладают высокой реакционной способностью. Это во многом определяет области их применения в химических синтезах как промежуточных продуктов.
Так как представителей галогенопроизводные углеводороды имеют много, принято классифицировать их по разным признакам. В основу ложится как строение цепи и кратность связи, так и различие в атомах галогенов и месте их положения.
Галогенопроизводные углеводородов: классификация
Первый вариант разделения основан на общепринятых принципах, которые применяются для всех органических соединений. Классификация основана на различии в типе углеродной цепи, ее цикличности. По данному признаку выделяют:
- предельные галогенопроизводные углеводороды;
- непредельные;
- ароматические;
- алифатические;
- ациклические.
Следующее разделение основано на виде атома галогена и его количественном содержании в составе молекулы. Так, выделяют:
- монопроизводные;
- дипроизводные;
- три-;
- тетра-;
- пентапроизводные и так далее.
Если говорить о виде галогена, то тогда название подгруппы состоит из двух слов. Например, монохлорпроизводное, трийодпроизводное, тетрабромгалогеналкен и так далее.
Также существует еще один вариант классификации, по которому разделяются преимущественно галогенопроизводные предельных углеводородов. Это номер атома углерода, к которому присоединен галоген. Так, выделяют:
- первичные производные;
- вторичные;
- третичные и так далее.
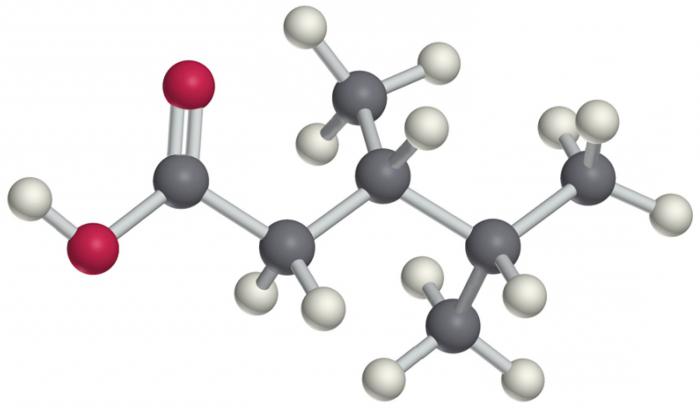
Каждого конкретного представителя можно ранжировать по всем признакам и определить полное место в системе органических соединений. Так, например, соединение с составом СН3 - СН2-СН=СН-CCL3 можно классифицировать так. Это непредельное алифатическое трихлорпроизводное пентена.
Строение молекулы
Наличие атомов галогена не может не сказаться как на физических и химических свойствах, так и на общих чертах строения молекулы. Общая формула для данного класса соединений имеет вид R-Hal, где R - свободный углеводородный радикал любого строения, а Hal - атом галогена, один или несколько. Связь между углеродом и галогеном сильно поляризована, вследствие чего молекула в целом склонна к двум эффектам:
- отрицательный индуктивный;
- мезомерный положительный.
При этом первый из них выражен значительно сильнее, поэтому атом Hal всегда проявляет свойства электроноакцепторного заместителя.
В остальном все особенности строения молекулы ничем не отличаются от таковых у обычных углеводородов. Свойства объясняются строением цепи и ее разветвленностью, количеством атомов углерода, силой ароматических признаков.
Особого внимания заслуживает номенклатура галогенопроизводных углеводородов. Как правильно следует называть данные соединения? Для этого нужно соблюдать несколько правил.
- Нумерация цепи начинается с того края, к которому ближе расположен атом галогена. Если же имеется какая-либо кратная связь, то отсчет начинается именно с нее, а не с электроноакцепторного заместителя.
- Название Hal указывается в префиксе, также следует указывать номер атома углерода, от которого он отходит.
- Последним шагом дается название основной цепи атомов (либо кольцу).
Пример подобного названия: СН2=СН-CHCL2 - 3-дихлорпропен-1.
Также название можно давать и по рациональной номенклатуре. В этом случае произносится наименование радикала, а затем - галогена с суффиксом -ид. Пример: СН3-СН2-СН2Br - пропилбромид.
Как и другие классы органических соединений, галогенопроизводные углеводороды строение имеют особенное. Это позволяет многих представителей обозначать исторически сложившимися названиями. Например, фторотан CF3CBrClH. Наличие сразу трех галогенов в составе молекулы обеспечивает данному веществу особые свойства. Его применяют в медицине, поэтому чаще пользуются именно исторически сложившимся названием.

Способы синтеза
Способы получения галогенопроизводных углеводородов достаточно разнообразны. Можно выделить пять основных методов синтеза данных соединений в лаборатории и промышленности.
- Галогенирование обычных углеводородов нормального строения. Общая схема реакции: R-H + Hal2 → R-Hal + HHal. Особенности протекания процесса заключаются в следующем: с хлором и бромом обязательно нужно ультрафиолетовое облучение, с йодом реакция практически невозможна либо очень медленна. С фтором взаимодействие слишком активное, поэтому использовать данный галоген в чистом виде нельзя. Кроме того, при галогенировании ароматических производных нужно использовать особые катализаторы процесса - кислоты Льюиса. Например, хлорид железа или алюминия.
- Получение галогенопроизводных углеводородов осуществляется также путем гидрогалогенирования. Однако для этого исходным соединением обязательно должен быть непредельный углеводород. Пример: R=R-R + HHal → R-R-RHal. Чаще всего подобное электрофильное присоединение используется для получения хлорэтилена или винилхлорида, так как это соединение является важным сырьем для промышленных синтезов.
- Воздействие гидрогалогенов на спирты. Общий вид реакции: R-OH + HHal→R-Hal + H2O. Особенностью является обязательное наличие катализатора. Примеры ускорителей процесса, которые можно использовать: хлориды фосфора, серы, цинка или железа, серная кислота, раствор хлорида цинка в соляной кислоте - реактив Лукаса.
- Декарбоксилирование солей кислот при окисляющем агенте. Другое название способа - реакция Бородина-Хунсдиккера. Суть заключается в отщеплении молекулы углекислого газа от серебряных производных карбоновых кислот при воздействии окисляющего агента - галогена. В результате образуются галогенопроизводные углеводородов. Реакции в общем виде выглядят так: R-COOAg + Hal → R-Hal + CO2 + AgHal.
- Синтез галоформов. Другими словами, это получение тригалогенпроизводных метана. Самый простой способ их производства - воздействие на ацетон щелочным раствором галогенов. В результате и происходит формирование галоформных молекул. Таким же способом синтезируются в промышленности галогенопроизводные ароматических углеводородов.
Особое внимание следует уделить синтезу непредельных представителей рассматриваемого класса. Основной метод - это воздействие на алкины солями ртути и меди в присутствие галогенов, которое приводит к образованию продукта с двойной связью в цепи.
Галогенопроизводные ароматических углеводородов получаются по реакциям галогенирования аренов или алкиларенов в боковую цепь. Это важные промышленные продукты, так как именно они используются в качестве инсектицидов в сельском хозяйстве.
Физические свойства
Физические свойства галогенопроизводных углеводородов напрямую зависят от строения молекулы. На температуры кипения и плавления, агрегатное состояние влияют количество атомов углерода в цепи и возможные ответвления в боковую часть. Чем их больше, тем показатели становятся выше. В целом можно охарактеризовать физические параметры в нескольких пунктах.
- Агрегатное состояние: первые низшие представители - газы, последующие до С12 - жидкости, выше - твердые тела.
- Имеют резкий неприятный специфический запах практически все представители.
- Очень плохо растворимы в воде, однако сами - отличные растворители. В органических соединениях растворяются очень хорошо.
- Температуры кипения и плавления увеличиваются с ростом числа атомов углерода в главной цепи.
- Все соединения, кроме фторпроизводных, тяжелее воды.
- Чем больше разветвлений в главной цепи, тем ниже температура кипения вещества.
Сложно обозначить множество сходных общих черт, ведь представители сильно различаются по составу и строению. Поэтому лучше приводить значения для каждого конкретного соединения из данного ряда углеводородов.
Химические свойства
Одним из самых важных параметров, который обязательно учитывается в химической промышленности и реакциях синтеза, являются химические свойства галогенопроизводных углеводородов. Они неодинаковы для всех представителей, так как есть ряд причин, обусловливающих различие.
- Строение углеродной цепи. Проще всего реакции замещения (нуклеофильного типа) происходят у вторичных и третичных галогеналкилов.
- Вид атома галогена также имеет важное значение. Связь между углеродом и Hal сильно поляризована, что и обеспечивает легкий ее разрыв с высвобождением свободных радикалов. Однако проще всего рвется связь именно между йодом и углеродом, что объясняется закономерным изменением (уменьшением) энергии связи в ряду: F-Cl-Br-I.
- Наличие ароматического радикала или кратных связей.
- Строение и разветвленность самого радикала.
В целом лучше всего галогеналкилы вступают в реакции именно нуклеофильного замещения. Ведь на атоме углерода после разрыва связи с галогеном концентрируется частично положительный заряд. Это позволяет радикалу в целом становиться акцептором элетроноотрицательных частиц. Например:
Этим объясняется тот факт, что от галогенпроизводных углеводородов можно перейти практически к любому классу органических соединений, нужно лишь подобрать соответствующий реагент, который предоставит нужную функциональную группу.
В общем можно сказать, что химические свойства галогенопроизводных углеводородов заключаются в способности вступать в следующие взаимодействия.
- С нуклеофильными частицами разного рода - реакции замещения. В результате могут получиться: спирты, простые и сложные эфиры, нитросоединения, амины, нитрилы, карбоновые кислоты.
- Реакции элиминирования или дегидрогалогенирования. В результате воздействия спиртового раствора щелочи происходит отщепление молекулы галогеноводорода. Так формируется алкен, низкомолекулярные побочные продукты - соль и вода. Пример реакции: CH3-CH2-CH2-CH2Br + NaOH (спирт) →CH3-CH2-CH=CH2 + NaBr + H2O. Данные процессы - один из основных способов синтеза важных алкенов. Процесс всегда сопровождается действием высоких температур. нормального строения по методу синтеза Вюрца. Суть реакции заключается в воздействии на галогенозамещенный углеводород (две молекулы) металлическим натрием. Как сильно электроположительный ион, натрий акцептирует атомы галогена из соединения. В результате освободившиеся углеводородные радикалы замыкаются между собой связью, формируя алкан нового строения. Пример: CH3-CH2Cl + CH3-CH2Cl + 2Na →CH3-CH2-CH2-CH3 + 2NaCl.
- Синтез гомологов ароматических углеводородов по методу Фриделя-Крафтса. Суть процесса - в воздействии на бензол галогеналкилом в присутствии хлорида алюминия. В результате реакции замещения происходит образование толуола и хлороводорода. В данном случае присутствие катализатора является необходимым. Помимо самого бензола таким способом можно окислять и его гомологи.
- Получение жидкости Греньяра. Этот реактив представляет собой галогенозамещенный углеводород с ионом магния в составе. Изначально осуществляется воздействие металлическим магнием в эфире на производный галогеналкил. В результате формируется комплексное соединение с общей формулой RMgHal, именуемое реактивом Греньяра.
- Реакции восстановления до алкана (алкена, арена). Осуществляются при воздействии водородом. В результате формируется углеводород и побочный продукт - галогеноводород. Пример в общем виде: R-Hal + H2 →R-H + HHal.
Это основные взаимодействия, в которые способны легко вступать галогенпроизводные углеводородов разного строения. Конечно, есть и специфические реакции, которые следует рассматривать для каждого конкретного представителя.

Изомерия молекул
Изомерия галогенопроизводных углеводородов - вполне естественное явление. Ведь известно, что чем больше атомов углерода в цепи, тем выше количество изомерных форм. Кроме того, непредельные представители имеют кратные связи, что также становится причиной появления изомеров.
Можно выделить две основные разновидности данного явления для этого класса соединений.
- Изомерия углеродного скелета радикала и основной цепи. Сюда же можно отнести и положение кратной связи, если она имеется в молекуле. Как и у простых углеводородов, начиная с третьего представителя можно записывать формулы соединений, имеющих идентичные молекулярные, но различные структурные формульные выражения. Причем, для галогенозамещенных углеводородов количество изомерных форм на порядок выше, чем для соответствующих им алканов (алкенов, алкинов, аренов и так далее).
- Положение галогена в составе молекулы. Его место в названии указывается цифрой, и даже если меняется всего на единицу, то свойства таких изомеров будут уже совсем различны.
О пространственной изомерии здесь речь не идет, поскольку атомы галогена делают это невозможным. Как и у всех остальных органических соединений, у галогеналкилов изомеры отличаются не только по строению, но и по физическим и химическим характеристикам.

Производные непредельных углеводородов
Подобных соединений, конечно, много. Однако нас интересуют именно галогенопроизводные непредельных углеводородов. Их же можно разделить на три основные группы.
- Винильные - когда атом Hal располагается непосредственно у атома углерода кратной связи. Пример молекулы: СН2=CCL2.
- С изолированным положением. Атом галогена и кратная связь располагаются в противоположных частях молекулы. Пример: СН2=СН-СН2-СН2-Cl.
- Аллильные производные - атом галогена расположен к двойной связи через один атом углерода, то есть находится в альфа-положении. Пример: СН2=СН-СН2-CL.
Особое значение имеет такое соединение, как хлористый винил СН2=CHCL. Оно способно к реакциям полимеризации с образованием важных продуктов, таких, как изоляционные материалы, непромокаемые ткани и прочее.
Еще один представитель непредельных галогенпроизводных - хлоропрен. Формула его - СН₂=CCL-СН=СН₂. Это соединение является исходным сырьем для синтеза ценных видов каучука, которые отличаются огнеустойчивостью, долгим сроком службы, плохой проницаемостью для газов.
Тетрафторэтилен (или тефлон) - полимер, который обладает качественными техническими параметрами. Используется для изготовления ценного покрытия технических деталей, посуды, различных приборов. Формула - CF2=CF2.
Ароматические углеводороды и их производные
Ароматическими называют те соединения, в состав которых входит бензольное кольцо. Среди них также есть целая группа галогенопроизводных. Можно выделить два основных типа их по строению.
- Если атом Hal связан непосредственно с ядром, то есть кольцом ароматическим, то тогда соединения принято называть галогенаренами.
- Атом галогена связан не с кольцом, а с боковой цепью атомов, то есть радикалом, отходящим в боковую ветвь. Такие соединения называются арилалкил галогенидами.
Среди рассматриваемых веществ можно назвать несколько представителей, имеющих наибольшее практическое значение.
- Гексахлорбензол - С6Cl6. С начала XX века использовался как сильный фунгицид, а также инсектицид. Обладает хорошим дезинфицирующим действием, поэтому его применяли для протравки семян перед высевкой. Имеет неприятный запах, жидкость достаточно едкая, прозрачная, может вызывать слезотечение.
- Бромистый бензил С6Н5СН2Br. Используется в качестве важного реагента при синтезе металлорганических соединений.
- Хлорбензол С6Н5CL. Жидкое бесцветное вещество, обладающее специфическим запахом. Используется при производстве красителей, пестицидов. Является одним из лучших органических растворителей.

Использование в промышленности
Галогенопроизводные углеводородов применение себе в промышленности и химических синтезах находят очень широкое. О непредельных и ароматических представителях мы уже сказали. Теперь обозначим в целом области использования всех соединений подобного ряда.
Галогенирование -- это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно -- за один этап замещается не более одного атома водорода:
1. CH4 + Cl2 > CH3Cl + HCl (хлорметан)
2. CH3Cl + Cl2 > CH2Cl2 + HCl (дихлорметан)
3. CH2Cl2 + Cl2 > CHCl3 + HCl (трихлорметан)
4. CHCl3 + Cl2 > CCl4 + HCl (тетрахлорметан).
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, замещая у них атом водорода, в результате этого образуются метильные радикалы СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Нитрование (реакция Коновалова)
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных. Реакция также подчиняется правилу Марковникова.
RH + HNO3 = RNO2 + H2O
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
1) метанв составе природного газа находит все более широкое применение в быту и на производстве;
3) жидкие углеводороды используются как горючее для двигателей внутреннего сгорания в автомашинах, самолетах;
4) метанкак доступный углеводород в большей степени используется в качестве химического сырья;
5) реакция горения и разложения метанаиспользуется в производстве сажи, идущей на получение типографской краски и резиновых изделий из каучука;
6) высокая теплота сгорания углеводородов обусловливает использование их в качестве топлива;
7) метан– основной источник получения водорода в промышленности для синтеза аммиака и ряда органических соединений.
Наиболее распространенный способ получения водорода из метана – взаимодействие его с водяным паром.
Реакция хлорирования служит для получения хлорпроизводного метана
Непредельные углеводороды ряда этилена, общая формула и химические свойства. Применение этиленовых углеводородов в медицине.
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4)
СH2=CH-CH3 + H2 → CH3-CH2-CH3
CH2=CH-CH3 + Br2 → CH2Br-CHBr-CH3 - качественная реакция на алкены — обесцвечивание бромной воды.
Присоединение по правилу Марковникову:
водород присоединяется к наиболее гидрогенезированному (= к тому, у которого больше водородов) атому углерода при двойной связи:
СH2=CH-CH3 + HCl = CH3-CHCl-CH3
1)В нейтральной (или слабощелочной среде:
СH2=CH2 → CH2(OH) — CH2(OH) — схематичное уравнение
3СH2=CH2 + 2KMnO4 + 4H2O = 3C2H4(OH)2 + 2MnO2 + 2KOH — полное уравнение
2)В кислой среде — идет разрыв двойной связи:
R-СH2=CH2-R → 2R-COOH — схематичное уравнение
полное сгорание: С2H4 + 3O2 = 2CO2 + 2H2O
Реакция полимеризации: n СH2=CH2 → n(-CH2-CH2-)
При взаимодействии этилена с хлороводородом образуется этилхлорид, который используют в медицине для проведения местной анестезии. Применение алкенов также связано с их способностью реагировать с водой, образуя при этом спирты. Так, из этилена в процессе реакции гидратации получается этиловый спирт. Нашли свое применение в качестве сырья для производства органических соединений, лаков, пластических масс, средств косметической промышленности и окиси алкенов.
Механизм реакции присоединения на примере непредельных углеводородов ряда этилена. Правило Марковникова. Применение этиленовых углеводородов в органическом синтезе.
Рассмотрим этот механизм на примере реакции присоединения бромоводорода к молекуле этилена.

Несмотря на то, что реакция гидробромирования описывается очень простым равнением, ее механизм включает несколько стадий.

Стадия 2. Связь водород-галоген разрывается с образованием электрофильной частицы Н+, и нуклеофильной частицы Br-. Освободившийся электрофил Н+ присоединяется к алкену за счет электронной пары двойной связи, образуя σ-комплекс – карбокатион.

Стадия 3. На этой стадии к положительно заряженному карбокатиону присоединяется отрицательно заряженный нуклеофил с образованием конечного продукта реакции.

Правило Марковникова — в органической химии правило, используемое для предсказания региоселективности реакции присоединения протонных кислот и воды к несимметричным алкенам и алкинам. Наиболее часто данное правило формулируют следующим образом: при присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Впервые правило было предложено русским химиком В. В. Марковниковым в 1869 году

.
Реакция протекает в две стадии. На первой, медленной стадии происходит присоединение протона H+ к двойной связи: при этом протон может связываться с одним из двух атомов углерода, образующих двойную связь. Образующиеся карбокатионы И1 и И2 имеют различную энергию (устойчивость), поскольку положительный заряд в них делокализуется с разной эффективностью. По этой причине вторичный карбокатион И2 является более устойчивым, и соответствующий ему бромид П2 образуется в большем количестве.

При более строгом рассмотрении необходимо сравнивать устойчивости не интермедиатов, а двух альтернативных переходных состояний на стадии образования карбокатионов, то есть энергии активации двух параллельных процессов. Для некоторых реакций различие этих величин достигает 25—30 кДж/моль.
Благодаря высокой химической активности углеводороды ряда этилена являются ценным сырьем для синтеза многих органических веществ.
Вопрос 42
Ацетилен — непредельный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Физические свойства:
При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом, однако технический ацетилен содержит примеси, которые придают ему резкий запах . Малорастворим в воде, хорошо растворяется в ацетоне. Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном [5] .
Химические свойства:
Для ацетилена (этина) характерны реакции присоединения:
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения .
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов - эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации)
В лаборатории ацетилен получают действием воды на карбид кальция ,а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
Ацетилен используют:
1)для сварки и резки металлов,
2)как источник очень яркого, белого света в автономных светильниках, где он получается реакцией
3)карбида кальция и воды (см. карбидная лампа),
4)в производстве взрывчатых веществ (см. ацетилениды),
5)для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука,ароматических углеводородов.
6)для получения технического углерода
7)в атомно-абсорбционной спектрофотометрии при пламенной атомизации
8)в ракетных двигателях
Вопрос 43
Ароматические соединения — циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения.
а)в присутствии катализатора – Солей железа (III) –бензол вступает в реакцию замещения, так же он реагирует и с хлором.
Б)взаимодействие с азотной кислотой
А)при действии солнечного света или ультрафиолетовых лучей. На свету присоединяется хлор и образуется гексахлорциклогексан (гексахлоран). Эта реакция используется и в промышленности, т.к. гексахлоран применяют для борьбы с насекомыми (инсектицид):
3. реакции окисления
А) при действии энергичных окислителей на гамологи бензола окислению подвергаются только боковые цепи
Б)бензол и его гомологи на солнце горят коптящем пламенем
Продукт для получения красителей, медикоментов, взрывчатых веществ, инсектицидов, пластмасс и синтетических волокон. Хороший растворитель многих органических веществ.
Получение. Бензол и его гомологи в больших количествах получают из нефти и каменноугольной смолы, образующейся при сухой перегонке каменного угля (коксовании). Сухая перегонка производится на коксохимических и газовых заводах
Вопрос 46
Этиленгликоль (гликоль; 1,2-диоксиэтан; этандиол-1,2), HO—CH2—CH2—OH — двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
· Как компонент автомобильных антифризов и тормозных жидкостей
· В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
· В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
· Как растворитель красящих веществ;
· В органическом синтезе:
· в качестве высокотемпературного растворителя.
· для защиты карбонильной группы путём получения 1,3-диоксолана
· В качестве криопротектора
· Для поглощения воды, для предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенириуют путём осушения и удаления солей.
· Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
· при производстве конденсаторов
· при производстве 1,4-диоксана
· компонент в составе систем жидкостного охлаждения компьютеров
· как теплоноситель в системах чиллер-фанкойл
· в качестве компонента крема для обуви (1—2 %)
· в составе для мытья стёкол вместе с изопропиловым спиртом
Глицерин (1,2,3-триоксипропан, пропантриол-1,2,3) — простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость. Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника (в качестве флюса при пайке).
Поскольку глицерин хорошо поддается желированию, в отличие например от этанола, и как и этанол горит без запаха и чада, его используют для изготовления высококачественных прозрачных свечей.
Технический глицерин используется для заполнения виброустойчивых манометров типа ДМ8008ВУ, заполнения торцевых уплотнений мешалок и др.
Также глицерин используется при изготовлении динамита.
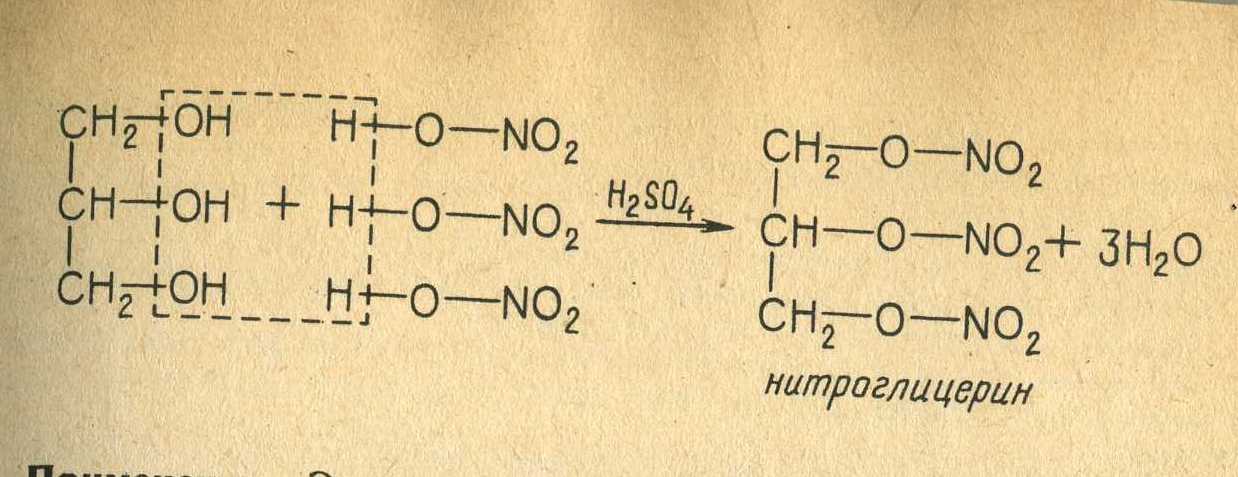

Вопрос 47
Фенол (гидроксибензол, устаревшее карболовая кислота) C6H5OH — простейший представитель классафенолов. Бесцветные игольчатые кристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ. Обладают специфическим запахом (таким, как запах гуаши, т. к. в состав гуаши входит фенол). Умеренно растворим в воде (6 г на 100 г воды), в растворах щелоче́й, в спирте, в бензоле, вацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине.
Химические свойства.:
Обладает слабыми кислотными свойствами, при действии щелочей образует соли — феноляты (например, фенолят натрия - C6H5ONa):C6H5OH + NaOH = C6H5ONa + H2O
· Вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп, увеличивает реакционную способность кольца к этим реакциям, и направляет замещение в орто- и пара-положения. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.

· Взаимодействие с металлическим натрием:
· Взаимодействие с бромной водой (качественная реакция на фенол):
C6H5OH + 3Br2(aqua) → C6H2(Br)3OH + 3HBr образуется твердое вещество белого цвета 2,4,6-трибромфенол
· Взаимодействие с концентрированной азотной кислотой:
· Взаимодействие с хлоридом железа(III) (качественная реакция на фенол):
6C6H5OH + FeCl3 → [Fe(C6H5OH)6]CI3 образуется трихлоридфенолят железа (III)(фиолетовое окрашивание)
Фенол весьма ядовит. При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуютПопадая на кожу, фенол очень быстро всасывается даже через неповрежденные участки и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Фенол является канцерогенным химическим веществом и способен вызвать рак. Смертельная доза для человека при попадании внутрь 1-10 г, для детей 0,05-0,5 г. [5] В лагерях смерти фашистской германии применялся для преднамеренной, активной, недобровольной эвтаназии, как правило в виде инъекции в сердце.
53)

Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств.Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом . На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Основной способ получения анилина — восстановление нитробензола. В промышленных условиях восстановление проводят водородом при 250-350 °С на никелевом или медном катализаторе.
В лаборатории для этой цели используют цинк в кислой среде:
С6Н5NО2 + 3Zn + 7HCl → C6H5NH3Cl + 3ZnCl2 + 2Н2О
или алюминий в щелочной среде:
C6H5NO2 + 2Al + 2NaOH + 4Н2О → C6H5NH2 + 2Na[Al(OH)4].
60)

Качественная реакция на белки. Белки выявляются в основном на реакциях, основанных на окрасках.
Ксантопротеиновая реакция. Данная реакция обнаруживает ароматические аминокислоты, входящие в белки (на примере тирозина):
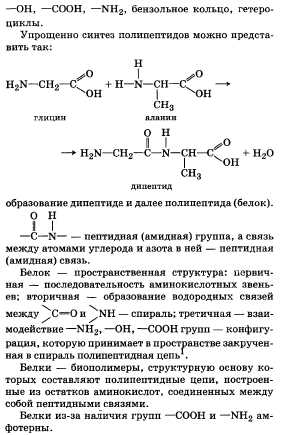
(OH)C6H4CH(NH2)COOH + HNO3 —-H2SO4——> (OH)C6H3(NO2)CH(NH2)COOH↓ + H2O — выпадает осадок желтого цвета.
(OH)C6H3(NO2)CH(NH2)COOH + 2NaOH ——-> (ONa)C6H3(NO2)CH(NH2)COONa + H2O — раствор становится оранжевым.

Реакции замещения. В этих реакциях замещение водорода легче происходит при третичном углеродном атоме, труднее — при вторичном и совсем плохо — при первичном.
1. Галогепирование (замещение галогеном) - важнейшая реакция алканов. Она протекает при освещении УФ-светом или в темноте при сильном нагревании, а также в присутствии катализаторов. Сравнительно легко алканы вступают в реакцию замещения с хлором и бромом, очень трудно — с иодом. С фтором реакция протекает со взрывом (поэтому обычно фтор разбавляют азотом или используют растворители). В результате замещения водорода галогеном образуются галогено-производные алканов. Например, хлорирование метана протекает с последовательным замещением в его молекуле всех атомов водорода на хлор:
Реакция галогенирования имеет цепной свободно-радикальный характер (Н.Н.Семенов). На первой стадии этого процесса под влиянием УФ-облучения (или высокой температуры) происходит распад молекулы хлора на два свободных радикала. Такой процесс называется инициированием:
Сl : Сl ® С1Ч + С1Ч
Затем начинается рост цепи. Свободный радикал взаимодействует с молекулой метана:
СН4 + С1Ч ® СН3Ч + НС1
Эта реакция обрывается, если исчезнут свободные радикалы. Поэтому обрыв цепи часто связан с взаимодействием свободных радикалов друг с другом:
С1Ч + С1Ч ® С1:С1
СН3Ч + С1Ч ® СН3:С1
2. Нитрование (замещение нитрогруппой NO2). Впервые эту реакцию открыл русский ученый М.И.Коновалов в 1888 г. (с тех пор она названа его именем). Алканы взаимодействуют с разбавленной азотной кислотой при нагревании, образуя нитропроизводные алканов:
В промышленности реакцию нитрования проводят, нагревая алканы с парами азотной кислоты при 250—500 °С и давлении (парофазное нитрование). Реакция нитрования, как и галогенирования, идет по цепному радикальному механизму. Нитрующим агентом является радикалоподобный оксид азота NO2, который, взаимодействуя с алканом, образует свободный радикал — алкил RЧ:
R—H + NO2Ч ® RЧ + HNO2
Взаимодействие этих радикалов приводит к образованию нитросоединений:
3. Сульфирование. Дымящая серная кислота (содержащая растворенный в ней SO3) с высшими алканами дает сульфокислоты. Например:
В результате таких реакций атом водорода в молекуле алкана замещается на сульфогруппу - SO3Н.
Соли сульфокислот (алкилсульфонаты) с C12-18 широко используются в качестве моющих средств. Эти соли можно получить и реакцией сульфохлорирования — действием на алканы смесью диоксида серы и хлора:
При взаимодействии сульфохлорида со щелочью образуется алкилсульфонат:
Читайте также:

