Механизм действия кортизола биохимия кратко
Обновлено: 30.06.2024
В свете появляющихся новых данных взгляд на систему гипоталамус-гипофиз-надпочечники-органы-мишени претерпевает значительные изменения, и наряду с механизмом отрицательной обратной связи, возникают предположения о существовании других регуляторных механизмов синтеза, активации и дезактивации ГКС. Тем не менее, в настоящее время имеется сравнительно небольшой объем данных о взаимосвязи между системной и местной продукцией кортизола в тканях. Неуклонный рост числа пациентов с сахарным диабетом (преимущественно 2 типа) и ожирением ставит новые задачи по разработке эффективных лекарственных средств и форм их доставки, методов своевременного выявления и профилактики развития заболевания. Понимание этих процессов позволит создать необходимую научную базу для поиска и разработки новых мишеней для фармакотерапии заболеваний, ассоциированных с нарушением синтеза, активации и действия ГКС.
Ключевые слова
Для цитирования:
For citation:
Введение
В основе любого научного открытия лежит накопление большого количества клинических наблюдений, литературных данных с последующей суммацией и систематизацией знаний и выдвижением новой гипотезы. В настоящее время имеется достаточное количество информации о механизмах действия кортизола и его клеточных мишенях, локального и системного действия, однако продолжающиеся экспериментальные исследования открывают все больше новых данных о биологической роли гормона. Исходным субстратом в стероидогенезе служит холестерин, либо получаемый с пищей, либо синтезируемый эндогенно из ацетата. Три основных пути биосинтеза в корковом веществе надпочечников приводят к образованию глюкокортикоидов, минералокортикоидов и надпочечниковых андрогенов. Наружная (клубочковая) зона участвует преимущественно в биосинтезе альдостерона, а внутренние (пучковая и сетчатая) служат местом биосинтеза глюкокортикоидов и андрогенов. Основным глюкокортикоидным гормоном у человека является гидрокортизон (кортизол). Суточная секреция кортизола составляет 15–30 мг и обладает выраженным суточным ритмом. Кортизол в плазме присутствует в трех видах: свободном, связанном с белком и в виде метаболитов. В норме на долю свободного, биологически активного кортизола приходится около 5% его количества, присутствующего в крови. Приблизительно 90% кортизола связывается специфическим белком (а2-глобулином) – транскортином, обладающим высоким средством к гормону. Менее 5% кортизола связывается белком с низким сродством – альбумином. Необходимо отметить, что именно от количества свободного кортизола зависит его биологическая активность, проявляющаяся в непосредственном воздействии на ткани. В норме глюкокортикостероиды (ГКС) участвуют во всех видах обмена (в метаболизме белков, углеводов, липидов), в связи с чем патофизиологические и клинические изменения при гиперкортицизме колеблются в широких пределах. Гиперпродукция глюкокортикоидов может быть следствием повышения уровня адренокортикотропного гормона при опухолях гипофиза (болезнь Иценко-Кушинга), опухолях, происходящих из других клеток (бронхов, тимуса, поджелудочной железы), вырабатывающих кортикотропинподобные вещества, или избыточного синтеза кортизола корой надпочечников (синдром Иценко-Кушинга). На примере этих орфанных заболеваний изучены различные эффекты избытка кортизола на органы и ткани. При гиперкортицизме наблюдаются нарушение толерантности к глюкозе или сахарный диабет, обусловленные стимуляцией глюконеогенеза и развитием инсулинорезистентности, усиление катаболизма белков, уменьшение мышечной массы, истончение кожи, остеопороз, инволюция лимфоидной ткани, своеобразное перераспределение и изменения морфологического состава жировой ткани. Как известно, глюкокортикоиды моделируют физиологию жировой ткани, изменяя секрецию адипокинов непосредственно или в связи с развивающейся инсулинорезистентностью, стимулируют дифференцировку адипоцитов, способствуя образованию новых клеток жировой ткани посредством активации транскрипции ряда ключевых генов [1, 2]. Гипернатриемия, гипокалиемия и, как следствие, артериальная гипертензия обусловлены некоторой минералокортикоидной активностью кортизола, которая проявляется при его избытке.
Кортизол и метаболический синдром
Хорошо известно, что ГКС оказывают влияние на распределение жировой ткани. Ряд исследований показал, что пациенты с ожирением имеют гиперактивацию фермента 11β-HSD1 в жировой ткани [4, 5] и гепатоцитах, ключевого фермента, стимулирующего конверсию метаболически неактивного кортизона в активный кортизол (рис. 1). Напротив, 11β-гидроксистероид дегидрогеназа 2 (11β-HSD2), катализирующая превращение кортизона в кортизол, имела низкую экспрессию.
Рис.1 Конверсия кортизола в кортизон
Как упоминалось ранее, было выдвинуто предположение, что активность 11β-HSD1 может быть одним из патогенетических механизмов, лежащих в основе развития метаболического синдрома. Данные экспериментальных исследований на животных показали, что селективная 11β-HSD1 гиперэкспрессия в жировой ткани (аналогично тому, что наблюдается у пациентов с ожирением) приводила к развитию метаболического синдрома, и, в частности, дислипидемии, ожирению, гипертензии, связанной с активацией системы ренин-ангиотензин-альдостерон, инсулинорезистентности и нарушению углеводного обмена. Кроме того, адипоциты имели больший размер (рис. 2), чем обычно, основной эффект наблюдался в висцеральной жировой ткани, возможно, из-за более высокой плотности рецепторов к ГКС [6, 7, 8].
Рис. 2 Электронная микрофотография адипоцитов
Полученные данные позволили рассматривать 11b-HSD1 в качестве новой мишени для фармакотерапии. II фаза рандомизированного двойного слепого плацебо-контролируемого исследования эффективности селективного ингибитора 11b-HSD1 (INCB013739) у пациентов с избыточной массой тела/ожирением и СД 2 типа показали статистически значимое увеличение печеночной и периферической чувствительности к инсулину, снижению глюкозы в плазме натощак, общего холестерина и липопротеинов низкой плотности (ЛПНП), триглицеридов плазмы и уровня АД [9]. Открытым остается вопрос: каким образом локальная гиперпродукция ГКС влияет на системный уровень кортизола и нарушается ли при этом механизм отрицательной обратной связи?
Кортизол и кардиоваскулярные риски
По данным Colao A. и соавт., в течение пяти лет после наступления ремиссии болезни Иценко-Кушинга концентрации холестерина, ЛПНП, индекс атерогенности, уровень инсулина остаются выше референсных значений, что определяет этих пациентов в группу высокого риска по сердечно-сосудистым осложнениям даже после достижения ремиссии заболевания [10–12].
Помимо перечисленных метаболических факторов, лежащих в основе кардиоваскулярных нарушений, кортизол оказывает ингибирующее действие на ангиогенез. Под ангиогенезом стоит понимать процесс роста новых кровеносных сосудов, который является необходимым в репарации тканей и при иных заболеваниях, протекающих с развитием ишемии ткани, таких как ишемическая болезнь сердца, хроническая артериальная недостаточность нижних конечностей и тд.
Регулирование ангиогенеза гипоксией является важным компонентом гомеостаза. В норме в ответ на снижение содержания кислорода в тканях, гипо ксие индуцируемый фактор Ia (HIF-1) стимулирует рост новых сосудов. Тот же механизм срабатывает и в ишемизированных тканях [13].
HIF-1 контролируемое производство фактора роста эндотелия сосудов (VEGF) приводит к аутокринной передаче сигнала, что имеет решающее значение для ангиогенеза. Многие из биологических процессов в ангиогенезе, инвазия внеклеточного матрикса и формирование трубки эндотелиальными клетками стимулируются в условиях гипоксии через HIF-1, который активирует транскрипцию десятков генов, чьи белковые продукты играют решающую роль в этих процессах [14].
Как показывают данные исследований, в процессе патологической перестройки миокарда, его гипертрофии, а затем дилятации с развитием сердечной недостаточности, одну из ключевых ролей играет HIF-1. HIF-1 стимулирует выработку VEGF, который, в свою очередь, связывается с рецептором на поверхности эндотелиальных клеток. После чего происходит активация сигнального пути ERK (Ras-ERK и MAPK/ERK), стимулирующего пролиферацию и миграцию эндотелиоцитов [15, 16, 17].
Глюкокортикоид-опосредованное ингибирование ангиогенеза играет важную роль в физиологии, патофизиологии и терапевтических подходах к некоторым заболеваниям. Тем не менее, механизмы, посредством которых глюкокортикоиды ингибируют рост новых кровеносных сосудов, до конца не изучены. В экспериментальном исследовании James J. Logie и соавт. продемонстрировано, что даже физиологические уровни глюкокортикоидов подавляют ангиогенез, непосредственно предотвращая формирование сосудистой трубки эндотелиальными клетками. В процессе ангиогенеза эндотелиальные клетки начинают активно пролиферировать, запускается процесс трансформации их морфологической структуры, что приводит к формированию высокоупорядоченных клеточных линий, составляющих внутренний слой новообразованных сосудов.
Воздействие кортизола снижает образование межклеточных контактов, не ухудшая при этом пролиферации, миграции или жизнеспособности эндотелиальных клеток. Предыдущие исследования показывают, что глюкокортикоиды подавляют ангиогенез путем ингибирования синтеза VEGF [18, 19, 20], что доказывает ингибирующее действие кортизола на сигнальные пути, который инициирует образование тубул.
Таким образом, в условиях гиперсекреции кортизола VEGF-опосредованный ангиогенез нарушается, что быстрее приводит к дезадаптации процессов компенсации сердечной деятельности и развитию тяжелой сердечной недостаточности, что и обуславливает неблагоприятный прогноз у пациентов с гиперкортицизмом любой этиологии.
Синтез кортизола в коже. Регуляция репарации
Ожирение и ассоциированные с ожирением состояния сопровождаются нарушениями физиологической репарации, что увеличивает вероятность замедленного заживления ран. Люди с ожирением имеют высокий риск развития венозных язв, различных кожных заболеваний (например, кандидоза, эритразмы) или более серьезных кожных инфекций (например, целлюлита, некротизирующего фасцита), гнойных осложнений после хирургических вмешательств. Однако роль ГКС в регуляции репарации ран в настоящее время достаточно плохо изучена.
Наряду с тканью надпочечников, синтезирующей глюкокортикоиды, все больше данных стало появляться о местах вненадпочечниковой продукции кортизола, к ним относятся мозг, легкие, сердце, тимус, клети иммунной системы и кожа [21, 22].
Несмотря на основную функцию кожи служить барьером для защиты внутренней среды организма от агрессивных воздействий, последние исследования в дерматологии были посвящены изучению способности клеток эпидермиса секретировать гормоны. Способность взаимодействовать с центральной нервной системой посредством локальной продукции в системный кровоток гормонов, нейропептидов, нейротрансмиттеров и других регуляторных факторов позволяет рассматривать кожу как нейроэндокринный орган [23].
Кератиноциты – первые клетки, которые реагируют на повреждение целостности кожного покрова, запускающего каскад реакций, что способствует изменению фенотипа кератиноцитов, приводит к их миграции и пролиферации, изменению способности кератиноцитов к адгезии и конфигурации цитоскелета [24] (рис. 3).
Рис. 3 Иммунофлюоресцентная микрофотография кератиноцитов
Кератиноциты обладают способностью синтезировать холестерин, который является предшественником всех стероидных гормонов. Кроме того, как показывает ряд исследований, клетки кожи способны секретировать гипоталамо-гипофизарные гормоны: проопиомеланокортин, адренокортикотропный гормон, тиреотропный гормон и соматотропный гормон [25, 26, 27, 28].
Экспрессия ключевых ферментов стероидогенеза в коже подтверждает предположение о том, что эпидермис может быть основным местом вненадпочечникового синтеза кортизола. Как и ожидалось, ферменты, которые контролируют активность кортизола, а именно конверсию в неактивный кортизон 11b-HSD1 и 11b-HSD2, также экспрессируются множеством подтипов кератиноцитов. Экспрессия CYP11B1 преимущественно выражена в базальных и супрабазальных слоях эпидермиса. Эти слои эпидермиса имеют наибольшую способность к пролиферации и являются основными источниками для регенерации тканей [29].
Экспрессия CYP11B1, ключевого фермента синтеза кортизола, повышается в ответ на воздействие АКТГ или провоспалительных цитокинов IL-1, что свидетельствует о прямом стимулирующем действии провоспалительных цитокинов [30] и снижается в ответ на метирапон. По всей видимости, секреция кортизола в ответ на повреждение ткани сначала повышается и достигает пика спустя 48 ч после воздействия повреждающего агента, а затем, при переходе раны в стадию пролиферации, постепенно снижается к исходному уровню спустя 96 ч, что подтверждают данные исследований на культуре человеческих кератиноцитов. Спустя 96 ч увеличивается экспрессия 11-HSD2 – фермента, конвертирующего преобразование активного кортизола в неактивный кортизон. Чтобы подтвердить предположение о существовании отрицательной обратной связи кортизол/IL-1, в культуру клеток добавляли ингибитор синтеза кортизола – метирапон. По сравнению с контролем, в группе метирапона отмечалось повышение экспрессии IL-1, что подтверждает наличие петли обратной связи, которая регулирует первоначальный ответ на повреждение ткани, предотвращая избыточное воспаление, которое может привести к дальнейшему повреждению тканей.
По данным последних исследований, глюкортикоиды действуют через Wnt-сигнальный путь, тем самым влияя на клеточный цикл кератиноцитов, ингибируя пролиферацию, миграцию, и индуцируя клеточную дифференцировку. Кроме того, ГКС ингибируют влияние эпидермального фактора роста (EGF), который непосредственно стимулирует миграцию и пролиферацию клеток [31, 32].
Таким образом, даже при функциональном гиперкортицизме за счет описанных механизмов нарушается нормальная репарация ткани. Эпидермис ран теряет способность к пролиферации и миграции, что может приводить к длительной персистенции раневых де фектов.
Заключение
В свете появляющихся новых данных, взгляд на систему гипоталамус-гипофиз-надпочечники-органы-мишени претерпевает значительные изменения, и наряду с механизмом отрицательной обратной связи возникают предположения о существовании других регуляторных механизмов синтеза, активации и дезактивации ГКС. Тем не менее, в настоящее время имеется сравнительно небольшой объем данных о взаимосвязи между системной и местной продукцией кортизола в тканях. Понимание этих процессов позволит создать необходимую научную базу для поиска и разработки новых мишеней для фармакотерапии заболеваний, ассоциированых с нарушением синтеза, активации и действия ГКС.
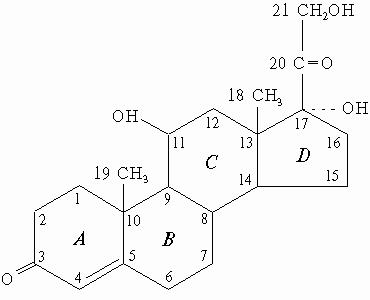
1.Название. Кортизол (гидрокортизон, или 17-гидрокортикостерон, соединение F).
2. Кортизол — биологически активный глюкокортикоидный гормон стероидной природы, то есть в своей структуре имеет стерановое ядро(Рис.3).
3.Биосинтез.Кортизолсинтезируется корой надпочечников из холестерола.У взрослого человека надпочечники за сутки выделяют 15-30 мг кортизола.Скорость синтеза и секреции кортизола стимулируются в ответ на стресс, травму, инфекцию, понижение концентрации глюкозы в крови. Повышение концентрации кортизола подавляет синтез кортиколиберина и АКТГ по механизму отрицательной обратной связи.
4. Биологическая роль.Кортизол жизненно необходим, т.к. участвует в регуляции многих обменных процессов, главным образом, углеводного обмена. Гормон стимулирует процесс глюконеогенеза.
Глюконеогенез — процесс образования в печени и отчасти в корковом веществе почек (около 10 %) молекул глюкозы из молекул других органических соединений — источников энергии, например свободных аминокислот, молочной кислоты, глицерина.
Кроме того, кортизол отвечает за защитные реакции: во время длительного голодания не дает упасть уровню содержания глюкозы в крови ниже критического уровня, усиливая ее синтез и замедляя распад. В стрессовых и шоковых ситуациях поддерживает артериальное давление (не ниже критической отметки).
5.Механизм действия кортизола
Нервная система реагирует на внешние воздействия (в том числе стрессовые), посылая нервные импульсы в гипоталамус. В ответ на сигнал гипоталамус секретирует кортиколиберин, который переносится кровью по т.н. воротной системе прямо в гипофиз и стимулирует секрецию им АКТГ. Последний поступает в общий кровоток и, попав в надпочечники, стимулирует выработку и секрецию корой надпочечников кортизола.
Реакция состоит, с одной стороны, в усилении синтеза глюкозы в печени и в проявлении (разрешении) действия многих других гормонов на обменные процессы, а с другой – в замедлении распада глюкозы и синтеза белков в ряде тканей, в том числе мышечной. Таким образом, эта реакция направлена в основном на экономию имеющихся энергетических ресурсов организма (снижение их расходования мышечной тканью) и восполнение утраченных: синтезируемая в печени глюкоза может запасаться в виде гликогена – легко мобилизуемого потенциального источника энергии.
Кортизол по механизму обратной связи ингибирует образование АКТГ: по достижении уровня кортизола, достаточного для нормальной защитной реакции, образование АКТГ прекращается.
В кровотоке кортизол связан с кортикостероид-связывающим глобулином – белком-носителем, который синтезируется в печени. Этот белок доставляет кортизол к клеткам-мишеням и служит резервуаром кортизола в крови. В печени кортизол подвергается превращениям с образованием неактивных, водорастворимых конечных продуктов (метаболитов), которые выводятся из организма.
Глюкокортикоиды оказывают разностороннее влияние на обмен веществ в разных тканях. В мышечной, лимфатической, соединительной и жировой тканях глюкокортикоиды, проявляя катаболическое действие, вызывают снижение проницаемости клеточных мембран и соответственно торможение поглощения глюкозы и аминокислот; в то же время в печени они оказывают противоположное действие. Конечным итогом воздействия глюкокортикоидов является развитие гипергликемии, обусловленной главным образом глюконеогенезом.
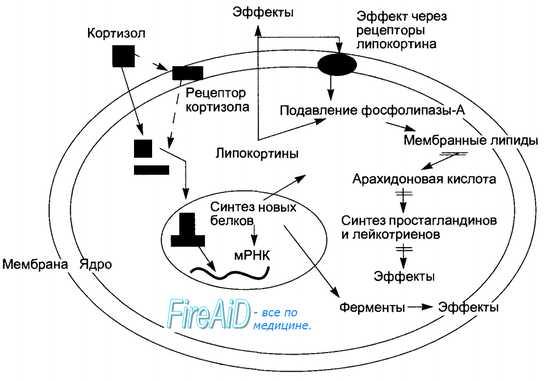
Рис.4. Механизм действия кортизола на клетку-мишень.
6.Норма кортизола меняется в зависимости от времени суток: утром обычно происходит повышение кортизола, вечером — значение кортизола минимально.
Повышенный синтез кортизола наблюдается при болезни Иценко-Кушинга. Болезнь Иценко - Кушинга (болезнь Кушинга) — тяжёлое нейроэндокринное заболевание, сопровождающееся гиперфункцией коры надпочечников, связанное с гиперсекрецией АКТГ. Гиперсекреция АКТГ вызывает повышенную секрецию кортизола, которая приводит к нарушению углеводного обмена, остеопорозу, гипертензии (повышение артериального давления), атрофии кожи, перераспределению жира, гирсутизму у женщин.
Одной из причин недостаточной секреции гормона кортизола может быть болезнь Аддисона. Болезнь Аддисона (гипокортицизм) — редкое эндокринное заболевание, в результате которого надпочечники теряют способность производить достаточное количество гормонов, прежде всего кортизола.Болезнь может быть следствием
первичной недостаточности коры надпочечников (при которой поражена или плохо функционирует сама кора надпочечников),
или вторичной недостаточности коры надпочечников, при которой передняя доля гипофиза производит недостаточно адренокортикотропного гормона (АКТГ) для адекватной стимуляции коры надпочечников.
Болезнь Аддисона приводит к хронической усталости, мышечной слабости, потери веса и аппетита, тошноте, боли в животе, низкому артериальному давлению, гиперпигментации кожи, гипогликемии, снижению объёма циркулирующей крови, обезвоживанию организма, тремору, тахикардии, тревоге, депресии и т.д.
Анализ особенностей устройства надпочечников. Рассмотрение гипер- и гипофункции железы. Обзор строения гормона кортизол. Исследование воздействия на организм. Этапы синтеза и регуляция кортикостероидов в организме. Применение гидрокортизона в медицине.
| Рубрика | Биология и естествознание |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 07.05.2016 |
| Размер файла | 648,1 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Содержание
1. Название внутренней секреции
2. Расположение железы
3. Особенности строения железы, позволяющие ей продуцировать гормоны
4. Название гормона
5. Строение гормона
6. Воздействие гормона на организм
7. Механизм действия гормона
8. Из чего синтезируется гормон
9. Применение гормона в медицинской практике
10. Регуляция деятельности железы
Список использованной литературы
Введение
Гормоны - сигнальные химические вещества, выделяемые эндокринными железами непосредственно в кровь и оказывающие сложное и многогранное воздействие на организм в целом либо на определённые органы и ткани-мишени. Гормоны служат гуморальными (переносимыми с кровью) регуляторами определённых процессов в определённых органах и системах.
В настоящее время описано и выделено более полутора сотен гормонов из разных многоклеточных организмов. По химическому строению их делят на три группы: белково-пептидные, производные аминокислот и стероидные гормоны.
1. Название внутренней секреции
Надпочечники представляют собой парный эндокринный орган, располагающийся в забрюшинном пространстве над верхними полюсами почек на уровне ТhXI - LI позвонков. Масса надпочечников взрослого человека в среднем составляет 5-8 г и, как правило, не зависит от пола и массы тела.
2. Расположение железы
Расположены надпочечники над верхними полюсами почек. У человека они находятся на уровне XI грудного - I поясничного позвонков, забрюшинно. Правый надпочечник имеет треугольную форму, левый - полулунную; вогнутые основания надпочечников примыкают к выпуклым полюсам почек. Вместе с почками надпочечники заключены в жировую капсулу и покрыты почечной фасцией. Длина надпочечника взрослого человека варьирует от 30 до 70 мм, ширина - от 20 до 35 мм, толщина - от 3 до 10 мм, масса обоих надпочечников составляет 10 -14 г.
3. Особенности строения железы, позволяющие ей продуцировать гормоны
Надпочечники состоят из двух слоев, представленных соответственно корковым и мозговым веществом. В коре надпочечников выделяют клубочковую, пучковую и сетчатую зоны.
Кортизол является гормоном пучковой зоны.
4. Название гормона
Систематическое название: (11в)-11,17,21-тригидроксипрегн-4-ен-3,20-дион
5. Строение гормона
Кортизол основной глюкокортикоид (С21-стероиды) человека.
6. Воздействие гормона на организм
Кортизол в норме в цифрах выглядит следующим образом: норма у детей до 15 лет составляет от 80 до 600 нмоль/литр, а для взрослых людей норма колеблется в пределах от 140 до 650 нмоль/литр.
Уровень кортизола при синтезе надпочечников имеет значительные суточные колебания. Утром норма повышена примерно на 50 единиц, нежели вечером. Поэтому анализ на свободный кортизол часто делают исходя из 3-х измерений в течение суток. Кортизол в слюне имеет примерно такую же зависимость для показателей анализа.
При беременности уровень кортизола необычайно высок, он может превышать норму в 3-5 раз, в остальных случаях такое отклонение концентрации от нормы - симптом серьезного заболевания. Основные недуги, повышающие уровень кортизола в крови это: симптомы гепатита и цирроза печени, симптомы сахарного диабета и ожирение, аденома гипофиза.
Кортизол является регулятором углеводного обмена организма, а также принимает участие в развитии стрессовых реакций. Для кортизола характерен суточный ритм секреции: максимальная концентрация отмечается в утренние, а минимальная концентрация в вечерние часы.
Кортизол стимулирует образование глюкозы в печени, усиливая глюконеогенез и одновременно увеличивая скорость освобождения аминокислот - субстратов глюконеогенеза из периферических тканей. В печени кортизол индуцирует синтез ферментов катаболизма аминокислот (аланинаминотрансферазы, трипто-фанпирролазы и тирозинаминотрансферазы и ключевого фермента глюконеогенеза - фосфо-енолпируваткарбоксикиназы). Кроме того, кортизол стимулирует синтез гликогена в печени и тормозит потребление глюкозы периферическими тканями. Это действие кортизола проявляется в основном при голодании и недостаточности инсулина. У здоровых людей эти эффекты кортизола уравновешиваются инсулином.
6.2 Гиперфункция
Гиперпродукция глюкокортикоидов (гиперкортицизм) может быть следствием повышения уровня АКТГ при опухолях гипофиза (болезнь Иценко-Кушинга) и опухолях других клеток (бронхов, тимуса, поджелудочной железы), вырабатывающих кортикотропинподобные вещества, или избыточного синтеза кортизола при гормонально-активных опухолях коры надпочечников (синдром Иценко-Кушинга).
При гиперкортицизме наблюдаются гипергликемия и снижение толерантности к глюкозе, обусловленные стимуляцией глюконеогенеза ("стероидный диабет"), усиление катаболизма белков, уменьшение мышечной массы, истончение кожи, остеопороз, инволюция лимфоидной ткани. Характерно своеобразное перераспределение отложений жира ("лунообразное лицо", выступающий живот). Гипернатриемия, гипертензия, гипокалиемия обусловлены некоторой минералокортикоидной активностью кортизола, которая проявляется при его избытке.
Для выявления первичной причины гиперкортицизма, помимо определения концентрации АКТГ в плазме крови, используют тесты с применением высоких доз синтетического глюкокортикоида дексаметазона (структурного аналога кортизола). Дексаметазон подавляет секрецию АКТГ по механизму отрицательной обратной связи.
Для болезни Иценко-Кушинга характерно снижение концентрации кортизола после применения дексаметазона более чем на 50%. Отсутствие реакции на введение дексаметазона может указывать на наличие опухоли надпочечников или внегипофизарной секреции АКТГ.
6.3 Гипофункция
Первичная недостаточность надпочечников (болезнь Аддисона) развивается в результате поражения коры надпочечников туберкулёзным или аутоиммунным процессом. Основные клинические проявления выражаются в снижении массы тела, общей слабости, снижении аппетита, тошноте, рвоте, снижении АД и типичной для первичной надпочечниковой недостаточности гиперпигментацйи кожи ("бронзовая болезнь"). Причина гиперпигментации - повышение продукции ПОМК - предшественника АКТГ и меланоцитстимулирующего гормона.
Вторичная недостаточность надпочечников может развиться при дефиците АКТГ, что, в свою очередь, может быть следствием опухоли или инфекционного поражения гипофиза. При вторичной недостаточности надпочечников, в отличие от болезни Аддисона, отсутствует гиперпигментация. надпочечник гормон кортизол синтез
При врождённой гиперплазии надпочечников нарушается синтез кортизола. В 95% случаев при этой патологии обнаруживается дефект 21-гидроксилазы (реже 11-гидроксилазы). Снижение продукции кортизола сопровождается увеличением секреции АКТГ, накоплением промежуточных продуктов синтеза кортикостероидов, в частности, предшественников андрогенов.
Избыток андрогенов ведёт к усилению роста тела, раннему половому созреванию у мальчиков и развитию мужских половых признаков у девочек (адреногенитальный синдром).
При частичной недостаточности 21-гидроксилазы у женщин может нарушаться менструальный цикл.
7. Механизм действия гормона
Выделившийся в кровь кортизол достигает клеток-мишеней (в частности, клеток печени). Благодаря своей липофильной природе легко проникает через клеточную мембрану в цитоплазму и ядро, где связывается со специфическими рецепторами. Гормон-рецепторный комплекс является фактором транскрипции, - активирует транскрипцию определённых участков ДНК. В результате синтез глюкозы в гепатоцитах усиливается, тогда как в мышцах снижается распад глюкозы. В клетках печени глюкоза запасается в виде гликогена. Таким образом, эффект кортизола состоит в сохранении энергетических ресурсов организма.
8. Из чего синтезируется гормон
Кортизол синтезируется из холестерола, который в основном поступает из крови в составе ЛПНП или синтезируется в клетках из ацетил-КоА. Значительная часть эфиров холестерола накапливается в цитозоле клеток в липидных каплях. Под влиянием АКТГ происходит активация специфической эстеразы, и свободный холестерол транспортируется в митохондрии.
Строение и основные этапы синтеза кортикостероидов:
1 - превращение холестерола в прегненолон (гидроксилаза, отщепляющая боковую цепь);
2 - образование прогестерона (3-в-гидроксистероиддегидрогеназа);
3,4,5 - реакции синтеза кортизола (3 - 17-гидроксилаза, 4 - 21-гидроксилаза, 5 - 11-гидроксилаза);
9,10,11 - путь синтеза тестостерона (9 - 17-гидроксилаза, 10 - 17,20-лиаза, 11 - дегидрогеназа).
Синтез кортизола начинается с превращения прегненолона в прогестерон. Эта реакция протекает в цитозоле клеток пучковой зоны коры надпочечников, куда прегненолон транспортируется из митохондрий. Реакцию катализирует 3-в-гидроксистероиддегидрогеназа.
В мембранах ЭР при участии 17-б-гидроксилазы происходит гидроксилирование прогестерона по С17 с образованием 17-гидроксипрогестерона. Этот же фермент катализирует превращение прегненолона в 17-гидроксипрегненолон, от которого далее при участии 17,20- лиазы может отщепляться двухуглеродная боковая цепь с образованием С19-стероида - дегидроэпиандростерона. 17 -гидроксипрогестерон служит предшественником кортизола, а дегидроэпиандростерон - предшественником андрогенов. Далее 17-ОН-прогестерон гидроксилируется 21-гидроксилазой (P450-C21), локализованной в мембране ЭР, и превращается в 11-дезоксикортизол, который переносится во внутреннюю мембрану митохондрий, где гидроксилируется при участии цитохрома Р450-с11 с образованием кортизола.
Скорость синтеза и секреции кортизола стимулируются в ответ на стресс, травму, инфекцию, понижение концентрации глюкозы в крови. Повышение концентрации кортизола подавляет синтез кортиколиберина и АКТГ по механизму отрицательной обратной связи.
Внутриклеточная локализация синтеза кортизола:
1 - аденилатциклазный комплекс;
3 - протеинкиназа А;
4 - холестеролдесмолаза отщепляет боковую цепь холестерола. ХС - холестерол; ЭХС - эфиры холестерола.
9. Применение гормона в медицинской практике
Кортизон - натуральный стероидный гормон, имеет ограниченное применение в связи с большим спектром побочных реакций. В настоящее время на основе кортизона разработаны синтетические глюкокортикоидные препараты, более эффективные и легко переносимые.
Препарат назначается только после глубокого обследования, кроме того, необходимо обеспечить постоянное наблюдение врача за массой тела, картиной крови, содержанием глюкозы в крови, артериальным давлением, состоянием психики, что возможно, как правило, только в условиях стационара.
Последствия длительного лечения и больших доз кортизона могут быть следующими: вирильное ожирение, гирсутизм, нарушения менструального цикла, остеопороз, симптомокомплекс Иценко - Кушинга, психические нарушения, угри, возможны прободения нераспознанной язвы, изъязвления пищеварительного тракта, геморрагический панкреатит.
Гидрокортизон является производным кортизона, используется в лечении таких заболеваний, как бурсит, артрит, тендовагинит, воспалительных и аллергических заболеваний кожи немикробной этиологии (аллергическом и контактном дерматите, экземе, нейродермите).
Применяется под контролем лечащего врача с систематическим обследованием крови, артериального давления, состояния психики и массы тела. Побочные явления при применении препарата случаются довольно часто. Такие явления, как вирильное ожирение, гирсутизм, угри, нарушения менструального цикла, остеопороз, симптомокомплекс Иценко - Кушинга, психические нарушения, геморрагический панкреатит, изъязвления пищеварительного тракта, прободения нераспознанной язвы, являются основанием для исключения из применения препаратов гормональной принадлежности.
В случае инфекционных заболеваний кожи, при язвенных поражениях кожи, туберкулезе, микозах, пиодермии, ранах применение гидрокортизона противопоказано.
В последнее время препарат не так широко используется, так как существуют более эффективные синтетические аналоги.
Преднизолон выступает в роли аналога гидрокортизона.
Является незаменимым средством при бронхиальной астме, инфекционном полиартрите, ревматизме, лимфатической и миелоидной лейкемии в стадии обострения, инфекционном мононуклеозе, нейродермитах. Неплохой эффект достигается при миастении, хроническом гломерулонефрите и циррозе печени.
10. Регуляция деятельности железы
Выработка гормонов надпочечника находится под контролем ЦНС и в тесной связи с функцией гипофиза.
Кортизол (гидрокортизон) является одним из двух основных представителей глюкокортикоидов (второй - кортикостерон) - гормонов позвоночных животных и человека, вырабатываемых корой надпочечников и регулирующих углеводный и белковый обмен в организме. Глюкокортикоиды увеличивают отложение гликогена в печени и повышают концентрацию глюкозы в крови, тормозят синтез белка в лимфоидной ткани, мышцах, соединительной ткани, но стимулируют образование белка в печени. Секреция глюкокортикоидов надпочечниками увеличивается под влиянием неблагоприятных воздействий (стресс), таким образом обеспечивается адаптация организма к изменившимся условиям внешней среды. В больших дозах глюкокортикоиды обладают противовоспалительным и десенсибилизирующим действием, что обусловливает их применение и их синтетических аналогов (преднизолон, триамцинолон, дексаметазон) в качестве противовоспалительных и антиаллергических средств.
Список использованной литературы
1. Биохимия: Учеб. для вузов, Под ред. Е.С. Северина., 2003.
Подобные документы
Описание сущности и устройства желез. Классификация этих органов в человеческом организме. Причины гипофункции и гиперфункции желез. Функции гипофиза. Роль щитовидной железы в эндокринной системе. Деятельность надпочечников, поджелудочной железы.
презентация [2,7 M], добавлен 10.09.2014
Стресс-реакция. Адреналин. Адренокортикотропный гормон. Кортизол и кортикостерон. Физическая работа как стресс-воздействие. Создание ступенчато повышающейся физической нагрузки. Определение уровня гормонов. Определение адренокортикотропного гормона.
дипломная работа [77,0 K], добавлен 15.12.2008
Биохимическое исследование кортикостероидов как подкласса стероидных гормонов, производимых исключительной корой надпочечников. Химическое строение и минералокортикоидная активность кортикостероидов. Анализ биологической роли и биосинтез кортикостероидов.
реферат [491,8 K], добавлен 16.04.2011
Регуляция деятельности внутренних органов посредством гормонов. Строение, функции, кровоснабжение, лимфоотток и иннервация гипофиза, сосудов и нервов, эпифиза, щитовидной железы, паращитовидной железы, поджелудочной железы, надпочечников, тимуса.
презентация [1,3 M], добавлен 27.04.2016
Гормоны коры и мозгового вещества надпочечников. Механизм действия стероидных гормонов. Функциональные взаимодействия в системе "гипоталамус - гипофиз - кора надпочечников". Гормоны щитовидной железы и их синтез. Синдромы нарушения выработки гормонов.
Кортизол – это гормон надпочечников. Его функция заключается в защите организма от внешних стрессов, посредством регулирования артериального давления. Кортизол принимает участие в обмене белков, углеводов и липидов. Кортизол выполняет ряд регуляторных функций, например, стимулирует выработку глюкозы из аминокислот печени, расщепление жиров для получения энергии, реагирует на воспалительные процессы в организме. Кортизол – это гормон стресса, эволюционно механизм активности этого гормона был связан с продолжительным периодом борьбы организма с нехваткой пищи.
Надпочечники – это парные секреторные органы. Расположены в верхней части почек. Надпочечники секретируют гормоны, необходимые для нормальной работы метаболизма.
Регуляция синтеза и активности кортизола осуществляет адренокортикотропный гормон (АКТГ). За выработку АКТГ отвечает гипофиз – это железа головного мозга, находящаяся в его нижней части. Взаимодействие кортизола и АКТГ осуществляется по методу обратной связи. Если в крови повышается концентрация кортизола, то происходит ингибирование выработки АКТГ. И наоборот, низкие концентрации кортизола активируют синтез АКТГ.
В норме уровень кортизола остается неизменным. От кортизола зависит уровень агрессии, лояльности, настроения, репродуктивные функции. Повышенная секреция кортизола происходит в ответ на стрессовые ситуации. Но в отличие от адреналина, выработка которого активирует физическую иммобилизацию, силу, повышенное внимание, кортизол стимулирует катаболические процессы в организме и активирует клеточный распад. Такой эффект наблюдается при длительном воздействие стрессовых факторов на организм. Для спортсменов этот фактор особенно важен. Если после интенсивной тренировки не нормализовать уровень кортизола, то запустятся катаболические механизмы, которые будут препятствовать росту мышечной массы. Кортизол влияет на белковые молекулы, которые выступают строительным материалом для мышечной ткани. Тонус мускулатуры будет снижен, а соответственно, и ее объем. Несмотря на такие негативные эффекты нормальные концентрации кортизола в крови жизненно необходимы для человека.
Функции, которые выполняет кортизол
- Нормализации артериального давления;
- Активации обменных механизмов глюкозы и инсулина;
- Быстрого противовоспалительного эффекта;
- Регуляции водного баланса, снимает отечность;
- Выведения токсинов из организма;
- Оказания противоаллергического эффекта.
Увеличение концентрации кортизола приводит к повышению артериального давления, скачку сахара в крови. На фоне длительного повышенного уровня кортизола развивается ожирение, ухудшение качества кожи и проявляются растяжки.
Клинический тест на уровень кортизола назначают для диагностики заболеваний коры надпочечников, например, синдром Кушинга и болезнь Аддисона. Результаты исследования уровня кортизола используют оценки причин нарушения обменных процессов в организме.
Измерение уровня кортизола в крови – это сравнительно точное исследование функции надпочечников. Уровень кортизола может меняться в течение дня. Максимальный уровень кортизола можно наблюдать в утренние часы, сразу после пробуждения, а минимальные – во второй половине дня, хотя всплески секреции кортизола могут происходить ночью. Для людей имеющий сменный график работы, и имеющие активность в ночное время эта картина может быть обратной. Для клинической диагностики используют результаты тестов на кортизол и АКТГ совместно, поскольку каждый из них контролирует концентрацию другого по принципу обратной связи (изменения одного гормона вызывают изменения в уровне другого в обратнопропорциональной зависимости).
Подготовка к исследованию
- Забор крови осуществляют в утренние часы натощак (не менее 6-8 часов после последнего приема пищи), если нет иных указаний направляющего врача;
- Разрешается пить воду без газа;
- Исключить физическую активность и стресс за сутки минут до анализа;
- Запрещается принимать алкоголь за сутки до исследования;
- За 30 минут до взятия крови воздержаться от курения.
Показания к назначению анализа
- При подозрении на развитие гиперфункции надпочечников (синдром Кушинга). Симптоматическая картина выражена повышенным артериальным давлением, склонностью к ожирению, мышечной дистрофии, проявлением растяжек в области живота;
- Диагностика гипофункции надпочечников (болезнь Аддисона);
- При таком состояние характерны быстрая утомляемость, слабость, пониженное артериальное давление, пигментные пятна на коже;
- Общее нарушение обменных процессов в организме;
- Нарушение менструального цикла;
- Для нормализации артериального давления;
- При наблюдении за состоянием пациента, проходящего лечение от перечисленных синдромов.
Интерпретация результатов
Уровень кортизола может варьировать в зависимости от пола и возраста. Даже у одного и того же человека, в течение суток, уровни кортизола могут значительно отличаться. Эмоциональные и физические нагрузки также могут внести определенные коррективы в полученные результаты. Поэтому принято использовать предельные показатели как норму, а сильные отклонения уже считать патологией.
Концентрация кортизола в крови у женщин в период покоя и при отсутствии гормональных перемен практически не отличается от уровня кортизола мужчины.
Уровни кортизола в слюне и в крови имеют схожее значение и могут использоваться для скрининга на болезнь Иценко-Кушинга и синдром Кушинга.
Существует три основных нарушения, возникающие в результате дисбаланса уровня кортизола.
- Эндогенный синдром Кушинга может быть АКТГ-независимый и АКТГ-зависимый. При АКТГ-независимой формы заболевания или первичный гиперкортицизм причиной увеличения концентрации кортизола могут быть опухоли надпочечников (одиночные или множественные аденомы), гиперплазия надпочечников. АКТГ-зависимый синдром Кушинга или вторичный гиперкортицизм – это гипофизарная форма заболевания. При этом состоянии происходит избыточный синтез АКТГ гипофизом. Также эту форму принято называть - болезнь Иценко-Кушинга. Это состояние, при котором гипофиз выделяет слишком много АКТГ, что приводит к перепроизводству кортизола.
- Экзогенный синдром Кушинга может быть стимулирован приемом глюкокортикостероидных препаратов в больших дозах. При таком состоянии источником повышенного кортизола становится внешнее воздействие неправильной медикаментозной терапии.
- мышечную дистрофию,
- изменение фигуры и черт лица,
- быструю утомляемость,
- непереносимость физических упражнений,
- плохо заживающие раны и ссадины,
- склонность к синякам и гематомам,
- головные боли,
- повышенный аппетит,
- склонность к депрессивный состояниям,
- слабый иммунитет.
Болезнь Аддисона
Болезнь Аддисона вызывается неспособностью надпочечников вырабатывать кортизол. Такая гипофункция коры надпочечников развивается медленно и сопровождается низким уровнем всех гормонов, вырабатываемых надпочечниками. Неспособность организма вырабатывать кортизол, приводит к серьезным нарушениям, поскольку, в случае стресса отсутствует защитный механизм. Такие люди предрасположены тяжелым травмам, сильной усталости и подавленному состоянию, тяжелому психологическому стрессу. Причинами гипофункции надпочечников могут быть опухолевые процессы, разрушающие орган, туберкулезная инфекция, некоторые аутоиммунные реакции.
Читайте также:

