Массовое число это кратко
Обновлено: 03.07.2024
В массовое число Массовое число атома - это сумма количества протонов и количества нейтронов в ядре. Эти частицы взаимозаменяемо обозначаются именем нуклоны, поэтому массовое число представляет их количество.
Пусть N - количество присутствующих нейтронов, а Z - количество протонов, если мы назовем A массовым числом, тогда:
Примеры массовых чисел
Вот несколько примеров массовых чисел для хорошо известных элементов:
Водород
Самый стабильный и многочисленный атом водорода также самый простой: 1 протон и один электрон. Поскольку ядро водорода не имеет нейтронов, верно, что A = Z = 1.
Кислород
В ядре кислорода 8 нейтронов и 8 протонов, поэтому A = 16.
Углерод
Жизнь на Земле основана на химии углерода, легкого атома с 6 протонами в ядре плюс 6 нейтронов, поэтому A = 6 + 6 = 12.
Уран
Этот элемент, намного тяжелее предыдущих, хорошо известен своими радиоактивными свойствами. В ядре урана 92 протона и 146 нейтронов. Тогда его массовое число A = 92 + 146 = 238.
Как получить массовое число?
Как упоминалось ранее, массовое число A элемента всегда соответствует сумме числа протонов и числа нейтронов, содержащихся в его ядре. Это тоже целое число, но . есть ли какое-нибудь правило относительно соотношения между двумя величинами?
Посмотрим: все перечисленные элементы легкие, кроме урана. Атом водорода, как мы уже сказали, самый простой. В нем нет нейтронов, по крайней мере, в его наиболее распространенной версии, а в кислороде и углероде есть равное количество протонов и нейтронов.
То же самое происходит и с другими легкими элементами, такими как азот, еще один очень важный для жизни газ, который имеет 7 протонов и 7 нейтронов. Однако по мере того, как ядро становится более сложным, а атомы становятся тяжелее, количество нейтронов увеличивается с другой скоростью.
В отличие от легких элементов, уран с 92 протонами имеет примерно в 1 ½ раза больше нейтронов: 1 ½ x 92 = 1,5 x 92 = 138.
Как видите, это довольно близко к 146 - количеству нейтронов, которое он имеет.
Все это становится очевидным на кривой на рисунке 2. Это график зависимости N от Z, известный каккривая ядерной устойчивости. Там вы можете увидеть, как легкие атомы имеют такое же количество протонов, что и нейтроны, и как с Z = 20 количество нейтронов увеличивается.
Таким образом, большой атом становится более стабильным, так как избыток нейтронов уменьшает электростатическое отталкивание между протонами.
Обозначения для атомов
Очень полезная запись, которая быстро описывает тип атома, следующая: символ элемента и соответствующие атомные и массовые числа записываются, как показано ниже на этой диаграмме:
В этих обозначениях атомы в предыдущих примерах будут:
Иногда используются другие более удобные обозначения, в которых для обозначения атома используются только символ элемента и массовое число, без атомного номера. Таким образом, 12 6C просто записывается как углерод-12, 16 8Или кислород - 16 и так далее для любого элемента.
Изотопы
Число протонов в ядре определяет природу элемента. Например, каждый атом, ядро которого содержит 29 протонов, является атомом меди, несмотря ни на что.
Предположим, атом меди по какой-то причине теряет электрон, это все равно медь. Однако теперь это ионизированный атом.
Атомному ядру сложнее получить или потерять протон, но в природе это может происходить. Например, внутри звезд более тяжелые элементы непрерывно образуются из легких элементов, поскольку звездное ядро ведет себя как термоядерный реактор.
И прямо здесь, на Земле, есть феномен радиоактивный распад, в котором некоторые нестабильные атомы изгоняют нуклоны и излучают энергию, превращаясь в другие элементы.
Наконец, существует вероятность того, что атом определенного элемента имеет другое массовое число, в данном случае это изотоп.
Хороший пример - всем известный углерод-14 или радиоуглерод, который используется для датировки археологических объектов и как биохимический индикатор. Это тот же углерод с идентичными химическими свойствами, но с двумя дополнительными нейтронами.
Углерод-14 менее распространен, чем углерод-12, стабильный изотоп, а также радиоактивен. Это означает, что со временем он распадается, выделяя энергию и частицы, пока не станет стабильным элементом, которым в его случае является азот.
Изотопы углерода
Углерод существует в природе как смесь нескольких изотопов, наиболее распространенными из которых являются уже упомянутые 12 6С или углерод-12. А кроме углерода-14 есть 13 6C с дополнительным нейтроном.
Это обычное явление в природе, например, известно 10 стабильных изотопов олова. С другой стороны, из бериллия и натрия известен только один изотоп.
Каждый изотоп, природный или искусственный, имеет разную скорость превращения. Таким же образом можно создавать искусственные изотопы в лаборатории, которые, как правило, нестабильны и радиоактивно распадаются за очень короткий период долей секунды, в то время как для других требуется гораздо больше времени, равное возрасту Земли или больше.
Таблица природных изотопов углерода
| Изотопы углерода | Атомный номер Z | Массовое число A | Изобилие% |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.11 |
| 14 6 C | 6 | 14 | Следы |
Примеры работы
- Пример 1
В чем разница между 13 7 N и 14 7 N?
Ответить
Оба являются атомами азота, так как их атомный номер равен 7. Однако один из изотопов с A = 13 имеет на один нейтрон меньше, а 14 7 N - самый распространенный изотоп.
- Пример 2
Сколько нейтронов находится в ядре атома ртути, обозначаемого как 201 80 Hg?

Ключевые слова конспекта: строение атома, элементарные частицы, протоны и электроны в атомах, атомный номер, массовой число, число нейтронов, нуклид, изотопы, ионы, катионы, заряд иона.
Согласно модели Резерфорда каждый атом состоит из находящегося в его центре ядра и электронной оболочки. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. Электроны движутся вокруг ядра. Число электронов атома равно положительному заряду ядра.
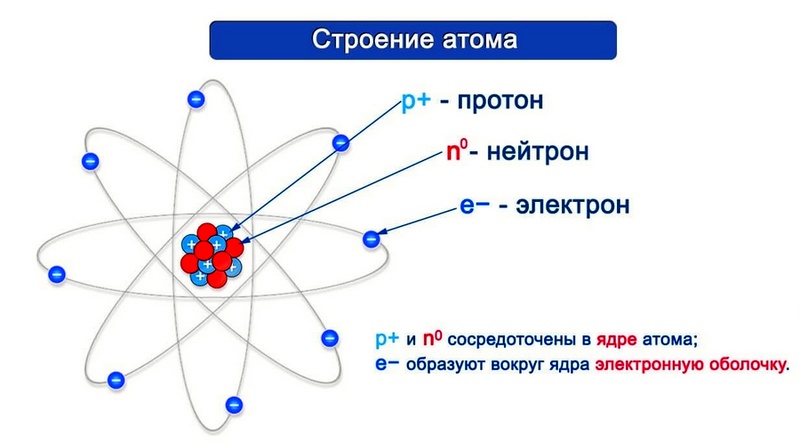
Диаметр атома 10 -10 м, диаметр ядра 10 -14 – 10 -15 м. Масса атома водорода равна 1,67 • 10 -24 г, атома углерода — 1,99 • 10 -23 г, атома железа — 9,29 • 10 -23 г.
Элементарные частицы — это протоны, электроны и нейтроны, из них состоят все атомы.
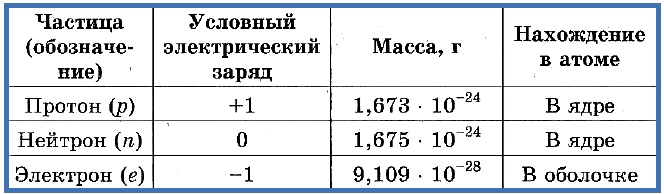
Число протонов разное у атомов различных видов, оно определяет заряд ядра атома и равно атомному номеру элемента в таблице Менделеева. Поскольку атом — электро-нейтральная частица, число электронов в нем равно числу протонов.
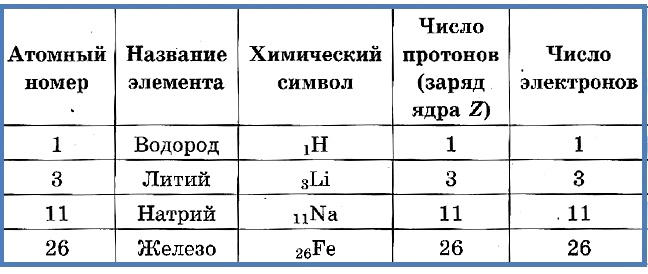
Атомный номер указывают слева внизу от символа элемента, например: 1Н, 26Fe. Обозначение атомного номера — прописная латинская буква Z.
Массовое число атома А — это сумма чисел его протонов и нейтронов в ядре. Массовое число указывают слева вверху от символа элемента или добавляют к названию элемента через дефис, например: 23 Na или натрий-23.
Массовое число кислорода, А( 16 О) = 16 = (8р + 8n).
Число нейтронов N в ядре атома определяют по формуле: N = A — Z. Например, для атома натрия с массовым числом 23, 23 Na: А = 23, Z = 11, N = А – Z = 23 — 11 = 12.
Нуклид — это вид атомов с определенным числом протонов и нейтронов в ядре. Например, в природе встречается три вида нуклидов кислорода: 16 О, 17 О и 18 О.
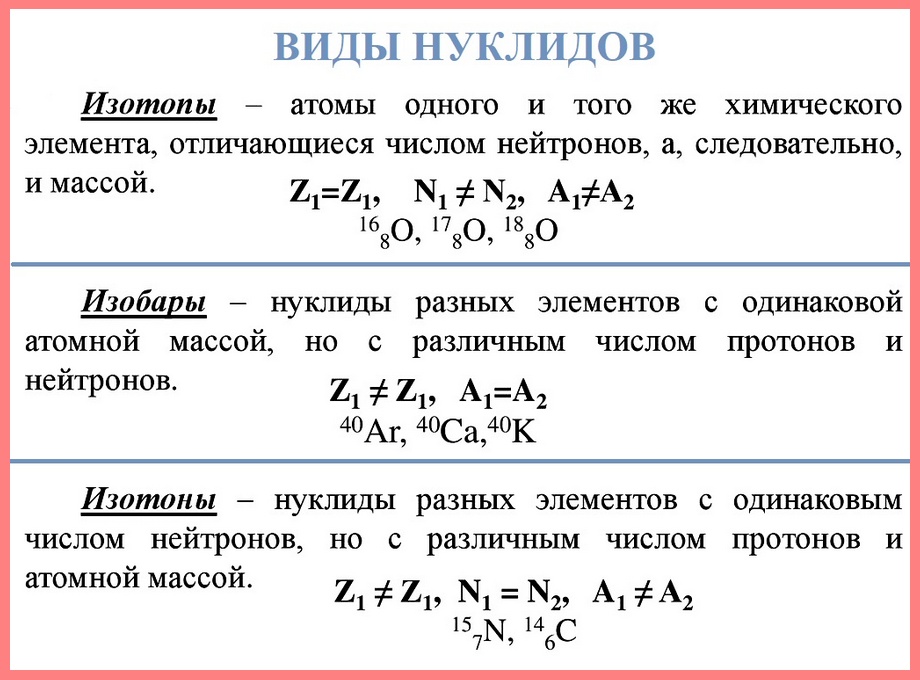
Изотопы — это атомы одного вида с одинаковым числом протонов, но разным числом нейтронов. Так, атомы 16 О, 17 О и 18 О — это изотопы. Природные изотопы урана — 234 U, 235 U и 238 U.
Ионы — заряженные частицы, образующиеся при отщеплении от нейтральных атомов или присоединении к ним электронов. Ионы образуются также из молекул в результате присоединения протона Н + (NH3 → NH4 + ) или отщепления Н + (HNO3 -> NO3 – ).

Катионы — это положительно заряженные ионы (Na + , Аl 3+ ), анионы — отрицательно заряженные ионы (Cl – , NO3 – ).
Заряд иона указывают в виде индекса справа вверху от символа химического элемента: Li + , Са 2+ . На первом месте пишут цифру, на втором — знак заряда. Цифру 1 не пишут.
Согласно протонно-нейтронной модели строения атомного ядра, заряд ядра должен быть равен сумме зарядов всех протонов, которые входят в его состав. Так как заряд протона равен элементарному заряду, то можно считать, что:
Экспериментально было доказано, что число Z совпадает с порядковым номером химического элемента в Периодической системе Менделеева.
Количество протонов в ядре атома совпадает с номером химического элемента в Периодической системе химических элементов и называется зарядовы м числом ( Z ).
Количество нейтронов в ядре атома принято обозначать N . Тогда количество протонов и нейтронов в ядре атома можно вычислить как:
Химические свойства атома определяются зарядовым числом, так как это число указывает на номер атома в периодической системе, т. е. определяет, какой именно это химический элемент. Физические свойства атома могут быть разными в зависимости от массового числа. Действительно, экспериментально было доказано, что ядра одного и того же химического элемента могут обладать разными массами. Например, в природе существует несколько видов атомов водорода: водород , дейтерий и тритий . Масса дейтерия приблизительно в два, а трития — в три раза больше массы водорода.
Так как изотопы — это атомы одного и того же химического элемента , то зарядовое число у изотопов одинаковое, а массовые числа различные. Это означает, что ядра изотопов содержат одинаковое число протонов и разное количество нейтронов.

Массовое число ( ) это термин , используемый в химии и физике , чтобы представлять число нуклонов , то есть сумма числа протонов (ов) , а количество нейтронов (ы) ( Н ) , составляющие ядро А.Н. атома .
Например, ядро углерода 12 ( 12 C) имеет 6 протонов и 6 нейтронов , поэтому его массовое число равно 12 (6 + 6).
Именно это число , которое определяет изотопное разнообразие в виде химического элемента . Он определяет количество нейтронов ( N ), количество протонов известно по атомному номеру ( Z ).
Химические элементы с одинаковым атомным номером, но с несколькими нейтронами и, следовательно, с другим массовым числом, называются изотопами .
Химические элементы с одинаковым массовым числом ( A ) называются изобарами .
Ядро с четным массовым числом - бозон ; тот, у которого нечетное массовое число, - фермион .
Читайте также:

