Комплексные соединения в природе кратко
Обновлено: 30.06.2024
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
ученица 10 класса
Богачева Людмила Анатольевна
Теоретическая часть
История открытия комплексных соединения…………………………………..…4
Комплексные соединения в природе……………………………………………. 6
Пространственное строение и изомерия комплексных соединений …………. 7
Основные типы и номенклатура комплексных соединений ……………….…..10
Природа химической связи в комплексных соединениях…………………….…13
Химический свойства комплексных соединений…………………………. …..15
Практическое применение комплексных соединений…………………..………17
Практическая часть
Получение комплексных соединений…………………………………………….18
Опыт, доказывающий гидратную изомерию…. ………………………….……..19
Выделение хлорофилла из зеленых листьев……………………………………. 20
Составление рекомендаций по использованию коллекции…………………….23
Список используемой литературы ………………………………………………….25
Комплексные соединения (лат. Complexus – сочетание, обхват) или, другими словами, координационные соединения- это частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами.
Комплексные соединения составляют наиболее обширный и разнообразный класс неорганических веществ. К ним принадлежат также многие металлорганические соединения, связывающие воедино ранее разобщенные неорганическую химию и органическую химию. Многие комплексные соединения витамин В 12, гемоглобин, хлорофилл и другие – играют большую роль в физиологических и биохимических процессах. Исследование свойств и пространственного строения комплексных соединений оказалось черезвычайно плодотворным для кристаллохимии, изучающей зависимость физико-химических свойств от структуры образуемых ими кристаллов, и породило новые представления о природе химической связи. К ценным результатам привело применение комплексных соединений и в аналитической химии. Не будет увеличением сказать, что успехи теоретической и прикладной химии за последние годы во многом связаны с изучением комплексных соединений.
Таким образом, можно сформулировать цель моей работы: «Изучить комплексные вещества, для успешной сдачи ЕГЭ по химии, и для пополнения копилки знаний о различных химических группах. Для успешного выполнения поставленной цели, нужно выполнить ряд задач:
Найти подходящий материал по данной теме
Практическим путем получить некоторые комплексные соединения, тем самым составив коллекцию для кабинета химии
Подробно изучить самые главные комплексные соединения: гемоглобин и хлорофилл
Теоретическая часть
История открытия комплексных соединений
Основателем координационной теории комплексных соединений является швейцарский химик Альфред Вернер (1866—1919) ( Приложение 1 ). Координационная теория Вернера 1893 года была первой попыткой объяснить структуру комплексных соединений. Эта теория была предложена до открытия электрона Томсоном в 1896 году, и до разработки электронной теории валентности. Вернер не имел в своём распоряжении никаких инструментальных методов исследований, а все его исследования были сделаны интерпретацией простых химических реакций.
В 1911 г. осуществление Вернером синтеза более чем 40 оптически активных молекул, не содержащих атомов углерода, убедило химическое сообщество в справедливости его теории.
2.2 Комплексные соединения в природе
Комплексные соединения широко распространены в живой природе и минеральном мире.
Гемоглобин, который входит в состав красных телец крови людей и животных, состоит из белка глобина и окрашенного соединения – гемма. Гемм представляет собой сложное комплексное соединение, в котором центральный атом Fe (+2). (Приложение 2)
Хлорофилл – зеленое вещество растений, имеет аналогичное строение, с той только разницей что центральным атомом является Магний. (Приложение 3) . Хлорофилл присутствует во всех фотосинтезирующих организмах — высших растениях, водорослях, сине-зелёных водорослях (цианобактериях), фотоавтотрофных простейших (протистах) и бактериях. Хлорофилл находит применение как пищевая добавка, однако при хранении в этанольном растворе, особенно в кислой среде, неустойчив, приобретает грязно-коричнево-зеленый оттенок, и не может использоваться как натуральный краситель. Нерастворимость нативного хлорофилла в воде также ограничивает его применение в качестве натурального пищевого красителя. Но хлорофилл вполне успешно используется в качестве натуральной замены синтетических красителей при изготовлении кондитерских изделий.
Голубая кровь некоторых морских животных содержит похожие с хлорофиллом соединения, в которых роль центрального атома выполняет Cu.
Витамин В12 – это тоже комплексное соединение, центральным атомом которого является атом Кобальта. Витамин В12 влияет на жировой, углеводный и белковый обмены. Стимулирует образование эритроцитов в костном мозге и рост аксонов нервных клеток.
Огромное количество лекарственных препаратов представляют собой комплексные соединения.
Большая часть минерального мира – это тоже комплексы. И между многих других такие ценные представители как изумруды Be3Al2[Si6O18], гранаты (Fe,Mn)3Al2[SiO4]3 , бирюза CuAl6(OH)8[PO4]4 и тому подобное.
Комплексные соединения (лат. Complexus – сочетание, обхват) или, другими словами, координационные соединения- это частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами.
Одинаковые лиганды симметрично располагаются в пространстве вокруг центрального атома. Чаще всего встречаются четные координационные числа – 2, 4, 6. Им соответствуют следующие геометрические конфигурации:
Одинаковые лиганды находятся по разные стороны от комплексообразователя, с углом 180 0 . Наблюдается у лекарственного препарата золота (I) хризолана Na 3 [Au(S 2 O 3 ) 2 ], используемого при лечении ревматоидного артрита: [O 3 S 2 –Au–S 2 O 3 ] 3-
-т етраэдрическая
По аналогии с катионом аммония (NH 4 + ) лиганды в таких комплексных соединениях располагаются в вершинах тетраэдра. Проявляется у комплексной соли цинка [Zn(NH 3 ) 4 ]Cl 2 , с электронной формулой валентной оболочки катиона 3d 10 4s 0 4p 0 .
-п лоская квадратная
Характерна для [Cu(NH 3 ) 4 ]SO 4 – комплекса, у которого из-за наличия неспаренногоd-электрона у ионаCu 2+ тетраэдрическое расположение лигандов сменяется на плоское квадратное.
- октаэдрическая, схематически можно изобразить так:

Самая многочисленная группа комплексных соединений:Na 2 [SiF 6 ],K 2 [PtCl 6 ],H 4 [Mn(CN) 6 ] и т.д., образуемых элементами V, VI и VII периодов таблицы Менделеева.
При наличии двух или большего числа неоднородных лигандов эквивалентность расположения их во внутренней сфере комплексообразователя нарушается и возможно появление комплексных изомеров, различающихся по цвету, растворимости, реакционной способности, дипольному моменту, способам получения. Для комплексных соединений свойственны следующие типы изомерии: геометрическая, сольватная (в водных растворах гидратная), ионизационная, координационная и оптическая (зеркальная).
Геометрическая или пространственная изомерия заключается в том, что комплекс, включающий неодинаковые лиганды, может существовать в двух или нескольких различных формах в зависимости от пространственного размещения лигандов вокруг комплексообразователя. К геометрической изомерии в первую очередь относится цис-транс -изомерия, проявляющаяся в основном в плоско-квадратных и о ктаэдрических комплексах:
цис (оранжево-желтый) транс (светло-желтый)
цис (оранжевый) транс (желтый)
Различие в структуре обусловливает различную физиологическую активность таких соединений. Например, малотоксичный плоско-квадратный цис-изомер платины обладает противоопухолевой активностью и нашёл применение в качестве лекарственного препарата; транс-изомер значительно более токсичен без какого-либо противоопухолевого действия.

Оптическая изомерия. Наблюдается у комплексных соединений, структура которых не имеет элементов симметрии. В простейшем случае это тетраэдрический комплекс, с четырьмя различными лигандами, для которого существуют два изомера (см. схему), не совмещающиеся в пространстве. Такие изомеры называют оптическими антиподами . Один из оптических изомеров способен вращать плоскость поляризованного света влево (L-изомер), второй – вправо (D-изомер).
Другие виды изомерии вызваны различным положением и связью лигандов внутренней и внешней координационных сфер. Так, гидратная изомерия имеет место при переходе воды из внутренней во внешнюю сферу. Например, для хлорида хрома (III) известны три модификации:
Ионизационная изомерия обусловлена различным распределением неодинаковых по своей природе ионов между внутренней и внешней координационными сферами, что приводит к изменению степени диссоциации комплексного соединения. Например: [Co(NH 3 ) 5 Br]SO 4 – красно-фиолетовый; [Co(NH 3 ) 4 SO 4 ]Br– красный, в большей степени диссоциирующий комплекс.
Координационная изомерия связана с переходом лигандов от одного комплексообразователя к другому в соединениях, образованных комплексными катионами и комплексными анионами: [Co(NH 3 ) 6 ] ∙ [Cr(CN) 6 ] и [Co(CN) 6 ] ∙ [Cr(NH 3 ) 6 ].
2.4 Основные типы и номенклатура комплексных соединений
К основным типам комплексных соединений относятся следующие:
Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: , , . Известны комплексы, аналогичные аммиакатам, в которых роль лиганда выполняют молекулы аминов: (метиламин). Такие комплексы называют аминатами.
![]()
Аквакомплексы — в которых лигандом выступает вода: и др. Находящиеся в водном растворе гидратированные катионы содержат в качестве центрального звена аквакомплекс. В кристаллическом состоянии некоторые из аквакомплексов удерживают и кристаллизационную воду, например: . Кристаллизационная вода не входит в состав внутренней сферы, она связана менее прочно, чем координированная, и легче отщепляется при нагревании.
Ацидокомплексы. В этих комплексах лигандами являются анионы. К ним относятся комплексы типа двойных солей, например ,комплексные кислоты — , гидроксокомплексы — и др.
Циклические, или хелатные (клешневидные), комплексные соединения. Они содержат би- или полидентатный лиганд, который как бы захватывает центральный атом подобно клешням рака:

В этих комплексах символом М обозначен атом металла, а стрелкой — донорно-акцепторная связь. Примерами таких комплексов служат оксалатный комплекс железа ( III ) и этилендиаминовый комплекс платины ( IV ) . К группе хелатов относятся и внутрикомплексные соединения , в которых центральный атом входит в состав цикла, образуя ковалентные связи с лигандами разными способами: донорно-акцепторным и за счет неспаренных атомных электронов. Комплексы такого рода весьма характерны для аминокарбоновых кислот.
Простейший их представитель — амииоуксусная кислота ( глицин ) — образует хелаты с ионами , например:

Известны также комплексы с более сложными амннокарбоно-выми кислотами и их аналогами. Такие лиганды называются комплексонами. Двухзарядный анион этилендиамиптетрауксусной кислоты , называемый в виде двунатриевой соли комплексоном III, или трилоном Б, дает с двухвалетным металлом комплекс типа:

Комплексные соединения часто имеют довольно сложный состав и строение; к настоящему времени разработаны специальные системы составления их химического названия (номенклатуры).
Существуют три основных подхода к номенклатуре комплексных соединений металлов.
1. Традиционные специфические вненоменклатурные названия, по которым различным комплексным соединениям присваивались те или иные наименования (например, K4[Fe(CN)6] - желтая кровяная соль, ферроцианид калия; K3[Fe(CN)6] - красная кровяная соль, феррицианид калия; [Pt(NH3)4](OH)2 - первое основание Рейзе; транс-[Pt(OH)2(NH3)2] - второе основание Рейзе; цис-[PtCl2(NH3)2] - хлорид Пейроне; K[Co(NO2)4(NH3)2] - соль Эрдмана и т.д.).
2. Номенклатура, предложенная основателем координационной теории швейцарским химиком Альфредом Вернером, принятая в несколько измененном виде его последователями.
3. Номенклатура, рекомендованная в 1960 г. комиссией по номенклатуре неорганических соединений Международного союза по чистой и прикладной химии (ИЮПАК).
В современной научной, учебной, медицинской литературе используются все три подхода, хотя можно отметить тенденции к преимущественному применению номенклатуры, рекомендованной ИЮПАК, как наиболее логически обоснованной. В русском языке эта номенклатура несколько модифицирована, адаптирована к правилам русского языка.
Номенклатура, предложенная А. Вернером
Название комплексного аниона начинают с указания состава внутренней сферы.
Во внутренней сфере, прежде всего называют анионы, прибавляя к их латинскому названию окончание . Например: хлоро, — циано, — сульфито, — гидрэксо и т. д. Далее называют нейтральные лиганды. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква. Число лигандов указывают греческими числительными: 1 — моно (часто не приводится), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Затем называют комплексообразователь, используя корень его латинского названия и окончание ат, после чего римскими цифрами указывают (в скобках) степень окисленности комплексообразователя. После обозначения состава внутренней сферы называют внешнесферные катионы. В случае неэлектролитов степень окисленности центрального атома не приводят, так как она однозначно определяется, исходя из электронейтральности комплекса.
Если центральный атом входит в состав катиона, то используют русское название элемента и в скобках указывают его степень окисленности. Например:

2.5. Природа химической связи в комплексных соединениях
В комплексных соединениях химическая связь между ионами внешней сферы и комплексом является ионной.
Внутри комплекса характер связей иной: комплексообразователь и лиганды образуют между собой ковалентные связи по донорно-акцепторному механизму. Причем, в подавляющем большинстве случаев, лиганды являются донорами электронных пар, а комплексообразователь представляет свободные орбитали (т.е. является акцептором). Такой механизм хорошо описывается с позиций метода валентных связей (МВС).
Но перед тем как перейти к рассмотрению химической связи с точки зрения МВС, полезно познакомиться с электростатической моделью.
Электростатические представления были разработаны Косселем и Магнусом с 1916 - 1922 гг, т.е. до появления квантовой химии как науки. В основу этих представлений положена следующая модель: положительно заряженный ион комплексообразователя находится в центре комплекса. Комплексообразователь является шаром, который окружен лигандами (отрицательно заряженными или незаряженными) то же шарообразной формы. Далее рассчитывается энергия притяжения между лигандами и комплексообразователем и энергия отталкивания между лигандами. Расчет приводит к следующим результатам (правилам):
1. Комплексообразователи, имеющие заряд +1 должны образовывать устойчивые комплексы с КЧ=2 или 3, заряд +2 с КЧ=4, заряд +3 с КЧ=4 или 6.
2. Чем больше заряд комплексообразователя, тем более устойчивы его комплексы с данными лигандами.
3. Чем больше по размеру лиганды, тем меньшее по величине КЧ склонен иметь комплексообразователь.
4. В комплексах с нейтральными лигандами комплексообразователь склонен к проявлению больших КЧ, по сравнению с КЧ в случае лигандов - анионов.
Перечисленные выше правила в ряде случаев не срабатывают, причем наибольшее число исключений известно для правила № 1. Так, например, ион Fe +2 должен иметь характерное КЧ=4, но почти во всех устойчивых комплексах КЧ (Fe +2 )=6 ( [Fe(CN) 6 ] -4 и т.д.)
Электростатические представления абсолютно неприменимы для комплексных частиц, в которых комплексообразователем является незаряженная частица (атом) - [Fe(CO) 5 ]; [Ni(CO) 4 ] и т.д. Электростатическая модель не объясняет пространственное строение многих комплексов, а так же их магнитные и оптические свойства.
Химическое строение комплексных частиц достаточно хорошо описывается с позиций валентных связей (МВС). По МВС комплексообразование является следствием перекрывания атомных орбиталей лигандов с гибридными атомными орбиталями комплексообразователя. Взаимодействие носит донорно-акцепторный характер (лиганды-доноры электронных пар, а комплексообразователь - акцептор). Геометрия комплекса (пространственное строение) определяется типом гибридизации атома или иона комплексообразователя. Тип гибридизации определяет так же КЧ комплексообразователя.
Как известно, металлы имеют свойство терять электроны и, тем самым, образовывать катионы. Положительно заряженные ионы металлов могут находиться в окружении анионов или нейтральных молекул, образуя частицы, называемые комплексными и способные к самостоятельному существованию в кристалле или растворе. А соединения, содержащие в узлах своих кристаллов комплексные частицы, называются комплексными соединениями.
Структура комплексных соединений
- Большинство комплексных соединений имеют внутреннюю и внешнюю сферы. Записывая химические формулы комплексных соединений, внутреннюю сферу заключают в квадратные скобки. Например, в комплексных соединениях К[Al(OH)4] и [Ca(NH3)8]Cl2, внутренней сферой являются группы атомов (комплексы) — [Al(OH)4] — и [Ca(NH3)8] 2+ , а внешней сферой — ионы К + и Сl – соответственно.
- Центральный атом или ион внутренней сферы называюткомплексообразователем. Обычно, в качестве комплексообразователей выступают атомы или ионы металлов с достаточным количеством свободных орбиталей – это p-, d-, f- элементы: Cu 2+ , Pt 2+ , Pt 4+ , Ag + , Zn 2+ , Al 3+ и др. Но это может быть и атомы элементов, образующих неметаллы. Заряд комплексообразователя обычно положительный, но также может быть отрицательным или равным нулю и равен сумме зарядов всех остальных ионов. В приведенных выше примерах комплексообразователями являются ионы Al 3+ и Ca 2+ .
- Комплексообразователь окружен и связан сигма-связью с ионами противоположного знака или нейтральными молекулами, так называемыми лигандами. В качестве лигандов в комплексных соединениях могут выступать такие анионы, как F – , OH – , CN – , CNS – , NO2 – , CO3 2– , C2O4 2– и др., или нейтральные молекулы Н2О, NН3, СО, NО и др. В наших примерах это – ионы OH — и молекулы NH3. Количество лигандов в различных комплексных соединениях лежит в пределах от 2 до 12. А само число лигандов (число сигма-связей) называется координационным числом (к.ч.) комплексообразователя. В рассматриваемых примерах к.ч. равно 4 и 8.
- Заряд комплекса (внутренней сферы) определяется как сумма зарядов комплексообразователя и лигандов.
- Внешнюю сферу образуют ионы, связанные с комплексом ионной или межмолекулярной связью и имеющие заряд, знак которого противоположен знаку заряда комплексообразователя. Числовое значение заряда внешней сферы совпадает с числовым значением заряда внутренней сферы. В формуле комплексного соединения записываются они за квадратными скобками. Внешняя сфера может и вовсе отсутствовать, в случае, если внутренняя сфера нейтральна. В приведенных примерах, внешнюю сферу образуют 1 ион K + и 2 иона Cl — соответственно.
Классификация комплексных соединений
Основываясь на различных принципах, комплексные соединения можно классифицировать различными способами:
По электрическому заряду: катионные, анионные и нейтральные комплексы
- Катионные комплексы имеют положительный заряд и образуются если вокруг положительного иона координированы нейтральные молекулы. Например, [Al(H2O)6]Cl3, [Ca(NH3)8]Cl2
- Анионные комплексы имеют отрицательный заряд и образуются, если вокруг положительного иона координированы атомы с отрицательной степенью окисления. Например, К[Al(OH)4], K2[BF4]
- Нейтральные комплексыимеют заряд равный нулю и не имеют внешней сферы. Они могут образоваться при координации вокруг атома молекул, а также при одновременной координации вокруг центрального положительно заряженного иона отрицательных ионов и молекул.
По количеству комплексообразователей
- Одноядерные – комплекс содержит один центральный атом, например, K2[Be(SO4)2]
- Многоядерные — комплекс содержит два и более центральных атомов, например, [CrFe(NH3)6(CN)6]
По типу лиганда
- Гидраты – содержат акво-комплексы, т.е. в качестве лигандов выступают молекулы воды. Например, [Cr(H2O)6]Br3, [Co(H2O)6]Br2
- Аммиакаты – содержат аммин-комплексы, в которых в качестве лигандов выступают молекулы аммиака (NН3). Например, [Zn(NH3)4]Cl2, [Ag(NH3)2]Cl
- Карбонилы – в таких комплексных соединениях, в качестве лигандов выступают молекулы монооксида углерода. Например, [Ni(CO)4], .
- Ацидокомплексы – комплексные соединения, содержащие в качестве лигандов кислотные остатки как кислородсодержащих, так и бескислородных кислот (F – , Cl – , Br – , I – , CN – , NO2 – , SO4 2– , PO4 3– и др., а также ОН – ). Например, K4[Ni(CN)6], Na2[FeCl4]
- Гидроксокомплексы— комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: K2[Zn(OH)4], Cs2[Sn(OH)6]
Комплексные соединения могут содержать лиганды, относящиеся к различным классам приведенной классификации. Например: К[Pt(H2O)3Br3], [Cr(NH3)4Br2]Br
По химическим свойствам: кислоты, основания, соли, неэлектролиты:
По количеству мест, занимаемых лигандом в координационной сфере
В координационной сфере лиганды могут занимать одно или несколько мест, т.е. образовывать с центральным атомом одну или несколько связей. По этому признаку различают:
- Монодентатные лиганды – это такие лиганды как молекулы Н2О, NH3, CO, NO и др. и ноны CN − , F − , Cl − , OH − , SCN − , и др.
- Бидентатные лиганды. К такому типу лигандов относятся ионы H2N—CH2—COO − , СО3 2− , SO4 2− , S2O3 2− , молекула этилендиамина H2N—CH2—CH2—H2N (сокращенно en).
- Полидентатные лиганды. Это, например, органические лиганды, содержащие несколько групп — CN или -COOH (ЭДТА). Некоторые полидентантные лиганды способны образовать циклические комплексы, называемые хелатными (например, гемоглобин, хлорофилл и др.)
Номенклатура комплексных соединений
Чтобы записать формулу комплексного соединения, необходимо помнить, что, как и любое ионное соединение, вначале записывается формула катиона, а после – формула аниона. При этом, формулу комплекса записывают в квадратных скобках, где вначале записывают комплексообразователь, затем лиганды.
А вот несколько правил, следуя которым составить название комплексного соединения не составит никакого труда:
4. Если количество лигандов больше единицы, то их число указывают греческими приставками:
5. Если же в названии самого лиганда уже присутствует греческая приставка, то название лиганда записывают в скобках и к нему прибавляют приставку типа:
2-бис-, 3-трис-, 4-тетракис-, 5-пентакис-, 6-гексакис-.
Например, соединение [Co(en)3]Cl3 называют – трис(этилендиамин)кобальт(III).
6. Названия комплексных анионов оканчиваются суффиксом – ат
После названия металла в скобках указывают римскими цифрами его степень окисления.
Например, назовем комплексные соединения:
Начнем с лигандов: 4 молекулы воды обозначаются как тетрааква, а 2 хлорид-иона – как дихлоро.
Далее указываем комплексообразователь – это хром и его степень окисления равна III.
Наконец, анионом в данном соединении является хлорид-ион.
Итак, полное название таково – хлорид тетрааквадихлорохрома(III)
Начнем с лигандов: в комплексном анионе содержится 4 лиганда CN — , которые называются тетрациано.
Далее указываем комплексообразователь – это никель и его степень окисления равна нулю.
Так как металл входит в состав комплексного аниона, то он называется никелат(0).
Итак, полное название таково – тетрацианоникелат(0) калия
КО́МПЛЕКСНЫЕ СОЕДИНЕ́НИЯ (координационные соединения), химические соединения, в которых можно выделить центр. атом (комплексообразователь) и непосредственно связанные с ним (координированные) один или неск. ионов и/или молекул. Координированные частицы называются лигандами , число донорных атомов в них, координированных центр. атомом, – его координационным числом . Центр. атом связывает лиганды как за счёт электростатического, так и за счёт донорно-акцепторного взаимодействия. Координационное число и степень окисления являются важнейшими характеристиками атома-комплексообразователя.
Комплексные соединения (КС) играют важную роль в деятельности живых организмов. Они также широко применяются в промышленности. Сегодня мы рассмотрим их видовое разнообразие, применение и историю исследования.
Введение в комплексные соединения
Комплексные соединения – это вещества, образующиеся при соединении лиганда и комплексообразователя. Играть роль взаимодействующих частичек могут атомы и ионы. А. Вернер в 1893-м представил миру теорию комплексных соединений, также называемую координационной теорией.
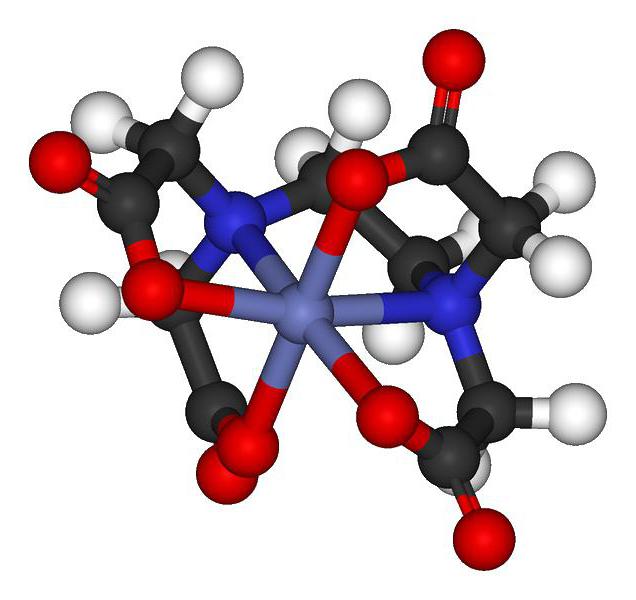
Для КС характерны наличие внешней сферы и полная диссоциация в растворе воды на малодиссоциирующие катионы и анионы. Однако есть и такие виды, у которых отсутствует внешняя сфера, что не позволяет им растворяться в воде. Существует огромное количество КС.
Виды соединений
Комплексные соединения разделяются на три главных вида:
- К первому виду, различающемуся по комплексному заряду, относятся комплексы катионного типа, в которых, окружив положительный ион, координируются нейтральные молекулы. Вторым видом называют анионный комплекс, в котором положительно окисленный атом выступает в роли комплексообразователя, а анионы простого или сложного типа составляют лиганды. Третий вид именуют нейтральным комплексом, он образовался из-за молекулярной координации вокруг атома, имеющего нейтральный заряд.
- В зависимости от природы лиганда их разделяют на аммиакаты (аммиак – лиганд), аквакомплексы (лиганд – вода), гидроксокомплексы (лиганды – гидроксид-ионы), ацидокомплексы (лиганды – остатки кислот), карбонилы (лиганды – молекулы углеродных оксидов второй валентности).
- В соответствии с местом расположения лиганды бывают монодентантные, бидентантные и полидентантные КС.
Исторические сведения
В 1893-м была совершена первая попытка исчерпывающе описать структуру КС при помощи координационной теории Альфреда Вернера. Работа была сделана до появления теории электронной валентности, а при исследованиях использовались обычные реакции химической природы.

В своей теории Вернер утверждал, что соединения неорганической природы имеют ядра, составленные из атомов комплексообразующего типа. Атомы, окружающие комплексообразующие, называют координационными. Они располагаются в соответствии с формой простого полиэдра. А. Вернер предполагал наличие связи координационного типа у общей электронной пары, которую атомы либо молекулы будут отдавать другой паре. Однако отсутствие существования подобных соединений вызвало недоверие у сообщества химиков. Вследствие этого следующие два десятилетия ученый пытался создать необходимые вещества, которые бы подтвердили его теорию.
Вернер в 1911-м осуществил синтез свыше сорока молекул оптического типа, которые не содержали углеродные атомы, что в конце концов изменило мнение ученых-химиков о его теории.
Альфред Вернер был удостоен в 1913-м Нобелевской премии за достижения в области химии.
Номенклатура
Комплексные соединения имеют систему создания собственных названий, состоящую из пяти пунктов:
Сведения о структуре
Внешняя координационная сфера представляет собой ионы, которые не разместились в пространстве внутренней сферы.
Связь между лигандом и центральным ионом может обуславливаться либо электростатическим притяжением, либо донорно-акцепторным механизмом.
Изомерия в координационных соединениях является главным статистическим аспектом. Говоря об изомерии, имеют в виду различное взаиморасположение в пространстве атомов либо составных элементов соединения, которое будет влечь за собой изменение физических и химических свойств соответствующего соединения – изомера. Изомерия КС бывает структурной, оптической и пространственной.
Стереохимия
Комплексные соединения, наряду с органическими веществами, высокомолекулярные соединения синтетического или природного происхождения – это главные объекты стереохимических исследований. А. Вернер по праву считается одним из тех ученых, кто дал развитие целой области исследований и оживил некоторые сферы химической деятельности. Стереохимия по сей день остается ориентиром координационных химических исследований.
Некоторые свойства и способы получения
Получение комплексных соединений имеет довольно широкий спектр выбора, однако чаще используются такие:
Комплексные соединения имеют также два важных магнитных свойства, по которым их классифицируют как парамагнитные и диамагнитные. Парамагнитные комплексы имеют собственные µ-моменты, и по этой причине, попадая во внешние электромагнитные поля, в процессе взаимодействия они втягиваются в них. Диамагнитный комплекс не имеет магнитного момента, и потому магнитное поле спешит вытолкнуть его. Свойства парамагнитного характера обуславливаются присутствием электронов, не имеющих пары, в своей структуре.
Использование

Соединения комплексного типа играют одну из важнейших ролей в любом организме, например, кислород в паре с кровяным гемоглобином доставляют O2 по организму к тканям и клеткам; находящийся внутри растений хлорофилл также считается комплексом.
Применение комплексных соединений широко используется в промышленности. При помощи химических методов, влекущих за собой образование КС, извлекают металлы из руды. Примерами могут служить чистое железо, никель и кобальт, которые получают при помощи температурного разложения карбонилов металлов. Эти сложные вещества, разлагаясь, выделяют необходимые металлы.

Аналитическая химия может использовать КС в качестве индикаторов. Органический и неорганический синтез может ускоряться из-за них, так как им присущи свойства катализатора в силу их высокой активности. Гальванопластика также не может обойтись без комплексных соединений, что обусловливается невозможностью получения столь надежных покрытий из простой соли, в отличие от соединений цианидов.
Читайте также:

