Каковы свойства воды кратко
Обновлено: 05.07.2024

Химические и физические свойства воды в жидком состоянии — термины, определения и комментарии
Строго говоря, в этом материале мы кратко рассмотрим не только химические и физические свойства воды в жидком состоянии, но и свойства присущие ей в общем как таковой.
Более детально про свойства воды в твердом состоянии вы можете прочитать в нашей статье — ЛЁД – ТВЕРДОЕ СОСТОЯНИЕ ВОДЫ → .
Аномальные свойства воды
Многие физические и химические свойства воды удивляют и выпадают из общих правил и закономерностей и являются аномальными, так например:
- В соответствии с закономерностями, установленными по принципу подобия, в рамках таких наук как химия и физика, мы могли бы ожидать, что:
- вода будет закипать при минус 70°С, а замерзать при минус 90°С;
- вода будет не капать с кончика крана, а литься тонкой струйкой;
- лед будет тонуть, а не плавать на поверхности;
- в стакане вода не растворилось бы более нескольких крупинок сахара.
Более подробно с аномальными свойствами Вы можете ознакомиться в нашей статье — АНОМАЛЬНЫЕ СВОЙСТВА ВОДЫ, ИЛИ УДИВИТЕЛЬНОЕ РЯДОМ → .
Вода имеет много и других аномалий, исследование которых вероятно принесет, в ближайшем будущем, новые неожиданные открытия.
Необходимо отметить, что вода в естественных природных условиях может существовать в трех агрегатных состояниях, более подробно, с которыми можно ознакомиться в нашей статье — АГРЕГАТНЫЕ СОСТОЯНИЯ ВОДЫ В ПРИРОДЕ → .
Как уже отмечалось выше, в данном материале мы перечислим основные физические и химические свойства воды и сделаем к некоторым из них краткие комментарии.
Физические свойства воды
ФИЗИЧЕСКИЕ СВОЙСТВА – это свойства, которые проявляются вне химических реакций.
Чистота
Чистота воды – зависит от наличия в ней примесей, бактерий, солей тяжелых металлов … , для ознакомления с интерпретацией термина ЧИСТАЯ ВОДА по версии нашего сайта необходимо прочитать статью — ЧИСТАЯ ВОДА → .
Цвет воды – зависит от химического состава и механических примесей
Большая советская энциклопедия
Цвет моря. Цвет, воспринимаемый глазом, когда наблюдатель смотрит на поверхность моря, Цвет моря зависит от цвета морской воды, цвета неба, количества и характера облаков, высоты Солнца над горизонтом и др. причин.
Понятие Цвет моря следует отличать от понятия цвет морской воды. Под цветом морской воды понимают цвет, воспринимаемый глазом при отвесном осмотре морской воды над белым фоном. От поверхности моря отражается лишь незначительная часть падающих на неё световых лучей, остальная их часть проникает вглубь, где поглощается и рассеивается молекулами воды, частицами взвешенных веществ и мельчайшими пузырьками газов. Отражённые и выходящие из моря рассеянные лучи и создают Ц. м. Молекулы воды рассеивают сильнее всего синий и зелёные лучи. Взвешенные частицы почти одинаково рассеивают все лучи. Поэтому морская вода с малым количеством взвесей кажется сине-зелёной (цвет открытых частей океанов), а со значительным количеством взвесей — желтовато-зелёной (например, Балтийское море). Теоретическая сторона учения о Ц. м. разработана В. В. Шулейкиным и Ч. В. Раманом.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978
Запах
Запах воды – чистая вода как правило, не имеет запаха.
Прозрачность
Прозрачность воды — зависит от растворенных в ней минеральных веществ и содержания механических примесей, органических веществ и коллоидов:
Экологический энциклопедический словарь
ПРОЗРАЧНОСТЬ ВОДЫ — способность воды пропускать свет. Обычно измеряется диском Секки. Зависит в основном от концентрации взвешенных и растворенных в воде органических и неорганических веществ. Может резко снижаться в результате антропогенного загрязнения и эвтрофирования водоемов.
Экологический энциклопедический словарь. — Кишинев И.И. Дедю. 1989
Словарь по гидрогеологии и инженерной геологии
- прозрачные;
- слабо опалесцирующие;
- опалесцирующие;
- слегка мутные;
- мутные;
- сильно мутные.
Вкус воды – зависит от состава растворенных в ней веществ.
Словарь по гидрогеологии и инженерной геологии
Вкус воды — свойство воды, зависящее от растворенных в ней солей и газов. Имеются таблицы ощутимой на вкус концентрации солей, растворенных в воде (в мг/л), например следующая таблица (по Штаффу).
Словарь по гидрогеологии и инженерной геологии. — М.: Гостоптехиздат. Составитель: А. А. Маккавеев, редактор О. К. Ланге. 1961
Температура
Температура плавления воды:
Научно-технический энциклопедический словарь
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ — температура, при которой вещество переходит из ТВЕРДОГО СОСТОЯНИЯ в жидкое. Температура плавления твердого вещества равна температуре замерзания жидкости, например, температура плавления льда, О °С, равна температуре замерзания воды.
Научно-технический энциклопедический словарь.
Температура кипения воды: 99,974°C
Научно-технический энциклопедический словарь
ТЕМПЕРАТУРА КИПЕНИЯ, температура, при которой вещество переходит из одного состояния (фазы) в другое, т. е. из жидкости в пар или газ. Температура кипения возрастает при увеличении внешнего давления и понижается при его уменьшении. Обычно ее измеряют при стандартном давлении в 1 атмосферу (760 мм рт. ст.) Температура кипения воды при стандартном давлении составляет 100 °С.
Научно-технический энциклопедический словарь.
Тройная точка воды
Тройная точка воды: 0,01 °C, 611,73 Па;
Научно-технический энциклопедический словарь
ТРОЙНАЯ ТОЧКА, температура и давление, при которых все три состояния вещества (твердое, жидкое, газообразное) могут существовать одновременно. Для воды тройная точка находится при температуре 273,16 К и давлении 610 Ра.
Научно-технический энциклопедический словарь
Поверхностное натяжение воды
Поверхностное натяжение воды – определяет силу сцепления молекул воды друг с другом, например, от этого параметра зависит то, как усваивается та или иная вода организмом человека.
Адгезия и когезия воды
Капиллярность
Капиллярность — свойство воды, благодаря которому вода может подниматься вертикально вверх в пористых материалах. Данное свойство реализуется через другие свойства воды, такие как — поверхностное натяжение, адгезия и когезия.
Жесткость воды
Жесткость воды – определяется количеством содержания солей, более подробно читайте в материалах — ЖЕСТКАЯ ВОДА — ЧТО ЖЕ ЭТО ТАКОЕ → и МИНЕРАЛИЗАЦИЯ ВОДЫ → .
Морской словарь
ЖЕСТКОСТЬ ВОДЫ (Stiffness of Water) — свойство воды, обескровливаемое содержанием растворенных в ней солей щелочноземельных металлов, гл. обр. кальция и магния (в виде двууглекислых солей — бикарбонатов), и солей сильных минеральных кислот — серной и соляной. Жёсткость воды измеряется в особых единицах, так наз. градусах жесткости. Градусом жесткости называется весовое содержание окиси кальция (СаО), равное 0,01 г в 1 л воды. Жесткая вода непригодна для питания котлов, так как способствует сильному образованию накипи на их стенках, что может вызвать пережог трубок котла. Котлы больших мощностей и особенно высоких давлений должны питаться совершенно очищенной водой (конденсат от паровых машин и турбин, очищенный посредством фильтров от примеси масла, а также дистиллят, приготовляемый в особых аппаратах-испарителях).
Самойлов К. И. Морской словарь. — М.-Л.: Государственное Военно-морское Издательство НКВМФ Союза ССР, 1941
Научно-технический энциклопедический словарь
ЖЕСТКОСТЬ ВОДЫ, неспособность воды образовывать пену с мылом из-за растворенных в ней солей, в основном кальция и магния.
Накипь в котлах и трубах образуется из-за присутствия в воде растворенного карбоната кальция, попадающего в воду при контакте с известняком. В горячей или кипящей воде карбонат кальция переходит в осадок в виде твердых известковых отложений на поверхностях внутри котлов. Карбонат кальция также не дает мылу пениться. Ионообменный контейнер(3), заполнен гранулами, покрытыми натрий-содержащими материалами. с которыми вода вступает в контакт. Ионы натрия как более активные, замещают ионы кальция Так как соли натрия остаются растворимыми даже при кипячении, накипь не образуется.
Научно-технический энциклопедический словарь.
Структура воды
Под структурой воды понимается определенное расположение молекул воды по отношению друг к другу. Это понятие активно используется в теории структурированной воды, читайте нашу статью — СТРУКТУРИРОВАННАЯ ВОДА — БАЗОВЫЕ ПОНЯТИЯ → .
Минерализация воды
Экологический энциклопедический словарь
МИНЕРАЛИЗАЦИЯ ВОДЫ — насыщение воды неорганич. (минеральными) веществами, находящимися в ней в виде ионов и коллоидов; общая сумма неорганических солей, содержащихся преимущественно в пресной воде, степень минерализации обычно выражают в мг/л или г/л (иногда в г/кг).
Экологический энциклопедический словарь. — Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989
Вязкость воды
Вязкость воды — характеризует внутреннее сопротивление частиц жидкости ее движению:
Геологический словарь
Вязкость воды (жидкости) — свойство жидкости, обусловливающее при движении возникновение силы трения. Является фактором, осуществляющим передачу движения от слоев воды, перемещающихся с большой скоростью, к слоям с меньшей скоростью. Вязкость воды зависит от температуры и концентрации раствора. Физически она оценивается коэф. вязкости, который входит в ряд формул движения воды.
Геологический словарь: в 2-х томах. — М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978
Различают два вида вязкости воды:
- Динамическая вязкость воды — 0,00101 Па•с (при 20°C).
- Кинематическая вязкость воды — 0,01012 см 2 /с (при 20°C).
Более подробно читайте в нашей статье — ВЯЗКОСТЬ ВОДЫ → .
Критическая точка воды
Критической точкой воды называется ее состояние при определенном соотношении давления и температуры, когда ее свойства одинаковы в газообразном и жидком состоянии (газообразной и жидкой фазе).
Критическая точка воды: 374°C, 22,064 MПа.
Диэлектрическая проницаемость
Диэлектрическая проницаемость, в общем, является коэффициентом показывающим, во сколько сила взаимодействия между двумя зарядами в вакууме больше чем в определенной среде.
В случае с водой этот показатель необычайно высок и для статических электрических полей равняется 81.
Теплоёмкость воды
Теплоёмкость воды — вода обладает на удивление высокой теплоемкостью:
Экологический словарь
Научно-технический энциклопедический словарь
УДЕЛЬНАЯ ТЕПЛОЕМКОСТЬ (обозначение с), тепло, необходимое для того, чтобы поднять температуру 1 кг вещества на 1К. Измеряется в Дж/К.кг (где Дж -ДЖОУЛЬ). Вещества с высокой удельной теплоемкостью, такие как вода, требуют большего количества энергии для поднятия температуры, чем вещества с низкой удельной теплоемкостью.
Научно-технический энциклопедический словарь
Теплопроводность воды
Теплопроводность вещества подразумевает его способность проводить тепло от своих более горячих частей к более холодным.
Передача тепла в воде происходит либо на молекулярном уровне, т. е. передаётся молекулами воды, либо благодаря движению / перемещению каких, либо объемов вод – турбулентная теплопроводность.
Теплопроводность воды зависит от температуры и давления.
Текучесть
Под текучестью веществ понимают их способность менять свою форму под влиянием постоянного напряжения или постоянного давления.
Текучесть жидкостей, так же определяется подвижностью их частиц, которые в состоянии покоя неспособны воспринимать касательные напряжения.
Индуктивность
Индуктивность определяет магнитные свойства замкнутых цепей электрического тока. Вода, за исключением некоторых случаев, электрический ток проводит, а следовательно и обладает определенной индуктивностью.
Плотность воды
Плотность воды — определяется отношением ее массы к объему при определенной температуре. Подробнее читайте в нашем материале — ЧТО ТАКОЕ ПЛОТНОСТЬ ВОДЫ → .
Сжимаемость воды
Сжимаемость воды – очень мала и зависит от солености воды и давления. Например у дистиллированной воды она равняется 0,0000490. В естественных природных условиях вода практически несжимаемая, но в промышленном производстве для технических целей воду сильно сжимают. Например, для резки твердых материалов, в том числе и таких как металлы.
Электропроводность воды
Электропроводность воды — во многом зависит от количества растворенных в них солей.
Радиоактивность
Радиоактивность воды – зависит от содержания в ней радона, эманации радия.
Физико-химические свойства воды
Словарь по гидрогеологии и инженерной геологии
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ — параметры, определяющие физико-химические особенности природных вод. К ним относятся показатели концентрации водородных ионов (рН) и окислительно-восстановительный потенциал (Eh).
Словарь по гидрогеологии и инженерной геологии. — М.: Гостоптехиздат. Составитель: А. А. Маккавеев, редактор О. К. Ланге. 1961
Растворимость
Разные источники данное свойство классифицируют по разному — одни относят его к физическим, другие к химическим свойствам вещества. Поэтому на данном этапе мы отнесли его к физико-химическим свойствам воды, что и подтверждается одним из определений растворимости, приведённом ниже.
Большой Энциклопедический словарь
РАСТВОРИМОСТЬ — способность вещества в смеси с одним или несколькими другими веществами образовывать растворы. Мера растворимости вещества в данном растворителе — концентрация его насыщенного раствора при данных температуре и давлении. Растворимость газов зависит от температуры и давления, растворимость жидких и твердых тел практически от давления не зависит.
Большой Энциклопедический словарь. 2000
Справочник дорожных терминов
Растворимость – свойство материала (веществ) образовывать однородные системы, имеющие одинаковый химический состав и физические свойства.
Справочник дорожных терминов, М. 2005
Общая химия
Растворимость – свойство газообразных, жидких и твердых веществ переходить в растворенное состояние; выражается равновесным массовым отношением растворенного вещества и растворителя при данной температуре.
Общая химия: учебник А. В. Жолнин; под ред. В. А. Попкова, А. В. Жолнина. 2012
Физическая энциклопедия
Кислотно-щелочное равновесие (pH воды)
Кислотно-щелочной баланс воды определяется pH показателем, значение которого может изменяться от 0 до 14. Значение 7 — определяет кислотно-щелочной баланс воды как нейтральный, если меньше 7 — вода кислотная, более 7 — щелочная вода.
Окислительно-восстановительный потенциал воды
Окислительно-восстановительный потенциал воды (ОВП) — способность воды вступать в биохимические реакции.
Химические свойства воды
ХИМИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВА – это свойства, которые проявляются в результате химических реакций.
Взаимодействие воды с металлами
При взаимодействии воды с большинством металлов происходит реакция с выделением водорода:
- 2Na + 2H2O = H2 + 2NaOH (бурно);
- 2K + 2H2O = H2 + 2KOH (бурно);
- 3Fe + 4H2O = 4H2 + Fe3O4 (только при нагревании).
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
При взаимодействии воды с благородными металлами, такими как золото, платина …, реакция отсутствует.
Взаимодействие воды с неметаллами
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
- C + H2O = H2 + CO (при сильном нагревании);
- CH4 + 2H2O = 4H2 + CO2 (при сильном нагревании).
Взаимодействие воды с электрическим током
При воздействии электрическим током вода разлагается на водород и кислород. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
Взаимодействие воды с оксидами неметаллов
Вода вступает в реакцию со многими оксидами неметаллов и некоторыми оксидами металлов. Это не окислительно-восстановительные реакции, а реакции соединения:
- SO2 + H2O = H2SO3 (сернистая кислота);
- SO3 + H2O = H2SO4 (серная кислота);
- CO2 + H2O = H2CO3 (угольная кислота).
Взаимодействие воды с оксидами металлов
Некоторые оксиды металлов также могут вступать в реакции соединения с водой.
Примеры таких реакций мы уже встречали:
CaO + H2O = Ca(OH)2 (гидроксид кальция (гашеная известь).
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. Например: ZnO, TiO2, Cr2O3, из которых приготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
Гидраты и кристаллогидраты
Вода образует соединения, гидраты и кристаллогидраты, в которых полностью сохраняется молекула воды.
- CuSO4 + 5 H2O = CuSO4.5H2O;
- CuSO4 — вещество белого цвета (безводный сульфат меди);
- CuSO4.5H2O — кристаллогидрат (медный купорос), синие кристаллы.
Другие примеры образования гидратов:
- H2SO4 + H2O = H2SO4.H2O (гидрат серной кислоты);
- NaOH + H2O = NaOH.H2O (гидрат едкого натра).
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
Био-синтез
Вода участвует в био-синтезе в результате, которого образуется кислород:
6n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света)
Выводы
Мы видим, что СВ разнообразны и охватывают практически все аспекты жизни на Земле. Как сформулировал один из ученых … изучать воду необходимо комплексно, а не в контексте отдельных ее проявлений.
![]()
Интересные факты о воде
Вода — самая удивительная и загадочная из всех жидкостей, существующих на Земле.
Учёные на протяжении многих столетий продолжают проводить исследования, находя новые интересные факты. Каждый человек знает, что без воды жизнь невозможна.
Вода участвует в формировании климата, для многих живых организмов является средой обитания. Её важность сложно недооценить. Не случайно, нашу планету называют голубой, именно вода покрывает 71 % поверхности земного шара.
В статье мы собрали самую важную и интересную информацию про воду: гипотезы её появления на нашей планете, особенности строения молекулы, агрегатные состояния, уникальные и необычные свойства.
Что такое вода, химические названия
Вода — это бинарное неорганическое соединение, химическая формула H2O.
При нормальных условиях представляет собой прозрачную, бесцветную жидкость, которая не имеет вкуса и запаха, текуча (принимает форму сосуда).
Молекула воды состоит из одного атома кислорода и двух атомов водорода, которые соединены между собой ковалентной связью. Никакие другие элементы таблицы Менделеева при соединении не образуют жидкости. Рассмотрим строение молекулы H2O на изображении.
![Что такое вода: агрегатные состояния, роль на Земле]()
Вода имеет несколько химических названий:
- оксид водорода;
- гидроксид водорода;
- монооксид дигидрогена;
- дигидромонооксид;
- гидроксильная кислота.
Агрегатные состояния
Из всех веществ, существующих на Земле, только вода может иметь три принципиально разных агрегатных состояния: жидкое, газообразное и твердое. Благодаря трём агрегатным состояниям происходит круговорот воды в природе и жизнь на Земле. Рассмотрим подробнее каждое агрегатное состояние.
- Жидкое (вода). В нормальных условиях вода является жидкостью. Образует мировой океан, реки, ручьи и т.д.
- Газообразное (водяной пар) — это бесцветный газ, не имеет вкуса и запаха. Испаряется с поверхности океанов, рек, болот, почвы, растений и поступает в воздух или образуется путём кипения жидкой воды или сублимации из льда. Сублимация — переход вещества из твёрдого состояния сразу в газообразное, минуя стадию плавления (перехода в жидкое состояние).
- Твердое (лёд). При температуре от нуля и ниже вода превращается в лёд. В холодное время года он сковывает реки и лужи, выпадает в виде осадков: снежинок, града, инея, образует ледяные облака. Встречается в виде ледников и айсбергов.
Строение в различных агрегатных состояниях
Жидкая вода, лёд и водяной пар имеют один и тот же состав, но разные состояния.
Рассмотрим строение молекулы на изображении.
![Что такое вода: агрегатные состояния, роль на Земле]()
Многочисленные исследования ученых подтверждают, что по структуре вода и лед близки друг к другу. Структура льда – это решетчатый каркас. Структура воды зависит от содержания разных веществ, которые в ней растворяются, а также от нерастворимых соединений и некоторых других факторов.
При температуре близкой к точке замерзания, молекулы жидкой воды собираются в небольшие группы, практически так, как в кристаллах. При температуре близкой к точке кипения они располагаются более свободно.
Свойства
Вода — уникальный природный компонент, который обладает рядом свойств. Рассмотрим основные:
- не имеет цвета, запаха и вкуса;
- распространенный растворитель;
- обладает высоким поверхностным натяжением, уступая в этом только ртути;
- имеет большую теплоту испарения (используется для терморегуляции);
- чистая вода — хороший изолятор;
- обладает большой теплоёмкостью (увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение ее температуры);
- плотность в разных диапазонах температур меняется неодинаково.
Существуют необычные свойства. Например, в твердом виде вода легче, чем в жидком. Лёд не тонет в воде. В твёрдом состоянии частички воды располагаются по порядку, между ними остается много свободного пространства. Когда лёд тает, активность частичек повышается, свободное пространство заполняется. Жидкая форма становится более тяжелой, нежели твердая.
Такая уникальная способность даёт возможность любому водоёму не замерзать по всей глубине. Даже при самом сильном морозе температура воды у дна не опускается ниже +4 ᵒС. Все живые существа (рыбы и другие) могут спокойно пережить самую суровую зиму подо льдом.
Когда лёд тает, плотность увеличивается, и становится максимальной при температуре +4 ᵒС. В диапазоне от +4 ᵒС до +40 ᵒС плотность снижается, потом снова увеличивается. При понижении температуры ниже +4 ᵒС плотность уменьшается, т.е. при замерзании вода расширяется.
Горячая вода замерзает быстрее, чем холодная. Это связано с большей скоростью испарения и излучения тепла.
Теплоемкость и некоторые другие физические свойства воды тоже зависят от температуры неодинаково. Другие виды жидкостей не имеют таких особенностей – чтобы какой-то один параметр менялся по-разному на разных порогах температуры.
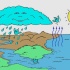
Круговорот воды в природе
Вода образует водную оболочку нашей планеты – гидросферу.
Её делят на Мировой океан, континентальные поверхностные воды и ледники, а также подземные водоёмы. Переходы H2O из одних частей гидросферы в другие составляют сложный круговорот воды на Земле
Круговорот воды в природе — это непрерывное движение воды в гидросфере Земли. В процессе этого обмена водная масса меняет агрегатное состояние: из жидкой или твердой превращается в газообразную и обратно.
Рассмотрим на примере.
- С поверхности океанов, морей, рек и суши вода в виде пара поднимается вверх.
- Высоко над землей он охлаждается и образует множество водяных капелек и льдинок. Из них образуются облака.
- В виде осадков вода возвращается на Землю.
Происхождение воды на планете
Возникновение воды на нашей планете является предметом научных споров. Существует 2 основные гипотезы:
- Космическое происхождение. Часть учёных считают, что вода появилась вследствие падающих метеоритов, астероидов, которые содержали воду.
- Земное происхождение. Другие учёные считают, что вода образовалась на Земле во время формирования, а не занесена с космоса.
Наука о воде
Изучением природных вод, явлений и процессов занимается наука Гидрология.
Первые упоминания о гидрологии появились на заре истории человечества около 6000 лет назад.
Начало гидрологических наблюдений в России относится к XV–XVI вв.: в записях русских летописцев сохранились сведения о свойствах воды, наводнениях, паводках, замерзании.
Значение на Земле
Без воздуха человек может прожить несколько секунд, без еды – несколько месяцев, без воды – максимум несколько суток. Снижение содержания воды в организме всего лишь на 2% может вызвать сильную слабость. При нехватке 8% уже может возникнуть серьезное недомогание, а при 12% – смерть.
Каждая клетка живого организма состоит из жидкости и нуждается в регулярном пополнении. Без воды не проживут ни люди, ни растения, ни животные.
Вода формирует климат, участвует в круговороте воды в природе, для многих живых организмов является средой обитания.
Применение
Все люди на планете прекрасно знают, что жизнь без воды невозможна. Любое начало жизни изначально зарождается в воде.
Человек применяет воду:
- для поддержании жизни (приготовления пищи, обеспечения организма водой);
- для бытовых нужд (гигиены, уборки и т. д);
- в сельском хозяйстве и животноводстве;
- промышленности (используется при производстве продуктов питания, чугуна, стали, резины и т. д);
- медицине;
- химии (в качестве реагента для химических реакций, опытов, исследований);
- рыболовстве;
- для транспортировки людей и грузов;
- для спорта;
- в земледелии;
- для пожаротушения;
- служит источником энергии (электростанции).
Сколько жидкости в теле человека
![Что такое вода: агрегатные состояния, роль на Земле]()
Эмбрион человека состоит из жидкости не менее, чем на 97%. Когда ребенок рождается, вода составляет около 80% его тела. В первые несколько суток после рождения этот показатель существенно снижается.
В дальнейшем содержание воды в организме человека постоянно уменьшается. В пожилом возрасте в теле человека доля воды не превышает 50-60%.
Как определить, сколько воды в теле человека?
Массу тела необходимо разделить на 3 и умножить на 2.
Стоит отметить, что расчет считается приблизительным (может отличаться на 5-10%) Так как количество воды зависит от возраста, пола, физической активности, состояния здоровья.
Основные функции
Вода необходима каждому живому существу. Каждый живой организм состоит из клеток. Ключевую роль выполняет вода. Она составляет около 70 процентов от её массы. Рассмотрим кратко основные функции.
- Растворитель. Большинство химических реакций протекают только в водной среде.
- Транспортная функция. Переносит питательные вещества из одной части в другую.
- Функция регенерации. С помощью воды удаляются ненужные продукты жизнедеятельности.
- Регулирует терморегуляцию. Защищает организм от перегрева и обеспечивает равномерное распределение тепла по организму.
- Все обменные процессы в организме регулируются водой.
Польза чистой питьевой воды
Врачи, диетологи и другие специалисты часто совершают ошибку, когда слишком много внимания уделяют разным продуктам питания и забывают про воду. Любые вещества, даже самые питательные и полезные, могут оказаться совершенно неэффективными, если нет растворителя, способного доставить их в нужные части тела. На Земле есть только один простой, надежный и распространенный растворитель – вода.
Вода участвует абсолютно во всех обменных процессах. И чтобы они протекали нормально, необходимо пить достаточное количество чистой воды. Именно воды, не чая, не напитков. Содержание разных примесей, консервантов и прочих веществ существенно меняют структуру, нормальное молекулярное состояние воды.
Изначально природой заложено употреблять чистую воду. Когда в организм вносится некая смесь, то пищеварительной системе приходится прикладывать много усилий, растрачивать много энергии, чтобы отделить все лишнее и получить воду. Кроме этого, высокое содержание сахара неизбежно провоцирует нарушение нормального обмена веществ.
Сколько нужно пить воды в день
Рекомендуется употреблять чистую воду без примесей 30-40 мл на 1 кг веса.
Средние показатели:
для женщины: 1,5 – 2 литра ежедневно;
для мужчины: 2,5 – 5 литров ежедневно.
Количество рекомендуемой нормы зависит от физической активности, климата и веса.
Процентное содержание в органах
Вода в теле человека находится в разных субстанциях и никогда не смешивается в единое целое.
Жидкости больше в тех клетках, в которых обмен веществ протекает более интенсивно. Рассмотрим таблицу № 1.
Таблица № 1. Процент содержания в органах человека
Органы Процент содержания Мозг 90 Лёгкие 86 Печень 86 Кровь 83 Яйцеклетки 90 Кости 72 Кожа 72 Сердце 75 Желудок 75 Селезёнка 77 Почки 83 Мышцы 75 Признаки обезвоживания
Если содержание воды резко меняется в одну или другую сторону, то это сразу сказывается на общем состоянии здоровья. Чрезмерное количество воды организм переносит намного легче, чем ее нехватку. Рассмотрим основные симптомы проявления нехватки воды в организме человека.
- Жажда – первый сигнал нехватки жидкости в организме.
- У человека возникают твердые каловые массы и запоры.
- Появляется усталость и слабость.
- Возникают головные боли и головокружения.
- Кожа становится сухой.
- Состояние может сопровождаться сильным упадком настроения (вплоть до тяжелой депрессии).
При длительном сохранении такого состояния могут возникнуть проблемы:
- с артериальным давлением;
- нарушением пищеварения;
- заболеваниями органов ЖКТ;
- может появиться диабет, ожирение (или наоборот – истощение, дистрофия);
- появляются зрительные и слуховые галлюцинации (при потери воды 10%);
- сильное обезвоживание может привести к смерти.
Проходя гидрологический цикл, вода может дополняться химическими элементами: ионами, растворенными газами, микроэлементами и т.д.
Воду квалифицируют по следующим признакам:
- по наличию и составу изотопов в молекуле;
- по степени растворения частиц солей и других примесей;
- по источнику;
- по взаимодействию с другими элементами и компонентами;
- по воздействию человека;
- по индивидуальным параметрам.
Рассмотрим некоторые виды на рисунке.
![Что такое вода: агрегатные состояния, роль на Земле]()
Запасы пресной воды
Несмотря на то, что Земля более, чем на 70% покрыта водой, лишь 1% является пресной (её солёность не превышает 0,5 ‰).
Более 2/3 запасов пресной воды на Земле хранится в ледниках. Крупнейшим водоёмом пресной воды считается озеро Байкал в России.Показатели качества
Современные нормы очистки водопроводной питьевой воды предполагают использование хлорсодержащих реагентов, которые избавляют воду от инфекций. В дополнение рекомендуется использовать дополнительные методы очистки. Например, фильтры.
Большой популярностью в развитых странах пользуется бутилированная питьевая вода. Она является экологически чистым продуктом. Реализуется в гигиенически чистой ёмкости и соответствует всем установленным требованиям.
25 интересных фактов
Ученые постоянно исследуют оксид водорода, находя интересные факты.
- Лёд не тонет в воде. Дело в том, что плотность льда меньше чем, воды в жидком состоянии. Поэтому морские обитатели продолжают жизнедеятельность. Другие вещества увеличивают плотность при замерзании.
- Большинство загрязнений вымораживаются при образовании льда.
- Более 2/3 запасов пресной воды на Земле хранится в ледниках.
- Вёдра для воды изготавливают в форме конуса для того, чтобы их не разорвало при случайном замерзании воды.
- Теплоёмкость и некоторые другие физические свойства воды зависят от температуры не одинаково.
- Жидкая вода регулирует температуру Земли, водяной пар — влажность воздуха.
- Снег способен отражать лучи света на 75%, а вода только на 5%, поэтому снежные ночи такие светлые.
- В Антарктиде есть озеро с водой, в 11 раз солёнее морской. В нем настолько соленая вода, что не замерзает даже при — 50 С.
- Горячая вода имеет способность замерзать быстрее, чем холодная. Этот факт легко проверить самостоятельно.
- Лёд встречается на полюсах Луны, а также на полюсах Марса и Меркурия.
- В Антарктике находится самый холодный лёд, а вот самым теплым льдом считается Альпийский, так как его температура составляет 0 градусов по Цельсию.
- Температура кипения воды не всегда составляет 100 градусов по Цельсию. Показатель зависит от атмосферного давления. Например, на Эльбрусе — самой высокой вершине Европы (5642 м), — вода закипит при 80,8 °С.
- Примерно на каждые 100 метров вглубь к центру Земли температура кипения увеличивается на 3°C.
- Озеро Байкал — самое большое пресное озеро в мире.
- Для производства 1 тонны стали требуется 300 тонн воды.
- Учёные считают, что мировой океан изучен только на 2-7%.
- На 1 кг тела коровы приходится 600 грамм жидкости.
- В теле рыбы 70-80 процентов.
- В медузе больше 95 процентов.
- Растения на 50-90 процентов состоят из жидкости.
- Вода участвует в фотосинтезе растений.
- Бегемот употребляет около 250 литров воды в сутки.
- Древесное растение Эвкалипт в сутки поглощает из почвы и испаряет 320 л влаги.
- Верблюд способен выпить больше 100 литров воды менее, чем за 15 минут.
- Скалистая белка может жить без воды до 100 дней.
Заключение
Вода – удивительное вещество, обладающее химическими и физическими свойствами. Она формирует климат на планете, для многих живых организмов является средой обитания, необходима для фотосинтеза растений и жизнедеятельности всех живых организмов.
![]()
Вода – это основа жизни на Земле, без живительной влаги ни одно живое существо в природе не способно долго прожить. Свойства воды очень разнообразны, благодаря чему она смогла найти самое широкое применение на нашей планете. Давайте познакомимся с самыми важными качествами воды.
![]()
Состояния воды
Все привыкли, что вода – это прозрачная жидкость, без цвета и вкуса. Однако она может находиться в трех состояниях:
Состояние воды напрямую зависит от температуры. Если на улице тепло, то вода – жидкая, при сильном холоде (меньше 0С) вода замерзает и превращается в лед, а при закипании (больше 100С) она начинает испаряться в воздух. Но в природе при любой погоде происходит испарение воды.
![Лед]()
Рис. 1. Лед.
Способность воды менять свое состояние под воздействием температуры объясняет такой важный процесс как круговорот воды в природе.
Прозрачность воды
Степень прозрачности может быть самой разной. К примеру, в чистой горной речке можно увидеть дно с песком и камнями, в аквариуме можно наблюдать за разноцветными рыбками. И даже если заварить чай, то вода все равно сохранит свою прозрачность, и в чашке можно будет увидеть дно.
которые читают вместе с этой
![]()
![]()
![]()
![]()
![Прозрачность воды]()
Рис. 2. Прозрачность воды.
Но если в воде находится слишком много посторонних примесей, она становится мутной. Пробежав по песчаному дну мелкой речки или добавив в чай варенье или молоко, от былой прозрачности ничего не останется.
Это значит, что прозрачность воды напрямую зависит от ее чистоты.
Цвет и запах воды
Каков цвет чистой воды? Этот простой вопрос может многих поставить в тупик. Но на самом деле у воды совершенно нет никакого цвета – она бесцветна.
Но как же быть с морями и океанами, реками и озерами, ведь вода в них отливает всеми оттенками синего, голубого и зеленого. На самом деле чистая прозрачная вода просто отражает те цвета, которые ее окружают. Если зачерпнуть пригоршню лазурной морской воды, она окажется бесцветной.
Вода абсолютно нейтральна и в плане ароматов чистая вода ничем не пахнет.
Вода и электричество
Каждый ребенок должен знать, что там, где есть вода, не место электрическим приборам! Вода очень хорошо проводит ток, и при ее попадании в розетку или на включенный электроприбор может произойти несчастный случай – сильный удар током. В некоторых случаях это может даже привести к смерти.
Именно поэтому нужно быть очень осторожным и следить за тем, чтобы электроприборы находились как можно дальше от воды.
Текучесть воды
В жидком состоянии вода способна течь. Течет она в реках и ручьях, из-под крана или перевернутой вниз бутылки.
Способность воды принимать форму посуды, в которой она находится, называется текучестью. Независимо от того, куда она налита, будь то чашка, замысловатая узкая ваза или канистра, вода всегда идеально повторит контуры емкости.
![Вода в сосуде]()
Рис. 3. Вода в сосуде.
При замерзании вода увеличивается в объеме. Об этом нужно помнить, прежде чем решить положить в морозильник бутылку с водой. Постепенно превращаясь в лед, вода способна разорвать сосуд: пластиковая бутылка лопнет, а стеклянная – разлетится на множество осколков.
Вода текучая , как и все жидкости. Поэтому на земле есть реки, ручьи и водопады, а в наш дом она может поступать по водопроводу.
Вода растворяет многие вещества . Если в воду насыпать соль и перемешать, то соль как бы пропадает. Вода остаётся прозрачной, но становится солёной. Это происходит потому, что частицы соли перемешиваются с частицами воды.
![shutterstock_162244724.jpg]()
Но известно много веществ, которые в воде не растворяются. Если смешать с водой песок, то вода станет мутной, а песок через некоторое время осядет на дне сосуда.
![shutterstock_1490431379.jpg]()
Для очистки воды от примесей твёрдых веществ используется фильтрование . Мутную воду пропускают через фильтр (специальную бумагу или ткань). На фильтре оседают твёрдые частицы, а вода становится чистой.
Читайте также: