Каковы способы получения альдегидов и кетонов кратко
Обновлено: 02.07.2024
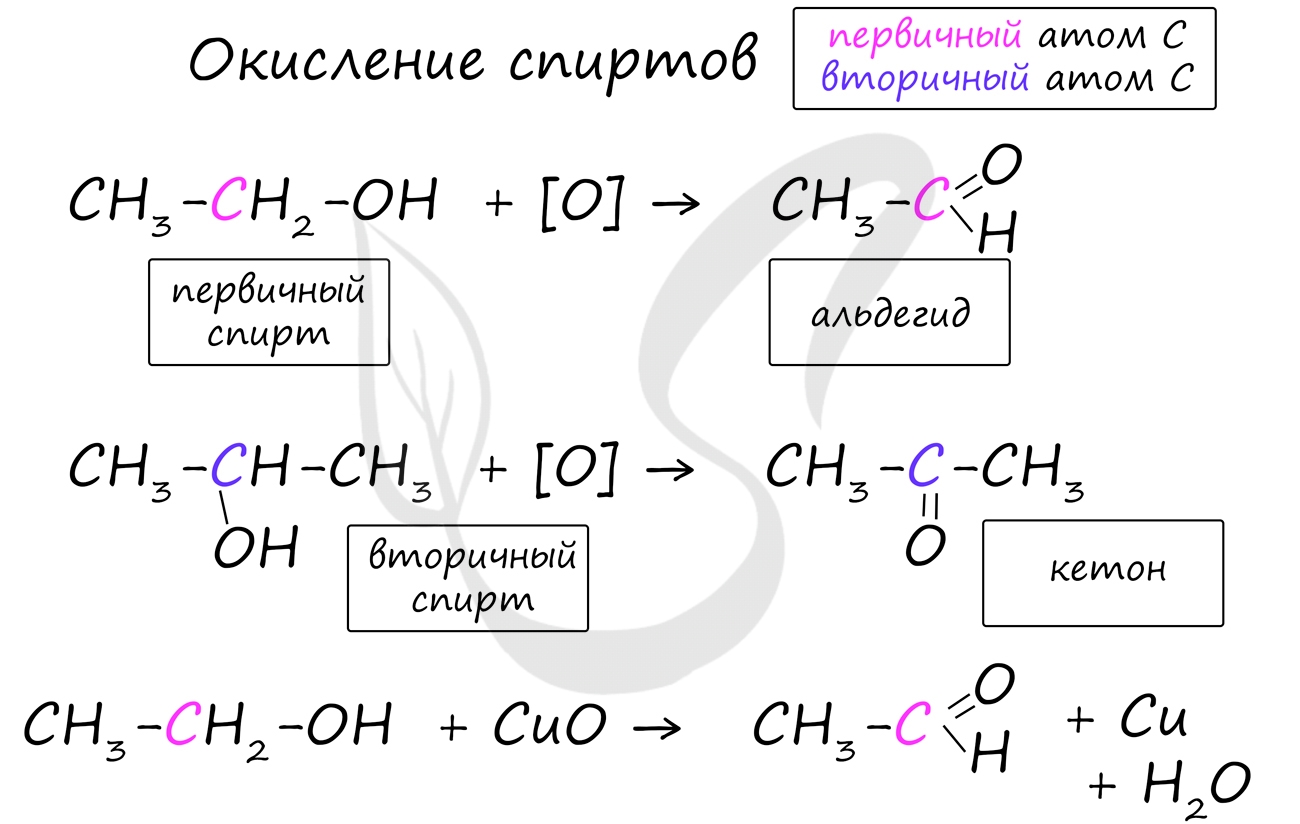
1. Окисление спиртов
В лаборатории карбонильные соединения получают окислением спиртов в жестких условиях в присутствии сильных окислителей (дихромата калия К2Cr2O7 или перманганата калия КМnО4) в серной кислоте Н2SO4. В качестве окислителя можно использовать оксид меди (II) при нагревании.
При окислении первичных спиртов образуются альдегиды:
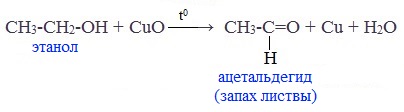
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот:
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в ходе реакции (tкип альдегида, не образующего межмолекулярные водородные связи, ниже tкип спирта и кислоты).
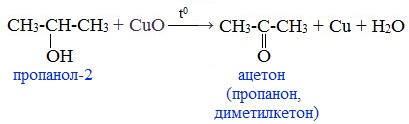
При окислении вторичных спиртов образуются кетоны:
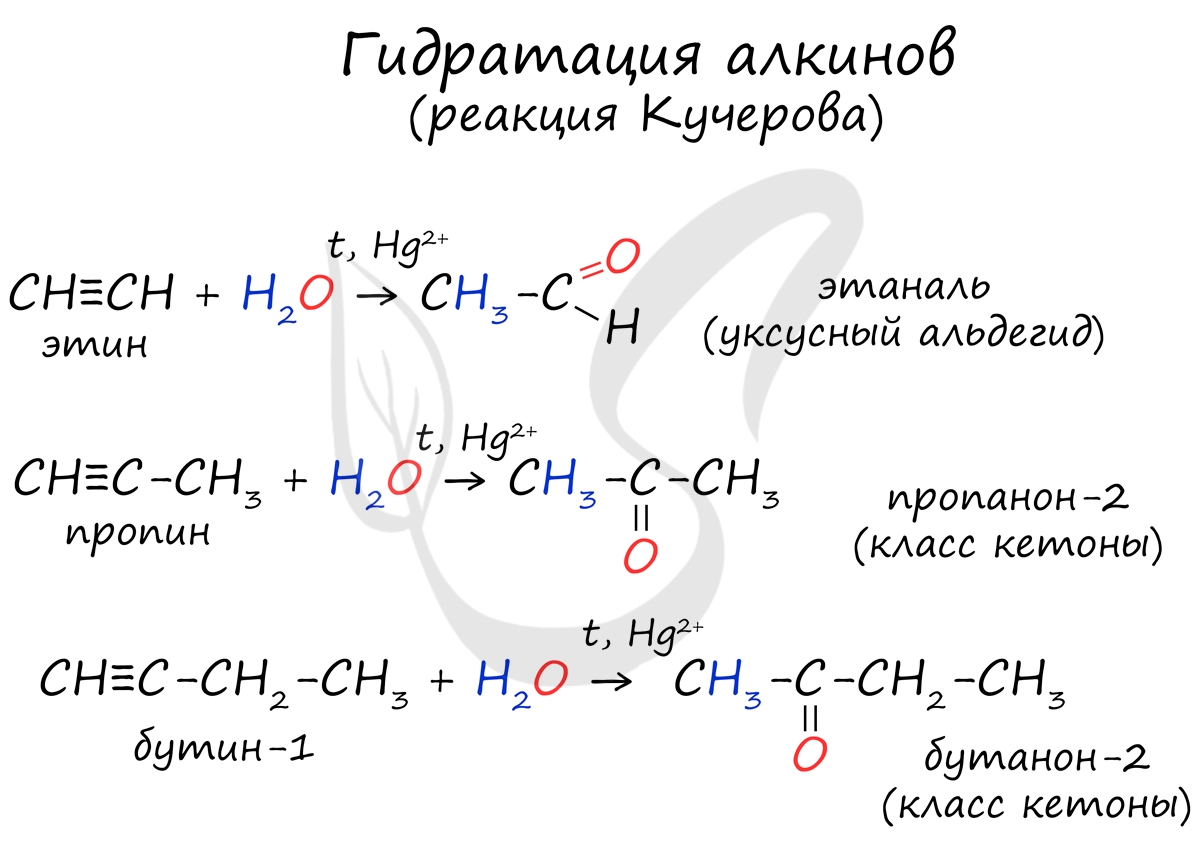
2. Гидратация алкинов (реакция Кучерова)
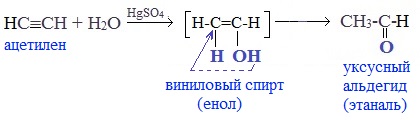
Присоединение воды к ацетилену происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта (енола), который изомеризуется в уксусный альдегид (в случае ацетилена):
Кетоны получают при гидратации других гомологов ряда алкинов:
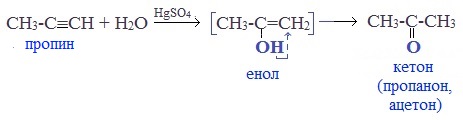
Раньше это был промышленный способ получения карбонильных соединений. В настоящее время этот способ находит ограниченное применение из-за загрязнения получаемых продуктов токсичными солями ртути и относительной дороговизны.
3. Каталитическое окисление алкенов кислородом воздуха
Этим способом в промышленности получают уксусный альдегид — окислением этилена кислородом воздуха (Вакер-процесс).
Эта реакция протекает в присутствии катализатора – смеси PdCl2 и CuCl2 и температуре 100 0 С:

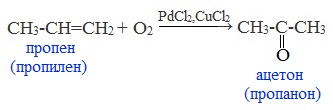
Этим экономичным способом получают низшие альдегиды и кетоны.
Этот промышленный способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы.
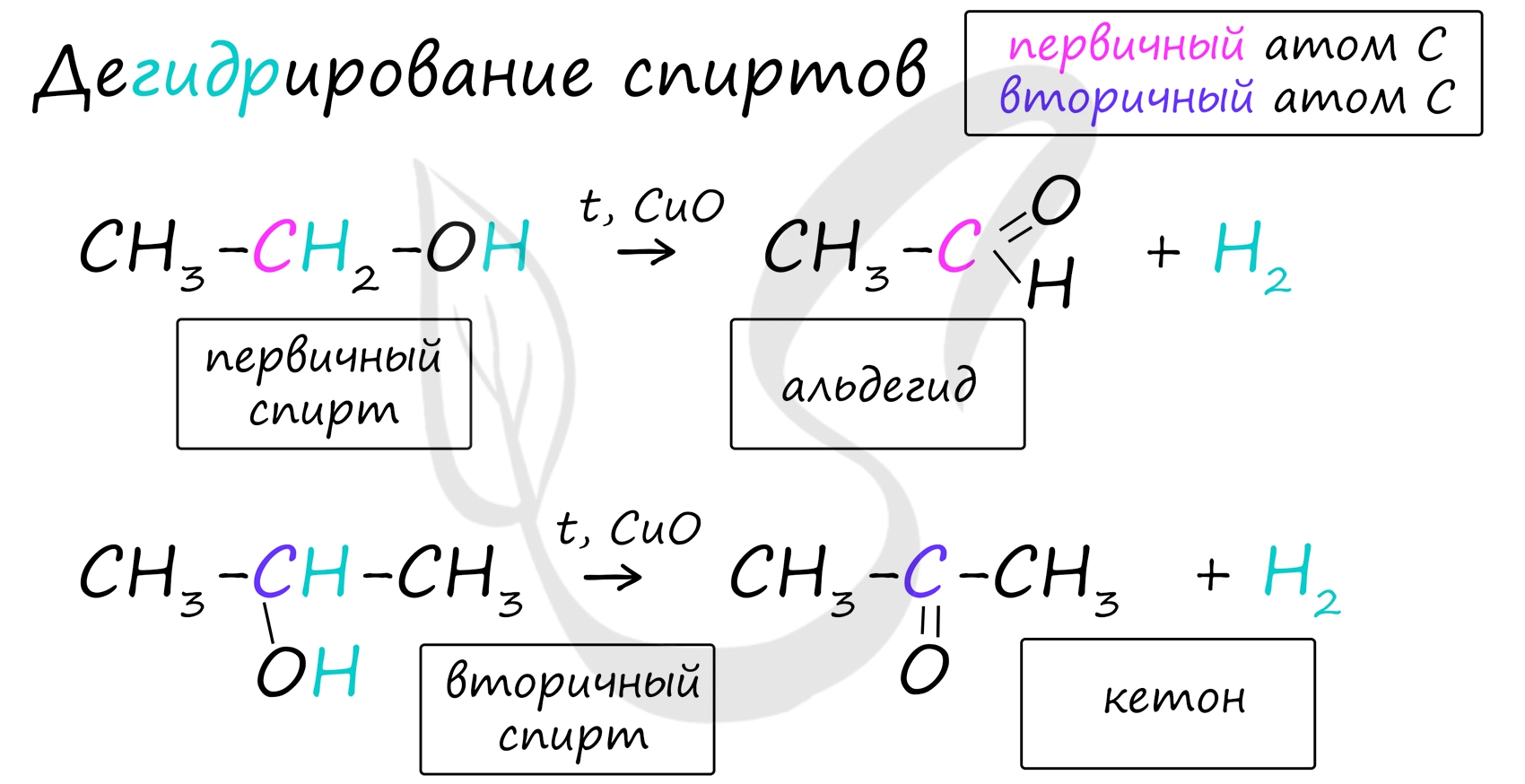
4. Каталитическое дегидрирование спиртов
В промышленности альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
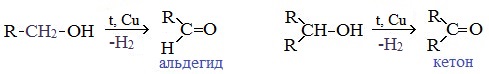
Первичные спирты окисляются до альдегидов, а вторичные – до кетонов.
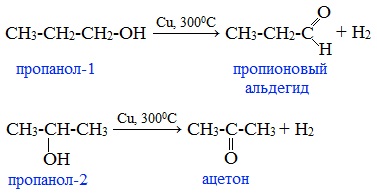
Этот способ позволяет получать карбонильные соединения, в особенности альдегиды, без побочных продуктов окисления.
В 1867 г. немецкий химик-органик А. Гофман, пропуская пары метилового спирта над раскаленной платиновой спиралью, получил газообразное вещество состава СН2О, молекула которого отличается от открытого Либихом альдегида на группу -СН2— . Именно это соединение (муравьиный альдегид) открывает гомологический ряд альдегидов.
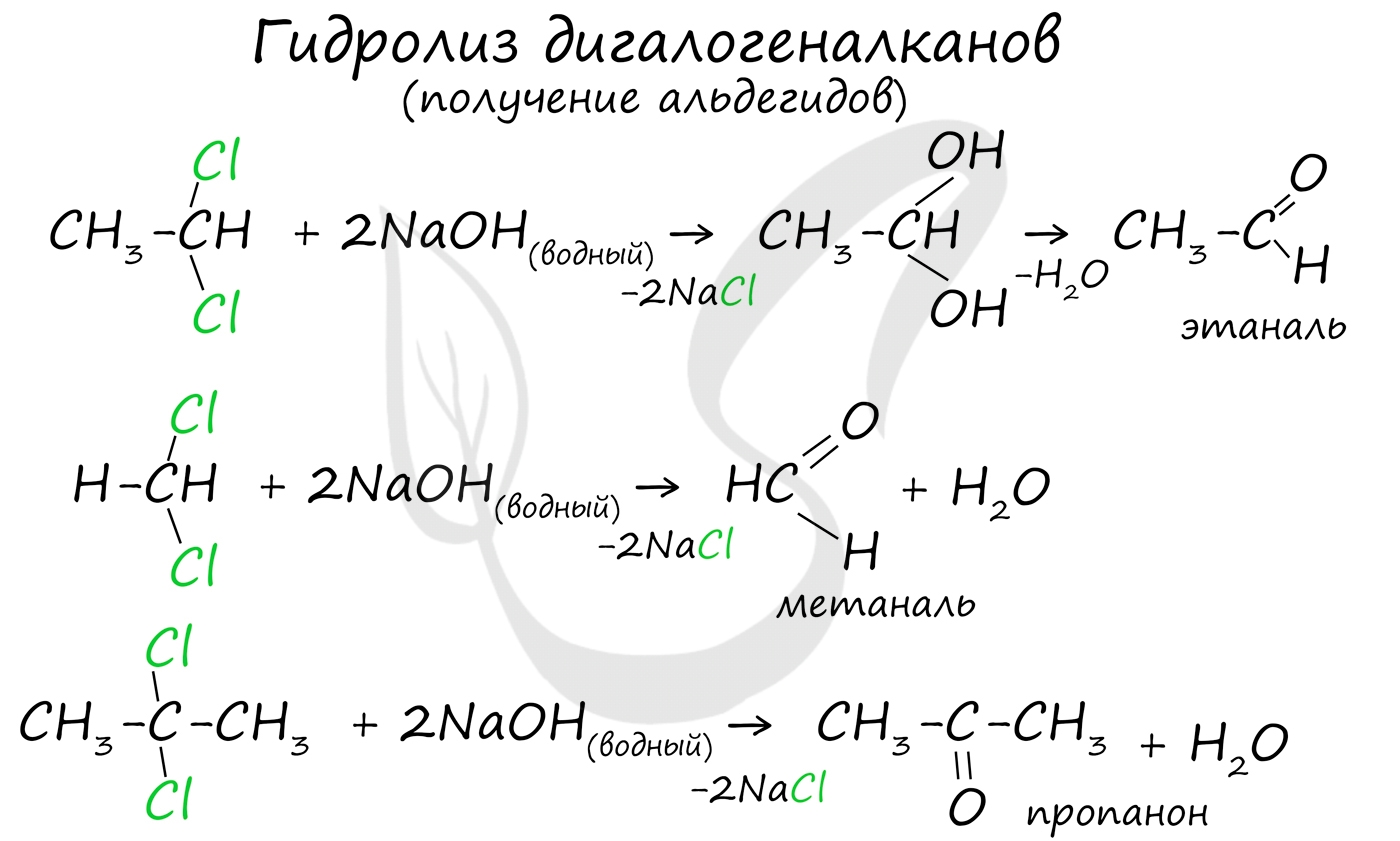
5. Щелочной гидролиз дигалогеналканов
Реакция протекает при действии водных растворов щелочей на дигалогензамещенные углеводороды, содержащие два атома галогена у одного и того же атома углерода.
При щелочном гидролизе дигалогеналканов образуются двухатомные спирты, в которых две группы ОН соединены с одним атомом углерода. Эти вещества неустойчивы и при отщеплении воды, превращаются в карбонильные соединения.
Если два атома галогена связаны с первичным атомом углерода, то образуются альдегиды:
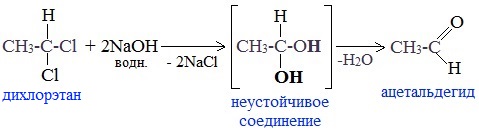
При гидролизе дигалогеналканов, содержащих атомы галогена у вторичного атома углерода, образуются кетоны:
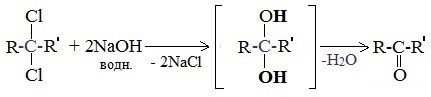
Это лабораторный способ получения карбонильных соединений.
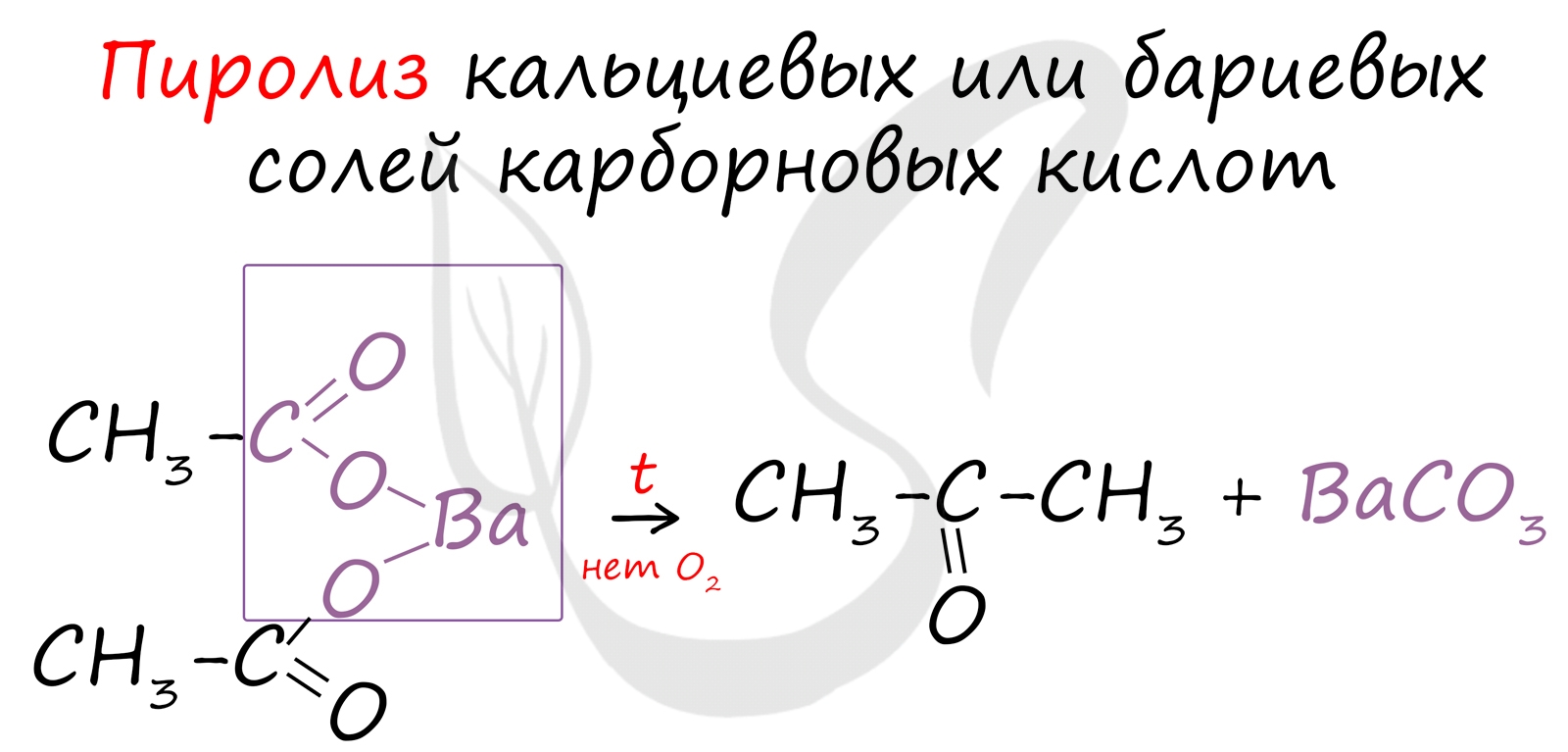
6. Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей карбоновых кислот образуются соответствующие карбонильные соединения. Из смешанной соли муравьиной и другой карбоновой кислоты получают альдегиды, а в остальных случаях образуются кетоны.
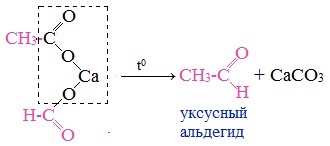


Это лабораторный способ получения карбонильных соединений.
7. Кумольный способ получения ацетона (наряду с фенолом)
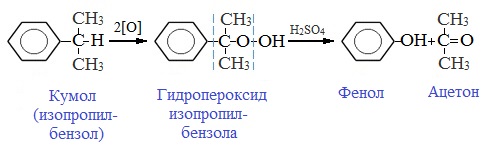
Простейший кетон – ацетон – получают кумольным методом вместе с фенолом:
Это промышленный способ получения ацетона.
Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
Получение формальдегида
1. Окисление метана
Формальдегид в промышленности можно получить окислением метана кислородом воздуха при высоких температурах с использованием катализатора:
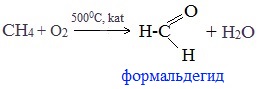
2. Окисление метанола
Основной промышленный способ получения формальдегида – окисление метанола с использованием серебряного катализатора при температуре 650 0 С и атмосферном давлении:
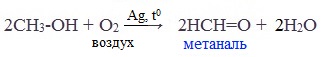
Реакция происходит на раскаленной серебряной сетке, через которую проходят пары ментола, смешанные с воздухом. Реакция настолько экзотермична, что выделяющейся в ходе ее теплоты достаточно для того, чтобы поддерживать сетку в раскаленном состоянии.
В настоящее время разработан перспективный способ высокотемпературного окисления метанола с использованием железомолибденовых катализаторов:
Альдегиды - летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
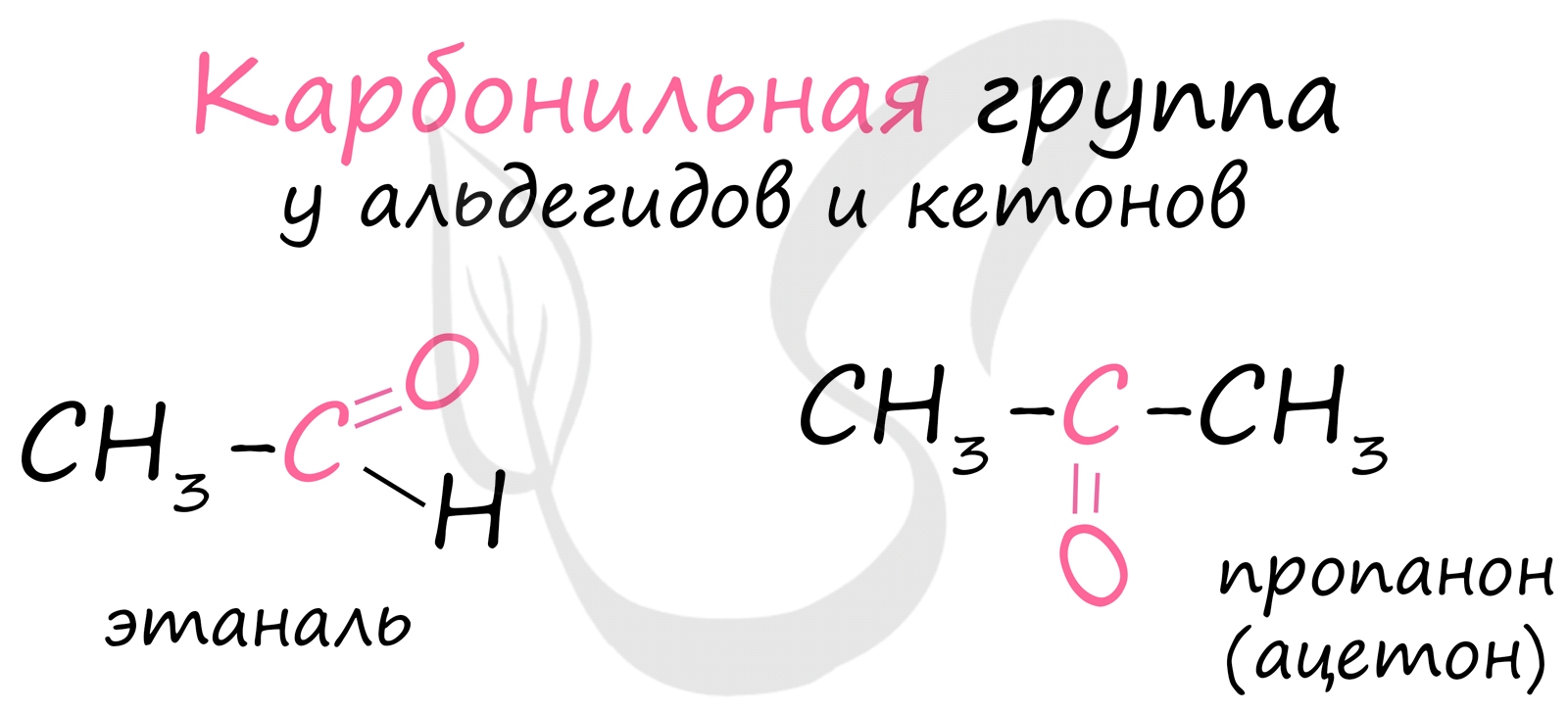
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.

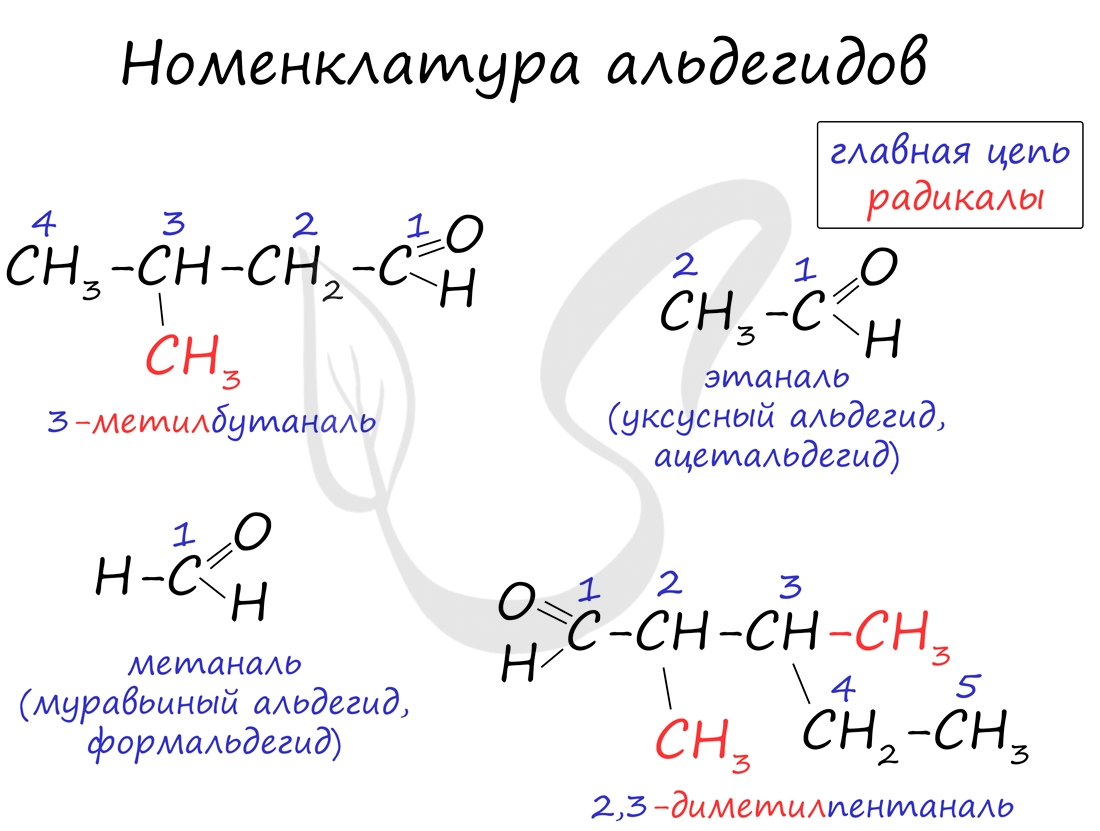
Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса "аль" к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот - HO. Например: метаналь - HCHO, этаналь - CH3CHO, пропаналь - C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь - формальдегид, этаналь - ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
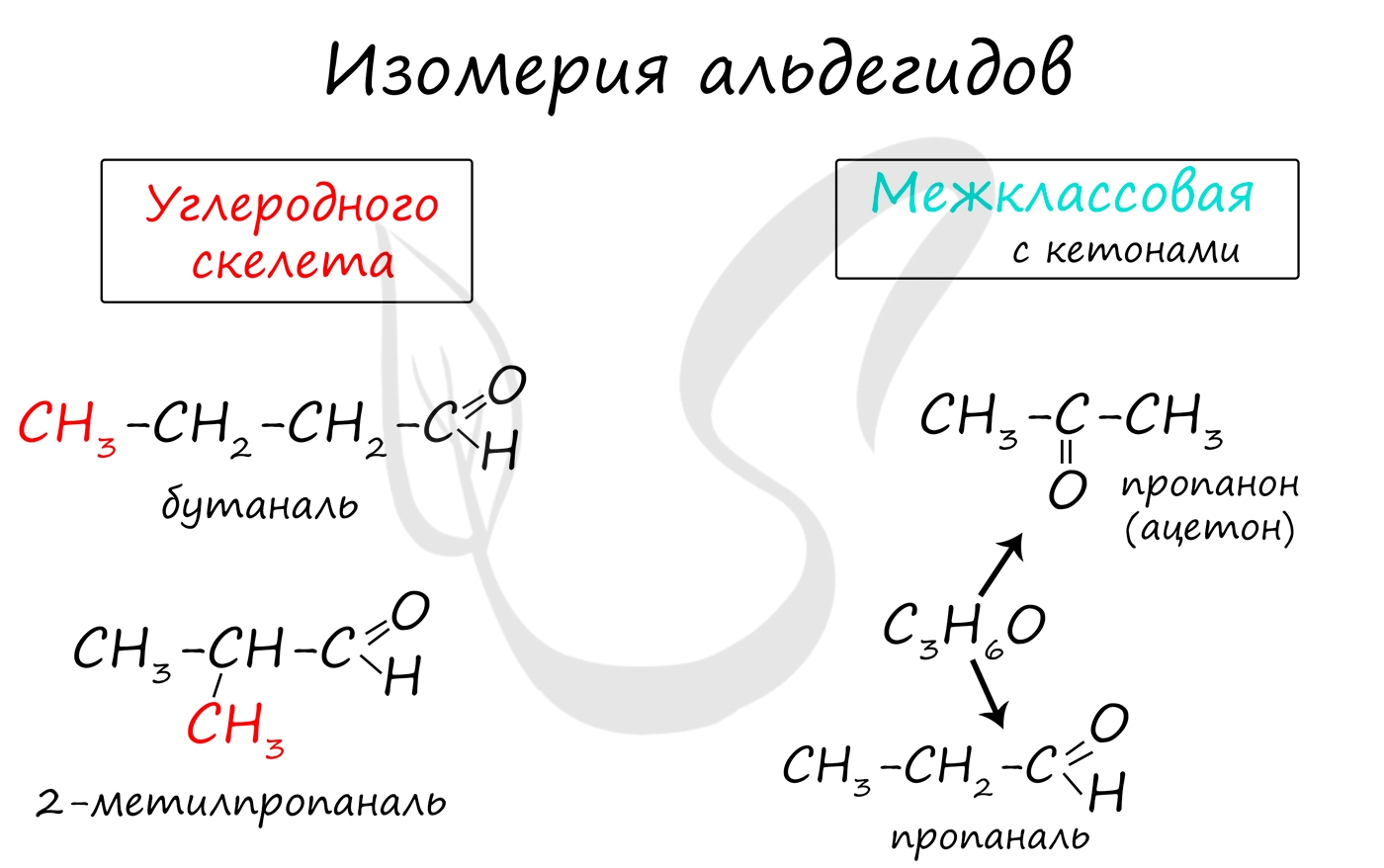
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов - кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов - у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
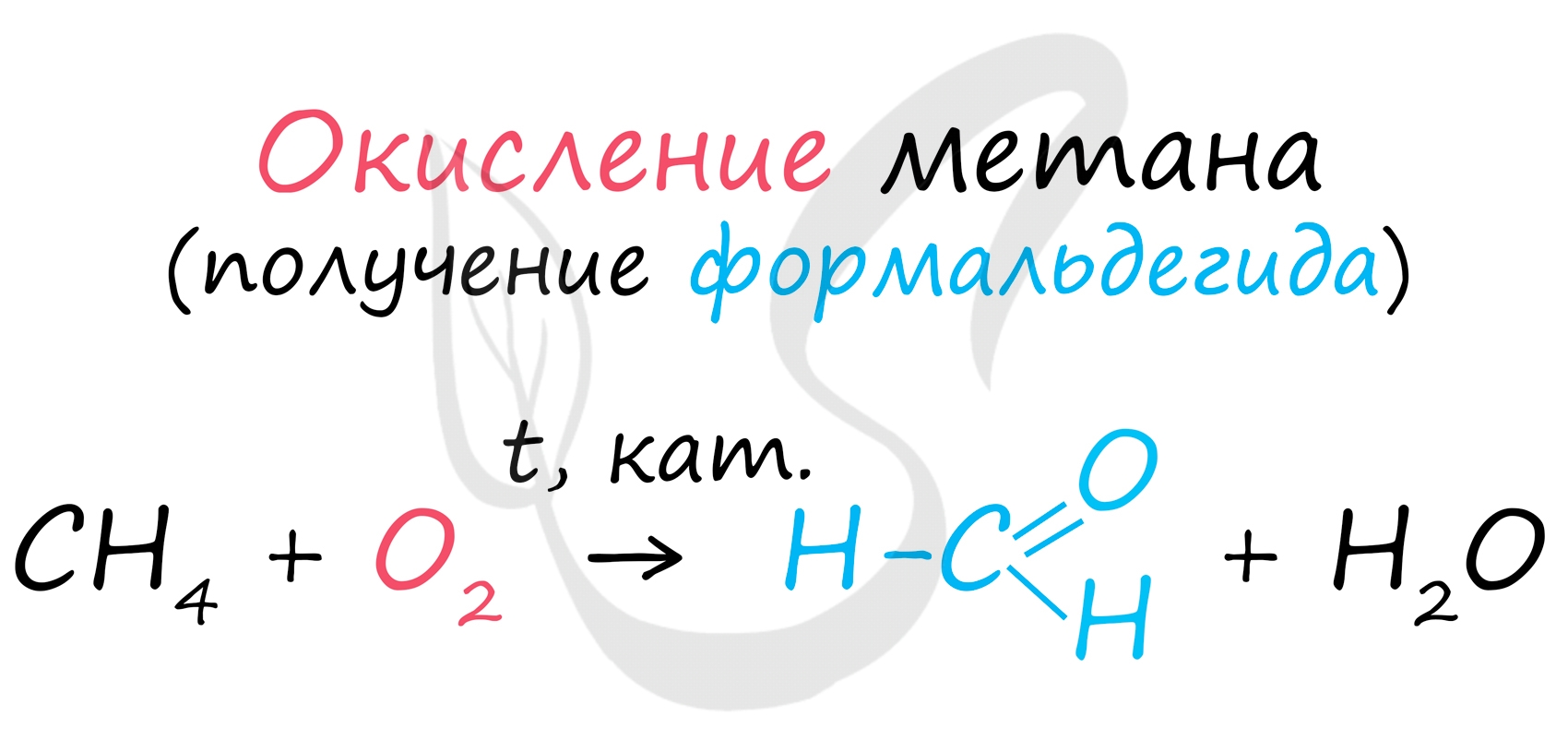
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.

Химические свойства альдегидов и кетонов
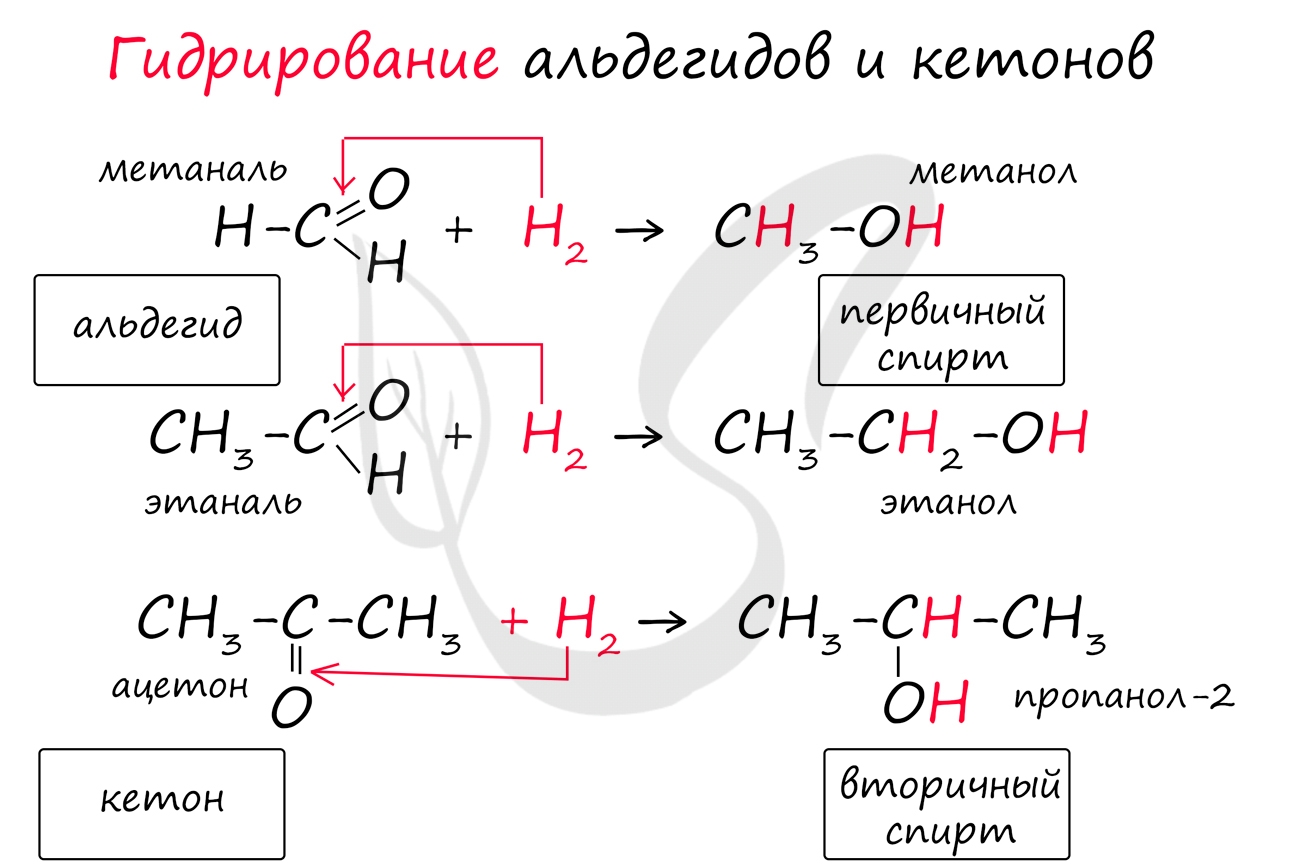
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов - вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
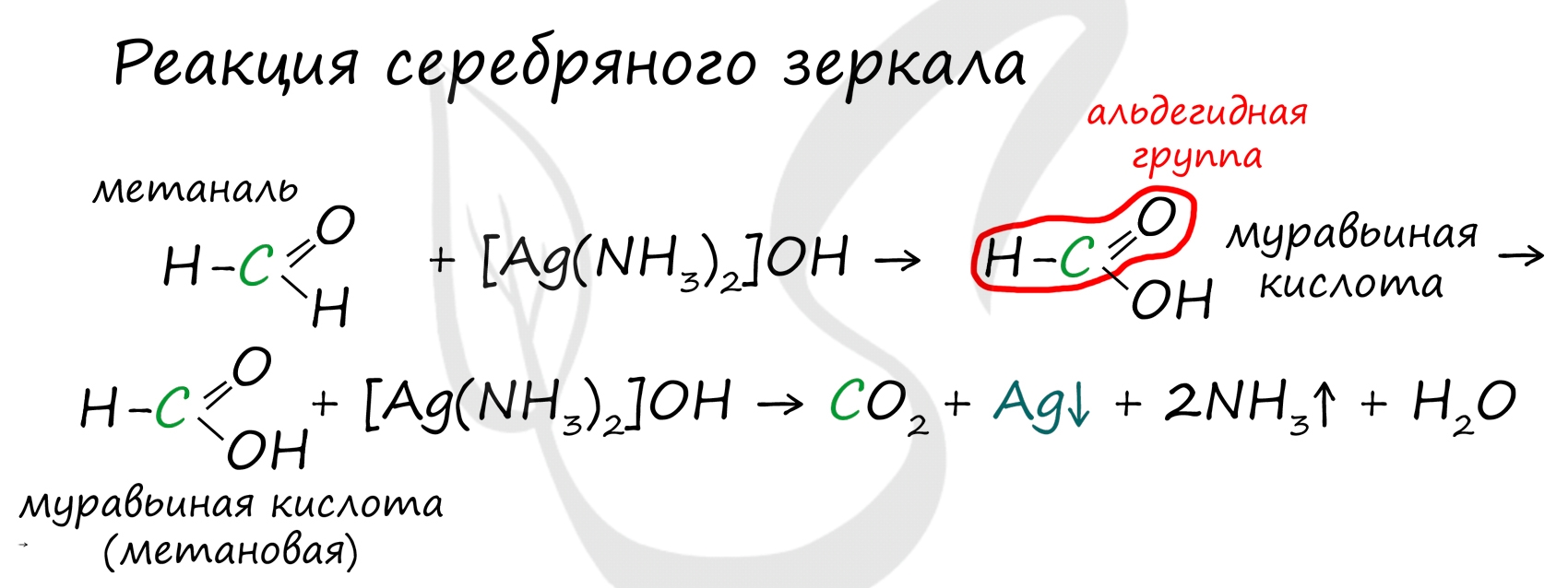
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли

Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом - наличием альдегидной группы у муравьиной кислоты.
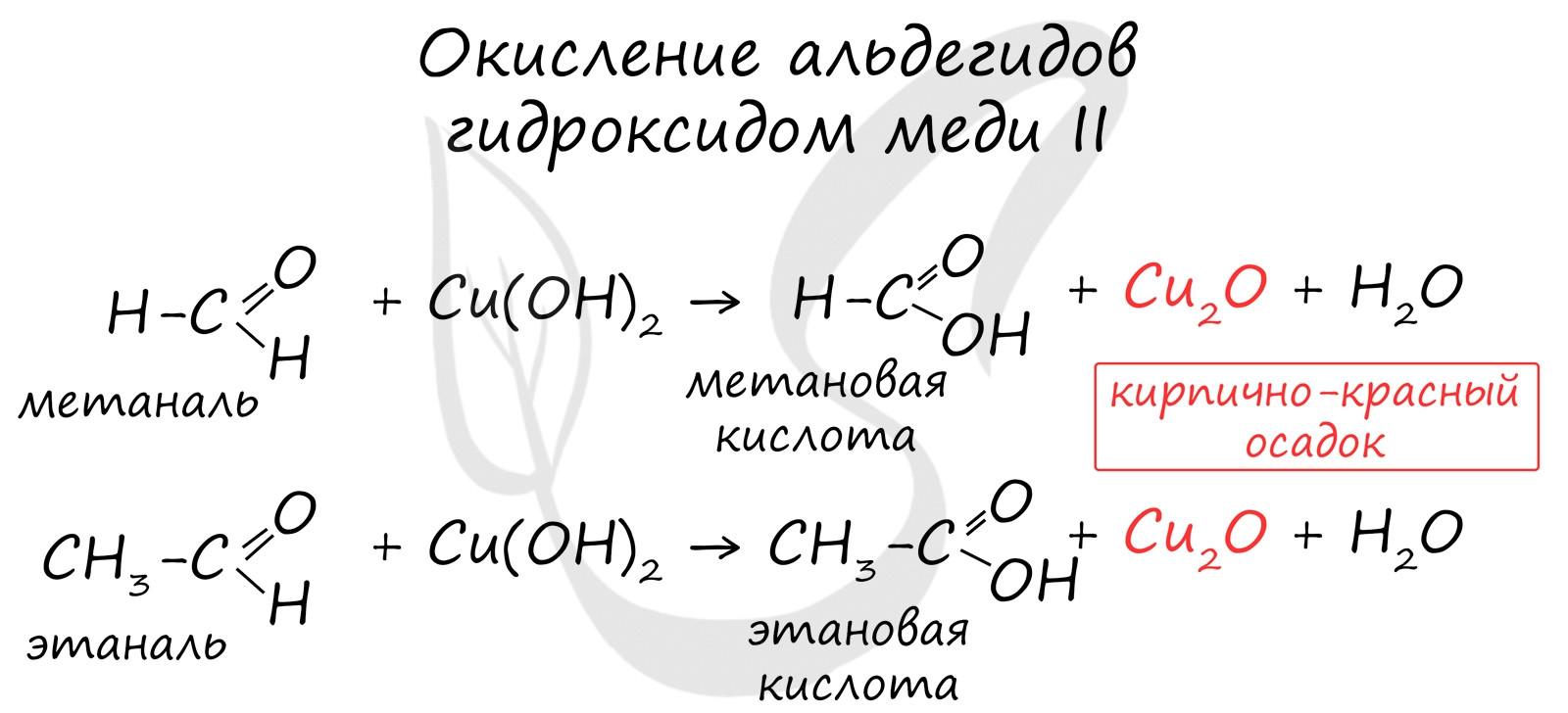
Окисление также возможно другим реагентом - гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.

В этом видеоуроке собран материал по основным физическим и химическим свойствам альдегидов и кетонов, способам получения отдельных представителей класса.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Альдегиды и кетоны: свойства и получение"
Рассмотрим физические свойства альдегидов. При обычных условиях метаналь находится в газообразном состоянии, имеет резкий неприятный запах и ядовит. Остальные альдегиды – жидкости и твёрдые вещества. Низшие альдегиды, как правило, имеют неприятный и резкий запах, высшие альдегиды обладают цветочным запахом.
Температуры кипения альдегидов ниже, чем у спиртов с таким же числом атомов углерода, так как в них отсутствуют межмолекулярные водородные связи.
Простейшие альдегиды хорошо растворяются в воде. Например, уксусный альдегид неограниченно растворим в воде, формальдегид достаточно хорошо растворим в воде. Формалин – это 40 %-ный раствор формальдегида.
Химические свойства альдегидов и кетонов обусловлены строением карбонильной группы. Из-за того, что в карбонильной группе у атома кислорода частичный отрицательный заряд, а у атома углерода – частичный положительный, для альдегидов характерны реакции присоединения.
Для альдегидов и кетонов характерны реакции присоединения водорода. При этом образуются спирты. Так, в реакции этаналя с водородом в присутствии никелевого или платинового катализатора, образуется этанол. Гидрирование альдегидов и кетонов относят к реакциям восстановления.

Кроме этого, альдегиды легко окисляются до соответствующих карбоновых кислот. Если к аммиачному раствору оксида серебра (I) прилить раствор уксусного альдегида и смесь нагреть, то образуется уксусная кислота и внутренняя поверхность пробирки покрывается тонким слоем серебра.

Ещё одной качественной реакцией на альдегиды является реакция со свежеприготовленным гидроксидом меди (II). Так, при окислении уксусного альдегида гидроксидом меди (II) образуется уксусная кислота и осадок красного цвета, представляющий собой оксид меди (I).

Окислить альдегиды можно также K2Cr2O7, KMnO4 или кислородом воздуха в присутствии катализатора. При этом также образуются карбоновые кислоты. Например, при окислении пропионового альдегида кислородом воздуха в присутствии катализатора образуется пропановая кислота.

В промышленных масштабах альдегиды получают из нефти, галогенпроизводных и спиртов.
В лаборатории альдегиды и кетоны получают окислением спиртов. Так, при окислении этанола оксидом меди (II) образуется уксусный альдегид.

При окислении пропанола-2 в тех же условиях образуется ацетон, который является кетоном.

Альдегиды и кетоны можно получить гидратацией алкинов. Так, гидратацией ацетилена в условиях реакции Кучерова образуется уксусный альдегид.
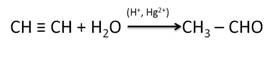
В результате присоединения воды к пропину образуется кетон – ацетон.

Одним из промышленных способов получения альдегидов является окисление алкенов в присутствии солей палладия.

Альдегиды можно получить и в реакции с алкенами – оксосинтез. Так, в реакции этилена с синтез-газом в определённых условиях образуется пропаналь.

Альдегиды и кетоны можно получить в реакции гидролиза дигалогензамещённых алканов. Например, в реакции 1,1-дихлорэтана с водным раствором щёлочи образуется этаналь, в реакции 2,2-дихлорпропана с водным раствором щёлочи образуется ацетон.

Альдегиды и кетоны получают дегидрированием спиртов в присутствии катализатора меди. Так, при дегидрировании первичного спирта этанола образуется этаналь, при дегидрировании вторичного спирта пропанола-2 образуется кетон – ацетон.

Таким образом, реакционная способность альдегидов и кетонов обусловлена строением карбонильной группы. Для альдегидов и кетонов характерны реакции присоединения по месту двойной связи С = О, для альдегидов характерны реакции окисления по месту связи С – Н в альдегидной группе. К основным промышленным способам получения альдегидов и кетонов относятся: окисление спиртов и дегидрирование спиртов.

Альдегиды и кетоны
Ключевые слова конспекта: Альдегиды. Альдегидная группа. Формальдегид. Ацетальдегид. Качественные реакции на альдегиды. Реакции поликонденсации. Карбонильная группа. Кетоны. Ацетон.
Понятие об альдегидах

Современный рынок конструкционных и отделочных материалов необыкновенно богат. Древесно-стружечные плиты, из которых изготовлена мебель, искусно маскируются под натуральное дерево. Искусственный камень, из которого сделаны столешницы кухонной мебели, внешне трудно отличить от натурального камня. Стеновые панели и пластиковая вагонка окрашены во все цвета радуги и легко монтируются. Ламинат или линолеум создают иллюзию настоящей древесины. Ручки кухонной посуды, корпуса розеток и выключателей должны выдерживать высокую температуру или электрическое напряжение, при этом не гореть, не плавиться, отвечать гигиеническим нормам, а потому должны быть изготовлены из веществ, соответствующих установленным требованиям.

Что же общего между такими непохожими предметами быта? При изготовлении многих из них используют полимерные вещества, получаемые на основе органического вещества формальдегида. Формальдегид имеет формулу СН2О, однако чаще всего её записывают в виде НСНО, поскольку она точнее отражает строение молекулы:

Между атомами углерода и кислорода имеется двойная связь. Группу
(или —СНО) называют альдегидной группой. Именно она определяет принадлежность соединения к классу альдегидов.

Гомологический ряд альдегидов
Формальдегид (метаналь) — родоначальник гомологического ряда альдегидов. Это бесцветный ядовитый газ с характерным запахом, хорошо растворимый в воде. Водный раствор формальдегида называют формалином.

Общая формула представителей гомологического ряда альдегидов СnН2nО. Обозначив углеводородный радикал буквой R, общую формулу альдегидов можно записать так:
Формулы и названия первых представителей этого класса органических веществ приведены в таблице 6. Международные названия альдегидов образуются от названий соответствующих алканов с добавлением суффикса -аль.

Способы получения альдегидов

Основной промышленный метод получения формальдегида — уже знакомая вам реакция окисления соответствующего спирта, в данном случае метанола:

Кроме того, возможно получение формальдегида в результате каталитического окисления метана:

Уксусный альдегид (этаналь) в промышленности получают прямым окислением этилена в присутствии катализатора — хлорида палладия(II):
Химические свойства альдегидов
Химические свойства альдегидов определяются в первую очередь наличием в их молекуле альдегидной группы.

Несмотря на наличие в альдегидной функциональной группе двойной связи, альдегиды не относят к непредельным соединениям. В типичные для непредельных соединений реакции присоединения они вступают с трудом. Тем не менее в присутствии катализатора водород способен присоединяться по связи

Формальдегид легко окисляется, образуя при этом карбоновую кислоту. Реакцию окисления формальдегида можно записать упрощённо, обозначив окислитель как [О]:

На реакциях окисления основаны качественные реакции на альдегиды. В роли окислителя можно использовать аммиачный раствор оксида серебра. В упрощённом виде эту реакцию можно выразить уравнением
При осторожном нагревании альдегида с аммиачным раствором оксида серебра на стенках пробирки образуется блестящий налёт металла, поэтому данная реакция получила название реакция серебряного зеркала.

Альдегиды легко окисляются также свежеприготовленным гидроксидом меди(II) в щелочной среде. При этом голубой цвет осадка изменяется на кирпично-красный в результате образования оксида меди(I):
Фенолформальдегидная смола
Наиболее важны с практической точки зрения реакции альдегидов, приводящие к получению высокомолекулярных продуктов (полимеров).
Взаимодействием формальдегида с фенолом синтезируют полимер фенолформальдегидную смолу. Является ли это взаимодействие реакцией полимеризации? Оказывается, нет. В данном случае протекает процесс поликонденсации, в результате которого, в отличие от полимеризации, помимо высокомолекулярного вещества, образуется побочный низкомолекулярный продукт (чаще всего вода). Схема взаимодействия формальдегида с фенолом:


Уравнении реакции:
Если фенолформальдегидной смолой пропитать стружки или опилки и спрессовать при нагревании, получится древесно-стружечная плита. Аналогичным образом склеиванием тонких слоёв древесины (шпона) получают фанеру. Если покрыть древесно-стружечную плиту или фанеру плёнкой с рисунком под дерево или камень, получится материал для изготовления мебели. Изделия из ДСП выделяют в окружающую среду токсичные мономеры фенолформальдегидной смолы — фенол и формальдегид. Даже незначительные концентрации этих веществ могут вызывать головную боль, резь в глазах, раздражение дыхательных путей и т. д. Выделение формальдегида из ДСП контролируется и является важным показателем качества плит.
Если в фенолформальдегидную смолу добавляют различные цветные красители, наполнители, помещают в форму и нагревают, то получают устойчивые к высоким температурам изделия из полимерного материала — фенопласта.
Формальдегид используют для дубления кожи в кожевенном производстве, так как при взаимодействии с белком он вызывает его денатурацию. В результате дубильного действия формалина кожа не подвергается гниению. На этом же свойстве формалина основано его применение для хранения биологических препаратов, дезинфекции и протравливания семян.

Понятие о кетонах

В отличие от молекул альдегидов, молекулы кетонов содержат два углеводородных радикала, связанные с функциональной карбонильной группой . Простейший представитель кетонов — хорошо известный растворитель лаков и красок ацетон, или диметилкетон:


Читайте также:

