Изобразите схемы строения электронной оболочки атомов алюминия фосфора кислорода химия кратко
Обновлено: 01.07.2024
Вопрос 2 (2).
а) сравним строение атомов азота и фосфора.
Строение электронной оболочки этих атомов схоже, оба на последнем энергетическом уровне содержат по 5 электронов. Однако у азота всего 2 энергетических уровня, а у фосфора - 3.
б) Сравним строение атомов фосфора и серы.
Атомы фосфора и серы имеют по 3 энергетических уровня, причем у каждого последний уровень незавершенный, но у фосфора на последнем энергетическом уровне 5 электронов, а у серы 6.
Вопрос 3 (3).
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов равно порядковому номеру элемента. Число энергетических уровней определяется номером периода и равно 3. Число внешних электронов определяется номером группы и равно 4.
Вопрос 4 (4).
Количество содержащихся в периоде элементов равно максимально возможному числу электронов на внешнем энергетическом уровне и это число определяется по формуле 2n 2 , где n — номер периода. Поэтому в первом периоде содержится только 2 элемента (2 . 1 2 = 2), а во втором периоде 8 элементов (2 . 2 2 = 8).
Вопрос 5 (5).
В астрономии — Период вращения Земли вокруг своей оси 24 часа.
В географии — Смена сезонов с периодом 1 год, а также морские приливы и отливы.
В физике — Периодические колебания маятника, движение поршня в двигателе внутреннего сгорания.
В биологии — Деление клеток микроорганизмов при оптимальных условиях через каждые 20 мин.
Вопрос 6 (6).
Электроны и строение атома были открыты в начале ХХ века, чуть позже было написано это стихотворение, которое отражает во многом нуклеарную, или планетарную, теорию строения атома, а также В. Брюсов допускает возможность, что и электроны тоже сложные частицы, строение которых учёные ещё не изучили.
Вопрос 7 (7).
Приведенные в учебнике выше поэтические строки говорят о большом поэтическом таланте В. Брюсова и гибком уме его, раз он мог так легко понять и принять все достижения современной ему науки. Эти два четверостишия показывают просвещенность и образованность поэта в данной области.

Фосфор (Р) – типичный неметалл с относительной атомной массой 31. Строение атома фосфора определяет его активность. Фосфор легко вступает в реакции с другими веществами и элементами.
Строение
Строение атома элемента фосфора отражено в периодической таблице Менделеева. Фосфор расположен под 15 номером в пятой группе, третьем периоде. Следовательно, атом фосфора состоит из положительно заряженного ядра (+15) и трёх электронных оболочек, на которых находится 15 электронов.
Рис. 1. Положение в таблице Менделеева.
Графически расположение строение атома выглядит следующим образом:
Фосфор относится к р-элементам. На внешнем энергетическом уровне в возбуждённом состоянии располагается пять электронов, которые определяют валентность элемента. В обычном состоянии внешний уровень остаётся незавершённым. Три неспаренных электрона указывают на степень окисления (+3) и третью валентность. Фосфор легко переходит из обычного в возбуждённое состояние.
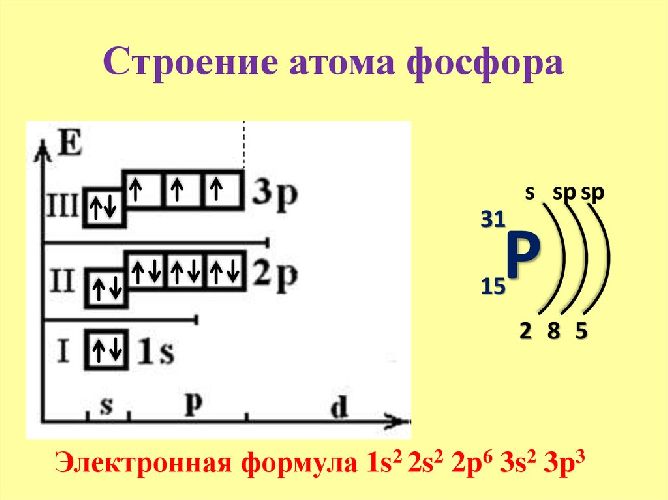
Рис. 2. Строение фосфора.
Ядро состоит из 15 протонов и 16 нейронов. Чтобы посчитать количество нейронов, необходимо вычесть из относительной атомной массы порядковый номер элемента – 31-15=16.
Аллотропия
Фосфор имеет несколько аллотропических модификаций, отличающихся строением кристаллической решётки:
- белый – ядовитое вещество, напоминающее воск, светится в темноте, т.к. окисляется при низких температурах;
- жёлтый – неочищенный белый фосфор (имеет примеси);
- красный – менее ядовитое вещество, чем белый или жёлтый фосфор, не воспламеняется и не светится;
- чёрный – похожее на графит вещество с металлическим блеском, проводит электрический ток, может переходить в металлический фосфор.

Рис. 3. Виды фосфора.
Белый фосфор – наиболее активная модификация элемента, которая быстро окисляется на воздухе, поэтому белый фосфор хранят под водой.
Свойства
Фосфор реагирует c простыми веществами – металлами и неметаллами, проявляя окислительно-восстановительные свойства. Основные реакции с фосфором описаны в таблице.
Читайте также:

