Химические свойства ртути кратко
Обновлено: 30.06.2024
№80 Ртуть
Ртуть известна с древнейших времен. Её находили в самородном виде (жидкие капли ртути в горных породах), получали при обжиге минералов, природных соединений ртути. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 г., ее металлические свойства (ковкость, электропроводность и др.) были доказаны трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть.
Русское название ртути происходит от праслав. *rьtоtь, связанного с лит. risti - "катиться". Латинское алхимическое название этого элемента Hydrargyrum происходит от др.-греч. слов "вода" и "серебро".
Получение:
Ртуть считается редким металлом (содержание в земной коре 8,3*10 -6 %). Хотя известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В России известно 23 месторождения ртути. Ртуть получают обжигом киновари (сульфида ртути(II)) HgS + O2 = Hg + SO2
или ее металлотермическим восстановлением: HgS + Fe = Hg + FeS
Образующиеся при этом пары ртути конденсируют и собирают. Эти способы применяли ещё алхимики древности.
Физические свойства:
Ртуть - единственный металл, который находится в жидком состоянии при комнатной температуре. Температура плавления 234,32 K (-38,83°C), температура кипения 630K (357°C). Плотность (13,55 г/см 3 ). Обладает высокой электропроводностью. Характерной особенностью ртути является ее способность растворять многие металлы, образует с ними жидкие и твёрдые сплавы - амальгамы.
Химические свойства:
При комнатной температуре не взаимодействует с кислородом, водой, растворами щелочей. При нагревании на воздухе при температуре около 300°C ртуть окисляется до оксида HgO, но при более высоких температурах оксид неустойчив и реакция не идет.
Растворяется в азотной кислоте, образуя нитрат ртути(I) Hg2(NO3)2 или ртути(II) Hg(NO3)2; растворение в царской водке идет с образованием комплексов: 3Hg + 2HNO3 + 12HCl -> 3H2[HgCl4] + 2NO +4H2O
В соединениях проявляет степень окисления +1 (образуя кластерный катион Hg2 2+ ) или +2.
Важнейшие соединения:
Соединения ртути(I) в большинстве неустойчивы, легко окисляются, восстанавливаются и диспропорционируют:
Оксид ртути(I), Hg2O, черный порошок, неустойчив, легко разлагается под действ. тепла или света, не растворим.
Нитрат ртути(I), Hg2(NO3)2, бесцветные кристаллы, растворим, гидролизуется по катиону.
Сульфат ртути(I), Hg2SO4, желто-белые кристаллы, нерастворим, образует кристаллогидрат Hg2SO4*2H2O.
Хлорид ртути(I), "каломель", Hg2Cl2 - бесцветные кристаллы, нерастворим.
Оксид ртути(II), HgO, существует в красной или желтой модификации, основной оксид, растворяясь в кислотах образует соли ртути(II), с водой не реагирует. При нагревании выше 300°C разлагается.
Нитрат ртути(II), Hg(NO3)2, бесцветные кристаллы, растворим, гидролизуется по катиону.
Хлорид ртути(II), "сулема", HgCl2 - бесцветные кристаллы, хорошо растворим.
Йодид ртути(II), HgI2 - ярко-красное вещество, нерастворимо в воде, но растворимо в избытке раствора KI? образуя комплексное соединение: HgI2 + 2KI = K2[HgI4].
Щелочной раствор этого комплексного соединения используется в аналитической химии для обнаружения аммиака и ионов аммония ("реактив Несслера"): K2[HgI4] + NH3 + 3KOH = [Hg2N]I*H2O + 7 KI + 2H2O (образуется желтый осадок)
Применение:
Металлическая ртуть является незаменимой во многих технических и научно-исследовательских приборах (кварцевых лампах, ртутно-паровых выпрямителях, в реле, в регуляторах давления, для изготовления термометров).
В большом количестве ртуть используется при получении щелочей и хлора (электролиз раствора NaCl с ртутным катодом), в амальгамной металлургии, для извлечения металлов из руд, их очистки, получения сплавов. В лабораторных условиях амальгама натрия находит применение в качестве восстановителя.
Многие соединения ртути используются в медицине, как антисептики и лекарства.
Сама ртуть, ее пары, практически все соединения, особенно хорошо растворимые, чрезвычайно ядовиты.
Ртуть — элемент побочной подгруппы второй группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum). Простое вещество ртуть — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты.
Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии
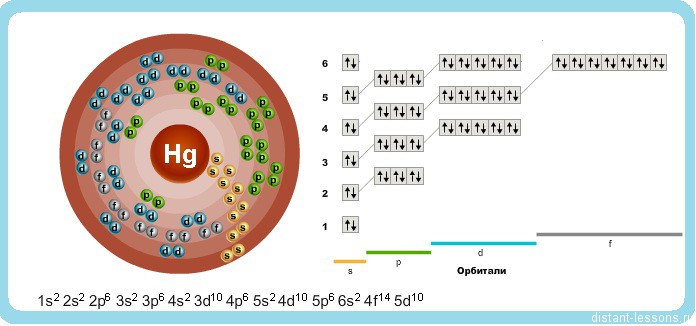
Исходя из электронного строения, можно сделать вывод, что для в соединениях ртуть будет проявлять степени окисления +2 и +1.
Физические свойства ртути:
- при комнатной температуре — сербристо-серая жидкость , легко переходящая в газообразное состояние ;
- электро- и теплопроводна;
- очень высокая плотность вещества;
Как видите, все вышеперечисленные свойства — характеристики металлического вещества, хотя и в жидком состоянии.
Химические свойства ртути:
1) Реакция с кислородом (при нагревании >300 ° С): 2Hg + O2 = 2HgO (красного цвета);
2) реагирует с водородом, но только с атомарным ( так же при нагревании): Hg + 2H = HgH2 — гидрид ртути;
3) C неметаллами ( при нагревании): Hg + S = HgS
4) Взаимодействие с кислотами: с кислотами-не окислителями не взаимодействует

В ряду активности металлов ртуть стоит после водорода, поэтому в реакциях с кислотами-окислителями водород не выделяется:
Как видно из реакции, чаще всего в соединениях ртуть проявляет степень окисления + 2, но +1 тоже встречается, причем в очень необычном виде:
Степень окисления
Соединения ртути
+1
Оксид — не выделен;
Гидроксид — не выделен
Катион ртути — Hg2 2+ , соответственно, соль — нитрат ртути (I) — Hg2(NO3)2
Кстати, таких соединений ртути (I) немало — смотрите таблицу растворимости:
+2
Что касается соединений ртути (II), то не смотря на то, что простое вещество ртуть — металл, в веществах HgS (черные или красные кристаллы) и HgJ2 (желтые кристаллы) cвязь ковалентная.
Связь ртуть-углерод в органических соединениях ртути самая прочная из всех известных металл-органических связей
Соединения ртути чрезвычайно ядовиты, соответственно, как и большинство других ядов, их часто используют в медицине:
- хлорид ртути (I) (каломель) — слабительное;
- меркузал и промеран — сильные мочегонные;
- хлорид ртути (II), цианид ртути (II), амидохлорид ртути и жёлтый оксид ртути(II) — антисептики (в том числе в составе мазей).
- Амальгаму серебра применяют в стоматологии в качестве материала зубных пломб.
Еще на эту тему:
Ввиду чрезвычайной токсичности современная медицина как лекарства соединения ртути не использует вообще. Перечисленные тутные диуретики сняты в производства в конце 60х годов, ртутные антисептики также более не используются — тем более, что в современных условиях имеется море аналогичных по эффекту, но практически нетоксичных и поэтому безопасных синтетических веществ.

Ртуть (Hg, от лат. Hydrargyrum ) — элемент шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80, относящийся к подгруппе цинка (побочной подгруппе II группы). Простое вещество ртуть — переходный металл, при комнатной температуре представляющий собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты, контаминант. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй такой элемент — бром). Название на английском - Mercury.

Тяжёлый жидкий металл серебристо-белого цвета
Содержание
- 1 История
- 1.1 Происхождение названия
- 2.1 Месторождения
- 7.1 Характерные степени окисления
- 7.2 Свойства металлической ртути
- 8.1 Медицина
- 8.2 Техника
- 8.3 Металлургия
- 8.4 Химическая промышленность
- 8.5 Сельское хозяйство
- 9.1 Гигиеническое нормирование концентраций ртути
- 9.2 Демеркуризация
- 9.3 Запрет использования содержащей ртуть продукции
История
![символ ртути]()
Ртуть известна с древних времён. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари. Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и её соединений, в частности сулемы. Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твёрдость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 году. Для представления элемента как у алхимиков, так и в настоящее время используется символ планеты Меркурий. Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства в твёрдом состоянии: ковкость, электропроводность и др.
Происхождение названия
Нахождение в природе
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В обычных условиях киноварь и металлическая ртуть не растворимы в воде, но в присутствии некоторых веществ (Fe2(SO4)3, озон, пероксид водорода) растворимость в воде этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах щелочных металлов с образованием, например, комплекса HgS•nNa2S. Ртуть легко сорбируется глинами, гидроксидами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg4Cl.
Месторождения
Ртуть считается редким металлом.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
В окружающей среде
![ртуть]()
До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограммов на 1 кубический дециметр льда. Природные источники, такие, как вулканы, составляют примерно половину всех выбросов атмосферной ртути. Причиной появления остальной половины является деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля (главным образом в тепловых электростанциях) — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Изотопы
Природная ртуть состоит из смеси 7 стабильных изотопов: 196 Hg (распространённость 0,155 %), 198 Hg (10,04 %), 199 Hg (16,94 %), 200 Hg (23,14 %), 201 Hg (13,17 %), 202 Hg (29,74 %), 204 Hg (6,82 %). Искусственным путём получены радиоактивные изотопы ртути с массовыми числами 171—210.
Получение
Ртуть получают обжигом киновари (сульфида ртути II) или металлотермическим методом:
HgS + O2 ⟶ Hg + SO2↑ HgS + Fe ⟶ FeS↓ + Hg
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании. В Новое время с ним стала конкурировать Идрия во владениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В 2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмадена и Идрии памятником Всемирного наследия человечества.
В надписях во дворце древнеперсидских царей Ахеменидов (VI—IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски.
Природная ртуть состоит из смеси семи стабильных нуклидов: 196 Hg (содержание 0, 146% по массе), 198 Hg (10, 02%), 199 Hg (16, 84%), 200 Hg (23, 13%), 201 Hg (13, 22%), 202 Hg (29, 80%) и 204 Hg (6, 85%). Радиус атома ртути 0, 155 нм. Радиус иона Hg + — 0, 111 нм (координационное число 3), 0, 133 нм (координационное число 6), иона Hg 2+ — 0, 083 нм (координационное число 2), 0, 110 нм (координационное число 4), 0, 116 нм (координационное число 6) или 0, 128 нм (координационное число 8). Энергии последовательной ионизации нейтрального атома ртути равны 10, 438, 18, 756 и 34, 2 эВ. Расположена во IIВ группе, 6 периода периодической системы. Конфигурация внешнего и предвнешнего электронных слоев 5s 2 p 6 d 10 6s 2 . В соединениях проявляет степени окисления +1 и +2. Электроотрицательность по Полингу 1, 9.
История открытия
Ртуть известна человечеству с древнейших времен. Обжиг киновари HgS, приводящий к получению жидкой ртути, использовали еще в 5 в. до н. э. в Междуречье. Использование киновари и жидкой ртути описано в древних документах Китая, Ближнего Востока. Первое подробное описание получения ртути из киновари описано Теофрастом около 300 лет до н. э.
В древности ртуть использовали для добычи золота из золотых руд. Этот способ основан на ее способности растворять многие металлы, образуя жидкие или легкоплавкие амальгамы. При прокаливании амальгамы золота летучая ртуть испаряется, золото остается. Во второй половине 15 в в Мексике применяли амальгамирование для извлечения из руды серебра.
Алхимики считали ртуть составной частью всех металлов, полагая, что изменением ее содержания можно осуществить превращение ртути в золото. Только в 20 в. физики установили, что в процессе ядерной реакции атомы ртути действительно превращаются в атомы золота. Но такой способ чрезвычайно дорог.
Нахождение в природе
Редкий рассеянный элемент. Содержание ртути в земной коре 7, 0·10 –6 % по массе. В природе ртуть встречается в свободном состоянии. Образует более 30 минералов. Основной рудный минерал киноварь. Минералы ртути в виде изоморфных примесей встречаются в кварце, халцедоне, карбонатах, слюдах, свинцово-цинковых рудах. Желтая модификация HgO встречается в природе в виде минерала монтроидита. В обменных процессах литосферы, гидросферы, атмосферы участвует большое количество ртути. Содержание ртути в рудах от 0, 05 до 6-7%.
Получение
Первоначально ртуть получали из киновари, помещая ее куски в вязанки хвороста и обжигая киноварь в кострах.
В настоящее время ртуть получают окислительно-восстановительным обжигом руд или концентратов при 700-800 о С в печах кипящего слоя, трубчатых или муфельных. Условно процесс может быть выражен:
Выход ртути при таком способе составляет около 80%. Более эффективен способ получения ртути путем нагревания руды с Fe и CaO:
Особо чистую ртуть получают электрохимическим рафинированием на ртутном электроде. При этом содержание примесей составляет от 1·10 –6 до 1·10 –7 %.
Физические и химические свойства
Ртуть — серебристо-белый металл, в парах бесцветный. Единственный жидкий при комнатной температуре металл. Температура плавления –38, 87°C, кипения 356, 58°C. Плотность жидкой ртути при 20°C 13, 5457 г/см 3 , твердой ртути при –38, 9°C — 14, 193 г/см 3 .
С использованием ртути голландский физик и химик Х.Камерлинг-Оннес в 1911 впервые наблюдал явление сверхпроводимости. Температура перехода α-Hg в сверхпроводящее состояние 4, 153К, β-Hg — 3, 949К. При более высоких температурах ртуть ведет себя как диамагнетик. Жидкая ртуть не смачивает стекло и практически не растворяется в воде (в 100 г воды при 25°C растворяется 6·10 –6 г ртути).
Стандартный электродный потенциал пары Hg 2+ 2/Hg 0 = +0.789 B, пары Hg 2+ /Hg 0 = +0.854B, пары Hg 2+ /Hg 2+ 2= +0.920B. В неокисляющих кислотах ртуть не растворяется с выделением водорода.
Кислород и сухой воздух при обычных условиях ртуть не окисляют. Влажный воздух и кислород при ультрафиолетовом облучении или электронной бомбардировке окисляют ртуть с поверхности с образованием оксидов.
Ртуть окисляется кислородом воздуха при температуре выше 300°C, образуя оксид ртути HgO красного цвета:
Ртуть не реагирует при нормальных условиях с молекулярным водородом, но с атомарным водородом образует газообразный гидрид HgH. Ртуть не взаимодействует с азотом, фосфором, мышьяком, углеродом, кремнием, бором, германием.
С разбавленными кислотами ртуть не реагирует, но растворяется в царской водке и в азотной кислоте. Причем, в случае с кислотой продукт реакции зависит от концентрации кислоты и соотношения ртути и кислоты. При избытке ртути, на холоду, протекает реакция:
С галогенами ртуть активно взаимодействует с образованием галогенидов. При реакциях ртути с серой, селеном и теллуром возникают халькогениды HgS, HgSe, HgTe. Эти халькогениды праrтически не растворимы в воде. Например, значение ПР HgS = 2·10 –52 . Сульфид ртути растворяется только в кипящей HCl, царской водке (при этом образуется комплекс [HgCl4] 2– ) и в концентрированных растворах сульфидов щелочных металлов:
Сплавы ртути с металлами называют амальгамами. Стойкие к амальгамированию металлы — железо, ванадий, молибден, вольфрам, ниобий и тантал. Со многими металлами ртуть образует интерметаллические соединения меркуриды.
Ртуть образует два оксида: оксид ртути(II) HgO и неустойчивый на свету и при нагревании оксид ртути(I) Hg2O (черные кристаллы).
HgO образует две модификации — желтую и красную, отличающиеся размерами кристаллов. Красная модификация образуется при добавлении к раствору соли Hg 2+ щелочи:
Желтая форма химически более активна, при нагревании краснеет. Красная форма при нагревании чернеет, но приобретает прежний цвет при охлаждении.
Соли ртути(I) содержат группировку Hg2 2+ со связью –Hg–Hg–. Получают эти соединения, восстанавливая соли ртути(II) ртутью:
В зависимости от условий, соединения ртути(I) могут проявлять как окислительные, так и восстановительные свойства:
Применение
Ртуть используют для изготовления катодов при электрохимическом получении едких щелочей и хлора, а также для полярографов, в диффузионных насосах, барометрах и манометрах; для определения чистоты фтора и его концентрации в газах. Парами ртути наполняют колбы газоразрядных ламп (ртутных и люминесцентных) и источников УФ излучения. Ртуть применяют при нанесении золотых покрытий и при добычи золота из руды.
Сулема — важнейший антисептик, применяют при разбавлениях 1:1000. Оксид ртути (II), киноварь HgS применяются для лечения глазных и кожных и венерических заболеваний. Киноварь также используют для приготовления чернил и красок. В древности из киновари готовили румяна. Каломель используется в ветеринарии в качестве слабительного средства.
Физиологическое действие
Ртуть и ее соединения высокотоксичны. Пары и соединения ртути накапливаясь в организме человека, сорбируются легкими, попадают в кровь, нарушают обмен веществ и поражают нервную систему. Признаки ртутного отравления проявляются уже при содержании ртути в концентрации 0.0002–0.0003 мг/л. Пары ртути фитотоксичны, ускоряют старение растений.
При работе с ртутью и ее соединениями следует предотвращать ее попадание в организм через дыхательные пути и кожу. Хранят в закрытых сосудах.
Ртуть – единственный из всех существующих в природе металлов, который остается жидким при комнатной температуре. В этих условиях на воздухе она не окисляется, в воде и щелочах не растворяется. Растворяется в холодной азотной кислоте и нагретой концентрированной серной. В обычных условиях активно испаряется, и скорость этого процесса прямо пропорциональна температуре и площади поверхности испарения. Пары ртути не имеют ни запаха, ни цвета, обнаружить их в воздухе можно только с помощью специальных приборов
Физические свойства ртути
Для ртути характерны низкая вязкость и высокое поверхностное натяжение. Эти свойства становятся причиной двух негативных с точки зрения ртутного загрязнения среды процессов:
- не ограниченная сосудом ртуть легко разделяется на мелкие шарики, тем самым резко увеличивая свою поверхность испарения;
- капли ртути очень подвижны и легко проникают в труднодоступные места, затрудняя их удаление.
Пары ртути отличает очень высокая летучесть, и слой воды или иной жидкости не представляет для них реальной преграды. То же самое можно сказать и о многих строительных материалах, таких как бетон, кирпич, лакокрасочное покрытие, линолеум или плитка. Ртутные пары равномерно пропитывают их на всю толщину, а также легко сорбируются из воздуха деревом, коврами и тканями. При повышении температуры или при механическом воздействии происходит обратная десорбция ртути в воздух помещения.
Чистая металлическая ртуть хорошо растворяет многие металлы, снижая тем самым прочность металлических конструкций, и образует непрочные соединения как с неорганическими, так и с органическими веществами.
Воздействие ртути на человека и животных
Для всего живого ртуть и ее соединения – это сильнейший яд, который может вызвать:
- общее отравление;
- угнетение половых желез;
- интоксикацию зародышей;
- пороки развития и уродства;
- мутацию генов, при которой дефекты становятся наследственными.
Основные пути попадания ртути в организм – это вдыхание ее паров с воздухом либо употребление с пищей или водой. Организм человека выводит не более 20% попавшей в него ртути, и она накапливается в почках и мозге, поражает плод, если женщина беременна, содержится в крови и грудном молоке. При концентрации паров ртути более 0,1 мг/м3 наступает острое отравление, признаки которого:
- возбуждение/угнетение центральной нервной системы (ЦНС);
- резкое снижение кровяного давления;
- поражение слизистых дыхательного и пищеварительного трактов;
- изменения формулы крови;
- повышенное содержание ртути в моче;
- тяжелое поражение почек;
- бронхит или даже пневмония.
Следствием длительного воздействия малых доз ртути является хроническое отравление, которое может проявиться с задержкой на несколько лет. Все это время в организме накапливаются необратимые нарушения с такими внешними признаками:
- общее недомогание;
- проблемы с пищеварением – потеря аппетита, поносы;
- проблемы с ЦНС – апатия, ртутная неврастения, головные боли, бессонница, повышенная психическая возбудимость, нарушение памяти;
- астеновегетативный синдром – тахикардия, неустойчивый пульс, ртутный тремор языка, век, конечностей и всего тела.
![Пролитая ртуть: как с ней бороться]()
![Пролитая ртуть: как с ней бороться]()
Мнение эксперта:
Вокруг нас находится немало источников ртути, хотя люди редко об этом задумываются. Например, это бытовые приборы — в обычном градуснике содержится до 2 граммов жидкого металла. До десятков граммов ртути также присутствует в энергосберегающих люминесцентных лампах, есть и медицинские источники этого токсичного вещества (к ним относятся некоторые вакцины и зубные пломбы с амальгамой). Мы часто недооцениваем опасность ртути. Между тем, ее испарения имеют свойство отравлять и накапливаться в организме, а при больших концентрациях ртуть даже впитывается слизистыми. Больше всего к отравлениям этим токсичным веществом чувствительны дети и женщины.
Алена Парецкая, врач — педиатр
Пролитая ртуть: как с ней бороться
Существуют как природные (месторождения), так и техногенные (места добычи, горнорудные и предприятия цветной металлургии, специальные полигоны-хранилища, отходы сжигания нефтепродуктов и т. д.) источники ртути, загрязняющей воздух, воду и почву. Бытовые и производственные помещения загрязняются ртутью при неправильной эксплуатации ртутных приборов и устройств, таких как термометры, манометры, выпрямители электрического тока. Статистика утверждает, что 80% всех работ МЧС в Санкт-Петербурге источники паров ртути. Если не принимать во внимание злоумышленные проливы ртути, то наиболее частая причина их существования – разбитый ртутный термометр и преступно халатное отношение к последствиям этого события
ОЧЕНЬ ВАЖНО!
![чем опасно отравление ртутью]()
![чем опасно отравление ртутью]()
Если у Вас в семье есть ребёнок, заранее объясните ему, что если он нечаянно
разобьёт термометр, его никто не будет за это ругать. В противном случае ваше чадо, испугавшись наказания за разбитый градусник, спрячет его остатки куда-нибудь под кровать или шкаф и ничего Вам не скажет – в итоге вся Ваша семья долгое время будет дышать ядовитыми парами ртути.При прохождении теста нужно помнить: Предельно допустимая концентрация ртути 300нг/м3
Читайте также:







