Химические свойства метана кратко
Обновлено: 05.07.2024
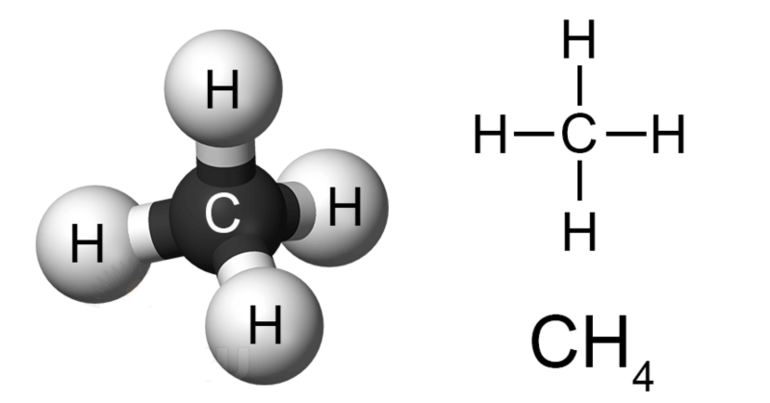
Метан – простейший представитель класса предельных углеводородов (строение молекулы приведено на рис. 1). Это бесцветный легкий горючий газ, не имеющий запаха и почти нерастворимый в воде.
Температура его кипения равна -161,5 o С, температура затвердевания -182,5 o С. Смесь метана с воздухом крайне взрывоопасна (особенно в соотношении 1:10).

Рис. 1. Строение молекулы метана.
Получение метана
Метан довольно часто встречается в природе. Он является основной составной частью природного газа газовых месторождений (до 97%), в значительном количестве содержится в попутном нефтяном газе (выделяющемся при добыче нефти), а также в коксовом газе. Выделяется со дна болот, прудов и стоячих вод, где он образуется при разложении растительных остатков без доступа воздуха, почему метан получил также название болотного газа. Наконец, метан постоянно скапливается в каменноугольных шахтах, где его называют рудничным газом.
Синтетические способы получения метана показывают взаимосвязь неорганических веществ с органическими. Можно выделить промышленные (1, 2, 3) и лабораторные (4, 5) способы его получения:
CO + 3H2→ CH4 + H2O (kat = Ni, t = 200 – 300 o C) (2);
Химические свойства метана
Метанпредставляет собой малореакционноспособное органическое соединение. Так, в обычных условиях он не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Все химические превращения, характерныедля метана протекают с расщеплением cвязейC-H:
Различают каталитическое (в качестве катализаторов применяют соли меди и марганца) (1, 2, 3) и полное (сгорание) (4) окисление метана:
Конверсию метана водяным паром и диоксидом углерода также можно отнести к способам его окисления:
Крекинг метана – важнейший метод химической переработки нефти и её фракций с целью получения продуктов меньшей молекулярной массы – смазочных масел, моторных топлив и т.д., а также сырья для химической и нефтехимической промышленности:
Применение метана
Метан составляет сырьевую основу важнейших химических промышленных процессов получения углерода и водорода, ацетилена, кислородсодержащих органических соединений – спиртов, альдегидов, кислот.
Примеры решения задач
| Задание | Определите массу хлора, необходимого для хлорирования по первой стадии 11,2 л метана. |
| Решение | Запишем уравнение реакции хлорирования метана: |
Найдем количество вещества метана:
Согласно уравнению реакции n(CH4) :n(Cl2) = 1:1, значит,количество моль хлора равно:
Тогда, масса хлора будет равна (молярная масса – 71 г/моль):
| Задание | Рассчитайте объемы хлора и метана, приведенные к нормальным условиям, которые потребуются для получения тетрахлорида углерода массой 38,5 г. |
| Решение | Запишем уравнение реакции хлорирования метана до тетрахлорида углерода (реакция происходит под действием УФ-излучения): |
Рассчитаем количество вещества тетрахлорида углерода (молярная масса равна – 154 г/моль):
n(CCl4) = 38,5 / 154 = 0,25 моль.
Согласно уравнению реакции n(CCl4) : n(CH4) = 1:1, т.е. n(CCl4) = n(CH4) = 0,25 моль. Тогда объем метана будет равен:
V(CH4) = 0,25 × 22,4 = 5,6 л.
По уравнению реакции найдем количество вещества хлора. n(CCl4) : n(Cl2) = 1:4, т.е. n(Cl2) =4 × n(CCl4) = 4 × 0,25 = 1 моль. Тогда объем хлора будет равен:
В земной атмосфере содержится много метана, но на этот факт никто не обращает внимания, так как наличие этого газа в воздухе никак не сказывается на организме человека. Но некоторые животные очень чувствительны к указанному веществу. К таковым относятся, например, канарейки. Ещё в начале XX века шахтёры брали этих птиц в забои, потому что они прекращали петь при повышенном содержании реагента в воздухе.
- Краткая характеристика
- Физические качества
- Химические свойства
- Получение в промышленности и лаборатории
- Применение метана
- Парниковый эффект
- Влияние на организм человека
Краткая характеристика
Почти 95% реагента появляется в результате биологических процессов. Пятая часть годовых выбросов газа в атмосферу приходится на коз и коров, в желудках которых живут бактерии, вырабатывающие метан. В атмосферу он попадает, когда рогатый скот выводит из организма продукты своей жизнедеятельности.
Другими источниками вещества являются:
- термиты;
- рис-сырец;
- болотистые водоёмы;
- фильтрация природного газа;
- фотосинтез растений;
- вулканы;
- давно погибшие организмы.
Поскольку вещество обычно связано с живыми организмами, то учёные полагают, что его присутствие на планете указывает на наличие жизни. Так, когда этот газ был обнаружен в атмосферах Марса, специалисты начали тщательное изучение планеты именно на предмет существования живых организмов. Но дальнейшие исследования показали, что на удалённых планетах Солнечной системы метана значительно больше, хотя там он появился в результате химических реакций.
На Земле вещество просачивается через трещины в земной коре, находящиеся на океанском дне, в больших количествах выделяется во время горных разработок и при лесных пожарах. Кроме того, недавно учёными был обнаружен новый источник газа, который никогда ранее в таком ключе не рассматривался.
Физические качества
Метан представляет собой самый простой углеводород. Считается, что он имеет специфический запах, но это распространённое заблуждение. Чистый газ не имеет запаха, характерный аромат он приобретает благодаря специальным добавкам, которые добавляют в вещество для предупреждения о его утечке, ведь цвета химическое соединение также не имеет.
Кроме того, к физическим свойствам метана относятся:

- Горение голубым пламенем.
- Сгорание без выделения вредных продуктов.
- Плохая растворимость в воде.
- Он легче воздуха.
- Основная составляющая природных, попутных нефтяных, рудничного и болотного газов.
- Кипение при температуре -161 °C.
- Замерзание при температуре -183 °C.
- Молярная масса составляет 16,044 г/моль.
- Плотность — 0,656 кг/м³.
- При соединении с воздухом образуются взрывоопасные смеси.
- В жидком виде представляет собой бесцветную жидкость без запаха.
Наиболее опасен метан, который выделяется во время подземных разработок полезных ископаемых, а также на фабриках, занимающихся переработкой и обогащением угля. Когда количество газа в воздухе достигает 5−6%, то он начинает гореть рядом с источниками тепла.

Если уровень вещества поднимается до 14−16%, то может произойти взрыв. При увеличении концентрации вещество горит при постоянном поступлении кислорода. Если же в этот момент количество метана начнёт снижаться, то результатом также может стать взрыв. При взрыве огонь, подпитываемый газом, движется со скоростью от 500 до 700 м/сек. Давление же вещества в этот момент в замкнутом пространстве составляет 1 Мн/м2.
Химические свойства
В химии формула метана — CH4. Соединение плохо вступает в химические связи.
В обычных условиях оно не реагирует со следующими веществами:
- концентрированные кислоты;
- расплавленные и концентрированные щелочи;
- щелочные металлические реагенты;
- галогены;
- перманганат калия; в кислой среде.

При температуре около 200 °C и давлении от 30 до 90 атмосфер болотный газ окисляется, преобразуясь в муравьиную кислоту. Вещество образует соединения, называемые газовыми гидратами, которые часто встречаются в природе.
По своим химическим свойствам метан схож с другими реагентами, относящимися к алканам. А потому он вступает в такие химические реакции, как:

- Конверсия в синтез-газ. Синтез-газ, который образуется в результате указанной реакции, используется для получения метанола, углеводородов и так далее.
- Галогенирование. Такая реакция является цепной. При ней молекула брома или йода подвергается воздействию света и распадается на радикалы, которое затем атакуют молекулы метана. В результате от соединения отрывается атом водорода, а газ становится свободным метилом CH3. Получившееся вещество сталкивается с молекулами брома или йода, которые разрушаются, образуя новые радикалы этих реагентов.
- Нитрование.
- Окисление или горение. Эта реакция происходит при избытке кислорода и описывается следующим уравнением: CH4 + 2O2 → CO2 + 2H2O. В этом случае пламя имеет голубой цвет. Если кислорода недостаточно, то результатом реакции становится выработка не углекислого газа, а оксида углерода. Если же кислорода ещё меньше, то взаимодействие веществ приведёт к выделению мелкодисперсного углерода.
- Сульфохлорирование.
- Сульфоокисление.
- Разложение.
- Дегидрирование.
- Каталитическое окисление. В подобных реакциях из болотного газа образуются карбоновые кислоты, спирты, альдегиды.
Получение в промышленности и лаборатории
В промышленных условиях вещество получают посредством нагревания углерода и водорода или синтеза водяного газа. Для того чтобы реакция протекала успешно, используют катализатор, обычно в этом качестве применяется никель. В США для добычи простейшего углеводорода используется специальная система, способная извлекать соединение из природного угля. Но также метан выделяется в виде подобного продукта при термической переработке нефти и нефтепродуктов, коксовании и гидрировании каменного угля.
В лаборатории для получения вещества применяются следующие методы:
- Реакция гидроксида натрия с ацетатом натрия.
- Взаимодействие карбида алюминия.
- Нагревание натристой извести с уксусной кислотой. Для этой реакции необходима безводная среда, а потому в ней применяется гидроксид натрия, который является наименее гигроскопичным.
Применение метана
Болотный газ самый термически устойчивый углеводород, а потому он широко применяется и в быту, и в промышленности. Хлорирование вещества даёт возможность получения метилхлорида, метиленхлорида, хлороформа, четырёххлористого углерода. Результатом его неполного сгорания является сажа, Если метан каталитически окисляется, то получается формальдегид. А его реакция с серой приводит к образованию сероуглерода.
К важным методам получения ацетилена из простейшего углеводорода относятся:
- термоокислительный крекинг,
- электрокрекинг.
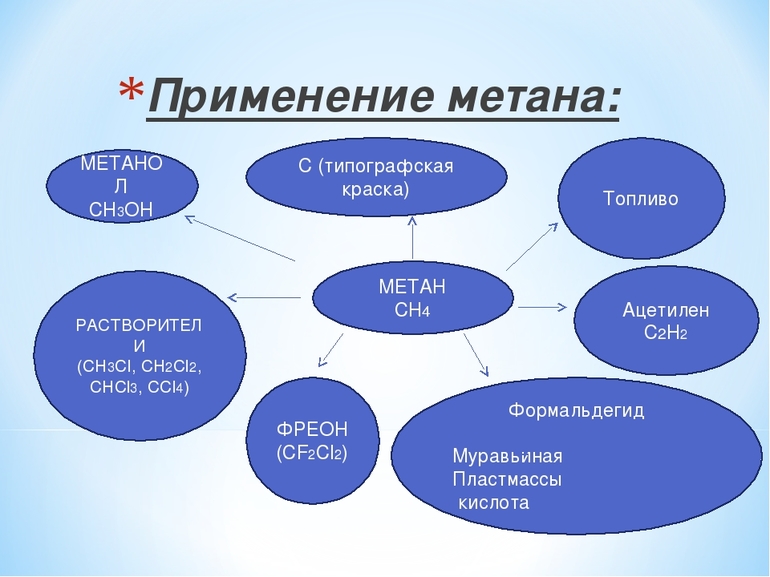
Газ также применяется для производства синильной кислоты. Кроме того, он даёт водород, необходимый для выработки водяного газа, который, в свою очередь, применяется для создания углеводородов, альдегидов и тому подобного. Кроме того, метан необходим при производстве нитрометана.
Учёные решили эту проблему, увеличив плотность газа до 200−250 атмосфер. Сжатое вещество закачивается в специальные баллоны, установленные на автомобилях особой конструкции.
Парниковый эффект

Метан является одним из газов, создающих на планете парниковый эффект. Чтобы измерить уровень его парниковой активности, необходимо принять за единицу меру воздействия на климат нашей планеты диоксида углерода. При таком соотношении влияние метана будет равно 23. Специалисты в области изучения парникового эффекта отмечают, что количество указанного газа в земной атмосфере значительно выросло за последние два столетия.
Объём метана в современной атмосфере в среднем составляет 1,8 части на миллион. Это количество в 200 раз меньше того же показателя углекислого газа. Необходимо отметить, что молекулы соединения рассеивают и удерживают теплоту, которую излучает нагретая солнцем планета, гораздо лучше, чем молекулы углекислого газа. И также необходимо отметить, что углеводород поглощает земное излучение в тех спектральных областях, которые свободно проходят через другие газовые соединения, создающие эффект парника.
Но тем не менее такие газы планете необходимы. Без двуокиси углерода, водяных паров, метана и других составляющих атмосферы температура на поверхности Земли была бы значительно ниже средних 15 градусов тепла.
Влияние на организм человека

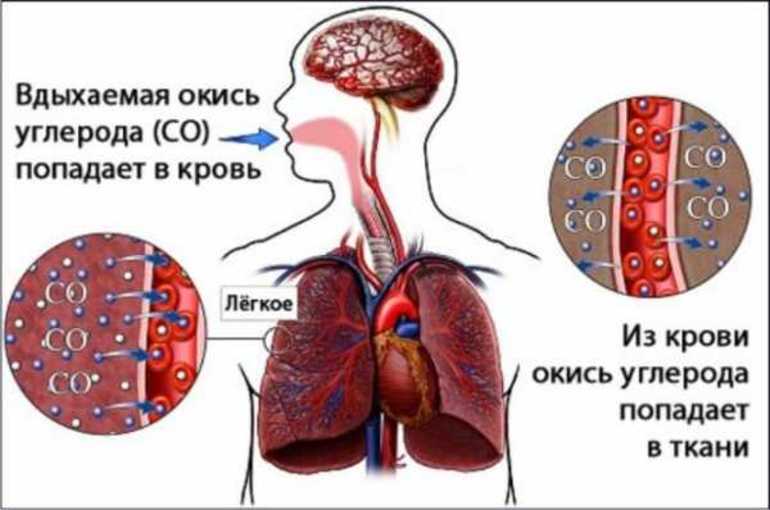
Человек может отравиться, надышавшись метаном при аварии на производстве или из-за неправильного обращения с приборами, работающими на этом газе. Возможна такая ситуация и при длительном нахождении на болоте, в шахте. Если концентрация вещества в воздухе составляет 20 и более процентов, то отравление может быть очень тяжёлым, вплоть до летального исхода.
Работники химических производств, рудников и шахт подвержены другому способу отравления углеводородом. Зачастую эти люди на протяжении длительного времени регулярно вдыхают небольшие дозы вещества.
Кроме того, хроническая интоксикация может наступить из-за заболеваний кишечника, например, дисбактериоза. В таких случаях в организме больного метан образуется в повышенном количестве. Этот газ не станет причиной серьёзной интоксикации, но всё же он может вызвать в организме разные нарушения, привести к желудочно-кишечному дискомфорту и общему ухудшению самочувствия.
Отличить острое отравление метаном можно по следующим признакам:


- головокружение;
- шум в ушах;
- сонливость;
- общая слабость;
- потеря координации;
- нарушение речи;
- резь в глазах;
- слезотечение;
- удушье;
- усиленное сердцебиение;
- понижение артериального давления;
- тошнота;
- приступы рвоты;
- синюшность кожных покровов и слизистых оболочек.
Если отравление тяжёлое, то человек теряет сознание, у него начинаются судороги, за которыми следует кома. А также возможна остановка дыхания и сердцебиения.
Если отравление метаном является хроническим, то пострадавший страдает от частых головных болей, общего недомогания, низкого артериального давления и снижения работоспособности. Человек становится бледным и вялым, испытывает упадок сил. Гипотония может вызывать обмороки. И также возможно истощение нервной системы, которое выражается в повышенной раздражительности, нервозности и тому подобном.
Метан известен, как один из самых опасных газов. Он токсичен, горюч и взрывоопасен. Вещество не имеет ни цвета, ни запаха, а потому обнаружить его в воздухе крайне сложно. Чтобы не подвергать своё здоровье и жизнь опасности, следует внимательно относится к технике безопасности и соблюдать осторожность при работе или бытовом использовании метана.

Метан – первый представитель ряда алканов с формулой СН4. Это бесцветный природный газ без запаха. Благодаря физическим и химическим свойствам метан используется в качестве топлива.
Строение
Молекула метана представляет собой тетраэдр, в середине которого находится углерод, соединённый простыми (одинарными) σ-связями с атомами водорода. Строение и свойства молекулы метана важны для понимания всей органической химии, так как большинство органических соединений содержит метильные группы -СН2.
Метан образует гомологический ряд алканов. Каждый последующий гомолог отличается от предыдущего на одну группу -СН2.
Получение
Метан – распространённый газ во Вселенной. Он находится в природном и попутном газе, образуется на дне морей, выделяется как конечный продукт жизнедеятельности кишечных бактерий. Метан входит в состав атмосферы планет-гигантов. На поверхности Титана – спутника Сатурна – находятся этан-метановые озёра и реки.
В промышленности метан выделяют из природного газа и получают при коксовании (прокаливании) каменного угля.
В лаборатории метан образуется при нагревании сухого гидроксида натрия с уксусной кислотой, а также при плавлении ацетата с гидроксидом натрия:
Впервые метан обнаружил на болотах физик Алессандро Вольта в 1776 году. Два года спустя он выделил из болотного газа чистый метан.
Свойства
Основные физические свойства:
- легче воздуха;
- без запаха и вкуса;
- плохо растворяется в воде;
- молекулярная масса – 16;
- температура плавления – -182,49°С;
- температура кипения – -161,56°С;
- температура вспышки – -188°С;
- температура самовоспламенения – 537,8°С.
Метан определяет физико-химические свойства гомологического ряда алканов. При обычных условиях метан и его гомологи малоактивны и вступают в реакции под действием высокой температуры и катализатора. Дополнительные условия необходимы для расщепления связи С-Н.
Основные реакции метана:
Концентрация метана в воздухе более 4 % взрывоопасна. Поэтому метану специально придают запах, смешивая газ с тиолами, содержащими серу. Это помогает контролировать утечку бытового газа.
Что мы узнали?
Метан – простейший представитель класса алканов, образующий гомологический ряд. Это бесцветный горючий газ, выделяемый из природного газа и получаемый при коксовании угля. Метан используется в качестве топлива. При высокой температуре самовоспламеняется. Газ подвержен нитрованию, галогенированию, сульфохлорированию, окислению под действием катализатора, водяного пара, горения, а также крекингу, используемого в переработке нефти.
Химические свойства метана ничем не отличаются от свойств, присущих всем веществам класса алканов. В школьном курсе химии метан изучают одним из первых веществ органики, так как он является одним из простейших представителей алканов.
В его составе один атом углерода и четыре атома водорода.
Формула метана и способы его получения
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану.
Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх.

Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах.
Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь.
Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля.
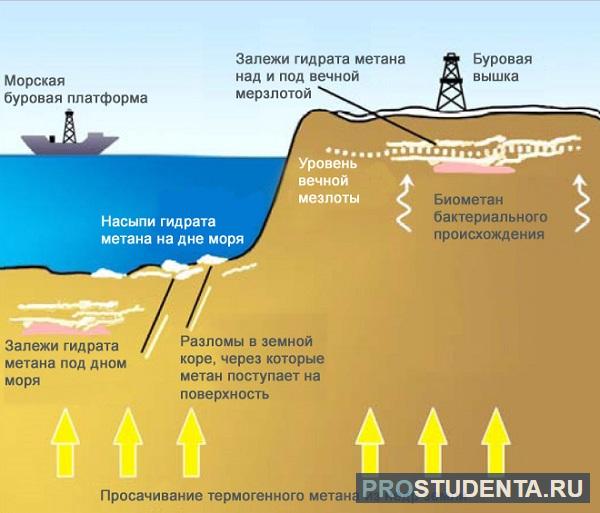
В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Физические свойства метана
- Бесцветный газ, без запаха.
- Взрывоопасен.
- Нерастворим в воде.
- Температура кипения: -162 o C, замерзания: -183°C.
- Молярная масса: 16,044 г/моль.
- Плотность: 0,656 кг/м³.
Химические свойства метана
Говоря о химических свойствах, выделяют те реакции, в которые вступает метан. Ниже они приведены вместе с формулами.
Горение метана
Как все органические вещества, метан горит. Можно заметить, что при горении образуется голубоватое пламя.
Называется такая реакция – реакцией горения или полного окисления.
Замещение
Метан также реагирует с галогенами. Это химические элементы 17 группы в периодической таблице Менделеева. К ним относятся: фтор, хлор, бром, йод и астат. Реакция с галогенами называется – реакцией замещения или галогенирования. Такая реакция проходит только в присутствии света.
Хлорирование и бромирование
Если в качестве галогена используется хлор, то реакция будет называться – реакцией хлорирования. Если в качестве галогена выступает бром, то – бромирование, и так далее.
Хлорирование. Низшие алканы могут прохлорировать полностью.
Точно так же метан может полностью вступать в реакцию бромирования.
С йодом такой реакции уже нет, а с фтором наоборот сопровождается быстрым взрывом.
Разложение
Так же этому углеводороду свойственна реакция разложения. Полное разложение:
И неполное разложение:
Реакция с кислотами
Метан реагирует с концентрированной серной кислотой. Реакция носит название сульфирования и происходит при небольшом нагревании.
Окисление
Как уже было сказано, СH4 может полностью окисляться, но при недостатке кислорода возможно неполное окисление.
Помимо прочего для этого газа характерно каталитическое окисление. Оно происходит в присутствии катализатора. При разном соотношении моль вещества получаются разные конечные продукты реакции. В основном это:
Реакция протекает при температуре 1500°C. Данная реакция также носит название – крекинг – термическое разложение.
Нитрование метана
Существует также реакция нитрования или реакция Коновалова, названная в честь ученого, который доказал, что с предельными углеводородами действует разбавленная азотная кислота. Продукты реакции получили название – нитросоединения.
Реакция проводится при температуре 140-150°C.
Дегидрирование метана
Кроме того, для метана характерна реакция дегидрирования (разложения) – отцепление атомов водорода и получения ацетилена, в данном случае.
Применение метана
Метан, как и остальные предельные углеводороды, широко используется в повседневной жизни. Его применяют в производстве бензина, авиационного и дизельного топлива.
Используют в качестве базы для получения различного органического сырья на предприятиях. Также метан широко используется в медицине и косметологии.

Метан применяют для получения синтетического каучука, красок и шин.
Атлеты используют так называемый жидкий метан для быстрого набора массы за короткий промежуток времени.
А при хлорировании метана образуется вещество, которое в дальнейшем используется для обезжиривания поверхностей или как компонент в средствах для снятия лака. Некоторое время продукт взаимодействия метана и хлора использовали в качестве наркоза.
Читайте также:

