Химические свойства альдегидов кратко
Обновлено: 05.07.2024
1. Р. Окисления.
Альдегиды легко окисляются до карбоновых кислот. Окислителями могут служить гидроксид меди (II), оксид серебра, кислород воздуха:
2. Р. Присоединения
Гидрирование - присоединение водорода.
Карбонильные соединения восстанавливаются до спиртов водородом, алюмогидридом лития, боргидридом натрия. Водород присоединяется по связи C=O. Реакция идет труднее, чем гидрирование алкенов: требуется нагревание, высокое давление и металлический катализатор (Pt, Ni):
3. Взаимодействие с вод ой.
4. Взаимодействие, со спиртами.
При взаимодействии альдегидов со спиртами могут образовываться полуацетали и ацетали. Полуацетали представляют собой соединения, в которых при одном атоме углерода содержится гидроксильная и алкоксильная группа. К ацеталям относят вещества, в молекулах которых содержится атом углерода с двумя алкоксильными заместителями.
Гидросульфит NaHSO3 тоже присоединяется по связи C=O с образованием кристаллического производного, из которого карбонильное соединение может быть регенерировано. Бисульфитные производные используются для очистки альдегидов и кетонов.
В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолформальдегидные смолы, из которых получают пластмассы — фенопласты (бакелиты). Фенопласты — важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготавливается большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали. Фрагмент фенолформальдегидной смолы показан ниже:
Исходными соединениями для получения альдегидов и кетонов могут быть углеводороды, галогенопроизводные, спирты и кислоты.
Применение карбонильных соединений
Формальдегид используется для получения пластмасс, например бакелита, дубления кож, дезинфекции, протравливания семян. Совсем недавно в нашей стране разработан метод получения полиформальдегида (—СН2—О—)n, который обладает высокой химической и термической устойчивостью.
Это ценнейший конструкционный пластик, способный во многих случаях заменить металлы. Ацетальдегид используют для получения уксусной кислоты и некоторых пластмасс. Ацетон применяется как исходное вещество для синтеза многих соединений (например, метилметакрилата, полимеризацией которого получают оргстекло); он используется также в качестве растворителя.
Альдегиды – органические вещества, относящиеся к классу карбонильных соединений, содержащих в своем составе функциональную группу –СН = О, которая называется карбонильной.
Общая формула предельных альдегидов и кетонов CnH2nO. В названии альдегидов присутствует суффикс –аль.
Простейшие представители альдегидов – формальдегид (муравьиный альдегид) –СН2 = О, ацетальдегид (уксусный альдегид) – СН3-СН = О. Существуют циклические альдегиды, например, циклогексан-карбальдегид; ароматические альдегиды имеют тривиальные названия – бензальдегид, ванилин.
Атом углерода в карбонильной группе находится в состоянии sp 2 -гибридизации и образует 3σ-связи (две связи С-Н и одну связь С-О). π-связь образована р-электронами атомов углерода и кислорода. Двойная связь С = О является сочетанием σ- и π-связей. Электронная плотность смещена в сторону атома кислорода.
Для альдегидов характерна изомерия углеродного скелета, а также межклассовая изомерия с кетонами:
Химические свойства альдегидов
В молекулах альдегидов имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; α-СН кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
1. Реакции присоединения:
— воды с образованием гем-диолов
— спиртов с образованием полуацеталей
— тиолов с образованием дитиоацеталей (в кислой среде)
— гидросульфита натрия с образованием α-гидроксисульфонатов натрия
— аминов с образованием N-замещенных иминов (основания Шиффа)
— гидразинов с образованием гидразонов
— циановодородной кислоты с образованием нитрилов
— восстановление. При взаимодействии альдегидов с водородом получаются первичные спирты:
R-CH = O + Ag2O → R-CO-OH + 2Ag↓;
— окисление альдегидов гидроксидом меди (II), в результате которого выпадает осадок оксида меди (I) красного цвета
Эти реакции являются качественными реакциями на альдегиды.
Физические свойства альдегидов
Первый представитель гомологического ряда альдегидов – формальдегид (муравьиный альдегид) – газообразное вещество (н.у.), альдегиды неразветвленного строения и состава С2-С12 – жидкости, С13 и длиннее – твердые вещества. Чем больше атомов углерода входит в состав неразветвленного альдегида, тем выше его температура кипения. С увеличением молекулярной массы альдегидов увеличиваются значения величин их вязкости, плотности и показателя преломления. Формальдегид и ацетальдегид способны смешиваться с водой в неограниченных количествах, однако, с ростом углеводородной цепи эта способность альдегидов снижается. Низшие альдегиды обладают резким запахом.
Получение альдегидов
Основные способы получения альдегидов:
![]()
С и давлении 300 атм
— гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей ртути (II) и в кислой среде:
— окисление первичных спиртов (реакция протекает при нагревании)
Применение альдегидов
Альдегиды нашли широкое применение в качестве сырья для синтеза различных продуктов. Так, из формальдегида (крупнотоннажное производство) получают различные смолы (фенол-формальдегидные и т.д.), лекарственные препараты (уротропин); ацетальдегид — сырье для синтеза уксусной кислоты, этанола, различных производных пиридина и т.д. Многие альдегиды (масляный, коричный и др.) используют в качестве ингредиентов в парфюмерии.
Примеры решения задач
| Задание | Бромированием СnH2n+2получили 9,5 г монобромида, который при обработке разбавленным раствором NaOH превратился в кислородсодержащее соединение. Пары его с воздухом пропущены над раскаленной медной сеткой. При обработке образовавшегося при этом нового газообразного вещества избытком аммиачного раствора Ag2O выделилось 43,2 г осадка. Какой углеводород был взят и в каком количестве, если выход на стадии бромирования 50%, остальные реакции протекают количественно. |
| Решение | Запишем уравнения всех протекающих реакций: |
R-CH = O + Ag2O → R-CO-OH + 2Ag↓.
Осадок выделившийся в последней реакции – это серебро, следовательно, можно найти количество вещества выделившегося серебра:
v(Ag) = m/M = 43,2/108 = 0,4 моль.
По условию задачи, после пропускания вещества полученного в реакции 2 над раскаленной металлической сеткой образовался газ, а единственный газ –альдегид – это метаналь, следовательно, исходное вещество – это метан.
Количество вещества бромметана:
v(CH3Br) = m/M = 9,5/95 = 0,1 моль.
Тогда, количество вещества метана, необходимое для 50% выхода бромметана – 0,2 моль. М(CH4) = 16 г/моль. Следовательно масса и объем метана:
| Задание | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: бутен-1 → 1-бромбутан + NaOH → А – Н2 → В + [Ag(NH3)2]OH → С + HCl → D. |
| Решение | Для получения 1-бромбутана из бутена-1 необходимо провести реакцию гидробромирования в присутствии пероксидных соединений R2O2 (реакция протекает против правила Марковникова): |
При взаимодействии с водным раствором щелочи 1-бромбутан подвергается гидролизу с образованием бутанола-1 (А):
Бутанол-1 при дегидрировании образует альдегид – бутаналь (В):
Аммиачный раствор оксида серебра окисляет бутаналь до аммонийной соли – бутирата аммония (С):
Бутират аммония при взаимодействии с соляной кислотой образует масляную (бутановую) кислоту (D):

Альдегиды являются производными углеводородов, их главной характеристикой является наличие карбонильной группы в молекулах. Что такое альдегиды, и каковы их химические свойства?
Альдегиды. Характеристика
Альдегиды – кислородосодержащие производные углеводородов, содержащие карбонильную группу C=O. В альдегиде две валентности атома углерода карбонила заняты алкильным радикалом и атомом водорода.
Общая структурная формула альдегида выглядит следующим образом:
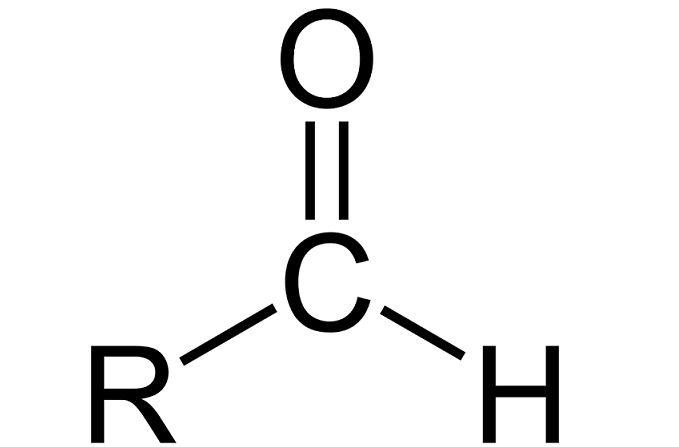
Рис. 1. Общая формула альдегида.
Альдегиды характеризуются изомерией углеводородного радикала. они могут иметь разветвленную или неразветвленную цепь. По международной номенклатуре названия альдегидов происходят от соответствующих углеводородов с прибавлением суффикса -аль, или от исторически сложившихся названий соответствующих карбоновых кислот, в которые они превращаются при окислении.
В альдегидах карбонильная группа всегда связана с атомом водорода. Также альдегидная группа обладает большой химической активностью.
Химические свойства альдегидов
Химические свойства альдегидов очень схожи с химическими свойствами кетонов. однако альдегиды способны проявлять большую активность, что связано с поляризацией связей.
Для карбонильных соединений характерны реакции присоединения, окисления и полимеризации подобно непредельным углеводородам. К реакциям с участием карбонильных групп относятся реакции присоединения, окисления и полимеризации:
- присоединение. Реакции присоединения чрезвычайно многочисленны, однако рассмотрим лишь реакции восстановления и взаимодействия со спиртами. При гидрировании или действиях других восстановителей из альдегидов образуются первичные спирты. Так, из уксусного и бензойного альдегидов образуются этиловый и бензиловый спирты, а из ацетона – изопропиловый спирт. При взаимодействии альдегидов со спиртами образуются полуацетали.
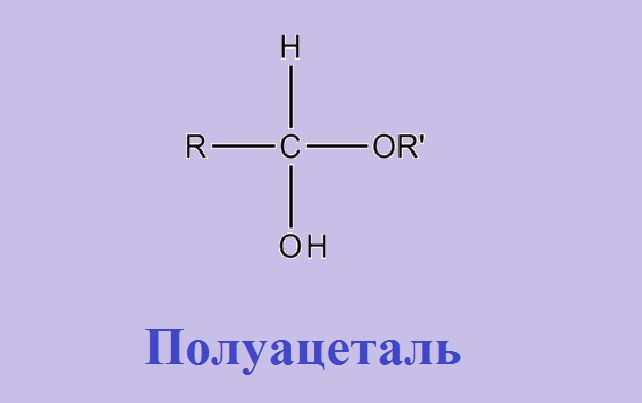
Рис. 2. Полуацетали.
Реакция получения полуацеталей обратима, так как это не стойкие соединения
Что мы узнали?
Альдегиды – органические соединения, в состав которых входит альдегидная группа (-CHO). Эти вещества, химические свойства которых изучаются в 10 классе, могут взаимодействовать со спиртами, окисляться, а также способны образовывать полимеры.
§ 30. Химические свойства, получение и применение альдегидов
Химические свойства альдегидов
Химические свойства альдегидов прежде всего обусловлены наличием в их молекулах альдегидной группы. По месту двойной связи альдегидной группы могут протекать реакции присоединения.
1. Гидрирование. Присоединение водорода
Молекула альдегида может присоединить по двойной связи молекулу водорода. Такая реакция сопровождаются разрывом π-связи в молекуле альдегида, так как она менее прочная, чем σ-связь:
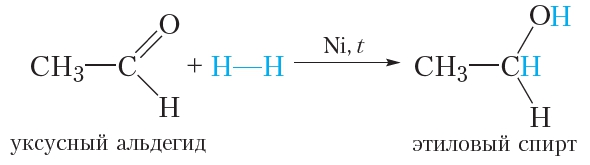
Условия протекания данной реакции схожи с реакцией гидрирования алкенов: смесь водорода с парами альдегида пропускают над нагретым никелевым катализатором.
Продуктом присоединения водорода к альдегиду является первичный спирт.
В результате присоединения водорода молекула альдегида восстанавливается, поэтому реакцию с водородом также называют реакцией восстановления альдегидов.
2. Окисление
Альдегидная группа легко окисляется. В качестве окислителей могут выступать ионы металлов, расположенных в ряду активности правее водорода — ионы серебра (Ag + ) и меди (Cu 2+ ).
Окисление альдегидов аммиачным раствором оксида серебра
Если к разбавленному раствору нитрата серебра приливать раствор аммиака, то выпадает белый осадок оксида серебра:
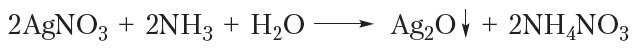
В протекающей реакции уксусный альдегид окисляется до уксусной кислоты, а оксид серебра восстанавливается с образованием металлического серебра:
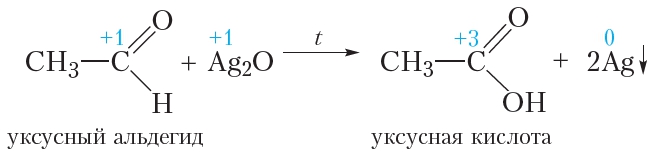
Окисление альдегидов гидроксидом меди(II)
В качестве окислителя альдегидов до соответствующих кислот может быть использован также гидроксид меди(II). Для проведения такой реакции в пробирку помещают раствор сульфата меди(II), затем прибавляют раствор щёлочи. При этом выпадает голубой осадок гидроксида меди(II):
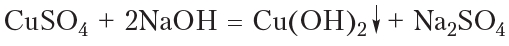
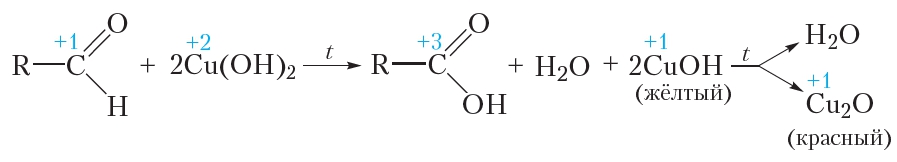
Затем в пробирку с осадком добавляют водный раствор альдегида и смесь нагревают. В процессе нагревания изначально голубой осадок становится жёлтым, а при дальнейшем нагревании — красным. Уравнение протекающей реакции:
Как видно из приведённого уравнения реакции, в результате восстановления гидроксида меди(II) образуется жёлтый осадок гидроксида меди(I), который при нагревании разлагается с образованием красного оксида меди(I).
Способность альдегидов окисляться до карбоновых кислот и восстанавливаться до спиртов особенно наглядно демонстрирует взаимосвязь между классами органических соединений, благодаря которой вещества одного класса могут быть получены из представителей других классов.
Читайте также:

