Атомный радиус это кратко
Обновлено: 02.07.2024
Важной характеристикой атома является его размер, т. е. атомный радиус. Размер отдельного атома не определен, поскольку внешняя его граница размыта за счет вероятностного нахождения электронов в различных точках околоядерного пространства. В силу этого, в зависимости от типа связи между атомами различают металлические, ковалентные, ван-дер-ваальсовы, ионные и др. атомные радиусы.
Значения ковалентных радиусов (rcov) рассчитаны как половина длины гомоатомной связи. В случае невозможности определить длину одинарной гомоатомной связи, значение rcov атома элемента A получают вычитанием ковалентного радиуса атома элемента B из длины гетероатомной связи A-B. Ковалентные радиусы зависят, главным образом, от размеров внутренней электронной оболочки.
Радиусы валентно-несвязанных атомов - ван-дер-ваальсовы радиусы (rw) определяют эффективные размеры атомов, обусловленные силами отталкивания заполненных энергетических уровней.
Значения энергии электронов, определенные по правилам Слэтера. позволили оценить относительную величину - кажущийся размер атома - rcmp (эмпирический радиус).
Длина связи дана в ангстремах (1 Å = 0.1 нм = 100 пм).
| Элемент | rme | rcov | rw | rcmp |
| H | 0.46 | 0.37 | 1.20 | 0.25 |
| He | 1.22 | 0.32 | 1.40 | - |
| Li | 1.55 | 1.34 | 1.82 | 1.45 |
| Be | 1.13 | 0.90 | - | 1.05 |
| B | 0.91 | 0.82 | - | 0.85 |
| C | 0.77 | 0.77 | 1.70 | 0.70 |
| N | 0.71 | 0.75 | 1.55 | 0.65 |
| O | - | 0.73 | 1.52 | 0.60 |
| F | - | 0.71 | 1.47 | 0.50 |
| Ne | 1.60 | 0.69 | 1.54 | - |
| Na | 1.89 | 1.54 | 2.27 | 1.80 |
| Mg | 1.60 | 1.30 | 1.73 | 1.50 |
| Al | 1.43 | 1.18 | - | 1.25 |
| Si | 1.34 | 1.11 | 2.10 | 1.10 |
| P | 1.30 | 1.06 | 1.80 | 1.00 |
| S | - | 1.02 | 1.80 | 1.00 |
| Cl | - | 0.9 | 1.75 | 1.00 |
| Ar | 1.92 | 0.97 | 1.88 | - |
| K | 2.36 | 1.96 | 2.75 | 2.20 |
| Ca | 1.97 | 1.74 | - | 1.80 |
| Sc | 1.64 | 1.44 | - | 1.60 |
| Ti | 1.46 | 1.36 | - | 1.40 |
| V | 1.34 | 1.25 | - | 1.35 |
| Cr | 1.27 | 1.27 | - | 1.40 |
| Mn | 1.30 | 1.39 | - | 1.40 |
| Fe | 1.26 | 1.25 | - | 1.40 |
| Co | 1.25 | 1.26 | - | 1.35 |
| Ni | 1.24 | 1.21 | 1.63 | 1.35 |
| Cu | 1.28 | 1.38 | 1.40 | 1.35 |
| Zn | 1.39 | 1.31 | 1.39 | 1.35 |
| Ga | 1.39 | 1.26 | 1.87 | 1.30 |
| Ge | 1.39 | 1.22 | - | 1.25 |
| As | 1.48 | 1.19 | 1.85 | 1.15 |
| Se | 1.60 | 1.16 | 1.90 | 1.15 |
| Br | - | 1.14 | 1.85 | 1.15 |
| Kr | 1.98 | 1.10 | 2.02 | - |
| Rb | 2.48 | 2.11 | - | 2.35 |
| Sr | 2.15 | 1.92 | - | 2.00 |
| Y | 1.81 | 1.62 | - | 1.80 |
| Zr | 1.60 | 1.48 | - | 1.55 |
| Nb | 1.45 | 1.37 | - | 1.45 |
| Mo | 1.39 | 1.45 | - | 1.45 |
| Tc | 1.36 | 1.56 | - | 1.35 |
| Ru | 1.34 | 1.26 | - | 1.30 |
| Rh | 1.34 | 1.35 | - | 1.35 |
| Pd | 1.37 | 1.31 | 1.63 | 1.40 |
| Ag | 1.44 | 1.53 | 1.72 | 1.60 |
| Cd | 1.56 | 1.48 | 1.58 | 1.55 |
| In | 1.66 | 1.44 | 1.93 | 1.55 |
| Sn | 1.58 | 1.41 | 2.17 | 1.45 |
| Te | 1.70 | 1.35 | 2.06 | 1.40 |
| I | - | 1.33 | 1.98 | 1.40 |
| Xe | 2.18 | 1.30 | 2.16 | - |
| Cs | 2.68 | 2.25 | - | 2.60 |
| Ba | 2.21 | 1.98 | - | 2.15 |
| La | 1.87 | 1.69 | - | 1.95 |
| Ce | 1.83 | - | - | 1.85 |
| Pr | 1.82 | - | - | 1.85 |
| Nd | 1.82 | - | - | 1.85 |
| Pm | - | - | - | 1.85 |
| Sm | 1.81 | - | - | 1.85 |
| Eu | 2.02 | - | - | 1.80 |
| Gd | 1.79 | - | - | 1.80 |
| Tb | 1.77 | - | - | 1.75 |
| Dy | 1.77 | - | - | 1.75 |
| Ho | 1.76 | - | - | 1.75 |
| Er | 1.75 | - | - | 1.75 |
| Tm | 1.74 | - | - | 1.75 |
| Yb | 1.93 | - | - | 1.75 |
| Lu | 1.74 | 1.60 | - | 1.75 |
| Hf | 1.59 | 1.50 | - | 1.55 |
| Ta | 1.46 | 1.38 | - | 1.45 |
| W | 1.40 | 1.46 | - | 1.35 |
| Re | 1.37 | 1.59 | - | 1.35 |
| Os | 1.35 | 1.28 | - | 1.30 |
| Ir | 1.35 | 1.37 | - | 1.35 |
| Pt | 1.38 | 1.28 | 1.75 | 1.35 |
| Au | 1.44 | 1.44 | 1.66 | 1.35 |
| Hg | 1.60 | 1.49 | 1.55 | 1.50 |
| Tl | 1.71 | 1.48 | 1.96 | 1.90 |
| Pb | 1.75 | 1.47 | 2.02 | 1.80 |
| Bi | 1.82 | 1.46 | - | 1.60 |
| Po | - | - | - | 1.90 |
| At | - | - | - | - |
| Rn | - | 1.45 | - | - |
| Fr | 2.80 | - | - | - |
| Ra | 2.35 | - | - | 2.15 |
| Ac | 2.03 | - | - | 1.95 |
| Th | 180 | - | - | 1.80 |
| Pa | 1.62 | - | - | 1.80 |
| U | 1.53 | - | 1.86 | 1.75 |
| Np | 1.50 | - | - | 1.75 |
| Pu | 1.62 | - | - | 1.75 |
| Am | - | - | - | 1.75 |
Общая тенденция изменения атомных радиусов такова. В группах атомные радиусы возрастают, так как с увеличением числа энергетических уровней увеличиваются размеры атомных орбиталей с большим значением главного квантового числа. Для d-элементов, в атомах которых заполняются орбитали предшествующего энергетического уровня, эта тенденция не имеет отчетливого характера при переходе от элементов пятого периода к элементам шестого периода.
В малых периодах радиусы атомов в целом уменьшаются, так как увеличение заряда ядра при переходе к каждому следующему элементу вызывает притяжение внешних электронов с возрастающей силой; число энергетических уровней в то же время остается постоянным.
Изменение атомного радиуса в периодах у d-элементов носит более сложный характер.
Величина атомного радиуса достаточно тесно связана с такой важной характеристикой атома, как энергия ионизации. Атом может терять один или несколько электронов, превращаясь в положительно заряженный ион - катион. Количественно эта способность оценивается энергией ионизации.
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.

В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в "строки и столбцы" - периоды и группы.
Период - ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 - называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).

Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
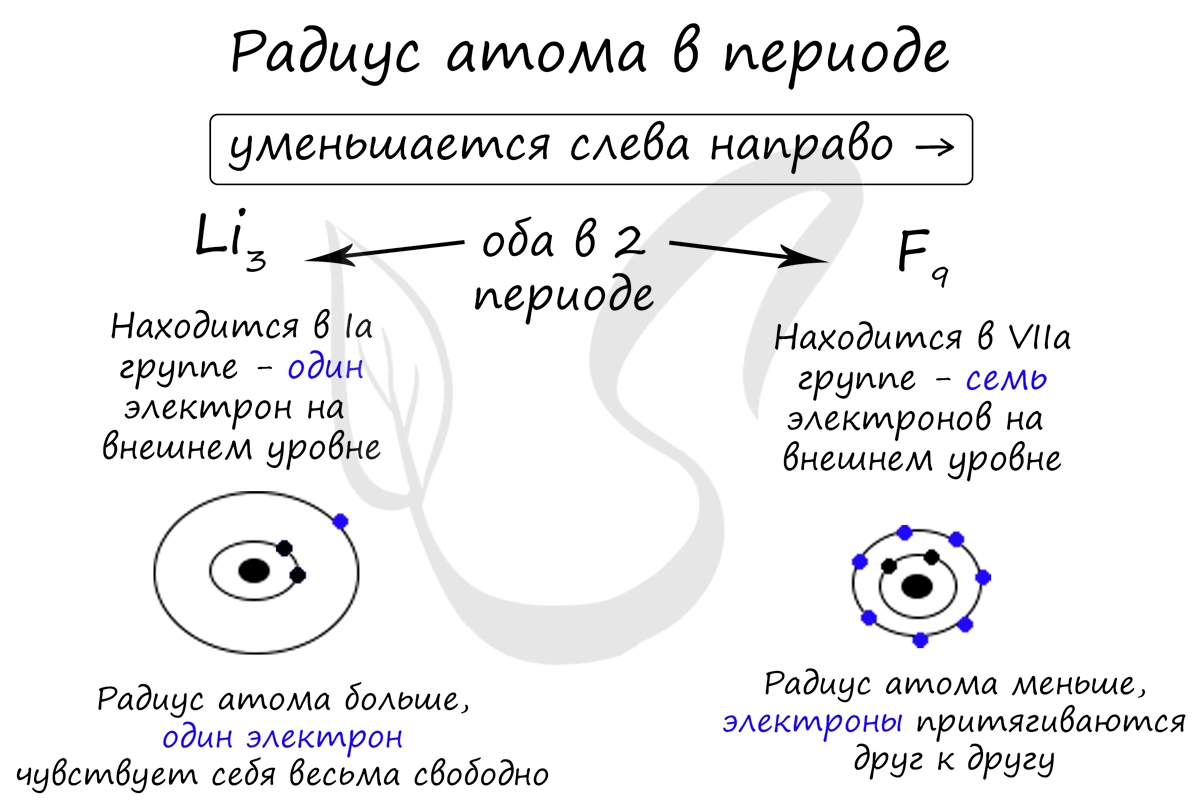
В периоде радиус атома уменьшается с увеличением порядкового номера элементов ("→" слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде "←" справа налево.
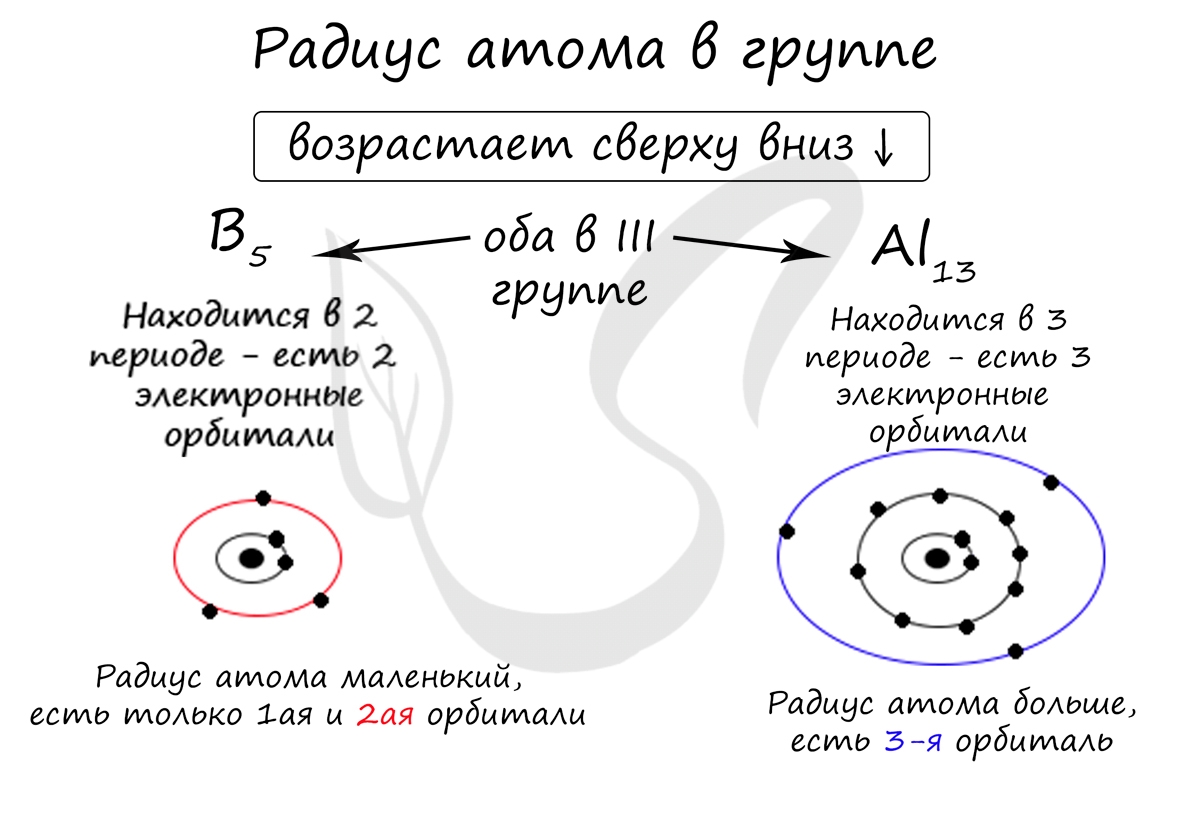
В группе радиус атома увеличивается с увеличением заряда атомных ядер - сверху вниз "↓". Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается - снизу вверх "↑". Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия - тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует - там нужно считать электроны "вручную", располагая их на электронных орбиталях.
- B5 - 1s 2 2s 2 2p 1
- Al13 - 1s 2 2s 2 2p 6 3s 2 3p 1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns 2 np 1 . Это будет работать для бора, внешний уровень которого 2s 2 2p 1 , алюминия - 3s 2 3p 1 , галия - 4s 2 4p 1 , индия - 5s 2 5p 1 и таллия - 6s 2 6p 1 . За "n" мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода - и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже :)

Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных - только "вручную".
Длина связи
Длина связи - расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
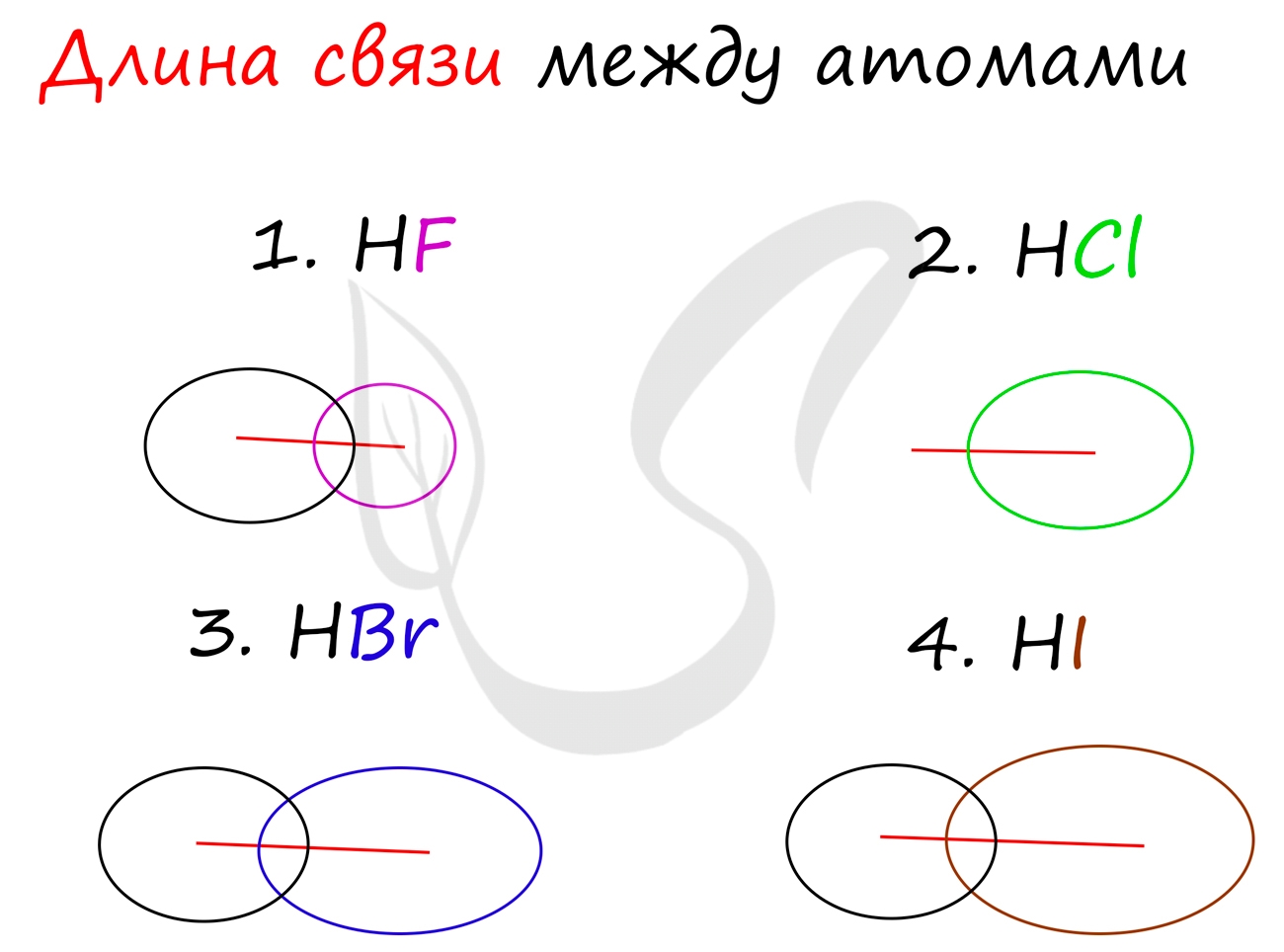
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические - усиливаются (слева направо "→"). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические - ослабевают (сверху вниз "↓").

Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны - у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера - самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева - металлы.

Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные - возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные - ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые - убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.

Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF - самая слабая из этих кислот, а HI - самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные - усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные - ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные - с неметаллическими и кислотными. Так гораздо проще запомнить ;-)

Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность - способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус "-".
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева - это фтор.

Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости "синонимичны" также понятия сродства к электрону - энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации - количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.

Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.

Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы - R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми "высшими" оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.

С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в "-" отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы - 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
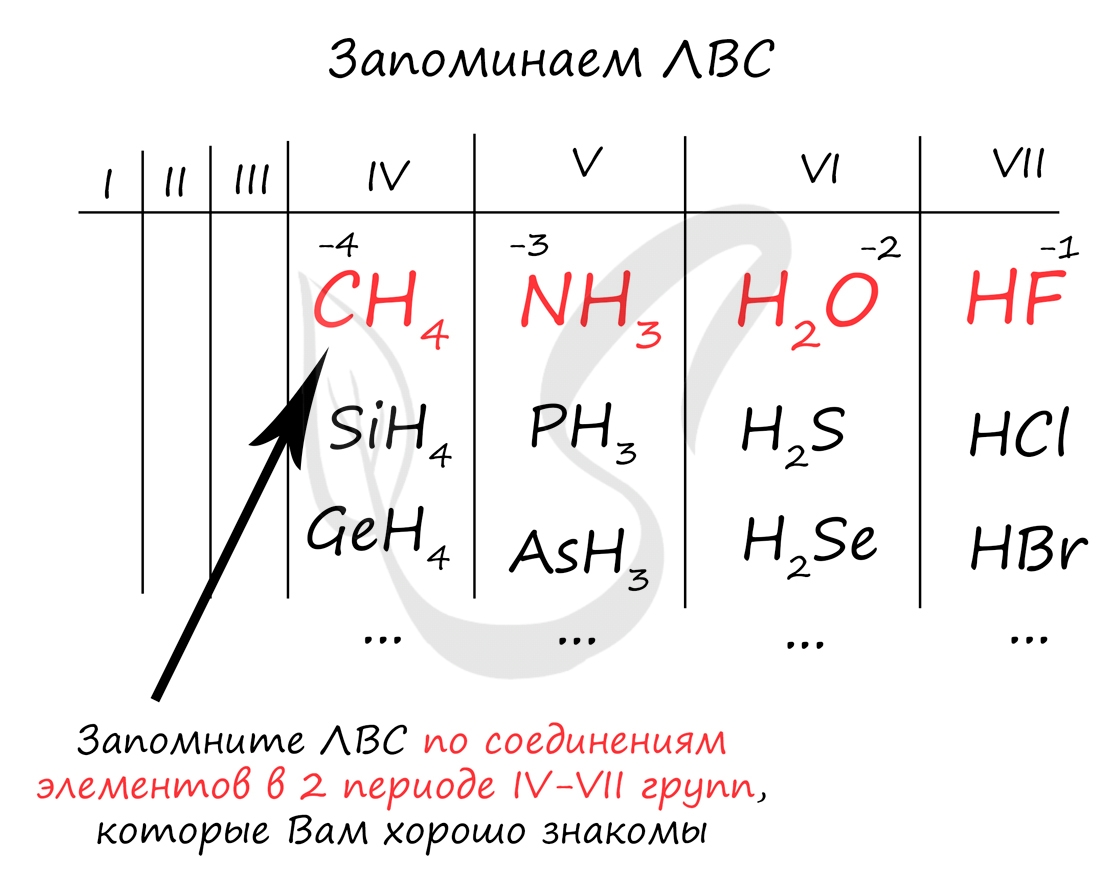
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы - H2S, H2Se, H2Te, H2Po.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Изображение атома гелия, где плотность вероятности нахождения электрона представлена серым цветом, более тёмные области соответствуют большей плотности.

Примерная форма молекулы этанола, CH3CH2OH. Каждый атом представлен сферой с радиусом Ван-дер-Ваальса.
Ра́диус а́тома — расстояние между атомным ядром и самой дальней из стабильных орбит электронов в электронной оболочке этого атома. Поскольку, согласно квантовой механике, атомы не имеют четких границ, а вероятность найти электрон, связанный с ядром данного атома, на определённом расстоянии от этого ядра быстро убывает с увеличением расстояния, атому приписывают некоторый определённый радиус, полагая, что в шаре этого радиуса заключена подавляющая часть электронной плотности (порядка 90 процентов). Существуют различные определения радиуса атома [⇨] , три наиболее широко используемых: радиус Ван-дер-Ваальса, ионный радиус и ковалентный радиус.
Согласно большинству определений, радиусы изолированных нейтральных атомов колеблются в диапазоне от 30 до 300 пм (или от 0,3 до 3 ангстрем), в то время как радиусы атомных ядер находятся пределах от 0,83 до 10 фм [2] . Следовательно, радиус типичного атома примерно в 30 тысяч раз больше радиуса его ядра.
Во многих случаях форма атома может быть аппроксимирована сферой. Это лишь грубое приближение, но оно может дать количественные представления и выступить в качестве базовой модели для описания для многих явлений, таких как плотность жидкостей и твердых веществ, диффузия жидкостей через молекулярные сита, расположение атомов и ионов в кристаллах, а также размер и форма молекул.
Радиусы атомов изменяются, подчиняясь определённым закономерностям периодической таблицы химических элементов. Например, радиусы атомов обычно уменьшаются при перемещении слева направо вдоль каждого периода (строки) таблицы, от щелочных металлов до благородных газов, и возрастают по мере продвижения сверху вниз в каждой группе (столбце). Радиусы атомов резко возрастают при переходе между благородным газом в конце каждого периода и щелочным металлом в начале следующего периода. Эти тенденции изменения радиусов атомов (наряду с другими химическими и физическими свойствами элементов) могут быть объяснены с точки зрения теории электронной оболочки атома, а также представляют доказательства подтверждения квантовой теории. Радиусы атомов уменьшаются в периодической таблице, потому что с увеличением атомного номера увеличивается число протонов в атоме, а дополнительные электроны добавляются в одну и ту же квантовую оболочку. Следовательно, эффективный заряд атомного ядра по отношению к внешним электронам увеличивается, притягивая внешние электроны. В результате электронное облако сжимается и атомный радиус уменьшается.
В атомное радио это важный параметр для периодических свойств элементов таблицы Менделеева. Это напрямую связано с размером атомов, поскольку чем больше радиус, тем они больше или объемнее. Точно так же это связано с их электронными характеристиками.
Чем больше в атоме электронов, тем больше его атомный размер и радиус. Оба они определяются электронами валентной оболочки, поскольку на расстояниях за пределами их орбит вероятность найти электрон приближается к нулю. Вблизи ядра происходит обратное: вероятность найти электрон увеличивается.
Верхнее изображение представляет собой упаковку ватных шариков. Обратите внимание, что каждый из них окружен шестью соседями, не считая другого возможного верхнего или нижнего ряда.То, как уплотняются ватные шарики, определяет их размеры и, следовательно, их радиус; так же, как с атомами.
Элементы в соответствии с их химической природой так или иначе взаимодействуют со своими атомами. Следовательно, величина атомного радиуса меняется в зависимости от типа присутствующей связи и твердой упаковки ее атомов.
Как измеряется атомный радиус?
На основном изображении можно легко измерить диаметр ватных шариков, а затем разделить его на два. Однако сфера атома полностью не определена. Зачем? Потому что электроны циркулируют и диффундируют в определенных областях пространства: орбиталях.
Поэтому атом можно рассматривать как сферу с неосязаемыми краями, по которым невозможно точно сказать, насколько далеко они заканчиваются. Например, на изображении выше область центра, близкая к ядру, имеет более интенсивный цвет, а ее края размыты.
Изображение представляет собой двухатомную молекулу E2 (как Cl2, H2, ИЛИ2, так далее.). Предполагая, что атомы представляют собой сферические тела, если бы расстояние было определено d который разделяет оба ядра ковалентной связью, тогда достаточно было бы разделить его на две половины (d/ 2) для получения атомного радиуса; точнее, ковалентный радиус от E до E2.
Что, если бы E не образовывал ковалентных связей с самим собой, а был бы металлическим элементом? Так d на это указывает количество соседей, окружающих E в его металлической структуре; то есть по координационному числу (N.C) атома внутри упаковки (вспомните ватные шарики на основном изображении).
Определение межъядерного расстояния
Чтобы определить d, которое представляет собой межъядерное расстояние для двух атомов в молекуле или упаковке, требует методов физического анализа.
Одним из наиболее широко используемых является дифракция рентгеновских лучей, при которой луч света облучается через кристалл и изучается дифракционная картина, возникающая в результате взаимодействия электронов с электромагнитным излучением. В зависимости от упаковки могут быть получены разные дифракционные картины и, следовательно, другие значения d.
Как связаны атомный радиус и координационное число? В. Гольдшмидт установил взаимосвязь между ними, в которой для N.C, равного 12, относительное значение равно 1; 0,97 для упаковки, в которой N.C атома равно 8; 0,96 для N.C, равного 6; и 0,88 для Н.З. 4.
Единицы
Начиная со значений N.C, равных 12, было построено множество таблиц, в которых сравниваются атомные радиусы всех элементов периодической таблицы.
Поскольку не все элементы образуют такие компактные структуры (N.C менее 12), соотношение В. Гольдшмидта используется для вычисления их атомных радиусов и выражения их для одной и той же упаковки. Таким образом стандартизируются измерения атомного радиуса.
Но в каких единицах они выражены? Учитывая d имеет очень малую величину, мы должны прибегнуть к единицам ангстрем Å (10 ∙ 10 -10 м) или также широко распространенный пикометр (10 ∙ 10 -12 м).
Как это меняется в периодической таблице?
За период
Атомные радиусы, определенные для металлических элементов, называются металлическими радиусами, а для неметаллических элементов - ковалентными радиусами (такими как фосфор, P4, или сера, S8). Однако между обоими типами спиц существует более заметное различие, чем различие в названии.
Слева направо в тот же период ядро добавляет протоны и электроны, но последние ограничены одним и тем же уровнем энергии (главным квантовым числом). Как следствие, ядро оказывает возрастающий эффективный ядерный заряд на валентные электроны, что сокращает атомный радиус.
Таким образом, неметаллические элементы в один и тот же период, как правило, имеют меньшие атомные (ковалентные) радиусы, чем металлы (металлические радиусы).
Спуск по группе
Когда вы спускаетесь по группе, активируются новые уровни энергии, которые позволяют электронам иметь больше места. Таким образом, электронное облако покрывает большие расстояния, его размытая периферия в конечном итоге удаляется от ядра, и, следовательно, атомный радиус увеличивается.
Сокращение лантаноидов
Аналогичный эффект можно наблюдать и с элементами p-блока из периода 4. На этот раз в результате слабого экранирующего эффекта d-орбиталей, которые заполняются при прохождении через периоды переходных металлов.
Примеры
Для периода 2 периодической таблицы атомные радиусы ее элементов равны:
Обратите внимание, что металлический литий имеет самый большой атомный радиус (257 пм), а фтор, расположенный в крайнем правом углу периода, является самым маленьким из них (64 пм). За тот же период атомный радиус спускается слева направо, и приведенные значения подтверждают это.
Литий при образовании металлических связей его радиус металлический; и фтор, поскольку он образует ковалентные связи (F-F), его радиус ковалентен.
Что, если вы хотите выразить атомные радиусы в единицах ангстрема? Просто разделите их на 100: (257/100) = 2,57Å. И так далее с остальными ценностями.
Читайте также:

