Гомогенный и гетерогенный катализ кратко
Обновлено: 05.07.2024
Катализатор активно, за счет химических связей (ковалентных, ионных, водородных) или электростатического взаимодействия, участвует в элементарном акте реакции. Он образует либо промежуточное соединение с одним из участников реакции (многостадийный процесс), либо активированный комплекс со всеми реагирующими веществами (одностадийный процесс). После каждого элементарного акта он регенерируется и может вступать во взаимодействие с новыми молекулами реагирующих веществ.
Таким образом, в ходе каталитической реакции катализатор остается химически неизменным, а его количество постоянным (если не учитывать механического уноса и возможности протекания побочных процессов, в которых катализатор участвует как реагент).
Различают также гомогенный и гетерогенный катализ.
При гомогенном катализе исходные вещества и катализатор находятся в одинаковом агрегатном состоянии. Скорость такой реакции зависит не только от наличия или отсутствия катализатора, но и от его концентрации в системе.
При гетерогенном катализе исходные вещества находятся в разных агрегатных состояниях. Чаще всего катализатор является твердым веществом, а реагенты – жидкостью или газом. Скорость такой реакции зависит от площади поверхности катализатора.
Механизм воздействия гомогенного и гетерогенного катализа в общих чертах схож. И в том и в другом случае катализаторы уменьшают энергию активации реакции, причем сам катализатор принимает участие в образовании активированного комплекса. Энергия активации такого комплекса меньше, чем Еа комплекса без катализатора, поэтому скорость реакции растет.
При распаде активированного комплекса катализатор высвобождается, и в реакции, таким образом, не расходуется. Но в деталях механизм действия гомогенного и гетерогенного катализа различается.
Механизм гомогенного катализа обычно объясняют с помощью теории промежуточных соединений. Согласно этой теории, катализатор (K) сначала образует с одним из исходных веществ промежуточное соединение АK, которое реагирует с другим исходным веществом с восстановлением катализатора. Схематически это можно представить так:
А + Б = АБ (реакция протекает медленно в отсутствии катализатора)
В присутствии катализатора процесс разбивается на 2 стадии:
1) А + K = АK (протекает быстро)
2) АK + Б = АБ + К (протекает быстро)
Энергия активации каждой из этих двух стадий меньше энергии активации некаталитической реакции (рис. 46).
Конкретным примером гомогенного катализа может служить реакция окисления SO2 в SO3 в присутствии катализатора NO.
Без катализатора реакция даже при нагревании практически не идет:
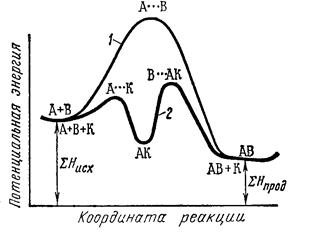
Рис. 46. Энергетическая схема хода реакции: 1 – без катализатора; 2 – в присутствии катализатора
В присутствии NO её скорость существенно возрастает, но сама реакция протекает в 2 этапа:
В гетерогенном катализе важнейшую роль играет адсорбция.
Поверхность твёрдого катализатора является неоднородной. На ней выделяют так называемые активные центры. Они возникают в тех местах поверхности катализатора, где атомы или ионы слабее всего связаны с кристаллической решеткой, т.е. там, где силовое поле наименее насыщено: выступы или пики на поверхности, ребра граней кристаллов. Таких активных центров как правило мало. Они составляют всего лишь 0,1% от поверхности катализатора.
Катализатор активно, за счет химических связей (ковалентных, ионных, водородных) или электростатического взаимодействия, участвует в элементарном акте реакции. Он образует либо промежуточное соединение с одним из участников реакции (многостадийный процесс), либо активированный комплекс со всеми реагирующими веществами (одностадийный процесс). После каждого элементарного акта он регенерируется и может вступать во взаимодействие с новыми молекулами реагирующих веществ.
Таким образом, в ходе каталитической реакции катализатор остается химически неизменным, а его количество постоянным (если не учитывать механического уноса и возможности протекания побочных процессов, в которых катализатор участвует как реагент).
Различают также гомогенный и гетерогенный катализ.

При гомогенном катализе исходные вещества и катализатор находятся в одинаковом агрегатном состоянии. Скорость такой реакции зависит не только от наличия или отсутствия катализатора, но и от его концентрации в системе.
При гетерогенном катализе исходные вещества находятся в разных агрегатных состояниях. Чаще всего катализатор является твердым веществом, а реагенты – жидкостью или газом. Скорость такой реакции зависит от площади поверхности катализатора.
Механизм воздействия гомогенного и гетерогенного катализа в общих чертах схож. И в том и в другом случае катализаторы уменьшают энергию активации реакции, причем сам катализатор принимает участие в образовании активированного комплекса. Энергия активации такого комплекса меньше, чем Еа комплекса без катализатора, поэтому скорость реакции растет.
При распаде активированного комплекса катализатор высвобождается, и в реакции, таким образом, не расходуется. Но в деталях механизм действия гомогенного и гетерогенного катализа различается.
Механизм гомогенного катализа обычно объясняют с помощью теории промежуточных соединений. Согласно этой теории, катализатор (K) сначала образует с одним из исходных веществ промежуточное соединение АK, которое реагирует с другим исходным веществом с восстановлением катализатора. Схематически это можно представить так:
А + Б = АБ (реакция протекает медленно в отсутствии катализатора)
В присутствии катализатора процесс разбивается на 2 стадии:
1) А + K = АK (протекает быстро)
2) АK + Б = АБ + К (протекает быстро)
Энергия активации каждой из этих двух стадий меньше энергии активации некаталитической реакции (рис. 46).
Конкретным примером гомогенного катализа может служить реакция окисления SO2 в SO3 в присутствии катализатора NO.
Без катализатора реакция даже при нагревании практически не идет:

Рис. 46. Энергетическая схема хода реакции: 1 – без катализатора; 2 – в присутствии катализатора
В присутствии NO её скорость существенно возрастает, но сама реакция протекает в 2 этапа:
В гетерогенном катализе важнейшую роль играет адсорбция.
Поверхность твёрдого катализатора является неоднородной. На ней выделяют так называемые активные центры. Они возникают в тех местах поверхности катализатора, где атомы или ионы слабее всего связаны с кристаллической решеткой, т.е. там, где силовое поле наименее насыщено: выступы или пики на поверхности, ребра граней кристаллов. Таких активных центров как правило мало. Они составляют всего лишь 0,1% от поверхности катализатора.
В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном и гетерогенном катализе. В последнем случае ускорение процесса обычно связано с каталитическим действием поверхности твердого тела (катализатора).
Действие катализатора при любом виде катализа объясняется тем, что он вступает в промежуточное взаимодействие с реагирующими веществами, направляя процесс по новому пути с меньшей энергией активации.
Так называют каталитический процесс, в котором реакционная смесь и катализатор образуют одну фазу (газообразную или жидкую). Гомогенно-каталитические реакции особенно распространены при проведении процессов в жидкой фазе. Гомогенными катализаторами обычно служат растворы кислот, оснований, солей и прежде всего солей d-элементов (Cr, Mn, Fe, Co, Cu и др.).
Явление катализа, в частности гомогенного, находит свое объяснение в теории промежуточных соединений. Эта теория исходит из того, что катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя с ним в той же фазе неустойчивое промежуточное соединение, которое отличается большой реакционной способностью. Далее промежуточное соединение энергично взаимодействует с другим компонентом реакционной смеси, и образуется конечный продукт. Катализатор при этом восстанавливается в первоначальном виде и количестве. Увеличение скорости реакции происходит за счет снижения энергии активации каждой из её отдельных стадий.
Рассмотрим следующую каталитическую реакцию в общем виде:
Примем, что энергия активации этой реакции Е1 высока, и она протекает с очень малой скоростью. В присутствии катализатора К образуется промежуточное соединение АК, которое требует для своего образования меньшую энергию активации Е2, чем для непосредственного взаимодействия веществ, т.е.
Промежуточное соединение АК взаимодействует с веществом В, образуя АВ и К.
В + АК → А…К…В → АВ + К (1.27)
Энергия активации этой стадии Е3 тоже меньше энергии активации некаталитического пути реакции, т.е. Е3 Е1, то и в этом случае скорость реакции возрастет из-за того, что и Е2 и Е3 меньше Е1.
Действие катализаторов может быть также проиллюстрировано рисунком 14, из которого видно, что снижение энергии активизации реакции приводит к возрастанию доли реакционноспособных (или активных) молекул (заштрихованная область).

Рис.13. Энергетическая схема реакции, протекающей с участием катализатора:
А и В-исходные вещества; АВ-продукт реакции; АК-первое переходное со-
состояние; ВАК-второе переходное состояние; Е1-энергия активации реакции;
без катализатора; Е2-энергия активации образования первого переходного состо-
ния; Е3-энергия активации образования второго переходного состояния.

Рис.14. Влияние катализатора на число активных молекул.
DN/(NDE)-доля молекул с определенной энергией;
Еа-энергия активации реакции без катализатора;
Еа-энергия активации реакции в присутствии катализатора.
Примеры влияния катализатора на снижение энергии активации реакции:
без катализатора 184 кДж/моль
катализатор – Au 105 кДж/моль
катализатор – Pt 69 кДж/моль
без катализатора 75 кДж/моль
катализатор – ионы I – 56 кДж/моль
катализатор – Pt 49 кДж/моль
(катализаторами распада перекиси водорода являются также Mn, Cu, Fe, ионы этих металлов, MnO2 и др.; их влияние на скорость столь значительно, что процесс может носить взрывной характер);
без катализатора 190 кДж/моль
катализатор – пары I2 136 кДж/моль
(скорость реакции при этом увеличивается в 100000 раз).
Последняя реакция является одним из примеров гомогенного каталитического процесса
Выделяющийся в неизменном виде катализатор – I2 может стимулировать разложение следующей молекулы уксусного альдегида.
Характер промежуточных соединений с катализатором различен. В кисло-основных реакциях, где электронные пары перемещаются без разобщения электронов (гетеролитический разрыв валентных связей), это, обычно, комплексы типа солей; в окислительно-восстановительных реакциях, в которых электронные пары разрываются (гомолитические или радикальные реакции), это, как правило, комплексы с участием молекул и ионов, содержащих металлы переменной валентности, прежде всего d-элементы. К первой группе относятся процессы, в которых катализатором служат кислоты и основания: это реакции присоединения или отщепления полярных молекул. В процессах второй группы перенос электронов осуществляется за счет попеременного окисления иона, содержащего металл.
Хотя промежуточные продукты являются весьма реакционно-способными (это очень нестойкие соединения с малым временем жизни), во многих реакциях их удается выделять, доказывая тем самым их существование.
Если реакционная смесь и катализатор находятся в разных фазах, то процесс называется гетерогенным катализом.
На практике наиболее часто встречаются два типа гетерогенного катализа: а) процессы, катализатор которых находится в твердой фазе, а реагирующие вещества – в жидкой; б) процессы, катализаторы которых находятся в твердой фазе, а реагирующие вещества – в газовой.
Гораздо реже встречаются каталитические процессы с катализатором в жидкой фазе. Реагирующие вещества в этом случае могут находиться в жидкой или газообразной фазе. Жидкие катализаторы представляют собой кислоты (например, серная или фосфорная), иногда другие активные вещества в воде или органических растворителях.
Рассмотрим некоторые особенности каталитических процессов с твердыми катализаторами. Распространенными гетерогенными катализаторами являются многие металлы, чаще всего переходные (Pt, Pd, Ni, Co, Cu, Fe, Mo и др.), их оксиды (Al2O3, CuO, NiO, ZnO, Cr2O3 и др.), соли и т.д.
При гетерогенном катализе исключительно большое значение имеет поверхность соприкосновения реакционной смеси с катализатором, т.к. процесс протекает на поверхности раздела фаз. Так, платина, взятая в виде пластинки, повышает скорость реакции в сотни раз меньше, чем то же весовое количество металла в виде мелкого порошка. Поэтому применяют не сплошные массы катализатора, а его тонко измельченные, порошкообразные формы. Но порошкообразный катализатор легко уносится струей газа или жидкости, а взятый в больших количествах - создает значительное сопротивление потокам реакционной массы. Поэтому обычно активное вещество осаждают на инертных пористых подкладках – носителях (силикагеле, алюмогеле, солях и т.п.) или прессуют, придавая катализатору форму пористых таблеток, шариков или цилиндров.
Гетерогенный катализ, по сравнению с гомогенным, является более сложным и состоит из нескольких стадий:
1) диффузия реагирующих веществ к поверхности катализатора;
2) адсорбция молекул на поверхности катализатора;
3) реакция на поверхности катализатора;
4) десорбция продуктов реакции;
5) диффузия продуктов реакции в объем.
В зависимости от условий проведения процесса и его особенностей наиболее медленной может быть любая из стадий, которая и определяет скорость процесса в целом. Если скорость реакции на поверхности катализатора больше скорости диффузии, то скорость процесса будет определяться скоростью диффузии. В этом случае говорят, что процесс лежит в диффузионной области. Если скорость химической реакции меньше, чем скорость диффузии, то скорость процесса в целом будет определяться скоростью химической реакции. В этом случае говорят, что процесс лежит в кинетической области. Если скорость диффузии и скорость химической реакции соизмеримы, то в этом случае говорят о процессе в переходной области.
Вторая, третья и четвертая стадии, совокупность которых и составляет собственно гетерогенный каталитический процесс, протекают с преодолением некоторых энергетических барьеров, т.е. молекулы на соответствующих стадиях должны обладать определенной энергией активации. Но все промежуточные стадии протекают с значительно меньшей энергией активации по сравнению с процессом без катализатора. Это и обусловливает увеличение скорости реакции в целом.
Основу теории гетерогенного катализа составляет адсорбционная теория, согласно которой на поверхности катализатора происходит адсорбция, т.е. концентрирование реагирующего вещества. Адсорбция является результатом взаимодействия неуравновешенных сил поверхностных частиц твердого катализатора с молекулами реагирующего вещества газовой или жидкой фазы.
Представим поверхность твердого тела на границе, например, с газом. Внутри твердого тела частицы (атомы, ионы или молекулы), образующие его решетку, правильно чередуются в соответствии с кристаллической структурой, причем их взаимодействия уравновешены. Состояние же частиц, находящихся на поверхности, иное – их взаимодействия не уравновешены, и поэтому поверхность твердого тела притягивает молекулы вещества из соседней газовой фазы. Газ адсорбируется поверхностью твердого тела (обратный процесс называется десорбцией), и в результате концентрация этого вещества на поверхности становится больше, чем в объеме системы в целом, что уже само по себе способствует повышению скорости, так как создаются лучшие кинетические условия – увеличивается вероятность соударения молекул. Кроме того, в результате взаимодействия отдельных атомов, составляющих молекулу реагирующего вещества, с атомами вещества - катализатора происходит ослабление внутримолекулярных сил в частицах реагирующих веществ, что приводит к их активации, увеличению их средней энергии и, таким образом, к уменьшению энергии активации реакции. Такая адсорбция получила название активированной, химической или хемосорбции. Иногда адсорбированные молекулы диссоциируют на отдельные атомы, отличающиеся большой химической активностью (например, водород на платине).
Известны случаи, когда между адсорбированными молекулами и частицами адсорбента образуются неустойчивые химические соединения, легко вступающие в дальнейшие реакции.
Адсорбционная теория объясняет, почему катализатор должен иметь максимальную поверхность на единицу веса: чем больше поверхность, тем количественно эффективнее идет процесс адсорбции, тем больше молекул реагирующих веществ активируются, и тем выше скорость реакции.
Экспериментальные факты указывают на то, что адсорбция молекул реагирующих веществ и процесс формирования поверхностных соединений про-
исходит не по всей поверхности, а только на отдельных участках катализатора, на так называемых активных центрах. Активные центры составляют совсем небольшую долю поверхности, что подтверждается действием каталитических ядов - веществ, блокирующих активные центры. Их ничтожное количество резко уменьшает активность катализатора или дезактивирует (отравляет) его полностью. Путем дозировки отравления можно определить число активных центров.
Существенным является не только число активных центров, но и характер их расположения. Чем больше геометрическое соответствие между строением молекул адсорбируемых веществ и расположением активных центров на поверхности катализатора, тем активнее он себя проявляет. Если число активных центров или же их расположение (по рисунку или по расстояниям между ними) не соответствует геометрии молекул реагирующих веществ, процесс ускоряться не будет.
В настоящее время представление об активных центрах является одним из основных качественных представлений в катализе. Вопрос о их природе (строении) является постоянным предметом научных исследований. Установлен ряд общих принципов выбора катализаторов для различных типов реакций. Во многих случаях определяющим фактором в их подборе является положение элементов в периодической системе Д.И. Менделеева.
Примером гетерогенного катализа может служить применяющийся в промышленности контактный способ получения серной кислоты, при котором протекает реакция между газами SO2 и O2 на поверхности твердой фазы – катализаторе оксиде ванадия V2O5 по схеме:
Другие примеры гетерогенного катализа:
производство водорода из водяного газа (смесь СО и Н2О) – катализатором является оксид железа, активированный оксидом хрома;
синтез аммиака из водорода и азота, катализируемый пористым железом, активированным оксидами калия, алюминия, кальция, кремния;
производство метилового спирта из монооксида углерода и водорода – функцию катализатора выполняет смесь оксидов цинка и хрома (III);
синтез углеводородов по Фишеру-Тропшу из смесей монооксида углерода с водородом в присутствии кобальта, железа или никеля;
производство ароматических углеводородов (сырья для нефтехимического синтеза) из бензинов – катализатором является Pt на оксиде алюминия и т.д.
Этот перечень можно продолжать очень долго, т.к. практически во всех производствах химической и нефтехимической промышленности используются катализаторы, и преимущественно гетерогенные.
Свидетельство и скидка на обучение каждому участнику
Зарегистрироваться 15–17 марта 2022 г.
Тема 1.2 лекция 8 Каталитические процессы. Гомогенный и гетерогенный катализ. Катализаторы.
Катализ можно определить как изменение скорости химической реакции под влиянием веществ- катализаторов, которые, участвуя в процессе, остаются в результате неизменёнными по количеству и химическому составу.
Если скорость реакции в присутствии катализатора увеличивается, то катализ является положительным; если скорость реакции уменьшается , то катализ отрицательный. Обычно положительный катализ называют просто катализом. Катализатор, замедляющий скорость химической реакции, обычно называют ингибитором. Как правило катализаторы не смещают химического равновесия, в одинаковой степени изменяя скорость прямой и обратной реакции. Катализаторы ( ингибиторы) могут ускорить или замедлить наступления равновесия, но не влияют на его состояние, т.е. не изменяют константу равновесия.
По сравнению с количествами реагирующих веществ катализатора, заметно изменяющее скорость реакции, ничтожно мала. Например, скорость окисления сульфита натрия в водном растворе значительно возрастает при введении катализатора сульфата меди в количестве 10 -13 моль/л. С увеличением концентрации катализатора возрастает и скорость химической реакции.
Катализаторы отличаются избирательностью действия ( специфичностью), т.е данный катализатор влияет на определённый вид реакции. Так, при пропускании паров этилового спирта при 300-400◦С над катализатором –медью или никелем- идёт реакция дегидрирования спирта с образованием ацетальдегида:
Если в качестве катализатора взять оксид алюминия AlO , то происходит дегидратация спирта с образованием этилена:
Иногда катализатор образуется в ходе самого химического процесса. Такие реакции называются автокаталитическими, а само явление автокатализом. При автокатализе скорость химической реакции вначале очень мала, с появлением продукта-катализатора она быстро возрастает и, достигнув максимума, снова снижается вследствие уменьшения концентрации реагирующих веществ.
Примером автокаталитической реакции может служить омыление эфира:
Катализатором этой реакции являются ионы Н + , которые появляются в растворе при диссоциации получающейся уксусной кислоты.
Различают катализ гамогенный и геторогенный. Если катализатор и реагирующие вещества находятся в одной фазе (жидкой или газообразной), катализ называют гамогенным. К этому типу реакций относится окисление SO 2 до SO 3 в присутствии катализатора NO 2 , гидролиз углеводов ( например, сахарозы) в водном растворе в присутствии кислоты.
При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах. Обычно реагирующие вещества находятся в жидком или газообразном состоянии, а катализатором является твердым телом, при этом реакция протекает на границе двух фаз, т.е на поверхности твердого катализатора. В некоторых случаях каталитическое действие оказывает материал, из которого сделана аппаратура для данного процесса.
Так, при переработке плодов и овощей следует избегать контакта их с медью , так как она активирует окисление витамина С.
Как было указано выше, ингибиторы замедляют реакцию. В том случае, если ингибитор тормозит процесс окисления, его называют антиокисдантом, или антиокислителем. Особенно важным является применение антиокислителей для предотвращения окислительной порчи жиров и жиросодержащих продуктов и увеличения сроков их хранения.
Гомогенный катализ
Во всех случаях гомогенного катализа катализатор реагирует с исходными веществами, образуя нестойкие промежуточные соединения. Иногда эти промежуточные соединения можно выделить и определить их состав, иногда это очень неустойчивые соединения и обнаружить их присутствие удается только специальными методами, например спектрофотометрическими. Существование таких промежуточных соединений Кобозевым Николай Ивановичем советским физико-химиком.
Предположим, что идёт реакция в присутствии катализатора К:
Это процесс может идти по следующим стадиям:
1)А+К=АК ( промежуточное соединение)
Увеличение скорости реакции при гамогенном катализе объяснится тем, что каждая из стадий характеризуется низкой энергией активации и , следовательно, идет с большой скоростью. Соответственно увеличивается и скорость всего процесса.
Примером гамогенной каталитической реакции, несколько более сложной, чем приведенная выше схема, является разложение ацетальдегида, которое катализаруется йодом.
Эта реакция протекает в две стадии:
Здесь катализатор образует два промежуточных соединения, которые затем взаимодействуют друг с другом, регенерируя катализатор.
Гомогенный катализ в растворах часто вызывает действие ионов Н + и ОН - . К таким реакциям относятся реакции этирификация, гидролиз сложных эфиров, в том числе и жиров, инверсия сахарозы.
Гетерогенный катализ
При гетерогенном катализе реакция протекает на поверхности катализатора. Отсюда следует, что площадь поверхностного слоя катализатора и его строение определяет активность катализатора. Для увеличения площади поверхностного слоя катализатору обычно придают пористую структуру или наносят его тончайшем слоем на какое-либо химически нейтральное вещество, имеющее пористую структуру- пемзу, асбест и т.д. Такие катализаторы называются нанесёнными , а вещества , на которые они наносятся,- носителями, или подкладками.
Большое влияние на активность твердого катализатора оказывает строение его поверхности. Установлено, что каталитической активностью обладают не вся поверхность, а только её определённые участки- активные центры.
Поверхность катализатора, как и поверхность любого кристаллического твердого тела, неоднородна. На ней всегда есть трещины, пики, выступы. Атомы или группы атомов, находящиеся на вершине этих пиков или выступов, по сравнению с атомами, расположенными в глубине, менее прочно связаны с кристаллической решёткой и обладает свободной валентностью. Благодаря этому они могут образовывать неустойчивые поверхностные промежуточные соединения с веществами жидкой или газообразной фазы, т.е. на этих участках поверхности идет химическая реакция.
Баландин Алексей Александрович советский физико-химик установил, что промежуточные соединения на поверхности катализатора могут образовываться в том случае, если строение активного центра- порядок в расположении атомов катализатора- соответствует геометрическому строению молекул реагирующего вещества.
Наличие активных центров на поверхности катализаторов подтверждается высокой чувствительностью к действию каталитических ядов- веществ, которые присутствуют в реагирующей смеси в очень малых количествах, способны снизить или полностью подавить активность катализатора. Например, при гидрировании жидких масел для получения твердого жира активность никелевого катализатора резко снижается, если в водороде будет незначительная примесь оксида углерода. Такое действие очень малых количеств каталитического яда объясняется тем, что молекулы его покрывают не всю поверхность катализатора, а оседают ( адсорбируются) только на его активных центрах, блокируют их и выводят из участия в реакции.
Всякое увеличение неоднородности поверхности должно повышать активность катализатора. Это используют на практике, вводя в катализатор некоторые вещества, которые самые не обладают каталитической способностью, но изменяют структуру поверхности и тем самым увеличивают активность катализатора. Эти вещества называют промоторами.
Очевидно, увеличением числа активных центров можно объяснить и высокую активность смешанных катализаторов.
На активность, а также на избирательность нанесенных катализаторов влияет природа носителя. Один и тот же катализатор, нанесенный на разные носители, катализирует реакции разных типов. Это объясняется различным строением активных центров катализатора в зависимости от природы носителя и строения его поверхности
Гомогенный катализ- катализатор и реакционная смесь находятся в одной фазе. Скорость пропорциональна катализатору, хотя его количество в системе невелико. Гомогенный катализ в растворах и биосредах может вызываться ионами Н (кислотный катализ) и гидроксила (основный катализ). Реакции омыления сложных эфиров и амидов. ОВР обычно катализируются катионами тех d-металлов для которых характерна переменная степень окисления (Fe +3 ; Fe +2 ; Сu + ; Сu +2 ). Примеры: процесс окисления SO2 и SO3 при помощи газообразных оксидов азота, омыление сложных эфиров, гидролиз дисахаридов при участии небольших количеств сильных кислот или щелочей.
Гетерогенный катализ- катализатор обычно твердый и реакция протекает на его поверхности. Скорость реакции сильно зависит от площади и состояния поверхности катализатора, т.к. реакция происходит не на всей поверхности, а только на её активных центрах. Примеры: синтез спиртов из смеси окиси углерода в H2 в присутствии катализатора; процессы дегидрирования, дегидратации в присутствии окиси металлов; разложение пероксида водорода в присутствии платины.
Основные свойства катализаторов. Факторы, влияющие на катализ.
Основные свойства катализаторов:
-в присутствии катализаторов изменяется механизм реакции и она направлена по пути с меньшим значением энергии активации каждой стадии, это и приводит к возрастанию скорости реакции.
-может способствовать определению ориентации молекулы в пространстве удобной для данного химического взаимодействия и влиять на энтропию переходного состояния, способствует её возрастанию.
Факторы, влияющие на катализ:
- свойства поверхности- процесс гетерогенного катализа протекает непосредственно на поверхности катализатора (величина удельной поверхности)
-при гомогенном катализе скорость процесса пропорциональна концентрации катализатора
33)Явление автокатализа (пример).Как изменяется во времени скорость автокаталитической реакции?
Автокатализ- самоукскорение реакции, обусловленное накоплением конечного или промежуточного продуктов обладающим каталитическим действием на данную реакции. Скорость автокаталитической реакции вначале возрастает вследствие увеличения количества продукта, являющегося катализатором, а затем падает в результате израсходования исходных веществ. Реакция начинается благодаря присутствию в начальный момент некоторого малого количества продукта (затравка) или другого катализатора, или, наконец, за счёт медленной некаталитической реакции, происходящей параллельно каталитической. Если начальная концентрация катализатора и скорость некаталитической реакции весьма малы, то в течение некоторого времени, называемого периодом индукции, реакция настолько медленна, что практически не обнаруживается, и лишь по истечении этого времени становится заметной.
Объясните механизм катализа с точки зрения теории образования промежуточных стадий. Энергетический профиль каталитической реакции.
Существует несколько теорий, объясняющий механизм действия катализаторов, однако главной причиной повышения скорости является уменьшение энергии активации реакции в присутствии катализатор Уменьшение энергии активации обусловлено тем, что в присутствии катализатора реакция протекает в несколько стадий с образованием промежуточных продуктов, и эти стадии характеризуются малыми значениями энергии активации. Например, реакция SO2+O2=2SO3 характеризуется высокой энергией активации и поэтому протекает с очень малой скоростью. В присутствии оксида азота (2) реакция протекает в 2 стадии: 2NO+O2=2NO2; 2NO2+2SO2+2SO3+2NO.Обе эти стадии имеют невысокие энергии активации. Приведенные уравнения показывают, что катализатор принимает участие в образовании промежуточного продукта а затем снова выделяется в свободном виде.
Сущность адсорбционной теории катализа.
-скорость химического процесса возрастает при адсорбции молекул реагирующих веществ на частицах катализатора (активных центрах)
-повышение концентрации реагирующих молекул и увеличивает возможность их результативных взаимодействий
-снижение энергии активации следовательно образование промежуточных соединений.
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Читайте также:

