Электронная микроскопия микробиология кратко
Обновлено: 05.07.2024
В настоящее время проведение микробиологических исследований является важной и актуальной деятельностью в биологии и медицине, так как они позволяют с высокой степенью точности и достоверности подтвердить или опровергнуть факт присутствия в организме (или другом исследуемом объекте) возбудителей инфекционных заболеваний. Классические микробиологические методы исследования решают задачи выделения чистой культуры возбудителя с его последующей идентификацией по биохимическим, антигенным и другим признакам [1]. Основу микробиологической диагностики инфекционных заболеваний составляют микроскопические, микробиологические, биологические, серологические и аллергологические методы [3]. Благодаря микробиологическим методам исследования можно установить возбудителей тех или иных инфекционных заболеваний и подобрать правильный метод лечения этого заболевания.
Цель: Описать основные микробиологические методы исследований, применяемых в биологии и медицине.
Задачи:
- охарактеризовать основные методы исследований в микробиологии по литературным источникам;
- ознакомить учащихся с основными микробиологическими методами исследований в кратком изложении.
Микроскопический метод
Микроскопические методы исследования – это способы изучения очень мелких, неразличимых невооруженным глазом объектов с помощью микроскопов. Широко применяются в бактериологических, гистологических, цитологических и других исследованиях.
Микроскопические методы исследований включают в себя приготовление мазков и препаратов для микроскопирования. В большинстве случаев результаты микроскопических исследований носят ориентировочный характер (например, определяют отношение возбудителей к окраске), так как многие микроорганизмы лишены явных морфологических (т.е. структурных) внешних и внутренних особенностей. Тем не менее микроскопией материала можно определить некоторые морфологические признаки возбудителей (например, наличие ядер, жгутиков, внутриклеточных включений и т.д.), а также установить сам факт наличия или отсутствия микроорганизмов в исследуемых образцах.
Существуют световая, фазово-контрастная, темнопольная (ультрамикроскопия), люминесцентная, поляризационная, ультрафиолетовая и электронная микроскопия [2].
Микробиологический метод
Биологический метод
Биологические методы исследований направлены на определение наличия токсинов возбудителя в исследуемом материале и на обнаружение самого возбудителя (особенно при его незначительном исходном содержании в исследуемом образце). Методы включают в себя заражение лабораторных животных исследуемым материалом с последующим выделением чистой культуры патогена либо установлением факта присутствия микробного токсина и его природы.
Моделирование экспериментальных инфекций у чувствительных животных — важный инструмент изучения патогенеза заболевания и характера взаимодействий внутри системы микроорганизм-макроорганизм. Для проведения биологических проб используют только здоровых животных определённой массы тела и возраста. Инфекционный материал вводят внутрь, в дыхательные пути, внутривенно, внутримышечно, подкожно, в переднюю камеру глаза, через трепанационное отверстие черепа, субокципитально (в большую цистерну головного мозга). У животных прижизненно забирают кровь, экссудат (скопившуюся жидкость) из брюшной полости, после гибели — кровь, кусочки различных органов, экссудаты из различных полостей [3].
Серологический метод
Серологические методы исследований для выявления специфических антител и антигенов возбудителя — важный инструмент в диагностике инфекционных заболеваний. Особую ценность они имеют в тех случаях, когда выделить возбудителя не представляется возможным. При этом необходимо выявить повышение титров антител (т.е. их концентрации), в связи с чем исследуют парные образцы сыворотки, взятые в интервале 10-20 суток (иногда этот интервал может быть более длительным). Aнтитела обычно появляются в крови на 1-2-ю неделю заболевания и циркулируют в организме относительно долго, что позволяет использовать их выявление для эпидемиологических исследований.
Особое значение имеют методы выявления микробных антигенов, порождающих антитела. В значимых количествах они появляются уже на самых ранних сроках, что делает их идентификацию важным инструментом экспресс-диагностики инфекционных заболеваний, а количественное их определение в динамике инфекционного процесса служит критерием эффективности проводимой антимикробной терапии.
Аллергологический метод
Антигены многих возбудителей обладают сенсибилизирующим действием, т.е. способны вызывать аллергические реакции. Это используют для диагностики инфекционных заболеваний, а также при проведении эпидемиологических исследований. Наибольшее распространение нашли кожно-аллергические пробы, включающие внутрикожное введение Аг (аллергена). Кожные пробы нашли применение в диагностике таких заболеваний как сап, мелиоидоз, бруцеллёз. Наиболее известна проба Манту, используемая как для диагностики туберкулёза, так и для оценки невосприимчивости организма к возбудителю [4].
Заключение
В данной работе были кратко описаны основные методы исследований в микробиологии (микробиологические методы исследований):
1. Микроскопический метод.
2. Микробиологический метод.
3. Биологический метод.
4. Серологический метод.
5. Аллергологический метод.
С помощью методов, применяемых в микробиологии, люди научились выявлять и определять различного рода возбудителей тех или иных инфекционных заболеваний. Правильно выбранный метод способствует в дальнейшем правильному лечению заболеваний.
В настоящее время наиболее широко используются микроскопический, микробиологический и биологический методы исследования, потому что именно благодаря этим методам можно выявить причину возникновения и проявления инфекционных болезней у живых организмов и дать верную характеристику возбудителям этих болезней.
Электронная микроскопия. Просвечивающий электронный микроскоп. Подготовка материала к микроскопии. Нативные препараты.
Теоретически разрешение просвечивающего электронного микроскопа составляет 0,002 нм; реальное разрешение современных электронных микроскопов приближается к 0,1 нм. На практике разрешение дли биологических объектов достигает 2 нм.
Просвечивающий электронный микроскоп (рис. 11-7) состоит из колонны, через которую в вакууме проходят электроны, излучаемые катодной нитью. Пучок электронов, фокусируемый кольцевыми магнитами, проходит через подготовленный образец. Характер рассеивания электронов зависит от плотности образца. Проходящие через образец электроны наблюдают на флюоресцирующем экране и регистрируют при помогли фотопластинки.
Сканирующий электронный микроскоп применяют для получения трёхмерного изображения поверхности исследуемого объекта.
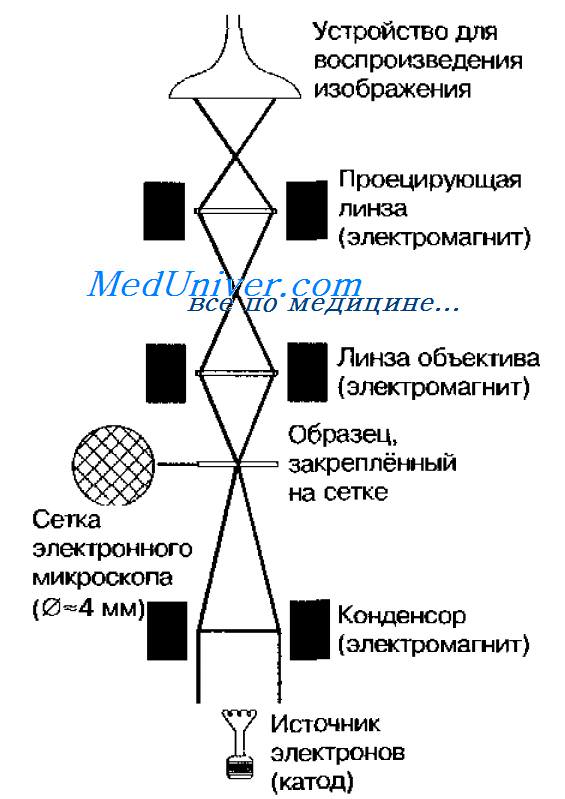
Рис. 11-7. Схема электронного микроскопа
Подготовка материала к микроскопии
В бактериологической практике микроскопически исследуют неокрашенные образцы (нативный материал) и окрашенные препараты (мазки или мазки-отпечатки), приготовленные из клинического материала или колоний выросших микроорганизмов.
Нативные препараты
Нативные препараты готовят для исследования живых неокрашенных бактерий Наибольшее распространение получили метод висячей капли, микрокамеры с плотными средами и негативные методы исследования живых бактерий. Для прижизненного исследования также часто применяются исследование в тёмном поле и фазово-контрастная микроскопия.
Подобные приёмы часто используют для диагностики сифилиса и предварительной диагностики диарей, вызванных кампилобактерами, а также для определения подвижности микроорганизмов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Электронная микроскопия – методы идентификации вирусов и диагностики вирозов с использование электронного микроскопа. Одну из первых микрографий вируса в 1939 году получили Г.А. Кауше и Е. Пфанкух при просмотре очищенных препаратов вируса табачной мозаики и Х-вируса картофеля. По мере совершенствования электронно-микроскопической техники расширялось и использование электронной микроскопии. В настоящее время данный метод широко применяется в фитовирусологии не только в качестве диагностического приема, но и при изучении биологии вирусов, особенностей их взаимоотношения с растениями и переносчиками, а также при определении концентрации вирионов.
Принцип работы электронного микроскопа
В устройство электронного микроскопа входит вольфрамовая нить, через которую проходит ток, нагревающий ее и вызывающий эмиссию электронов. Высокое отрицательное напряжение, прилагаемое к нити, обеспечивает значительную разность величины потенциалов между вольфрамовой нитью и заземленной пластиной анода.
Разность потенциалов приводит к ускорению движения электронов по направлению к аноду. При этом часть электронов проходит через отверстие в центре анода (центральную апертуру) и формирует электронный луч, направленный вниз по колонне микроскопа.
Данный луч фокусируется первой (конденсорной) магнитной линзой и освещает исследуемый препарат.
Основная масса электронов проходит через исследуемый объект без отклонения, но часть их подвергается рассеиванию тяжелыми атомами объекта и выбивается из общего электронного луча. Чем плотнее структура объекта, тем сильнее рассеивание лучей. В результате формируется структура выходящего луча, способная при повторной фокусировке преобразоваться в изображение исследуемого объекта.
Электроны, прошедшие сквозь объект, фокусируются второй магнитной линзой (объективной). Она и создает увеличенное изображение, которое увеличивается третьей (проекционной) магнитной линзой, а затем проецируется на экран с люминофорным покрытием.
Чаще всего вирусы фотографируют при увеличении в 20–50 тысяч раз. При печати фотографии есть возможность увеличить изображения ещё в несколько раз.
Требования к изучаемым биологическим объектам
Биологические объекты, предназначенные для изучения с помощью электронной микроскопии, должны отвечать следующим требованиям:
- обладать высокой электрической проводимостью;
- обладать устойчивостью к вакууму;
- обладать устойчивостью к нагреванию;
- обладать устойчивостью к действию электронного пучка;
- обладать достаточно большими значениями атомных масс элементов, входящим в его состав;
- быть выделенным из свежего материала.
Для четкой видимости вирионов под электронным микроскопом применяют контрастирование вирусных препаратов при их приготовлении – напыление металлом (хром, вольфрам, платина, золото) или негативное контрастирование при помощи химических соединений. Для негативного контрастирования используются фосфорно-вольфрамовая кислота, молибденовокислый аммоний, вольфрамат натрия. Негативное контрастирование обеспечивает возможность изучения внутренней структуры вирионов.
Методы приготовления вирусных препаратов
Вирусные препараты готовят на специализированных сетках диаметром 2–3 мм. Сверху сетки покрыты пленкой-подложкой из формвара или коллодия. Препараты для метода электронного микроскопирования готовят согласно специальным методикам.
- Метод погружения – пригоден для выявления нитевидных, палочковидных вирусов в ростках, листьях, кожуре клубней. Для этого край листа обрезают и место среза погружают на пару секунд в каплю дистиллированной воды, нанесенную на сетку с пленкой-подложкой. Таким же образом срезают кожуру клубня или росток (на высоте 1/3 клубня), место среза погружают в каплю дистиллированной воды на сетке. После высыхания капли препарат контрастируют металлом.
- Метод разбавленной суспензии – кусочек исследуемого листа (1 смили 10–30 мг) растирают в фарфоровой ступке до однородной массы и добавляют маленькими порциями 10–20 мг дистиллированной воды. Растирание продолжают до получения однородной разбавленной смеси. Каплю, полученной взвеси, наносят на сетку и после высыхания напыляют металлом. Метод применяется для исследования стабильных палочковидных и нитевидных вирусов, характеризующихся относительно высокой концентрацией вирионов в тканях растений.
- Препараты для лабильных вирусов (с нестойкими вирионами) готовят, используя с применением различных приемов, способствующих стабилизации вирусных частиц. Для таких вирусов, особенно с бацилловидной формой используют только негативное контрастирование. Для каждого вида лабильных вирусов разрабатываются индивидуальные способы контрастирования. В частности, вирус мозаики люцерны и вируса обыкновенной мозаики огурца сохраняют путем обработки очищенных препаратов формалином перед негативным контрастированием. Стабилизация вирионов вируса штриховатой мозаики пшеницы производится с помощью вакуум-инфильтрации внутрь тканей листьев 12% раствора глютаральдегида в течение получаса, затем суспензия негативно окрашивается фосфорно-вольфрамовой кислотой.
Иммуносорбентная электронная микроскопия
Иммуносорбентная электронная микроскопия является методом, сочетающий серологию с электронной микроскопией. Пленки-подложки обрабатывают специфическими антисыворотками. Это дает возможность выявить низкую концентрацию вирусов и дифференцировать вирусные частицы при смешанной инфекции.
При использовании данного метода сетку, пленкой вниз, помещают в каплю антисыворотки, обладающей специфичностью к данному вирусу. Через 30–40 секунд сыворотку удаляют фильтровальной бумагой, оставляя на пленке следы влаги. Затем сетку переносят на поверхность капли сока растения, затем на каплю контрастера. Избыточную жидкость удаляют фильтровальной бумагой.
При такой подготовке биологического материала под электронным микроскопом можно наблюдать вирусы, связанные и покрытые антителами диагностической сыворотки.
(c) Справочник AgroXXI
Мельчайшие размеры микроорганизмов обусловливают использование для изучения морфологии бактерий точных оптических приборов - микроскопов. Наиболее часто применяются светлопольная микроскопия, микроскопия в темном поле, фазово-контрастная и люминесцентная микроскопия. Для специальных микробиологических исследований используется электронная микроскопия.
Светлопольная микроскопия
Светлопольная микроскопия осуществляется с помощью обычного светового микроскопа, основной частью которого является объектив. На оправе объективов обозначается увеличение: 8, 10, 20, 40, 90.
При исследовании микробов применяется иммерсионная система (объектив). Иммерсионный объектив погружают в каплю кедрового масла, нанесенного на препарат. Кедровое масло имеет такой же коэффициент преломления, как и стекло, и этим достигается наименьшее рассеивание световых лучей (рис. 1.12).

Рис. 1.12. Ход лучей в иммерсионном объективе
Изображение, получаемое в объективе, увеличивает окуляр, состоящий из двух линз. В отечественных микроскопах применяются окуляры с увеличением 7, 10, 15 (рис. 1.13). Общее увеличение микроскопа определяется произведением увеличения объектива на увеличение окуляра. В микробиологии обычно используются увеличения в 900-1000 раз. Качество микроскопа зависит не от степени увеличения, а от его разрешающей способности.

Рис. 1.13. Схема сложного светового микроскопа для наблюдения в светлом поле, отрегулированного для освещения по Келеру
Под этим надо понимать наименьшее расстояние между двумя точками препарата, при котором они еще четко различимы под микроскопом. Разрешающая способность обычных световых микроскопов с иммерсионной системой равна 0,2 мкм.
Темнопольная микроскопия
Микроскопия в темном поле зрения основана на следующем принципе (рис. 1.14). Лучи освещают объект не снизу, а сбоку и не попадают в глаза наблюдателя: поле зрения остается темным, а объект на его фоне оказывается светящимся. Это достигается с помощью специального конденсора (параболоид) или обычного конденсора, прикрытого в центре кружком черной бумаги.

Рис. 1.14. Схема микроскопа для наблюдения в темном поле.
На середину покровного стекла наносят исследуемый материал. Края углубления на предметном стекле смазывают вазелином, и им накрывают покровное стекло так, чтобы капля находилась против центра углубления. Затем переворачивают препарат покровным стеклом вверх. Темнопольная микроскопия используется для изучения живых неокрашенных микроорганизмов.
Фазово-контрастная микроскопия
При прохождении пучка света через неокрашенный объект изменяется лишь фаза колебания световой волны, что не воспринимается человеческим глазом. Чтобы изображение стало контрастным, необходимо превратить фазовые изменения световой волны в видимые амплитудные. Это достигается с помощью фазово-контрастного конденсора и фазового объектива (рис. 1.15).

Рис. 1.15. Схема фазово-контрастного микроскопа.
Фазово-контрастный конденсор представляет собой обычный объектив с револьвером и набором кольцевых диафрагм для каждого объектива. Фазовый объектив снабжен фазовой пластинкой, которую получают нанесением солей редкоземельных элементов на объектив. Изображение кольцевой диафрагмы совпадает с кольцом фазовой пластинки соответствующего объектива.
Фазово-контрастная микроскопия значительно повышает контрастность объекта и используется для изучения нативных препаратов.
Люминесцентная микроскопия
Люминесцентная микроскопия основана на способности некоторых веществ под влиянием падающего на них света испускать лучи с другой (обычно большей) длиной волны (флюоресцировать). Такие вещества называют флюорохромами (акридиновый желтый, родамин и др.). Объект, обработанный флюорохромом, при освещении ультрафиолетовыми лучами приобретает яркий цвет в темном поле зрения.
Основной частью люминесцентного микроскопа является осветитель, имеющий лампу ультрафиолетового цвета и систему фильтров к нему (рис. 1.16). Очень важно использование нефлуоресцентного иммерсионного масла.
Люминесцентная микроскопия в практической микробиологии используется для индикации и идентификации возбудителей инфекционных заболеваний.

Рис. 1.16. Схематическое изображение флуоресцентного микроскопа: 1 - дуговая лампа; 2 - кварцевый коллектор; 3 - кювета, заполненная раствором сернокислой меди; 4 - передняя часть коллектора; 5 - ультрафиолетовый фильтр; 6 - призма; 7 - пластинка из уранового стекла; 8 - окулярный фильтр, поглощающий
ультрафиолетовые лучи.
Электронная микроскопия
Возможности оптических микроскопов ограничены слишком большой длиной волны видимого света (6000 А). Объекты, размеры которых меньше этой величины, находятся за пределами разрешающей способности светового микроскопа. В электронном микроскопе вместо световых волн используются электронные лучи, обладающие чрезвычайно малой длиной волны и высокой разрешающей способностью (рис. 1.17).

Рис. 1.17. Схема трансмиссионного электронного микроскопа.
В качестве источника электронных лучей применяют электронную пушку, основой которой служит вольфрамовая нить, нагретая электрическим током. Между вольфрамовой нитью и анодом на пути электронов находится электрическое поле высокого напряжения. Электронный поток вызывает свечение фосфоресцирующего экрана. Проходя через объект, части которого имеют различную толщину, электроны будут соответственно задерживаться, что проявится на экране участками затемнения. Объект приобретает контрастность.
С помощью электронной микроскопии можно обнаружить самые мелкие структуры, получить увеличение до 200 000 и увидеть объекты размером 0,002 мкм.
Читайте также:

