Атомная теория дальтона кратко
Обновлено: 05.07.2024
Глоссарий по теме:
Химический элемент – совокупность атомов с одинаковым зарядом ядра.
Атом – мельчайшая частица химического элемента, стоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Молекула – мельчайшая частица вещества, обладающая его химическими свойствами.
Относительная атомная масса – отношение массы атома данного элемента к одной атомной единице массы. 1 атомная единица массы (а.е.м.) составляет 1/12 массы атома углерода 12 С (1,66∙10 -27 кг).
Стехиометрия (от греч. stoicheion – первоначало, элемент; metreo – измеряю) – система законов, правил и терминов, обосновывающих расчёты состава веществ и количественных соотношений между массами (объемами) веществ в химических реакциях.
Основная и дополнительная литература по теме урока:
1. Естествознание. 10 класс: учебник для общеобразоват. организаций: базовый уровень / И.Ю. Алексашина, К.В. Галактионов, И.С. Дмитриев, А.В. Ляпцев и др. / под ред. И.Ю. Алексашиной. – 3-е изд. – М.: Просвещение, 2017. – С. 137-139.
2. Савинкина Е.В. История химии. Элективный курс: Учебное пособие / Е.В. Савинкина, Г.П. Логинов, С.С. Плоткин. – М.: БИНОМ. Лаборатория знаний, 2007. – С. 35-44.
3. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин. – М.: Аванта+, 2000. – С. 27-28.
Открытые электронные ресурсы по теме урока:
Левченков С.И. Период количественных законов // Краткий очерк истории химии: Учебное пособие для студентов химфака РГУ. URL:
Теоретический материал для самостоятельного изучения
Использование количественных методов изучения веществ приводит к ряду важных открытий: закон сохранения массы, закон постоянства состава вещества, закон кратных отношений, закон объемных отношений и др. Так, ещё в конце XVIII века немецкий химик Иеремия Вениамин Рихтер (1762 – 1807) ввёл понятие стехиометрии и показал, что элементы соединяются в определенных соотношениях. В начале XIX века французский учёный Джозеф Луи Пруст (1754 – 1826) на основе количественных исследований состава множества природных и синтетических веществ открывает закон постоянства состава вещества. Количественно исследуя составы многих веществ, английский физик и химик Джон Дальтон (1766 – 1844) формулирует закон кратных отношений. В ходе измерений объемов различных газов и продуктов их взаимодействия французский физик и химик Жозеф Луи Гей-Люссак (1778 – 1850) открывает закон объёмных отношений. В начале XIX века итальянский учёный Амедео Авогадро (1776 – 1856) формулирует закон о постоянстве числа молекул, содержащихся в одинаковых объемах разных газов. Все эти открытия основывались на представлениях о дискретном строении вещества и существовании в природе конечного числа элементов, обладающих определённым набором свойств, которые можно определить химическим путем.
Объединить атомистику и элементаризм в единое учение удалось английскому учёному Джону Дальтону.
Основные положения атомной теории, которую создал Д. Дальтон, можно кратко сформулировать следующим образом:
Несмотря на ошибочность полученной шкалы относительных атомных весов и несовершенства новой атомной теории Д. Дальтон совершил настоящий прорыв в науке. Рассматривая его теорию с современных позиций, можно увидеть, что учёный понимал элемент как атомы одного вида, с определенными атомными весами, а каждый атом – это атом определенного химического элемента. Иными словами, атомы различных химических элементов не одинаковы по своим свойствам и по их массам, тогда как все атомы одного и того же вещества совершенно одинаковы.
Таким образом, благодаря работам Д. Дальтона атомистические идеи и представления об элементах, претерпев долгое историческое развитие, были объединены в единое учение. Созданная учёным атомная теория, в которой он ввел фундаментальное понятие относительного атомного веса – первый количественный параметр, характеризующий атом, послужила теоретической базой для дальнейшего развития химии и физики.
Резюме теоретической части.
Примеры и разбор решения заданий тренировочного модуля:
1. Укажите верные утверждения:
Утверждение
Правильный ответ и пояснение
А. Дальтон понимал элемент как атомы одного вида, с определенной атомной массой.
Б. Дальтон правильно определил относительные атомные массы известных на тот момент элементов.
Неправильное утверждение. Неправильно определив состав многих веществ, Дальтон получил ошибочные данные об относительных массах элементов.
В. Дальтон ввёл в науку первую количественную характеристику атома.
Правильное утверждение. Дальтон ввёл фундаментальное понятие относительного атомного веса – первый количественный параметр, характеризующий атом.
Правильный ответ: А, В.
2. Установление соответствие между элементами двух множеств. К каждой позиции первого столбца подберите соответствующую позицию второго.
Формулировка закона
Название закона
Вещества, независимо от нахождения в природе и способа получения имеют один и тот же состав.
В одинаковых объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Закон сохранения массы вещества
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате химической реакции.
Закон постоянства состава вещества
Формулировка закона
Название закона
Вещества, независимо от нахождения в природе и способа получения имеют один и тот же состав.
Закон постоянства состава вещества
В одинаковых объёмах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате химической реакции.

Ученые XVIII в. не смогли связать атомистические представления с учением о химических элементах. Все Они ошибочно полагали, что элементы состоят из одинаковых, но различным образом расположенных атомов.
Такой подход, во-первых, никак не объяснял качественного многообразия окружающего мира, а во-вторых, не мог дать химикам правильного ответа на интересующие их вопросы. Поэтому к концу XVIII в. исследователи, занимающиеся поиском химических элементов и изучением их свойств, почти полностью отошли от атомистических представлений.
Выход из создавшегося положения нашел Д. Дальтон, который предположил, что атомы различных элементов имеют различную массу. При химических реакциях атомы сближаются и образуют молекулы химического соединения. Масса любой молекулы равна сумме масс составляющих ее атомов. Теория Дальтона отражала наиболее важную для того времени сторону химических превращений — соотношение масс реагирующих веществ.
Для объяснения имеющихся экспериментальных данных Д. Дальтон наделил атомы тремя свойствами: атомы неизменны и неделимы (обоснование закона сохранения массы веществ при химических реакциях); все атомы одного и того же элемента тождественны (обоснование закона постоянства состава); атомы способны соединяться между собой в различных отношениях (обоснование закона кратных отно шений).
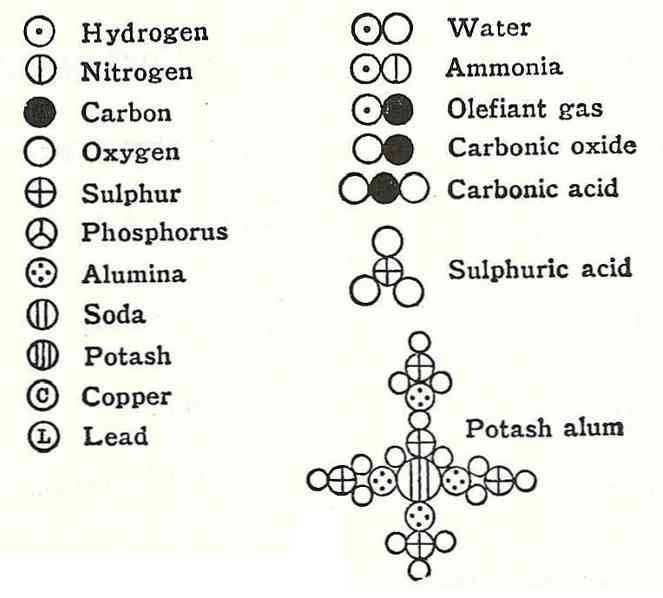
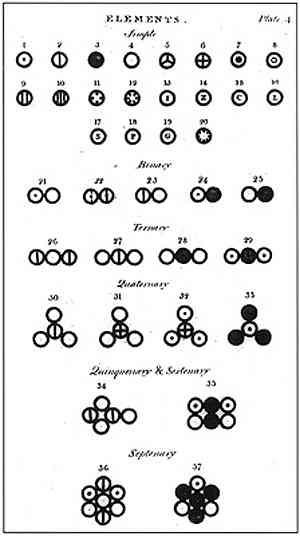
Поскольку абсолютные массы атомов невозможно было определить непосредственным взвешиванием, Д. Дальтон предложил рассчитывать относительные томные массы, приняв массу атома водорода за еди ницу.
На основании данных химического анализа различных соединений он к 1810 г. вычислил относительные атомные массы девятнадцати элементов. Однако при своих расчетах Д. Дальтон руководствовался неправильным представлением об атомном составе молекул.
Он совершенно произвольно считал, что элементы соединяются друг с другом в соответствии с принципом наибольшей простоты, и записывал формулу аммиака как NH, поды — НО, этилена — СН, а метана — СН2. Соответственно ошибочными получались и значения атомных масс.
В 1818 г. известный шведский химик Иене Якоб Берцелиус предложил выражать относительные атомные массы в кислородных единицах, принимая массу атома кислорода за 100. Но от перехода к другой системе отсчета численные значения атомных масс правильнее не стали.
Убедившись, что с помощью только закона кратных отношений и теории Дальтона невозможно определить истинные значения атомных масс, английский химик Уильям Волластон начал использовать в повседневных расчетах величины химических эквивалентов элементов.
Химическим эквивалентом элемента называется такое его количество, которое соединяется с одной частью водорода или с восемью частями кислорода или замещает их в других соединениях. Оказалось, что
элементы соединяются друг с другом в количествах, пропорциональных их эквивалентам (закон эквивалентов.
Развитие атомистической теории совпало по времени с широким изучением электрических явлений. Это нашло свое отражение во взглядах ученых на природу атомов. В начале XIX в. общераспространенным было мнение, что между атомами и электричеством существует тесная связь и что в основе соединения атомов друг с другом лежат электрические процессы.
В 1818 г. Я. Берцелиус разработал общую теорию строения химических соединений, положив в ее основу следующие положения:
1. Все атомы состоят из положительно и отрицательно заряженных частиц и соединяются между собой при помощи кулоновских сил.
2. Атомы металлов имеют избыток положительного электричества, а атомы неметаллов — избыток отрицательного электричества.
Теория Берцелиуса объяснила относительную легкость взаимодействия металлов с неметаллами и различие их физических и химических свойств. Однако она не смогла объяснить причин, вызывающих соединение неметаллов друг с другом, и была постепенно оставлена.
Статья на тему Атомная теория Дальтона
Похожие страницы:
Что такое строение вещества Атомы и молекулы Атомная теория Дальтона Гипотеза Авогадро Теория химического строения Периодический закон и система элементов.
Содержание статьи1 Гипотеза Авогадро1.1 Закон Авогадро1.2 Относительные атомные массы элементов Гипотеза Авогадро Д. Дальтон не видел различия между химическим элементом.
Развитие атомистики Дальтоном. Введение в химию понятия об атомном весе Открытие закономерностей, определяющих соединение элементов, позволило английскому химику Дальтону разработать.
Содержание статьи1 Периодический закон и система элементов Д. И. Менделеева1.1 Что такое периодический закон1.2 Аналитическое выражение периодического закона в конце.
Теория химического строения Одновременно с появлением атомно-молекулярной теории Дальтона — Авогадро перед учеными встал вопрос о взаимном расположении атомов в.
Что такое закон кратных отношений Многие элементы могут соединяться друг с другом в нескольких различных весовых отношениях, но при этом.
Ключевое различие - атомная теория Дальтона против современной атомной теории
Атомная теория Дальтона - старейшая теория атома. В 1808 году Джон Далтон опубликовал свою теорию, состоящую из нескольких постулатов, построенных на основе его экспериментов и законов химического соединения. Позже ряд ученых внесли свой вклад в развитие современной атомной теории, которая отличается от атомной теории Дальтона и содержит более продвинутые факты об атоме и его поведении. Ключевое различие между атомной теорией Дальтона и современной атомной теорией состоит в том, что структура и свойства атома согласно теории Дальтона отличаются от структуры и свойств, предложенных современной атомной теорией.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое атомная теория Дальтона
3. Что такое современная атомная теория
4. Сравнение бок о бок - атомная теория Дальтона и современная атомная теория в табличной форме
5. Резюме
Что такое атомная теория Далтона?
Атомная теория Дальтона - это набор постулатов, предложенных для описания структуры и свойств атома. На развитие этой первой атомной теории повлияли такие факты, как растворение различных газов в воде в различных пропорциях, состав оксида олова с 88% олова, остальное - кислород, и т. Д. Затем Дальтон предложил следующие постулаты.
- Вся материя состоит из неделимых атомов.
- Атомы одного элемента идентичны друг другу по массе, размеру и форме.
- Атомы могут объединяться друг с другом в небольших целых числах.
- Атомы нельзя ни создать, ни уничтожить.
- Атом - это самая маленькая единица вещества, которая может принимать участие в химической реакции.
Эти постулаты, приведенные выше, не объясняют подробно структуру или свойства атома.
Что такое современная атомная теория?
Поскольку в атомной теории Дальтона было так много недостатков, ученые начали проводить больше экспериментов, чтобы объяснить точную структуру и свойства атома. Это привело к развитию современной атомной теории. Современная атомная теория указала на недостатки атомной теории Дальтона. Эти дефекты можно указать ниже.
- Атомы неделимы; они состоят из субатомных частиц.
- Могут быть неидентичные атомы одного и того же элемента. Их называют изотопами.
- Атомы не всегда объединяются в небольшом количестве. В полимерах большое количество атомов объединяется в молекулу.
- Атомы могут быть уничтожены делением (например, атомная бомба).
- Иногда в определенных реакциях участвуют субатомные частицы. (например: радиоактивный распад)
Помимо этого, современная атомная теория объясняет больше деталей об атоме и его поведении. Некоторые из этих деталей перечислены ниже.
- Атомы состоят из субатомных частиц, таких как электроны, протоны и нейтроны.
- Протоны и нейтроны вместе образуют ядро атома, где электроны находятся на орбиталях вокруг ядра, которое выглядит как облако.
- Орбитали, занятые электронами, являются уровнями энергии, которые указывают энергию определенного электрона.
- Эти энергетические уровни состоят из подуровней энергии.
- Основная характеристика, которую имеют все атомы одного и того же элемента, - это количество протонов. Атомы одного и того же элемента могут иметь разное количество электронов, называемых ионами, и разное количество нейтронов, называемых изотопами.
- Соединения могут состоять из одного и того же элемента или из разных элементов.
- Когда все элементы рассматриваются вместе, их атомы обладают периодически меняющимися свойствами.
В чем разница между атомной теорией Дальтона и современной атомной теорией?
Атомная теория Дальтона против современной атомной теории
Резюме - Атомная теория Дальтона против современной атомной теории
Несмотря на отсутствие хорошо оборудованных лабораторий, Дальтон смог построить теорию об атомах, невидимых для глаза. Это привело к развитию современной атомной теории, которая может объяснить почти все, что касается структуры и свойств атомов. Существует большая разница между атомной теорией Дальтона и современной атомной теорией, поскольку структура и свойства атома согласно теории Дальтона отличаются от структуры и свойств, предлагаемых современной атомной теорией.
Вы можете скачать PDF-версию этой статьи и использовать ее в автономных целях в соответствии с примечаниями к цитированию. Пожалуйста, загрузите PDF-версию здесь. Разница между атомной теорией Далтона и современной атомной теорией.
Атомная модель Далтона или Атомная теория Далтона, Это было предложение, представленное между 1803 и 1807 годами английским химиком и математиком Джоном Далтоном. Это было первое предложение концептуальной организации относительно структуры и функционирования атомов..
Модель Далтона также известна как сферическая модель, поскольку она предполагает тот факт, что атом является неделимой, твердой и компактной сферой. Благодаря этой модели стало намного проще дать объяснение химии остальному миру, и это стало основой для многих инновационных исследовательских проектов, которые последовали. Могли бы объяснить, почему вещества реагировали в определенных состояниях.
Согласно Далтону, материя состояла из минимальной единицы, называемой атомом, которую нельзя было ни разрушить, ни разделить. Эта единица, ранее предложенная Демокритом и его наставником Леучипо, была основой исследований Далтона и создания его атомной модели..
Используя эту атомную теорию, Джон Далтон попытался поднять идеи греческих философов о существовании атома (атомная теория вселенной), но используя в качестве платформы различные лабораторные эксперименты, которые позволили ему продемонстрировать свои идеи..
- 1 Постулаты атомной модели Далтона
- 1.1 Постулат 1
- 1.2 Постулат 2
- 1.3 Постулат 3
- 1.4 Постулат 4
- 1.5 Постулат 5
- 1.6 Постулат 6
- 2.1 Формула воды
- 2.2 Состав атомов
- 4.1 Предшественник атомных теорий
- 4.2 Он заложил основы современной химии
- 4.3 Сначала опубликовать таблицу химических весов
- 4.4 Дайте имя дальтонику
Постулаты атомной модели Далтона
![]()
Далтон сформулировал свою атомную модель с 6 постулатами, в которых он объясняет, как он основывал свои исследования и как он их проводил..
Постулат 1
![]()
На изображении выше представлено краткое изложение модели Далтона: атомы будут крошечными сферами, неразделимыми, неразрушимыми и однородными.
Первый постулат Дальтона гласил, что элементы состоят из крошечных частиц, называемых атомами, которые не могут быть разделены и не могут быть уничтожены.
Кроме того, Далтон заметил, что эти частицы не могут измениться ни в одной химической реакции..
Постулат 2
![]()
Второй постулат Дальтона установил, что все атомы, присутствующие в одном и том же элементе, имеют одинаковый вес, как и в других характеристиках..
С другой стороны, также установлено, что атомы разных элементов имеют разную массу. Из этого предложения возникло знание об относительных атомных весах, которые были продемонстрированы при сравнении различных элементов с водородом.
Постулат 3
![]()
Третий постулат Дальтона установил, что атомы неделимы, даже когда они объединены в химических реакциях. Также они не могут быть созданы или уничтожены.
Комбинация атомов, как равных, так и разных, будет генерировать более сложные соединения, но этот процесс не изменит тот факт, что атом является минимальной единицей вещества.
Постулат 4
![]()
Четвертый постулат Дальтона установил, что даже когда атомы объединяются в соединения, они всегда будут иметь отношение, которое может быть выражено в простых и полных числах. Это выражение не будет отображаться во фракциях, так как атомы неделимы.
Постулат 5
Пятый постулат Дальтона гласил, что существует возможная комбинация разных атомов в разных пропорциях для образования более чем одного соединения.
Таким образом, можно объяснить, что из конечного количества атомов произошла вся существующая материя во вселенной..
Постулат 6
Шестой и последний постулат Дальтона гласил, что каждое химическое соединение было создано из комбинации атомов двух или более различных элементов..
Ошибки атомной модели Далтона
Как и вся теория в мире науки, было много опровержений в отношении модели, предложенной Далтоном, которые были продемонстрированы на протяжении многих лет, оставляя позади инновационные идеи Далтона..
Формула воды
Примером этого является аргумент, приведенный Далтоном в отношении формулы воды, которая, по его словам, состоит из водорода и кислорода..
Из-за этого утверждения было много ошибок в расчете массы и веса некоторых основных соединений, которые были основаны на этой информации.
Несколько лет спустя европейские ученые Гай-Люссак и Александр фон Гумбодт опровергли эту информацию и доказали, что вода на самом деле состоит из двух атомов водорода и одного кислорода. Спустя 6 лет Амадео Авогадро указал точный состав воды и из-за этого существует Закон Авогадро.
Состав атомов
С другой стороны, в двадцатом веке был выявлен истинный состав атомов. В этом случае было показано, что существует меньшая единица, такая как протоны, электроны и нейтроны.
Точно так же возникло существование различных атомных весов, установленных в периодической таблице Менделеева и Мейера, существование изотопов и более специфические химические свойства..
выводы
Несмотря на его ошибки, вклад Джона Далтона имел большое значение в мире науки и вызвал сенсацию в его время из-за большого количества информации, которую он предоставил.
Ваш научный вклад все еще действителен и все еще изучается.
Атомная модель Дальтона десятилетиями не подвергалась сомнению из-за ее актуальности в мире науки и ее правильного объяснения исследованиям и гипотезам, которые были представлены в тот момент в истории науки..
Основной вклад Далтона
Его вклад в мир науки состоял главным образом в разъяснении и формулировании гипотез о природе с помощью количественных тестов..
Ученый умер от сердечного приступа 27 июля 1884 года в Манчестере и вскоре после этого получил почести от монархии..
Предшественник атомных теорий
Джон Далтон был английским химиком, математиком и химиком. Он родился 6 сентября 1766 года в Камберленде, Великобритания, и известен как один из предшественников атомных теорий с момента, когда он представил свою атомную модель..
Он заложил основы современной химии
Далтон известен как один из предшественников в создании таблицы относительных весов для химических элементов. Этот факт помог заложить основы того, что мы знаем сегодня как современная химия.
Сначала опубликовать таблицу химических весов
Далтон был первым ученым, который имел честь опубликовать таблицу атомных весов, включающую такие элементы, как водород, кислород, фосфор, углерод и сера. Благодаря этой публикации Далтон начал работать и формировать то, что будет его атомной моделью.
Дайте имя дальтонику
Следует отметить, что Далтон был одним из первых людей, у которых были проблемы со зрением, и у которых возникли проблемы с отображением цветов, и из-за него это состояние называется дальтонизмом..
Читайте также: