Аномальные свойства воды кратко
Обновлено: 05.07.2024
Люди привыкли к воде и считают ее обычным веществом. Они часто воспринимают ее как нечто само собой разумеющееся до тех пор, пока засуха не начнет угрожать посевам и запасам питьевой воды, или сильное наводнение не создаст угрозу жизни и имуществу. Многие не осознают, что структура воды и ее аномальные свойства обеспечивают существование жизни на Земле.
Один из ранних греческих философов, Фалес Милетский (640-546 гг. до н. э.), исследовал универсальный характер воды. Он считал ее основным элементом, из которого рождается все. Обилие воды было очевидным, но Фалес заметил, что она является единственным веществом, естественным образом присутствующим на Земле одновременно в трех разных состояниях: твердом, жидком и газообразном. В холодный зимний день снег и лед покрывают поля, рядом течет река, а над головой плывут облака.
Формы материи
Все вещества существуют в трех различных состояниях, которые зависят от температуры и давления. Твердые тела обладают определенной формой и имеют кристаллическую внутреннюю структуру. По этому определению вещество, подобное стеклу, будет считаться высоковязкой жидкостью, поскольку оно не обладает кристаллическим строением. Твердые тела склонны противостоять внешним воздействием. Они могут быть преобразованы в жидкость путем нагрева. Температура замерзания воды при давлении в 1 атмосферу равна 0 °С, ниже которой она существует в виде льда.
Жидкость, в отличие от твердого тела, не обладает твердостью и не имеет определенной формы. У нее есть объем, и она принимает форму сосуда, в котором хранится. Внешнее воздействие вынуждает ее течь. Вода представляет собой жидкость между температурами замерзания и кипения (100 °С). Жидкости могут переходить в газообразную фазу при нагреве выше точки кипения.
Газ не имеет ни формы, ни определенного объема. Он принимает форму и занимает объем сосуда, в котором находится. Газ расширяется и сжимается с изменением температуры и давления и способен легко диффундировать в другие газы.

Точки кипения и замерзания
Аномальными свойствами воды являются ее необычно высокие температуры кипения и замерзания по сравнению с другими соединениями с аналогичной молекулярной структурой. Другие подобные вещества в обычных условиях являются газами. Ожидается, что вода с ее более низкой молекулярной массой, чем аналогичные соединения, должна иметь более низкие температуры кипения и замерзания. Однако из-за полярной природы ее молекулы и водородных связей температура ее кипения равна 100 °C, а замерзания – 0 °C. Для сравнения, соответствующие значения у сероводорода H2S равны -60 °C и -84 °C, у селеноводорода H2Se этот показатель составляет -42 °C и -64 °C и у теллуроводорода -2 °C и -49 °C.
Твердая фаза
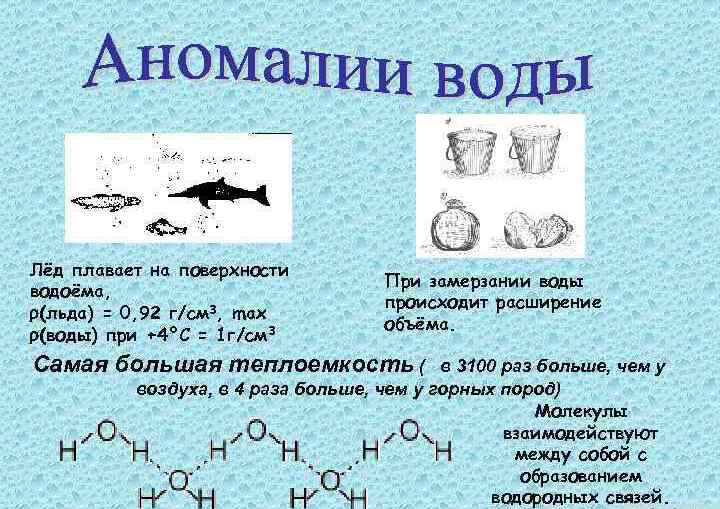
Как правило, с понижением температуры вещества становятся более плотными, и вода не является исключением. Ее плотность при 25 °C составляет 0,997 г/мл и увеличивается с до максимальной (1 г/мл) при T = 4 °C. В метрической системе измерения килограмм определяется как масса 1 л воды с максимальной плотностью. Между 4 °C и точкой замерзания 0 °C происходит удивительная вещь, которая наблюдается у очень небольшого числа веществ. Вода постепенно расширяется, становясь менее плотной. Плотность льда при 0 °C составляет около 0,917 г/мл. Молекулы воды образуют кристаллы в форме тетраэдра (четырехсторонней фигуры, каждая грань которой представляет собой равносторонний треугольник). Поскольку плотность твердой фазы меньше, чем жидкой, лед плавает. При замораживании объем воды увеличивается на 1%.
Очень важно, что лед расширяется и плавает на поверхности. Из-за этого зимой лопаются водопроводы и появляются выбоины на дорогах. Замерзание и таяние воды в значительной степени ответственно за разрушение скал и образование почв. Кроме того, если бы озера и потоки замерзали снизу вверх, то водная жизнь вообще перестала бы существовать, а климатические и погодные условия резко изменились.

Теплоемкость
Еще одним аномальным свойством воды является ее чрезвычайно высокая способность поглощать тепло без значительного повышения температуры. Например, летнее солнце на пляже нагревает песок до такой степени, что становится невозможно по нему ходить. Вода при этом остается прохладной. Оба вещества поглощают равное количество тепловой энергии, но температура песка выше. Пустой железный котелок, висящий над огнем, быстро раскалится докрасна, но если он заполнен водой, то его нагрев происходит постепенно. Высокая теплоемкость воды делает ее хорошей охлаждающей жидкостью в конденсаторах и автомобильных радиаторах, предотвращающих двигатели от перегрева. Ее значение в 5 раз превышает теплоемкость песка и примерно в 10 раз – железа.
Умеренный климат в прибрежных районах является результатом поглощения в течение дня огромного количества солнечной тепловой энергии водой и медленного высвобождения ее ночью. Внутренние районы вдали от побережья обычно испытывают гораздо более высокие экстремальные температуры. Огромные океаны на Земле (около 75% площади поверхности) отвечают за смягчение климата на нашей планете, поддерживая существование жизни.
Теплота плавления и испарения
С теплоемкостью связана теплота фазового перехода. Это количество тепловой энергии, поглощаемой или высвобождаемой веществом, которое изменяется в фазе (от жидкого до твердого состояния, или наоборот, и от жидкого до газообразного, или наоборот) без изменения температуры. Необычайно высокие значения удельной теплоты плавления (332,4 кДж/кг) и испарения (2256,2 кДж/кг) – очередные аномальные физические свойства воды. При замерзании выделяется такое же количество тепла, которое поглощается в процессе плавления.

Практическим примером использования удельной теплоты плавления воды является использование льда для охлаждения напитков в изолированном кулере. В процессе таяния лед поглощает тепловую энергию напитков, сохраняя их прохладными. Емкость с водой в теплице в холодную зимнюю ночь смягчит температуру в помещении из-за тепла, выделяемого при замерзании. Конденсация пара высвобождает то же количество тепла, которое поглощается в процессе испарения. Удельная теплота испарения в 5 раз превышает теплоту, необходимую для повышения температуры от 0 до 100 °C. Аномальное свойство воды хранить большое количество накопленной тепловой энергии делает паровое отопление эффективным. В процессе конденсации пар высвобождает накопленную тепловую энергию. Дневная гроза в жаркий летний день – еще один пример высвобождения тепловой энергии в верхних слоях атмосферы при конденсации горячего влажного воздуха. Даже ураган является примером влияния перераспределения огромного количества тепловой энергии, поглощенной тропическими океанами.
Системы испарительного охлаждения работают наоборот. Вода в процессе испарения поглощает тепловую энергию из воздуха, охлаждая его.
Универсальный растворитель
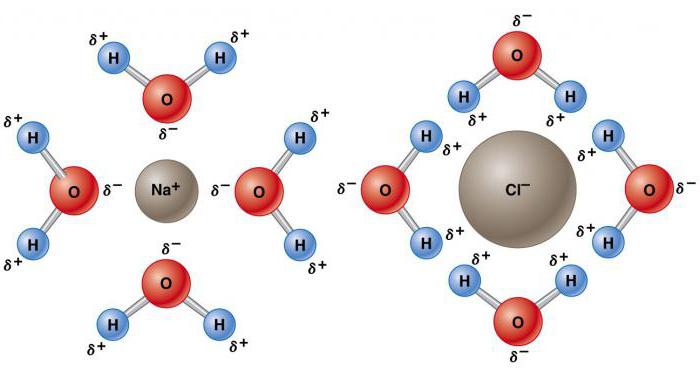
Растворитель способен растворять другое вещество с образованием гомогенной смеси (раствора) на молекулярном уровне. Еще одним аномальным свойством воды в химии благодаря ее полярной природе является ее способность растворять другие полярные соединения – соли, спирты, карбоксильные соединения и т. д. В воде растворяется больше веществ, чем в любом другом растворителе. В ней можно найти более половины известных химических элементов, некоторые в высоких концентрациях, а другие – только в следовых количествах. Например, концентрация насыщения хлорида натрия составляет около 36 г на 100 мл, а карбоната кальция – около 0,0015 г. Способность воды растворять вещество зависит от его химического состава, силы химических связей элементов, температуры и рН.
Неполярные соединения, в том числе большинство углеводородов, растворяются в низких или следовых количествах. Например, масла, как правило, плавают на поверхности воды.

Поверхностное натяжение
К аномальным свойствам воды относят и ее самое высокое (после ртути) поверхностное натяжение по сравнению с любой другой жидкостью. Это сила притяжения молекул, расположенных под поверхностью и тех, которые находятся на границе раздела жидкость-воздух. Она удерживает воду от растекания. Полярные соединения, как правило, имеют гораздо более высокое поверхностное натяжение, чем неполярные. И вода не является исключением. При 20 °С данный показатель равен 0,07286 Н/м (у этилового спирта – 0,0228 Н/м).
Без внешнего воздействия капля H2O принимает форму сферы, поскольку эта фигура обладает наименьшей площадью поверхности на единицу объема. Капли дождя являются крошечными пулями, которые при длительном воздействии разрушают горные породы. По этой же причине объекты, более тяжелые, чем вода, могут удерживаться на ее поверхности. Насекомые способны ходить по ней, а лезвие бритвы – плавать.
Водородная связь определяет аномальное свойство воды смачивать большинство поверхностей. Такие вещества считаются гидрофильными. Вода способна подниматься по стенкам стакана и других емкостей. Другие вещества, такие как масла, жиры, воск и синтетика (полипропилен и т. д.), не намокают. Они являются гидрофобными. Мембранные фильтровальные картриджи с размером пор менее 1 мкм изготавливают из гидрофобных полимеров с помощью смачивающих агентов, снижающих поверхностное натяжение воды, чтобы последняя могла проникнуть и оставаться в них. Это явление называется капиллярным эффектом. Он отвечает за движение воды в почве и по корням растений и крови по кровеносным сосудам.

Аномальные свойства воды и их значение для жизни
H2O является неотъемлемым компонентом существования всего живого. Это объясняет недавний интерес к обнаружению воды в других частях Вселенной. Все известные биохимические процессы происходят в водной среде. Большинство живых существ содержат 70–80% H2O по весу.
Кроме того, вода играет значительную роль в процессе фотосинтеза. Растения используют лучистую энергию солнца для превращения воды и углекислого газа в углеводы: 6CO2 + 6H2O + 672 ккал → C6H12O6 + 6O2. Фотосинтез – самая основная и важная химическая реакция на Земле. Он поставляет питательные вещества, прямо или косвенно, всем живым организмам и является основным источником атмосферного кислорода.
Аномальные свойства воды и их причины
Способность элементов формировать соединения зависит от способности их атомов отдавать или принимать электроны. Элементы первого типа становятся положительно заряженными ионами (катионами), а второго – отрицательно заряженными анионами.
Способность элемента взаимодействовать с другими элементами для образования соединений называется валентностью. Она соответствует количеству полученных или отданных электронов. Для неорганических соединений алгебраическая сумма валентных чисел элементов равна нулю. Электростатическое притяжение противоположно заряженных ионов с образованием соединения называется ионной связью.
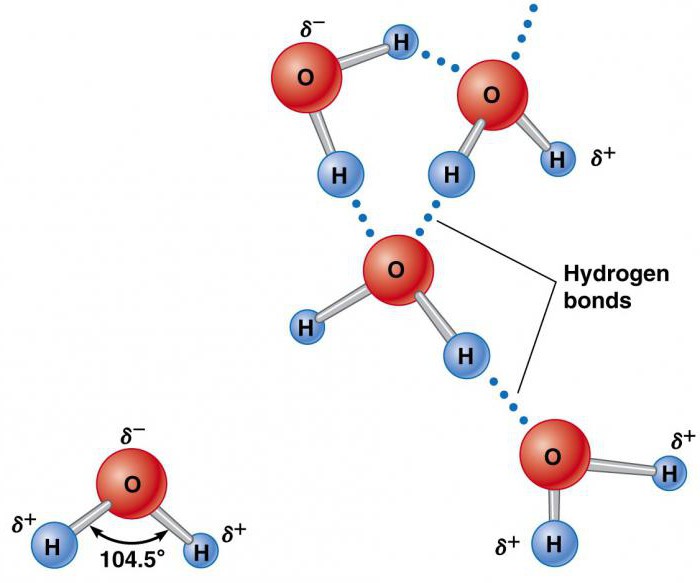
Элементы, которые образуют воду (водород и кислород), существуют отдельно в молекулах H2 и O2, содержащих по два атома. Они удерживаются вместе благодаря обмену электронной парой в химической связи, называемой ковалентной. Она намного сильнее ионной. Два атома, удерживаемые вместе ковалентной связью, образуют намного более устойчивую молекулу, чем ее составные части. В ней водород объединяется кислородом посредством общих электронных пар. Это уникальное распределение электронов в образованном химическом соединении заставляет атомы H располагаться по отношению к O под углом 104,5°.
Аномальные физические свойства воды объясняются ее структурой и химической связью.
Атом кислорода оказывает относительно сильное воздействие на общую пару электронов, в результате чего атомы водорода становятся электроположительными, а атом кислорода – электроотрицательной областью. Поскольку положительно и отрицательно заряженные участки распределены неравномерно по отношению к центральной точке, молекула воды является полярной.
Такая ее природа заставляет ее становиться электростатически привлекательной для других молекул H2O, а также ионов и контактных поверхностей с заряженными участками. Электроположительные атомы водорода притягиваются к электроотрицательным атомам кислорода соседних молекул воды. Это явление называется водородной связью. Ее прочность составляет всего около 10% ковалентной, но она отвечает за большинство аномальных физических свойств воды. К ним относятся высокие температуры замерзания и кипения, теплоемкость, удельная теплота плавления и испарения, растворимость и поверхностное натяжение.
Водородная связь отвечает за поддержание целостности молекулы H2O во время химических реакций. В то время как другие соединения подвергаются ионизации, сама вода сохраняет свою химическую целостность. Лишь относительно небольшое число молекул ионизируется в водород и гидроксильные ионы. Поэтому H2O является относительно плохим проводником электрического тока. Специфическое сопротивление теоретически чистой воды составляет 18,3 МОм∙см, в то время как питьевая имеет удельное сопротивление менее 10 000 Ом∙см. Таким образом можно легко проверить чистоту H2O.
Аномальные свойства воды объясняются наличием водородных связей, из-за которых имеет место низкая плотность льда. Вдоль них при замерзании располагаются молекулы, что приводит к расширению вещества. По этой причине лед плавает на поверхности воды. Повышенное давление снижает температуру плавления. Давление, создаваемое лезвием конька, топит лед, создавая слой, обеспечивающий изящное скольжение. Даже при чрезвычайно низких температурах высокое давление ослабляет кристаллическую решетку. Это является причиной того, что огромные ледяные массы, такие как ледники, постепенно движутся.
Дипольный момент
Полярная природа молекулы воды заставляет ее ориентироваться в электрическом или магнитном поле. Электроотрицательный атом кислорода выстраивается к положительному полюсу, а электроположительные атомы водорода – в направлении отрицательного. Вода имеет исключительно большой дипольный момент, представляющий собой произведение расстояния между зарядами, умноженное на величину заряда.
Диэлектрическая проницаемость является еще одним свойством, связанным с дипольным моментом. Молекулы воды путем выравнивания в электрическом поле стремятся нейтрализовать его и создать устойчивость к передаче электростатического заряда. Диэлектрическая проницаемость вещества определяется ε в уравнении F = Q1∙Q2/ε∙r 2 , где F – сила между двумя зарядами Q, разделенная расстоянием r в среде.
По мере увеличения диэлектрической проницаемости сила между зарядами уменьшается. Высокая диэлектрическая постоянная уменьшает силу притяжения ионов, что объясняет аномальные химические свойства воды растворять самые разнообразные вещества.
Заключение
Для людей вода – это обычное вещество, которое часто принимается как должное. Несмотря на то что аномальные свойств воды объясняются на атомном уровне, ее значение действительно велико. Очевидно, что она необходима для существования жизни на Земле. Аномальные свойства воды, кратко говоря, позволяют ей служить медиатором химических и биохимических процессов, формировать нашу природную среду и участвовать в создании климата и погоды.

Интересные факты
Мы редко задумываемся над смыслом слова "вода". На нашей планете более 70 % от всей площади занимают реки и озера, моря и океаны, айсберги, ледники, болота, снега на вершинах гор, а также вечная мерзлота. Несмотря на такое огромное количество воды, для питья пригоден только 1 %.

Биологическое значение
Нет такой системы в живом организме, которая бы могла функционировать без H2O. Несмотря на аномалии воды, она является эталоном для определения количества теплоты, массы, температуры, высоты местности.

Основные понятия
H2O — оксид водорода, в котором содержится 11,19 % водорода, 88,81% кислорода по массе. Это бесцветная жидкость, которая не имеет ни запаха, ни вкуса. Вода является обязательным компонентом технологических процессов в промышленности.
Впервые данное вещество было синтезировано в конце 18 века Г. Кавендишем. Ученый взрывал смесь кислорода и водорода электрической дугой. Впервые проанализировал разницу в плотности льда и воды в 1612 году Г. Галилей.
В 1830 году была создана паровая машина французскими учеными П. Дюлонгом и Д. Араго. Это открытие позволило изучить взаимосвязь между давлением насыщенного пара и температурой. В 1910 году американским ученым П. Бриджменом и немцем Г. Тамманом обнаружено несколько полиморфных модификаций у льда при высоком давлении.
В 1932 году американскими учеными Г. Юри и Э. Уошберном была открыта тяжелая вода. Аномалии физических свойств данного вещества были открыты благодаря совершенствованию аппаратуры и методов проведения исследований.
Некоторые противоречия в физических свойствах
Чистая вода является прозрачной бесцветной жидкостью. Ее плотность при превращении в жидкость из твердого вещества возрастает, в этом проявляется аномалия свойств воды. Нагревание ее от 0 до 40 градусов приводит к росту плотности. В качестве аномалии воды необходимо отметить высокую теплоемкость. Температура кристаллизации составляет 0 градусов по Цельсию, а кипения — 100 градусов.
У молекулы этого неорганического соединения угловое строение. Ядра, входящие в ее состав, формируют равнобедренный треугольник, в основании которого располагаются два протона, а вершиной является атом кислорода.
Аномалии плотности
Ученым удалось выявить порядка сорока особенностей, характерных для H2O. Аномалии воды заслуживают пристального рассмотрения и изучения. Ученые пытаются пояснить причины каждого фактора, дать ему научное объяснение.
Аномалия плотности воды заключается в том, что у данного вещества свое максимальное значение плотность начинается при +3,98°С. При последующем охлаждении, переводе из жидкости в твердое состояние наблюдается уменьшение плотности.
Для остальных соединений плотность в жидкостях при уменьшении температуры снижается, так как увеличение температуры способствует росту кинетической энергии молекул (растет скорость их передвижения), что приводит к повышенной рыхлости вещества.
Рассматривая подобные аномалии воды, необходимо отметить, что и для нее при повышении температуры свойственен рост скорости, но плотность понижается только при повышенных температурных значениях.
После уменьшения плотности льда он будет находиться на поверхности воды. Объяснить данное явление можно тем, что молекулы имеют в кристалле регулярное строение, имеющее пространственную периодичность.
Если у обычных соединений молекулы упакованы в кристаллах плотно, то после плавления вещества, регулярность пропадает. Подобное явление наблюдается только при расположении молекул на значительных расстояниях. Уменьшение плотности при плавлении металлов является ничтожно малой величиной, оценивается в 2-4 %. Плотность воды превышает аналогичный показатель у льда на 10 процентов. Таким образом, это и есть проявление аномалии воды. Химия объясняет подобное явление дипольным строением, а также ковалентной полярной связью.

Аномалии сжимаемости
Продолжим разговор об особенностях воды. Для нее характерно непривычное температурное поведение. Ее сжимаемость, то есть уменьшение объема, по мере повышения давления вполне можно считать примером аномалии физических свойств воды. Конкретно какие особенности здесь необходимо отметить? Другие жидкости гораздо проще сжать под давлением, а вода приобретает такие признаки только при высоких температурах.
Температурное поведение теплоемкости
Данная аномалия является одной из сильнейших для воды. Теплоемкость говорит о том, какое необходимо затратить количество теплоты для того, чтобы повысить температуру на 1 градус. Для многих веществ после плавления теплоемкость жидкости увеличивается не больше чем на 10 процентов. А для воды после плавления льда данная физическая величина возрастает в два раза. Ни у одного вещества подобного роста теплоемкости не зафиксировано.
Во льду та энергия, которая подводится к нему для нагревания, расходуется в большей части на рост скорости движения молекул (кинетическую энергию). Существенный рост после плавления теплоемкости свидетельствует о том, что в воде происходят иные энергоемкие процессы, для которых нужно подводимое тепло. Именно они и являются причиной повышенной теплоемкости. Данное явление характерно для всего диапазона температур, при котором вода имеет жидкое агрегатное состояние.
Как только она превращается в пар, аномалия пропадает. В настоящее время многие ученые занимаются анализом свойств переохлажденной воды. Оно заключается в ее возможности сохранять жидкое состояние ниже точки кристаллизации 0°С.
Переохладить воду вполне можно в тонких капиллярах, а также в неполярной среде в качестве мельчайших капелек. Возникает закономерный вопрос о том, что наблюдается с аномалией плотности в подобной ситуации. По мере переохлаждения плотность воды существенно снижается, она стремится к плотности льда при понижении температурного значения.

Причины появления
Появляются они между молекулами данного неорганического соединения благодаря особенностям распределения плотности электронов. Атомы водорода обладают определенным положительным зарядом, а кислорода — отрицательным. В итоге молекула воды имеет форму правильного тетраэдра. Подобное строение характеризуется валентным углом 109,5°. Самым выгодным расположением является размещение по одной линии кислорода и водорода, имеющих разный заряд, следовательно, водородная связь характеризуется электростатической природой.
Итак, необычные (аномальные) свойства воды являются следствием особенного электронного строения ее молекулы.

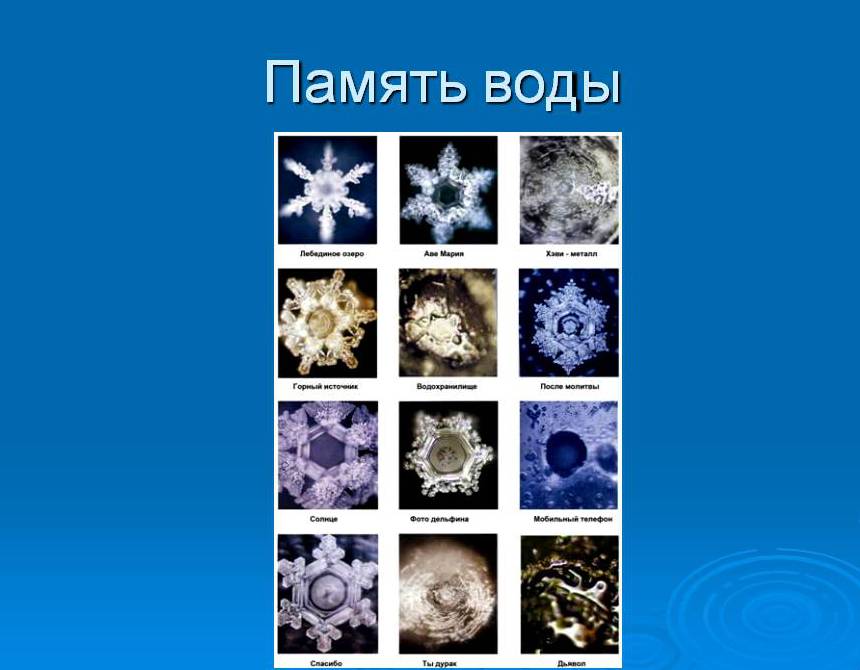
В рамках эксперимента Масау Эмото воздействовал на воду разными способами, потом заново ее замораживал, вел фотосъемку. Ему удалось получить зависимость между формой кристаллов льда и музыкой, которую "слушала" вода. Удивительно, но самые гармоничные снежинки ученый зафиксировал при использовании классической и народной музыки.
Использование современной музыки, по мнению Масау, "загрязняет" воду, поэтому им были зафиксированы кристаллы неправильной формы. Интересным фактом является и выявление японским ученым зависимости между формой кристаллов и человеческой энергией.

Вода - это самое удивительное вещество, которое содержится в большом количестве на нашей планете. Сложно представить себе какие-либо сферы деятельности современного человека, в которых бы она не принимала активное участие. Многогранность данного вещества определяется аномалиями, причиной которых стало тетраэдрическое строение воды.





Аномальные свойства воды

Автор работы награжден дипломом победителя III степени
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке "Файлы работы" в формате PDF
Люди привыкли к воде, и считают ее обычным веществом. Многие не осознают, что структура воды и ее аномальные свойства обеспечивают существование жизни на Земле.
Обоснование выбора темы: с водой мы сталкиваемся ежедневно, и она занимает важнейшее место в нашей жизни. С одной стороны - нет ничего более простого и доступного на планете, как вода, с другой – более загадочного и уникального.
Цель исследования: выяснить причины уникальности воды; при проведении физико-химических опытов, доказать, что вода необычное вещество.
~ изучить и проанализировать литературу и информацию в Интернете по данной теме;
~ провести наблюдения за основными состояниями воды, её физическими свойствами;
~ определить и выделить удивительные свойства воды;
~ провести эксперименты и опыты, доказывающие уникальность воды;
~ понаблюдать, как человек использует необычные свойства воды;
Объект исследования: вода.
Предмет исследования: свойства воды, присущие только ей и неочевидные в природе.
Гипотеза: мы предположили, что аномальные свойства воды можно доказать в домашних условиях.
Методы исследования:
~ анализ литературы и других источников;
Актуальность заключается в практической значимости уникальности воды на современном этапе развития науки и техники. Проект реализуется в рамках химии и физики и может быть квалифицирован как экспериментально-информационный.
Глава № 1. ВОДА В ПРИРОДЕ
Вода входит в состав всех живых и растительных организмов. Вода присутствует не только в организме всех живых существ нашей планеты, но и во всех веществах на Земле – в минералах и горных породах.
Вода находится в постоянном и активном круговороте. Его движущей силой является Солнце, а основным источником воды - Мировой океан. Увлажняющая почву вода всасывается корнями растений. Вместе с водой растения получают растворенные питательные вещества. В растениях она поднимается по стеблям и возвращается в виде пара, в атмосферу через листья.
Вода в естественных природных условиях может существовать в трех агрегатных состояниях: твёрдое – лёд; жидкое – вода; газообразное - водяной пар. Один из ранних греческих философов, Фалес Милетский (640-546 гг. до нашей эры), исследовал универсальный характер воды. Он считал ее основным элементом, из которого рождается все. Обилие воды было очевидным, но Фалес заметил, что она является единственным веществом, естественным образом, присутствующим на Земле одновременно в трех разных состояниях: твердом, жидком и газообразном. В холодный зимний день снег и лед покрывают поля, рядом течет река, а над головой плывут облака.
Глава № 2. УДИВИТЕЛЬНЫЕ СВОЙСТВА ВОДЫ
§ 1. Химическая формула воды. Физические свойства воды
Вода - это простейшее химическое соединение двух атомов водорода и одного атома кислорода: H2O. Из химических свойств воды особенно важна способность воды растворять вещества разной химической природы. Она удивительно легко растворяет большое количество самых разнообразных веществ и газов и, что тоже весьма важно, так же легко их отдает.
Физические свойства воды – это свойства, которые проявляются вне химических реакций. Основными физическими свойствами воды являются – запах, цвет, прозрачность, вкус, плотность, температура, жесткость, вязкость, структура.
§ 2. АНОМАЛЬНЫЕ СВОЙСТВА ВОДЫ
Многие физические и химические свойства воды удивляют и выпадают из общих правил и закономерностей и являются аномальными. Отдельные свойства воды не соответствуют многим принципам физики и химии. Рассмотрим некоторые уникальные свойства воды.
Горячая вода застывает быстрее холодной
При замерзании вода увеличивается в объеме
В большинстве случаев при замерзании молекулы веществ располагаются ближе друг к другу, структура их становится компактнее и плотнее. Но с водой эта схема не работает. Плотность воды, при переходе ее из твердого состояния в жидкое, не уменьшается, как почти у всех других веществ, а возрастает. При замораживании объем воды увеличивается на 1%, но при этом становится не такой плотной, поэтому лед всегда легче воды, и находится на ее поверхности. Если бы озера замерзали снизу вверх, то водная жизнь вообще перестала бы существовать, а климатические и погодные условия резко изменились.
Вода – уникальный растворитель
К аномальным свойствам воды относят и ее самое высокое (после ртути) поверхностное натяжение по сравнению с любой другой жидкостью. Молекулы воды активно притягиваются друг к другу, в результате ее поверхность, стремится к минимуму. Именно поэтому естественной формой любой жидкости является шар. Объекты, более тяжелые, чем вода, могут удерживаться на ее поверхности. Насекомые способны ходить по ней, а лезвие бритвы или игла – плавать.
§ 3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Те аномальные свойства воды, которые мы описали выше, попробуем проверить в домашних условиях.
Опыт № 1. Проведем эксперимент и понаблюдаем за горячей и холодной водой в морозильной камере.
Условия: В ячейки для льда я налила теплую воду 35 ° С и поставила в морозильную камеру, засекла время превращения воды в лёд. Тоже самое проделала с холодной водой – 0,5 ° С.
Результат: тёплая вода превратилась в лед через 20 минут; холодная вода превратилась в лед через 25 минут. Для опыта необходима вода определенной температуры.
Вывод: горячая вода замерзает быстрее, чем холодная при определенных условиях.
Опыт № 2. В ходе работы над проектом я обратила внимание, что вода может перемещаться самостоятельно.
Вывод: вода может подниматься вверх без посторонней помощи (приложение № 2) Это удивительное свойство помогает растениям получать влагу из почвы и перемещать от корней по стеблям к листьям.
Опыт № 3. Я задумалась, а какая вода быстрее будет подниматься вверх?
Условия: Я взяла 2 стакана: № 1 - с теплой водой и № 2 - с холодной водой; две полоски картона, один конец которых окрашен в разные цвета маркерами; опустила концы полосок картона в стаканы.
Результат: Краски маркера на полоске в тёплой воде поднялись вверх быстрее и выше, чем в холодной.
Вывод: теплая вода поднимается вверх быстрее холодной (приложение № 3). Теперь мне понятно, почему растения нужно поливать теплой водой, она доставит необходимые питательные вещества из почвы и живительную влагу быстрее.
Опыт № 4. Горку можно соорудить практически из чего угодно — и песка, соли, сахара. А можно ли сделать неподвижную горку из воды?
Условия: Я взяла хорошо вымытый сухой стакан, наполнила его водой до отказа, после чего аккуратно опускала в него по одной монете.
Результат: По мере опускания монет в стакан, вода из него не выливалась, а начала понемногу приподниматься, образуя горку. Это хорошо заметно, если посмотреть на стакан сбоку. По мере увеличения в стакане количества монет, горка становилась всё выше - поверхность воды надулась, словно воздушный шарик. Однако, в какой-то момент этот шарик лопнул, и вода струйками потекла по стенкам стакана. В этом опыте горка на поверхности воды образуется за счёт поверхностного натяжения.
Вывод: Взаимодействуя с твёрдой поверхностью, вода плохо к ней прилипает и плохо растекается. Именно поэтому она не стекает сразу же через край стакана при образовании горки (приложение № 4).
Опыт № 5. А можно ли управлять плавающими на поверхности предметами, при этом ничем их не касаясь.
Условия: В миску, наполненную водой, аккуратно положила 10-12 спичек. Расположила их в форме лучей звезды, по возможности равномерно. Взяла жидкое мыло и капнула в воду в центре спичечной звезды.
Результат: Спички тут же начали плыть от него к краям блюдца.
В другой миске вместо мыла опустила в центр спичечной звезды кончик кусочка сахара-рафинада.
Результат: Спички, наоборот, поплыли в обратном направлении и собрались возле погружённого в воду сахара.
Вывод: Такое поведение спичек обусловлено следующим: погружая в воду разные вещества (мыло и сахар), мы тем самым изменяем силу поверхностного натяжения. Когда капаешь мыло на поверхность жидкости, оно растворяется и смешивается с ней. Молекулы мыла проходят между молекулами воды и снижают их взаимное притяжение. Сахар действует противоположно мылу - он увеличивает поверхностное натяжение. (приложение № 5).
Опыт № 6. Следующий опыт показал, что поверхность воды может растягиваться. Как вы думаете, сколько капелек воды поместится на обычной монетке?
Условия: Я положила монетку на блюдце, а блюдце - на очень ровную поверхность. В пипетку набрала воды, капнула воду в центр монетки с очень близкого расстояния.
Результат: Опытным путем мной установлено, что на 2-х рублевой монетке помещается 20 капель воды, а на 5-ти рублевой - 28 капель. Вода на монете располагается не ровным тонким слоем, как это может показаться перед экспериментом, а образует горку. Поверхность воды растягивается и становится все более выпуклой с каждой новой каплей до тех пор, пока тонкая пленка, которую образует поверхность воды, не порвется. И тогда почти вся вода с монетки вытечет в блюдце
Вывод: Поверхность воды растягивается за счет поверхностного натяжения (приложение № 6).
Опыт № 7. В предыдущем опыте мы убедились, что поверхность воды похожа на тонкую пленку, которая может растягиваться. Теперь мы сможем рассмотреть эту пленку, и увидеть, что она может не только удерживать воду внутри, но и не дает утонуть относительно тяжелым предметам и прогибаться под их весом.
Условия: Я налила воду в стакан, взяла иголку и, держа ее горизонтально, поднесла максимально близко к поверхности воды и опустила.
Результат: Иголка плавает и можно будет рассмотреть, как поверхность воды прогибается под ее весом.
Вывод: Поверхностное натяжение воды позволяет удерживать на поверхности достаточно тяжелые предметы (приложение № 7).
Опыт № 8. В холодное время года наши квартиры теплые благодаря паровому отоплению. А почему в батареях именно вода?
Условия: Я поставила металлический ковш на плиту. Через 10 секунд его нельзя взять в руки - он раскален, так как металл нагрелся. В этот же ковш нальем стакан воды и поставим на плиту. Доводим до кипения, на это нужно уже больше времени. Переливаем горячую воду из ковша в стакан с ложкой.
Результат: Через десять минут металлический ковш остыл, а стакан стал очень горячим. Вода нагрела ложку и стенки стакана.
Вывод: У воды есть свойство долго удерживать тепло. Поэтому в батареях именно вода, ну и, конечно, вода самое доступное текучее вещество (приложение № 9).
Опыт № 9. Вода имеет свойство менять плотность при переходе в твердое состояние. Так ли это на самом деле?
Условия: Я взяла стеклянную бутылку, налила воду и поместила её в морозильную камеру холодильника.
Результат: вода замерзла и расширилась, её объём увеличился и бутылка растрескалась.
Вывод: Вода при низких температурах превращается в лед и при этом расширяется (приложение № 10).
Опыт № 10. Логично было бы предположить, что замерзая, вода, как и любое другое вещество становится тяжелее.
Условия: Кусочек льда я опустила в стакан с водой.
Результат: Лед плавает на поверхности и не тонет.
Вывод: Замерзая, вода увеличивается в объеме, но структура становится более рыхлой. Поэтому лед, легче самой воды, он плавает на поверхности и не тонет.
Опыт № 11. Приведем еще один интересный опыт, который продемонстрирует теплопроводность воды.
Условия: В воздушный шарик я налила холодную воду и немного надула. Поднесла шарик к горящей свече.
Результат: Воздушный шар не лопнул, так как в нем вода. Надуваем другой воздушный шарик и подносим к огню, он лопнул.
Вывод: Теплопроводность воды в 24 раза выше, чем у воздуха. Пока вода не испарится в шарике, он не лопнет (приложение № 12).
Опыт № 12. Жидкости, имеющие разную плотность – не смешиваются.
Условия: В стакан я поочерёдно налила жидкости разной плотности и цвета (растительное масло и воду).
Результат: они не смешиваются.
Вывод: Водородная связь определяет аномальное свойство воды смачивать большинство поверхностей. Такие вещества считаются гидрофильными. Другие вещества, такие как масла, жиры, воск и синтетика не намокают. Они являются гидрофобными. Разная плотность не дает смешиваться молекулам воды и масла (приложение № 13) .
Объект моего исследования – вода - кажется будничным и естественным, только на первый взгляд. Исследование позволило мне сделать вывод, что многие свойства воды, присущи только ей, они обязательно встречаются в природе, но они совсем не так очевидно представляются глазам наблюдателя, как в наших опытах. На основе опытов, мы доказали уникальность воды, как химического вещества, а физические свойства воды действительно обусловлены особенностями ее строения. Гипотеза, что аномальные свойства воды можно доказать в домашних условиях – подтвердилась.
В данной работе были рассмотрены такие уникальные свойства воды, как высокая теплоёмкость, плотность, теплопроводность, конвекция или перемешивание, поверхностное натяжение.
~ опытным путём рассмотрены различные свойства воды, являющиеся уникальными, как физико-химического вещества;
~ экспериментально установлено, что физические свойства воды действительно обусловлены особенностями ее строения. На основе это, было доказана уникальность воды, как химического вещества.
В ходе работы над проектом я научилась самостоятельности, у меня появился интерес к предметам физика и химия, которые мне еще только предстоит изучать, развились исследовательские умения и навыки, например, умение пользоваться дополнительной литературой, думать, рассуждать, делать выводы.
Список использованной литературы
1. Вода для жизни. Сбережем воду – сохраним жизнь. / авт.-сост. А. Н. Пахоменко и др. – Могилев: Могилев. обл. укруп. тип,
2. Врублевский А. И. Основы химии. Школьный курс. – 2-е изд. – Мн.: Юнипресс, 2010г. – 960 с.
3. Глинка Н. Л. Общая химия: учеб. пособие для вузов. – 23-е изд., испр. /Под ред. В. А. Рабиновича. – Л.: Химия, 1983г. – 704 с.
4. Энциклопедический словарь юного физика - М.: Педагогика, 1981
Справа – стакан с водой +35 °C, слева – стакан с водой - 0, 5 °C
Горячая вода начала превращаться в лед через 20 минут, холодная через 25 минут
средний стакан пустой, в двух крайних стаканах – вода
вода по бумажным мостикам перешла в средний стакан
картонную полоску с отметкой черного цвета опускаем в стакан с холодной водой, с отметкой коричневого цвета – в стакан с теплой водой

Про общие физические и химические свойства воды, мы писали в нашем материале – ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ В ЖИДКОМ СОСТОЯНИИ ( читать → ).
В этом материале, мы кратко перечислим основные аномальные свойства воды.
Температура замерзания и кипения
Температуры замерзания и кипения воды не соответствуют общим закономерностям и законам химии. Так мы знаем, что вода в реальной жизни замерзает при 0°C, а кипит при 100°C, в то время как в соответствии с общими правилами химии эти процессы должны проходить при -90°C (минус девяносто) и -70°C (минус 70) соответственно.
Уникальные термические свойства воды
Вода имеет уникальную по своей величине аномальную теплоемкость равную 4,18 кДж (кг-К). Это означает, что вода медленно охлаждается и медленно нагревается.
Вода является эффективным регулятором температур, она ограничивает резкие перепады температур. Более подробно с этим ее свойством вы можете ознакомиться в нашей статье – УДЕЛЬНАЯ ТЕПЛОЁМКОСТЬ ВОДЫ, ИЛИ ПОЧЕМУ МЫ ТАКИЕ, КАК ЕСТЬ …
Температурная яма
Как мы видим, температура человеческого тела 36,6 °C близка к этому значению.
Аномальное свойство воды — эффект Мпембы
Удивительно, но факт – горячая вода замерзает быстрее холодной, что противоречит логике и общему восприятию вещей.
Аномальные свойства воды при температуре + 3,98 ° по Цельсию
Как мы уже отметили выше, температура + 3,98 °C, является для воды важным значением. При понижении температуры до этого уровня вода ведет себя в соответствии с общими законами и правилами этих наук. При дальнейшем понижении температуры у воды начинают проявляются ее аномальные свойства.
При температуре + 3,98 °C у воды плотность имеет наибольшее значение, а объем наименьший.
Аномальные свойства воды при замерзании — объём и плотность
Еще одним важным для всех нас является ее аномальное свойство при замерзании увеличиваться в объеме, тем самым уменьшая свою плотность. Уточним, что до + 3,98 °C вода ведет в соответствии с общими законами химии и физики, а далее проявляются ее аномальные свойства.
Поверхностное натяжение воды
Еще одним удивительным и во многом аномальным свойством воды является ее поверхностное натяжение.
Хорошо всем известный пример демонстрирует, как аккуратно положенная на воду металлическая швейная игла плавает на ее поверхности, что во многом удивительно. Ведь плотность метала гораздо больше плотности воды.
Вся жизнь на Земле своим существованием во многом обязано именно этому свойству воды.
Вода — отличный растворитель
Вода является отличным растворителем, она удивительно легко растворяет большое количество самых разнообразных веществ и газов. И что тоже весьма важно, так же легко их отдает. Например, благодаря именно этому свойству после дождя мы чувствуем удивительную свежесть – дождь очищает воздух.
Вода и магнитное поле
Под воздействием магнитного поля у воды меняется ее способность к растворению веществ, изменяется скорость, проходящих в ней, химических реакций.
Заключение
Аномальные свойства воды еще раз подтверждают общеизвестное высказывание — удивительное рядом с нами.
Аномальные свойства воды, или удивительное всегда рядом с нами

2 комментария к “Аномальные свойства воды, или удивительное всегда рядом с нами”
Однако наличие водородной связи у воды — это всего лишь необходимое, но не достаточное условие для объяснения необычных свойств воды. Самым важным обстоятельством, объясняющим основные свойства воды, является структура жидкой воды как целостной системы.
… правильное :) утверждение — вода целостная система …
Оставьте комментарий
Поделись с друзьями :)
Рубрики сайта
Публикации
Публикации
Поиск по сайту
Политика конфиденциальности / Условия и положения использования сайта - Privacy policy / Terms and conditions
Администрация ресурса может не разделять мнение автора. При подготовке материалов информация берётся из общедоступных источников и специальной проверки на достоверность не проходит.
Администрация сайта радикально негативно относится к нарушениям авторских или каких либо других имущественных прав. Поэтому, если Вы вдруг обнаружили, что на страницах нашего сайта нарушены, какие либо авторские или имущественные права, просим вас незамедлительно, воспользовавшись формой обратной связи, сообщить нам про это. После получения подтверждения нарушения мы незамедлительно устраним его.
На сегодняшний день ученые выделяют 66 необъяснимых свойств воды. Наиболее удивительные свойства: изменяющаяся плотность, высокая теплоемкость и большое поверхностное натяжение.

Если бы вода не обладала всеми этими свойствами, то жизнь на Земле была бы намного суровее, чем сейчас, а возможно ее вообще бы не было.
Точно доказано, что если бы вода не могла бы менять плотность при понижении температуры, то все реки и озера промерзали бы до дна. Никакой жизни под водой, естественно, при этом не могло бы.
Только вода, в отличие от других жидкостей, имеет максимальную плотность только при 4 градусах Цельсия. А при дальнейшем понижении плотность воды вновь начинает убывать. В итоге вода в озерах и реках никогда не промерзает до дна.
Высокая теплоемкость воды не только позволяет нам обогреваться с помощью батарей зимой, но и согревать целые континенты. Ведь именно океанские течения приносят с южных регионов то тепло, которые позволяет согревать северные регионы, и делают возможным жить там.
Такое свойства, как высокое поверхностное натяжение дают возможность расти деревьям на нашей планете. Если бы вода не обладала этим аномальным свойством, то никакие питательные вещества не могли бы поступать к кронам деревьев, в особенность гигантских.
Таким образом, вода обладает целым набором удивительных свойств, которые не применимы к каким-либо другим жидкостям. Однако все эти свойства имеют совершенно понятный и значимый смысл для всего живого на нашей планете.
Все, что связано с уникальными свойствами воды, напоминает фокусы, которые исполняет иллюзионист. Мы не знаем, как он это делает, но не видим никакого обмана. Все кажется вполне логичным, четким и понятным, однако повторить мы никогда не сможем.
С водой тоже все просто, но ни одна жидкость не может повторить того, что может обыкновенная вода.
Читайте также:

