Соединение галогенов конспект кратко
Обновлено: 06.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Конспект урока будет удобен на уроке химии для 9 класса, здесь есть цель и задачи, все этапы урока соблюдены, организационный момент, приветствие, мотивация к учебной деятельности, приветствие, актуализация опорных знаний, открытие нового. Познакомить учащихся с соединениями галогенов. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы, продолжить развитие умений выделять главное, сравнить строение атомов галогенов.
Дать характеристику физическим свойствам галогенов.
Дать характеристику химическим свойствам галогенов.
Познакомить с областями применения галогенов, их роли в работе организма человека.
Конспект урока по химии для 9 класса на тему: Соединения галогенов
Цель – Познакомить учащихся с соединениями галогенов
Задачи урока: Познакомить учащихся с соединениями галогенов. Развивать внимание, память, речь, аналитическое мышление, способность делать выводы, продолжить развитие умений выделять главное, сравнить строение атомов галогенов.
Дать характеристику физическим свойствам галогенов.
Дать характеристику химическим свойствам галогенов.
Познакомить с областями применения галогенов, их роли в работе организма человека.
I.Организационный этап. Мотивация к учебной деятельности .
Учитель: - Учебник на столе у вас?
А ручки и тетрадки?
Тогда урок начнём сейчас,
Раз всё у вас в порядке.
Чтобы литературные тайны познавать,
Нужно всё серьёзно изучать.
- проверка готовности класса к уроку:
Я рада новой встрече с вами,
Приятно ваше общество, друзья!
Ответы ваши вы готовьте сами,
Их с интересом буду слушать я.
Мы сегодня снова будем читать,
Выводы делать и рассуждать.
А чтобы урок пошёл каждому впрок
Активно включайся в работу, дружок!
Вот книжки на столе,
Не хочется играть
Сегодня в прятки
Сегодня в классе у ребят
Урок очень важный
А почему он важный –
Добрый день, мои друзья,
Встрече с вами рада я.
Сели ровно, все достали,
Вспоминаем все, что знали,
Оставляем все заботы
И включаемся в работу.
II. Актуализация знаний учащихся.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
1. Рассчитайте массу 1 л фтора и хлора при н. у. Найдите их относительную плотность по водороду и воздуху.
2. Растворы хлора, брома и иода в воде соответственно называют хлорной, бромной и йодной водой. Почему нет фторной воды?
3. Проведите аналогию между реакциями щелочных металлов и фтора с растворами солей.
4. Рассчитайте степени окисления атомов химических элементов в следующих соединениях: КСlO3 (бертолетова соль), НСlO (хлорноватистая кислота), НСlO4 (хлорная кислота). Напишите формулы оксидов, соответствующих кислотам.
5. Вычислите объём хлора (н. у.), который потребуется для вытеснения всего иода из 300 г 15%-го раствора иодида калия. Вычислите количество вещества новой соли, которое при этом образуется.
Ответ на вопрос 1

Ответ на вопрос 2
Фторная вода не существует, т.к. фтор реагирует с водой:
Ответ на вопрос 3

Ответ на вопрос 4

Ответ на вопрос 5

Ответ на вопрос 6

Ответ на вопрос 7
Это название фтор получил благодаря способности плавикового шпата понижать температуру плавления фторидов.
III. Работа по новой теме.
Галогеноводороды и галогеноводородные кислоты. Все галогеноводороды (общую формулу их можно записать как НГ) — бесцветные газы, с резким запахом, токсичны. Очень хорошо растворяются в воде и дымятся во влажном воздухе, так как притягивают находящиеся в воздухе водяные пары, образуя при этом туманное облако.
На рисунке 93 проиллюстрирован опыт, наглядно показывающий хорошую растворимость хлороводорода в воде (при обычных условиях в одном объёме воды растворяется около 500 его объёмов).


Растворы галогеноводородов в воде являются кислотами, это HF — фтороводородная, или плавиковая, кислота, НСl — хлороводородная, или соляная, кислота, НВг — бромоводородная кислота, HI — иодоводородная кислота. Способность их к электролитической диссоциации с образованием катионов водорода увеличивается от HF к HI.
Самая сильная из галогеноводородных кислот — иодоводородная, а самая слабая — фтороводородная. Большая прочность химической связи Н—F (поэтому фтороводородная кислота слабо диссоциирует в воде) обусловлена малым размером атома F и соответственно малым расстоянием между ядрами атомов водорода и фтора. С увеличением радиуса атома от F к I растёт и расстояние Н—Г, прочность молекул уменьшается и соответственно способность к электролитической диссоциации увеличивается.
Наиболее технически важными являются хлороводород и соляная кислота. В промышленности хлорово- дород получают синтезом из водорода и хлора:
В лабораторных условиях для получения хлороводорода используют реакцию, проводимую при нагревании (рис. 94):
![]()
Необратимому протеканию этой реакции способствует летучесть НСl.
Соляная кислота представляет собой бесцветную, дымящуюся на воздухе жидкость, которая несколько тяжелее воды. Это типичная кислота, взаимодействует с металлами, оксидами и гидроксидами металлов и солями (приведите уравнения соответствующих реакций и охарактеризуйте их в свете теории электролитической диссоциации и процессов окисления и восстановления там, где это имеет место) .
Соляная кислота находит широкое применение в промышленности (рис. 95).
Соли галогеноводородных кислот. Галогеноводородные кислоты образуют соли: фториды, хлориды, бромиды и иодиды. Хлориды, бромиды и иодиды многих металлов хорошо растворимы в воде.
Для определения в растворе хлорид-, бромид- и иодид-ионов и их различения используют реакцию с нитратом серебра AgNO3 (рис. 96). В результате реакции хлоридов (и самой соляной кислоты) с этим реактивом выпадает белый творожистый осадок хлорида серебра AgCl, сокращённое ионное уравнение этой реакции записывается так:
![]()


В реакциях с бромоводородной кислотой и её солями и с иодоводородной кислотой и её солями также образуются осадки, но только жёлтого цвета, которые различаются оттенками:



А вот для распознавания фтороводородной кислоты и её солей (фторидов) нитрат серебра в качестве реактива непригоден, так как образующийся фторид серебра AgF растворим в воде. Для доказательства присутствия в растворе фторид-ионов F - можно использовать реакцию с ионами кальция Са 2+ так как фторид кальция CaF2 выпадает в осадок (рис. 97).
Своё название плавиковая кислота получила из-за уникального свойства: при взаимодействии с оксидом кремния (IV), входящим в состав стекла, как бы плавить его:
![]()


Галогены в природе. Галогены в природе существуют только в связанном состоянии. Среди них наиболее распространены хлор (0,19% от массы земной коры) и фтор (0,03%).

Важнейшее природное соединение хлора — галит NaCl (рис. 99), с ним вы подробно знакомились в прошлом году. Галит добывают путём разработки залежей каменной соли — твёрдого хлорида натрия.
Кроме галита, встречается природный хлорид калия КСl. Это минералы сильвин (рис. 100) и сильвинит (смесь КСl и NaCl, состав которой отражают формулой KCl • NaCl).
Природный минерал фтора — это флюорит, или плавиковый шпат CaF2 (рис. 101).
Бром и иод — рассеянные элементы и своих минералов не образуют. Эти элементы концентрируются в водах океанов и морей, в водах буровых скважин, а также в водорослях (рис. 102).

1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
![]()
1. Докажите зависимость степени электролитической диссоциации от природы электролита на примере галогеноводородных кислот.
2. В четырёх пробирках находятся прозрачные растворы фторида, хлорида, бромида и иодида натрия. Как распознать эти вещества с помощью одного реактива?
Физкультминутка
Закройте глаза, расслабьте тело
Представьте- вы птицы, вы вдруг полетели!
Теперь в океане дельфином плывете,
Теперь в саду яблоки спелые рвете.
Налево, направо, вокруг посмотрели,
Открыли глаза и снова за дело!
Раз – два – руки в горизонтали,
Обе руки в горизонтальной плоскости одновременно вправо – влево;
Три – четыре – руки по вертикали.
Обе руки одновременно резким движением поднимаются вверх и опускаются вниз.
Помни, период – это горизонталь,
Руки на пояс, наклоны туловища вправо и влево;
Ну а группа – это вертикаль!
Руки на пояс, прыжки на месте.
IV. Закреплени е
Ответ на вопрос 1
Электролитическая диссоциация увеличивается от HF к HI. Самая сильная из галогеноводородных кислот— иодоводородная, а самая слабая — фтороводородная. Большая прочность химической связи Н—F (фтороводородная кислота слабо диссоциирует в воде) обусловлена малым размером атома F и соответствующим малым расстоянием между ядрами атомов водорода и фтора. С ростом радиуса атома от F к I растет и межъядерное расстояние, прочность молекул уменьшается и соответствующая способность к электролитической диссоциации увеличивается.
Ответ на вопрос 2

Ответ на вопрос 3

Ответ на вопрос 4

Рефлексия (4 мин.)
Учитель создаёт условия для заключительной рефлексии:
- Сегодня на уроке я научилась(ся)…
- Сегодня на уроке я узнал(а)…
- Сегодня на уроке я закрепил(а) свои знания…
- Что ещё я хотел(а) бы узнать о водороде.
Выставление оценок.
Обобщение полученных на уроке сведений
Проводит беседу по вопросам.
Оценивание учащихся за работу на уроке
Что запомнилось на уроке, что понравилось.
-Как вы оцениваете свою работу на уроке?
(Мнение учителя о работе каждого из отвечающих.)
Дополните предложение высказав своё мнение об уроке
Сегодня на уроке …. Было легко…
Я узнал Мне понравилось
Я научился Не понравилось
Было сложно Меня удивило
Домашнее задание
Напишите не менее четырёх-пяти уравнений реакций получения хлорида магния. Там, где это имеет место, запишите и ионные уравнения и рассмотрите окислительновосстановительные процессы.
Напишите уравнения химических реакций, иллюстрирующие следующие превращения:
Укажите окислительно-восстановительные реакции и разберите их. Уравнения реакций с участием электролитов запишите также в ионной форме. Пересказ параграфа

Химические свойства галогенов
Ключевые слова конспекта: химические свойства галогенов, реакция галогенов с металлами, реакции с неметаллами, реакции галогенов с водой, со щелочами, с солями-галогенидами.
Раздел ОГЭ: 3.1.2. Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
1. Реакция с металлами.
Галогены реагируют практически со всеми металлами (кроме благородных металлов) с образованием галогенидов. Например, натрий горит в хлоре: 2Na + Cl2 = 2NaCl
Со фтором реакции идут очень бурно, с йодом – только при нагревании, часто требуется вода как катализатор.

Окислительная активность галогенов снижается от фтора к йоду. Это можно продемонстрировать на примере окисления железа (обратите внимание на его степень окисления в галогенидах):

В ходе реакции с бромом Вг2 может образоваться как FeBr3, так и FeBr2:

В реакции с йодом I2 при температуре 500 °С образуется Fel2:
Фтор, хлор и бром окисляют железо глубже (до Fe 3+ ), чем йод.
2. Реакции с неметаллами.
Окислительную способность галогенов можно сопоставить и в реакциях с неметаллами. Галогены реагируют со многими неметаллами (исключением являются благородные газы, азот N2, кислород O2).

Галогены реагируют с водородом, при этом условия проведения реакции зависят от того, с каким из галогенов проводится реакция:
Со фтором реакция может начинаться даже при t° = –250 °С, с хлором реакция идёт при сгорании водорода в хлоре или даже при комнатной t° на свету. С бромом и йодом реакция идёт при температуре 350–500 °С или при наличии катализатора платины Pt. Реакция образования йодоводорода HI обратима. Таким образом, по мере увеличения относительной молекулярной массы галогена от фтора F2 к иоду I2 условия проведения реакции должны быть более жёсткими.
Обратите внимание: здесь встретилась сравнительно редкая для серы степень окисления +2.
С йодом сера не реагирует. Более глубокое окисление серы в реакции со фтором демонстрирует более высокую окислительную способность фтора.
В реакциях фосфора с хлором и бромом могут образоваться РCl3 и РВг3, но по мере повышения температуры в результате окисления фосфора глубина окисления возрастает – образуются РCl5 и РВг5.
Остальные галогены не реагируют с простыми веществами, образованными углеродом (алмазом, графитом).
3. Реакции с водой.
4. Реакции со щелочами.
5. Реакции галогенов с солями-галогенидами.
Галогены способны вытеснять друг друга из солей-галогенидов и из галогеноводородов. Фтор F2 вытесняет все остальные галогены из галогеноводородов и галогенидов (в растворах параллельно идёт реакция окисления воды). Хлор Cl2 вытесняет бром и йод из НВг, бромидов, HI и иодидов. Бром Вг2 вытесняет йод из йодидов и йодоводорода. Йод I2 не вытесняет другие галогены:
Признаком данной реакции в растворе является изменение окраски с бесцветной на жёлтую.



К важнейшим соединениям галогенов относят галогеноводороды состава НЭ (Э — элемент галоген) и их водные растворы — галогеноводородные кислоты, а также образуемые ими соли. Атомы в молекулах галогеноводородов связаны ковалентной полярной одинарной σ-связью . На рисунке 70 показано образование химической связи в молекуле HCl.

Рис. 70. Модели образования химической связи в молекуле хлороводорода
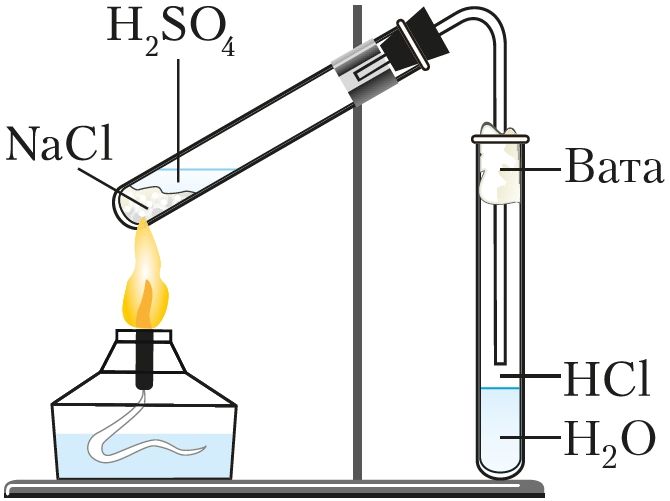
Рис. 71. Получение соляной
кислоты в лаборатории
Хлороводородная кислота
Хлороводородная (соляная) кислота HCl — крупнотоннажный продукт химической промышленности. Oна является водным раствором хлороводорода, который представляет собой бесцветный газ с резким запахом. Растворимость HCl при 20 °С составляет около 450 объёмов на 1 объём воды.
Концентрированная соляная кислота, содержащая 36–38 % хлороводорода и имеющая плотность 1,19 г/см 3 , дымит на воздухе, так как из неё выделяется газообразный хлороводород. Разбавленные растворы НСl не дымят.
В промышленности соляную кислоту получают растворением в воде хлороводорода. При этом хлороводород синтезируют из простых веществ:
В лабораторных условиях хлороводород получают действием концентрированной серной кислоты на хлориды (NaCl или KCl) при нагревании ( рис. 71 ):
Химические свойства. Являясь сильным электролитом, хлороводородная кислота диссоциирует с образованием ионов водорода и хлорид-ионов:
и обладает всеми общими свойствами кислот: действует на индикаторы и образует соли (хлориды) при взаимодействии с металлами (1), основными и амфотерными оксидами (2), гидроксидами металлов (3), солями (4):
К специфическим свойствам соляной кислоты следует отнести реакции, обусловленные наличием аниона Сl – . Выделим два важнейших.
1. Реакции окисления хлорид-ионов. Ион хлора в составе хлороводородной кислоты имеет низшую степень окисления –1 и способен её повышать при потере электронов. Значит, за счёт ионов хлора кислота является восстановителем. Например, для получения хлора в лаборатории используют реакцию концентрированной соляной кислоты с сильными окислителями (МnO2, КМnO4, КClO3):
2. Реакции связывания аниона Сl – c катионами некоторых металлов, например свинца Pb 2+ , серебра Ag + в растворе. Это иллюстрируют уравнения реакций:
2HCl + Pb(NO3)2 = PbCl2↓ + 2HNO3;
Pb 2+ + 2Cl – = PbCl2↓;
HCl + AgNO3 = AgCl↓ + HNO3;
Ag + + Cl – = AgCl↓.
Действие нитрата серебра(I) приводит к образованию белого творожистого осадка AgCl, что используют как тест (качественная реакция) на хлорид-ионы ( Приложение 3 ).
Сопоставление свойств галогеноводородных кислот и их солей
Фтороводород HF является жидкостью при температурах ниже 19 °С , а HCl, HBr, HI — газообразные вещества при н. у. ( табл. 23 ). Резкое отличие НF по агрегатному состоянию можно объяснить образованием водородных связей между полярными молекулами вещества: H—F … H—F … H—F … H—F .
Таблица 23. Галогеноводороды
Ассоциаты молекул фтороводорода настолько прочны, что не разрушаются (присутствуют) даже в газовой фазе до 90 °С . Фтороводород обладает неограниченной растворимостью в воде. Его раствор является слабой кислотой (фтороводородная кислота): . Низкая сила кислоты НF обусловлена высокой прочностью (энергией) связи в молекуле.
Остальные галогеноводороды хорошо растворимы в воде и представляют собой сильные кислоты: HBr → H + + Br – ; HI → H + + I – .
Большинство солей, образуемых этими кислотами, хорошо растворимы в воде. Для качественного определения в растворах хлорид-, бромид- и йодид-ионов используют реакцию с раствором нитрата серебра(I) AgNO3. При этом хлориды образуют белый творожистый осадок AgCl, бромиды — светло-жёлтый AgBr, йодиды — жёлтый AgI ( табл. 24 , Приложение 3 ):
Ag + + Cl – = AgCl↓; Ag + + Br – = AgBr↓; Ag + + I – = AgI↓.
Эти осадки не растворяются в азотной кислоте.
Нитрат серебра(I) не образует осадка с растворимыми фторидами, поэтому фторид-ионы определяют с помощью раствора CaCl2 ( Приложение 3 ):
CaCl2 + 2NaF = CaF2↓ + 2NaCl; Ca 2+ + 2F – = CaF2↓.
Таблица 24. Качественные реакции на анионы галогеноводородных кислот
Применение галогенов и их соединений
Галогены находят широчайшее применение и как простые вещества, и в виде соединений. Это иллюстрируют данные таблицы 25.
Таблица 25. Применение галогенов и некоторых их соединений
Обеззараживание питьевой воды. Отбеливание льняных и хлопчатобумажных тканей.
Органический синтез. Извлечение цветных металлов из руды. Получение соляной кислоты
Хлор содержится в очень опасном для жизни и здоровья веществе — диоксине, который может образоваться в результате реакций органических веществ и хлора при повышенной температуре. Органические соединения хлора и фтора (например, фреоны) учёные считают одной из причин разрушения озонового слоя Земли.
Растворы галогеноводородов являются кислотами.
Хлороводород получают синтезом из простых веществ либо действием концентрированной серной кислоты на твёрдый хлорид натрия.
Соляная кислота является окислителем за счёт водорода и восстановителем за счёт хлора.
Обнаружить хлорид-, бромид- и йодид-ионы можно с помощью раствора нитрата серебра(I). Нерастворимые галогениды серебра различаются цветом: AgCl — белый, AgBr — светло-жёлтый, AgI — жёлтый.
Вопросы, задания, задачи
1. Запишите химические формулы и назовите агрегатное состояние галогеноводородов при нормальных условиях.
2. Из перечня Mg(OH)2, FeCl2, FeCl3, Fe(NO3)3, HBr, HCl, MgCl2, ZnSO4 выпишите формулы и назовите вещества, которые при действии раствора AgNO3 образуют белый творожистый осадок.
3. Определите степени окисления атомов в соединениях: KClO3, HClO4, Cl2, KCl. В котором из них атомы хлора могут выступать только в роли восстановителя?
4. Определите массу хлороводорода в порции соляной кислоты массой 50 г с массовой долей вещества 12 % .
5. Рассчитайте объём хлороводорода ( н. у. ), который может выделиться при действии концентрированной серной кислоты на хлорид натрия массой 100 г .
6. Запишите химические формулы веществ, реагирующих с соляной кислотой: медь, оксид меди(II), оксид кальция, оксид углерода(IV), железо, гидроксид цинка, сульфат натрия, карбонат натрия. Объясните свой выбор. Составьте уравнения соответствующих реакций.
7. Предложите план экспериментального определения растворов йодида калия, бромида натрия и фторида натрия, находящихся в пронумерованных пробирках, используя:
- а) реакции замещения;
- б) реакции обмена.
Запишите уравнения соответствующих реакций в молекулярной и ионной формах.
8. Объясните причины нарушения последовательного изменения температур кипения галогеноводородов на рисунке 44 в § 17 .
9. Определите массовую долю вещества в растворе, полученном при растворении хлороводорода объёмом 40 дм 3 ( н. у. ) в воде объёмом 120 см 3 .
10. Для получения брома газообразный хлор пропустили через раствор массой 2 кг с массовой долей бромида калия 0,12 % . Рассчитайте массу полученного брома.
*Самоконтроль
1. Самой слабой кислотой является:
2. Водный раствор фтороводорода содержит частицы:
3. Соляная кислота реагирует с:
4. Белый творожистый и жёлтый осадок соответственно при взаимодействии с нитратом серебра(I) образуют:
Галогены (греч. hals - соль + genes - рождающий) - химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.

Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.

- F - 2s 2 2p 5
- Cl - 3s 2 3p 5
- Br - 4s 2 4p 5
- I - 5s 2 5p 5
- At - 6s 2 6p 5
Природные соединения
- NaCl - галит (каменная соль)
- CaF2 - флюорит, плавиковый шпат
- NaCl*KCl - сильвинит
- 3Ca3(PO4)2*CaF2 - фторапатит
- MgCl2*6H2O - бишофит
- KCl*MgCl2*6H2O - карналлит

Простые вещества - F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте - HF - был впервые получен фтор.
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.

В лабораторных условиях галогены могут быть получены следующими реакциями.
-
Реакции с металлами
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.

F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность ;)
Br2 + F2 → BrF (фтор более электроотрицателен, чем бром - F - )
Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод - Br - )
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
Хлор реагирует с водой обратимо, образуя хлорную воду - смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.

Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами - только при нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
- HF - фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl - хлороводород (газ), соляная кислота (жидкость)
- HBr - бромоводород, бромоводородная кислота
- HI - йодоводород, йодоводородная кислота
- HAt - астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI - газы, хорошо растворимые в воде.
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
HF - является слабой кислотой, HCl, HBr, HI - сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.

Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
KOH + HCl → KCl + H2O (реакция нейтрализации)

Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.

В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

